米渣蛋白质脱糖去杂工艺研究
2017-12-14张燕萍
宋 腾 ,张燕萍 *
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122)
米渣蛋白质脱糖去杂工艺研究
宋 腾1,2,张燕萍*1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122)
为获得米渣脱糖去杂的最佳方法,分析了冻融预处理、酶处理、超声波及其协同作用对米渣蛋白纯度的影响,然后对液固体积质量比、加酶量、酶解时间、酶解温度和超声波功率等因素对米渣蛋白纯度的影响进行研究,并在单因素实验的基础上,采用Central Composite中心组合实验设计,以米渣蛋白纯度为响应值,建立米渣脱糖去杂的二次回归模型,通过响应面分析和方差分析得出影响米渣脱糖效果的最优参数为:液固体积质量比6.1 mL/g、加酶量600 μ/g、酶解温度62℃、酶解时间88 min、超声波功率140 W,此时所得米渣蛋白质的纯度为92.01%,与理论预测值(92.68%)一致。
冻融;超声波;糖化酶;米渣;工艺优化
米渣是淀粉糖、味精、饴糖等大米深加工后的副产物[1],在淀粉糖生产和味精发酵工业每年产生3 000多万吨[2],多用于动物饲料,利用率较低。而米渣中含有大量的蛋白质 (质量分数40%~70%)[3-4],几乎保留了大米中所有的蛋白质,明显高于大豆蛋白含量;并且相对于其它植物蛋白,大米蛋白的蛋白价、消化率及省物价等方面均具有较高的优势,是一种优质的植物蛋白质资源。在大米糖化加工过程中,高热和高压作用致使大米中的蛋白质发生变性并且经美拉德途径与糖形成糖蛋白复合物,导致蛋白质提取难、溶解性和乳化性较差[5-6]。因此,有必要建立一种高效的提取方法,既能提高米渣中蛋白质的回收率,又能改善其功能性如溶解性和乳化性,从而提高米渣蛋白的生物利用率。
目前,米渣中提取蛋白质的方法主要有:碱溶酸沉法[6]、酶水解法[7]、碱酶法[3]、超声预处理[6]等,但是碱法和酸法提取分别需要较高浓度的碱液和酸液,致使蛋白质的结构受到很大的破坏,容易产生不良风味和危害健康的物质;此外,米渣中的蛋白被外层的糊精、淀粉紧密包裹,形成致密的结构,导致酶解效率较低。
作者首先利用冻融对米渣进行预处理,使大米蛋白和淀粉、糊精形成的致密高分子物质结构变得较为疏松,同时结合超声波处理断裂米渣中的化学键,从而增加酶与反应底物位点接触的概率,促进更多的淀粉降解为可溶性糖,从而提高产品中蛋白质的纯度。
1 材料与方法
1.1 材料与试剂
米渣:上海某大米深加工公司提供;糖化酶(酶活50 000 u/g):江苏锐阳生物科技有限公司产品。
1.2 仪器与设备
KQ-300DV数控超声波清洗器:昆山超声仪器有限公司产品;RJ-LDL-50G低速大容量多管离心机:无锡瑞江分析仪器有限公司产品;HH-S2系列恒温水浴锅:江苏金坛市环宇科学仪器厂产品;EL3002电子天平:梅特勒-托利多仪器(上海)有限公司产品;K9840自动凯氏定氮仪:济南海能仪器股份有限公司产品。
1.3 方法
1.3.1 实验方法 米渣→粉碎→过100目筛→脱脂→碱液溶解→-20℃冷冻→研磨粉碎(冷冻、研磨循环重复2次)→调节pH→糖化酶→超声波→超声波协同水浴酶解→灭酶→离心分离→水洗→冷冻干燥
1.3.2 测定方法 按照GB 5009.5-2010中的凯氏定氮法进行测,蛋白质系数为5.95。
蛋白质纯度 (%)=(样品中蛋白质质量/样品质量)×100%
1.3.3 实验设计 比较不同处理方式(Ⅰ(对照,未处理米渣)、Ⅱ糖化酶、Ⅲ冻融+糖化酶、Ⅳ超声波预处理+糖化酶、Ⅴ超声波协同糖化酶、Ⅵ冻融+超声波协同糖化酶)对米渣蛋白去杂效果的影响。
单因素实验设计主要考虑料比、加酶量、酶解温度、酶解时间及超声波功率等因素对米渣蛋白纯度的影响。
在单因素实验的基础上,根据Central Composite实验设计原理,以蛋白质纯度为响应值,通过响应面分析对米渣蛋白脱糖去杂工艺进行优化,获得最优脱糖工艺条件。每组实验重复3次,取其平均值。中心组合实验的因素水平如表1所示。

表1 中心组合实验因素水平表Table 1 Factors and levels of central composite design
2 结果与分析
2.1 不同处理方式对米渣蛋白脱糖效果的比较
由图1可以看出,不论是单独糖化酶水解或超声波协同糖化酶水解,冻融处理均有助于糖化酶对淀粉的水解,从而提高米渣蛋白的纯度。可能原因在于在米渣的冻融过程中,水分进入淀粉分子内部,由此在米渣颗粒内外形成的冰晶在循环冷冻过程中对淀粉结构造成损伤[8],并且随着冻融次数的增加,冰晶的形成和溶解产生一定的机械力,扩大了淀粉分子内部通道,使得淀粉包括的蛋白质释放出来[8-9],而且增加了糖化酶与淀粉接触的概率,加速了淀粉降解效率。此外,与超声波预处理相比,超声波与酶解协同处理对米渣蛋白的纯度影响较大,其原因在于[10-13]:超声波在介质中形成的微流效应促进底物迅速进入酶的催化部位及产物进入介质,表构象发生改变,使其折叠更合理,易于与底物结合,从而影响酶促反应进程,提高酶催化效率。

图1 不同处理方式对米渣蛋白质纯度的影响Fig.1 Effect of different treatment on the purity of rice protein isolates
2.2 液固体积质量比对米渣蛋白质纯度的影响
由图2可知,随着液固体积质量比的增加,米渣蛋白的纯度不断增加;当液固体积质量比达到6 mg/L时,米渣蛋白的纯度达到最大值,此后随着液固比的增加,米渣蛋白的纯度出现缓慢的下降趋势,说明反应体系中过量的液体会阻碍酶对淀粉的降解。原因在于超声波在液体介质中传播时,在介质中的不同部位所形成的超声场强度;当液固体积质量比达到一定值时,适当强度的超声波进入米渣颗粒内部,使米渣颗粒结构变的较为疏松并且破坏淀粉中的部分化学键[13-14],相应促进了酶反应;但是随着体系中液体介质的增加,超声场强度被稀释,
酶解效率下降,表现出液固体积质量比超过一定值时,米渣蛋白质的纯度开始下降。

图2 液固体积质量比对米渣蛋白质纯度的影响Fig.2 Effect of liquid-solid ratio on the purity of riceprotein isolates
2.3 加酶量对米渣蛋白质纯度的影响
由图3可知,随着加酶量的增加,米渣蛋白质的纯度不断上升,当加酶量大于500 u/g时,米渣蛋白的纯度几乎不再增加。原因在于在反应底物一定的情况下,加酶量不足时,其全部参与酶催化反应,随着加酶量的增加,可利用底物与酶充分接触完全反应,继续增加酶的使用量并不会使不可利用底物参与反应,因而当加酶量超过500 u/g时,几乎没有额外的淀粉被降解。

图3 加酶量对米渣蛋白质纯度的影响Fig.3 Effect of enzyme concentration on the purity of rice protein isolates
2.4 酶解温度对米渣蛋白质纯度影响
由图4可以看出,酶解温度对米渣蛋白质纯度的影响较为明显,随着酶解温度的上升,米渣蛋白质的纯度不断上升;当酶解温度达到60℃时,米渣蛋白质纯度达到最大值;当温度超过60℃时,米渣蛋白质纯度出现缓慢下降趋势。原因在于当温度超过60℃时,糖化酶的活性下降,对淀粉的水解效率降低;此外,随着温度的升高,米渣中未被水解的淀粉易发生糊化[15-16],从而造成反应体系粘度的上升,阻碍了料液的流动,降低了酶与淀粉的接触机率,间接抑制了酶对淀粉的降解。
2.5 酶解时间对米渣蛋白质纯度的影响
由图5可以看出,随着酶解时间的延长,米渣蛋白质的纯度不断上升,当酶解时间达到80 min时,米渣蛋白质纯度达到最大值,其后米渣蛋白质的纯度略微下降。原因在酶解的开始阶段,酶将体系中的淀粉降解转化为可溶性的糊精和其它糖类物质,随着时间的延长其对淀粉的降解效果越好,并且酶解时间的延长有利于将米渣中的淀粉结构变得更为疏松[17],增加了酶活性位点与底物的结合,酶解效果也就越好;但是当酶解时间超过一定值时,酶解产生的可溶性糖类物质进入米渣的空隙中,并且部分和米渣中的蛋白质发生美拉德反应[18],重新结合在蛋白质上,相应降低了米渣蛋白质的纯度。

图4 酶解温度对米渣蛋白质纯度的影响Fig.4 Effect of enzymolysis temperature on the purity of rice protein isolates
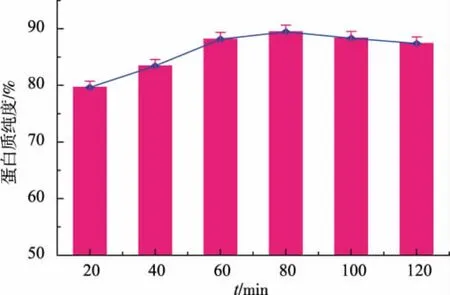
图5 酶解时间对米渣蛋白质纯度的影响Fig.5 Effect of enzymolysis time on the purity of rice protein isolates
2.6 超声波功率对米渣蛋白质纯度的影响
由图6可以看出,在100~140 W范围内,随着超声功率的增加,米渣蛋白质纯度逐渐提高,在140 W时达到最大值;但是当超声波功率大于140 W时,米渣蛋白质纯度随着超声波功率的增加而逐渐下降。原因在于在一定范围内(100~140 W),随着功率的增加,超声波的空化和机械剪切作用逐渐增强,淀粉形成的网孔状结构也就越多[10],米渣结构变得越疏松,增加了酶与底物的结束,加速了酶催化淀粉降解;超声波在米渣溶液体系中传播时,产生的微流效应促进淀粉与酶的催化部位充分结合以及降解产生的可溶性物质进入介质[13],表现为超声波促进米渣中淀粉的降解速率的提高;空化作用产生的冲击波改变了酶分子的构象[12],使其折叠更合理,更易于与底物结合形成中间产物,从而影响酶促反应的进程,提高了酶催化效率。但是随着超声功率的增加,水分子降解产生的自由基能促使酶分子中二硫键的断裂以及促使硫原子产生R-SH,破坏了酶的二级结构;同时超声波功率的增强,由此产生的空化作用也逐渐增强,破坏了酶的分子结构甚至是断裂酶分子成小片段,使酶活性下降,降低了酶对米渣中淀粉的降解,表现为米渣蛋白质纯度的下降。

图6 超声功率对米渣蛋白质纯度的影响Fig.6 Effect of ultrasound power on the purity of rice protein isolates
2.7 米渣蛋白质的超声波辅助酶法脱糖去杂工艺优化及方差分析
通过Design Expert对实验结果进行二次响应面回归分析,得出如下回归模型:

同时得到模型的方差分析结果,如表2所示。方差分析结果可以得出,所建立的模型在α=0.01水平上极显著的,液固比、加酶量、酶解温度、酶解时间对米渣蛋白纯度的影响在α=0.001水平上极显著。对于二次项来说,AB、AC、BC在α=0.01水平极显著,CD、CE在α=0.05水平上显著,说明这些因素直接存在相互作用。对于模型的Lack of Fit,其P值=0.066 2,不显著,说明实验误差较小;并且模型的R2=0.974 9、R2Adj=0.955 0,说明模型的拟合效果较好,能对用于描述实验所考察各因素对米渣蛋白纯度的影响。
2.8 响应曲面分析
根据方差分析结果,采用Design Expert对存在相互交互影响的因素进行响应曲面分析,结果显示:液固体积质量比和加酶量对米渣蛋白质纯度的影响之间存在显著的交互作用。同时,加酶量对米渣纯度的影响大于温度对米渣蛋白纯度的影响、酶解时间对米渣蛋白纯度的影响大于酶解温度米渣蛋白的影响,酶解温度对米渣蛋白纯度的影响大于超声波功率对米渣蛋白纯度的影响。
3 结语
1)比较分析了糖化酶、冻融+糖化酶、超声波预处理+糖化酶、超声波协同糖化酶、冻融+超声波协同糖化酶等处理对米渣蛋白的脱糖效果,得出冻融、超声波协同有利于米渣中淀粉降解,促进了糖化酶对米渣的脱糖效果。
2)各因素对米渣蛋白纯度的影响顺序为:液固体积质量比>加酶量>酶解时间>酶解温度>超声波功率,并且得到脱糖的最优参数为:液固体积质量比 6.1 mL/g、加酶量 600 u/g、酶解温度62℃、酶解时间88 min、超声波功率140 W,此时所得米渣蛋白的纯度为92.01%。
3)通过不同处理方式比较以及单因素实验和响应面优化,得出冻融预处理结合超声波协同酶处理能够有效对米渣中的淀粉进行降解,提高米渣蛋白的纯度。
[1]LIU Liu,YUAN Jianglan,JIN Yan,et al.Acetylating modification to rice residue protein by response surface analysis[J].Food Science and Technology,2013,38(2):55-59.(in Chinese)
[2]LIU Shanshan,CHEN Jiwang,CHEN Lu,et al.Physicochemical properties and morpological structure of rice dreg foaming protein[J].Journal of the Chinese Cereals and Oils Association,2015,30(4):33-38.(in Chinese)
[3]DONG Ruichen,WANG Shenqi,XIONG Hua,et al.Characterization of rice residue protein peptide made by a new enzymolysis process[J].Science and Technology of Food Industry,2013,34(4):137-139.(in Chinese)
[4]LIN Tao,JIANG Li,ZHAO Xiaohu,et al.Ultrasonic improves enzymatic hydrolysis reaction of rice dreg protein by trypsase[J].Food Research and Development,2012,33(3):6-9.(in Chinese)
[5]ZHOU Kan,XIONG Hua,CHEN Shengjun,et al.The high protein of the rice protein peptide preparation and the product nutrition ingredient analysis[J].Journal of Food Science and Biotechnology,2009,28(1):28-32.(in Chinese)
[6]JIANG Li,LIN Tao,ZHAO Xiaohu,et al.Extraction of protein from rice dreg using purifying and enzyme treating[J].Food Science and Technology,2011,36(12):179-182.(in Chinese)
[7]DONG Huizhong,ZHAO Liming,JIANG Lihua,et al.Study on extraction of functional rice protein by enzymatic method[J].Journal of Chinese Institute of Food Science and Technology,2013,13(4):87-93.(in Chinese)
[8]ARUNYANART T,CHAROENREIN S.Effect of sucrose on the freeze-thaw stability of rice starch gels:Correlation with microstructure and freezable water[J].Carbohydrate Polymers,2008,74(3):514-518.
[9]YU S,ZHANG Y,LI H,et al.Effect of freeze-thawing treatment on the microstructure and thermal properties of non-waxy corn starch granule[J].Starch-Starke,2015,67:1-13.
[10]HU A,LI L,ZHENG J,et al.Different-frequency ultrasonic effects on properties and structure of corn starch[J].Journal of the Science of Food and Agriculture,2014,94(14):2929-2934.
[11]BHASARKAR J,BORAH A J,GOSWAMI P,et al.Mechanistic analysis of ultrasound assisted enzymatic desulfurization of liquid fuels using horseradish peroxidase[J].Bioresource Technology,2015,196:88-98.
[12]SZABO O E,CSISZAR E.The effect of low-frequency ultrasound on the activity and efficiency of a commercial cellulase enzyme[J].Carbohydrate Polymers,2013,98(2):1483-1489.
[13]ZHU F.Impact of ultrasound on structure,physicochemical properties,modifications,and applications of starch[J].Trends in Food Science&Technology,2015,43(1):1-17.
[14]HERNOUX V A,LASSI U,HU T,et al.Simultaneous microwave/ultrasound-assisted hydrolysis of starch-based industrial waste into reducing sugars[J].ACS Sustainable Chemistry&Engineering,2013,1(8):995-1002.
[15]RODER N,GERARD C,VEREL A,et al.Factors affecting the action of α-amylase on wheat starch:Effects of water availability.An enzymic and structural study[J].Food Chemistry,2009,113(2):471-478.
[16]AI Y,JANE J.Gelatinization and rheological properties of starch[J].Starch-Starke,2015,67(3-4):213-224.
[17]ZHAO Q,XIONG H,SELOMULYA C,et al.Enzymatic hydrolysis of rice dreg protein:Effects of enzyme type on the functional properties and antioxidant activities of recovered proteins[J].Food Chemistry,2012,134(3):1360-1367.
[18]MOKNI G A,MAKLOUF G I,SILA A,et al.Effects of enzymatic hydrolysis on conformational and functional properties of chickpea protein isolate[J].Food Chemistry,2015,187:322-330.
The Purity of Rice Protein Isolates Subjected
SONG TENG1,2,ZHANG Yanping*1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
In order to obtain the optimum Impurity removal technologies of rice protein isolates,this paper analysis freeze-thawing pretreatment,enzymatic hydrolysis on,ultrasound,and their synergy on the purity of rice protein isolates.Then the effects of liquid-solid ratio,enzyme concentration,enzymolysis time,enzymolysis temperature and ultrasound power on the purity of rice protein isolates were analyzed.On the basis of single factor experiments,Central Composite design combined with response surface analysis and variance analysis were employed to optimize process parameters.The optimum process conditions were as follows:liquid-solid ratio 6.1 mL/g,enzyme concentration 600 u/g,enzymolysis temperature 62 ℃ ,enzymolysis time 88min and ultrasound power 140 W.Under these conditions,the theoretical purity of rice protein isolates was 92.68% ,which was closely agreed with the experimental value(92.01%).
freeze-thawing,ultrasound,glucoamylase,rice dreg,process optimization
TS 262.4
A
1673—1689(2017)10—1106—05
2015-09-02
*通信作者:张燕萍(1964—),女,江西南昌人,副教授,主要从事谷物与淀粉工程研究。E-mail:1170676297@qq.com
宋腾,张燕萍.米渣蛋白质脱糖去杂工艺研究[J].食品与生物技术学报,2017,36(10):1106-1110.
