EMA实时荧光PCR技术检测食品中单核增生李斯特活菌方法研究
2017-12-13,,,,,,,,
,,, ,,,, ,
·论著·
EMA实时荧光PCR技术检测食品中单核增生李斯特活菌方法研究
张俊彦,梅玲玲,徐昌平,占利,陈鸿鹄,张云怡,陈建才,张政,杨勇
目的利用叠氮溴化乙錠(EMA)实时荧光PCR技术,建立直接检测食品中单增李斯特活菌的方法。方法根据单核李斯特菌inlA基因设计特异性引物和探针。用不同EMA浓度、不同光照次数优化样品前处理条件。用平板计数法验证该方法的检出限及对死菌的抑制率。用35株单增李斯特菌、25株非单核李斯特菌、92株非李斯特菌验证该方法特异性。用添加了不同剂量的单增李斯特死菌、活菌及金黄色葡萄球菌的15件饮料,15件熟肉制品进行模拟实样检测。结果单增李斯特活菌EMA实时荧光PCR方法的Ct=(38.46-3.30)×log(菌量)(R2=0.999)。最低检测的活菌浓度为55 cfu/反应。对死菌DNA抑制效率≥ 99.98%。35株单增李斯特菌Ct值最低16.21,最高29.38,而25株非单单增李斯特菌、92株非单增李斯特菌的Ct值均大于35或无Ct值。重复试验Ct值变异系数小于5%。30件模拟实样单增李斯特菌的检测结果与常规方法完全一致。且EMA实时荧光PCR方法检出时间仅需10 h左右,而常规分离培养方法需要5~7 d。结论EMA实时荧光PCR检测技术是一种快速、简便、特异性强、灵敏度高、仅检测单增李斯特菌活菌的有效方法,可作为食品中检测单增李斯特活菌的方法推广使用。
单增李斯特菌;活菌;叠氮溴化乙锭(EMA);实时荧光PCR技术
单核细胞增生李斯特菌可引起新生儿、老年人和免疫缺陷病人脑膜炎、败血症,孕妇流产等疾病,死亡率高达20%~30%。该菌主要通过食物传播[1-3]。近年来,因该菌引发疾病所导致死亡和孕妇流产的报道有所增加[4]。已引起国内食品安全专家的关注。
常规的食品中单增李斯特菌分离鉴定方法,需要进行2次增菌,用选择性培养基分离,进行生化鉴定,整个过程需要1周以上,并且由于培养基的敏感性、生化反应的稳定性欠佳等因素,对单增李斯特菌的检出率、准确性带来了极大挑战。近年来,应用普通PCR、实时荧光PCR等分子生物学快速检测单增李斯特菌技术时有报道[5-8]。但是,食品加工后多数细菌已死亡,DNA核酸却仍保留,造成PCR结果的假阳性,由此限制了实时荧光PCR检测技术在食品单增李斯特菌检测中的使用。死细胞的细胞膜能够被叠氮溴乙锭(EMA)穿过,并且细胞的DNA在光激活的作用下能与EMA结合。结合了叠氮溴乙锭的DNA无法进行PCR扩增,从而避免了PCR结果中出现假阳性问题[9-10]。本文通过将实时荧光PCR技术与EMA相结合,建立了一种食物中单增李斯特活菌检测方法。
1 材料与方法
1.1 实验材料
1.1.1实验菌株 单增李斯特菌(CMCC 54001、CMCC 54002、CMCC 54003、CMCC 54004、CMCC 54005)、格氏李斯特菌(ATCC25401)、无害李斯特菌(ATCC33090)、伊凡诺夫李斯特菌(ATCC19119)、威尔逊李斯特菌(ATCC35897)、金黄色葡萄球菌(ATCC 25923)、表皮葡萄球菌(ATCC12228)、粪链球菌(CMCC32001)、蜡样芽胞杆菌(ATCC11778)、乙型溶血性链球菌(CMCC32210)、枯草芽胞杆菌(ATCC63501)、肠炎沙门菌(ATCC50041)、大肠埃希氏菌(ATCC25922、8099)、副溶血性弧菌(ATCC17802、ATCC33653)、拟态弧菌(ATCC33847)分别购自中国生物制品检定所、中国微生物菌种保藏中心;本实验室从食品或病人粪便标本分离的菌株:单核增生李斯特菌30株、英诺克李斯特菌13株、莫氏李斯特菌5株、威氏李斯特菌3株、金黄色葡萄球菌20株、蜡样芽胞杆菌20株、副溶血性弧菌10株、大肠埃希氏菌10株、沙门菌10株、志贺菌10株。
1.1.2引物和探针 选择单核李斯特菌inlA基因保守序列(登录号HQ111554.1),用DNAMAN 7.0软件设计探针和特异性引物(Primer Express 3.0软件设计)。在探针3′端用淬灭荧光染料BHQ1标记,5′端用报告荧光染料6-Carboxyfluorescein(FAM) 标记。委托宝生物工程(大连)有限公司合成引物和特异性探针。引物和荧光探针序列见下:上游引物(inlAF)5′-AAC ATC AGT CCC CTA GCA GGT TT-3′;下游引物(inlAR)5′-TTC CAG CTG ATT TTC ATT AAG CTC TA-3′;荧光探针(inlApb)5′-FAM-ACC GCA CTC ACT ACC-BHQ1-3′
1.1.3试剂和仪器;PCR反应试剂(DRR039S)购自宝生物工程(大连)有限公司;叠氮溴乙锭(EMA)购自美国Biotium公司;所有培养基均购自北京陆桥技术股份有限公司,经质量验收合格后,在有效期内使用;7500 Fast 实时荧光定量PCR系统(美国ABI life technology公司产品)。
1.2 方法
1.2.1光作用次数和EMA作用浓度的选择方法 取0.5麦氏浓度的单增李斯特菌(CMCC 54001)悬液,90 ℃加热10 min灭活,分装至1.5 mL EP管,每管200 μL,共计18管。按EMA终浓度为0 μg/mL、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL,光作用(放置黑暗处,时间8 min,650 W卤素灯,光照8 min)1次、2次、3次作矩阵配比处理后,用生理盐水洗3次后,沉淀加200 μL TE缓冲液悬浮,置沸水浴20 min,-20 ℃以下冰箱冻融1次,10 000 r/min离心5 min后,吸取上清作为DNA模板,进行实时荧光PCR检测。同步选择同浓度EMA及光作用条件,对同浓度单增李斯特活菌进行光处理和实时荧光PCR检测。取对死菌的扩增效率最低,而对活菌扩增效率影响最小的EMA作用浓度和光作用次数作为最佳EMA作用条件。
1.2.2EMA实时荧光PCR方法 模板DNA制备:对于菌培养物:可直接挑取1~2菌落至200 μL TE缓冲液。若为食品样品,则需称或吸取25 g(mL)到225 mL李斯特增菌液(LB1)中,36 ℃±1 ℃ 增菌8 h 后,各吸1 mL,离心,沉淀加200 μL TE 缓冲液溶解。然后,均按最佳EMA作用条件处理后,沸水浴20 min,-20 ℃以下冻融1次,10 000 r/min离心5 min,吸取上清液作为模板DNA。
反应体系:10 μL 2×Premix Ex TaqTM,各0.4 μL上、下游引物(浓度10 μmol/L),0.8μL探针(浓度10 μmol/L),3.0 μL模板DNA,5.4 μL ddH2O,共20 μL。
反应条件: 95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火40 s,40个循环。在退火温度处设定荧光检测点。荧光检测模式选择FAM荧光,阈值线的设定选在刚好超过正常阴性对照的最高点, 如果Ct值≤35,且待测样品的荧光增长曲线超过设定的阈值线且对数增长良好,判定为阳性。阴性判定依据为Ct值gt;35或无Ct值。
1.2.3最低检出限及对死菌抑制率检测 取0.5麦氏单位单增李斯特菌(CMCC 54001)悬液1.0 mL,用10倍梯度稀释成100~10-78种浓度,各取200 μL,进行EMA实时荧光PCR扩增。同时用血琼脂按平板涂布计数法进行菌浓度计数,结果0.5麦氏单位单增李斯特菌(CMCC 54001)浓度为1.8×108cfu/mL。经换算用作检测的8种菌浓度分别为5.4×105cfu /反应、5.4×104cfu /反应、5.4×103cfu /反应、5.4×102cfu /反应、5.4×101cfu /反应、5.4 cfu /反应、5.4×10-1cfu /反应、5.4×10-2cfu /反应。以确定方法的最低检出限。
对死菌DNA抑制率试验及计算方法:同步取同浓度经90 ℃作用15 min的单增李斯特死菌,按相同的方法进行EMA实时荧光PCR扩增,确定方法对死菌DNA抑制率;将用此方法扩增测得的死菌的Ct值,用上述用活菌检测所得的Ct值与反应浓度线性公式计算,得出死菌经EMA处理后DNA扩增浓度。该检测方法对死菌DNA的抑制效率由[1-(EMA处理后死菌的DNA扩增浓度/死菌浓度)]×100计算得出。
1.2.4特异性验证 为验证方法的特异性,对以下菌株的菌悬液进行EMA实时荧光PCR扩增:5株单核李斯特菌标准株、30株单核李斯特菌分离株、13株英诺克李斯特菌、5株莫氏李斯特菌、4株威氏李斯特菌、1株格氏李斯特菌、1株无害李斯特菌、1株伊凡诺夫李斯特菌、21株金黄色葡萄球菌、21株蜡样芽胞杆菌、12株大肠杆菌、12株副溶血性弧菌、11株肠炎沙门菌、10株志贺菌、1株表皮葡萄球菌、1株粪链球菌、1株乙型溶血性链球菌、1株枯草芽胞杆菌、1株拟态弧菌。
1.2.5重复性验证 计算重复试验的Ct值的变异系数来验证方法的重复性, 反应Ct值由隔天连续5次对以下进行EMA实时PCR检测得到,包括单增李斯特菌标准菌株(CMCC 54001)1株、单增李斯特菌分离株2株、沙门菌(CMCC 50013)1株和大肠埃希菌标准株(ATCC 25922)1株。
1.2.6模拟样品检测 取熟肉制品和饮料各15份,分别称或吸25 g(mL)到225 mL李斯特增菌液(LB1)中,所有样品中添加了英诺克李斯特氏菌(菌浓度约为105cfu/mL), 其中在每类样品中,5份样品未添加单增李斯特菌, 2份既添加死的单增李斯特菌(菌浓度均约为104cfu/mL)、又添加活的单增李斯特菌(菌浓度均约为103cfu/mL), 4份添加死的单增李斯特菌(菌浓度均约为104cfu /mL),4份添加活的单增李斯特菌(菌浓度分别约为10 000 cfu/mL、1 000 cfu /mL、100 cfu /mL、10 cfu /mL)。按《食品安全国家标准 食品微生物学检验 单增细胞增生李斯特氏菌检验》(GB 4789.30-2010)方法对上述加标样品进行单增李斯特菌分离鉴定。同步36 ℃±1 ℃培养8 h后,各吸1 mL,进行EMA实时荧光PCR扩增。以验证2种检测方法是否一致。
2 结 果
2.1EMA作用浓度和处理次数优化结果 将EMA终浓度为25 μg/mL、20 μg/mL、15 μg/mL、10 μg/mL、5 μg/mL、0 μg/mL,光处理(黑暗处放置8 min,650 W卤素灯光照8 min)1次、2次、3次进行矩阵配比设计成18种排列组合,对同一种浓度单增李斯特菌死菌、活菌进行EMA实时荧光PCR检测结果,经EMA处理的15个组合,死菌的Ct值从23.13~35.91,并且随着EMA浓度和光处理次数增加不断提升,死菌Ct值不断增大,即对死菌DNA抑制效率不断提升,但提升效率EMA浓度明显高于光处理次数(表1)。综合考虑EMA对死菌、活菌DNA的影响以及工作效率,最终本研究选择最佳条件为25 μg/mL的EMA终浓度,光处理1次(黑暗处放置,8 min,650 W卤素灯光照8 min)。
2.2最低检出限检测结果 分别用8种浓度分别为5.4×105cfu /反应、5.4×104cfu /反应、5.4×103cfu /反应、5.4×102cfu /反应、54 cfu /反应、5.4 cfu /反应、5.4×10-1cfu /反应、5.4×10-2cfu /反应浓度单增李斯特菌菌培养物进行EMA实时荧光PCR扩增,结果Ct值和待测菌浓度对数有良好的线性关系,Ct=(38.46-3.30)×log(菌量),相关系数(R2)为0.999(图1-A)。方法的最低检测浓度为54 CFU/反应(图1-B)。
表1 EMA作用浓度和处理次数优化结果(Ct值)
Tab.1 Optimization of EMA concentration and irradiating times
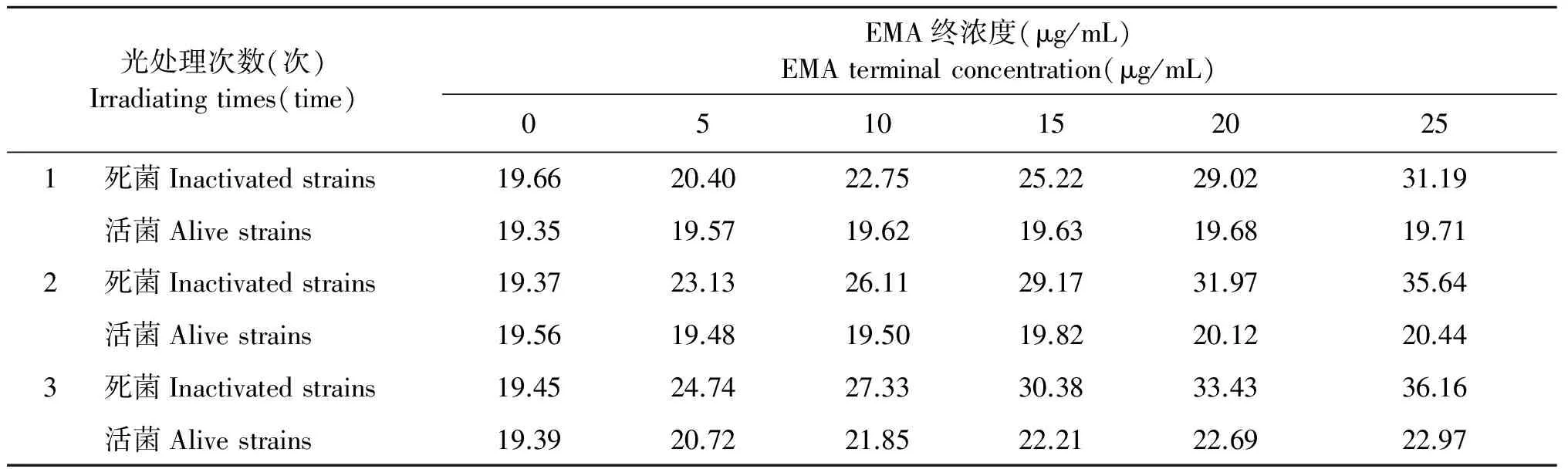
光处理次数(次)Irradiatingtimes(time)EMA终浓度(μg/mL)EMAterminalconcentration(μg/mL)05101520251死菌Inactivatedstrains19.6620.4022.7525.2229.0231.19活菌Alivestrains19.3519.5719.6219.6319.6819.712死菌Inactivatedstrains19.3723.1326.1129.1731.9735.64活菌Alivestrains19.5619.4819.5019.8220.1220.443死菌Inactivatedstrains19.4524.7427.3330.3833.4336.16活菌Alivestrains19.3920.7221.8522.2122.6922.97
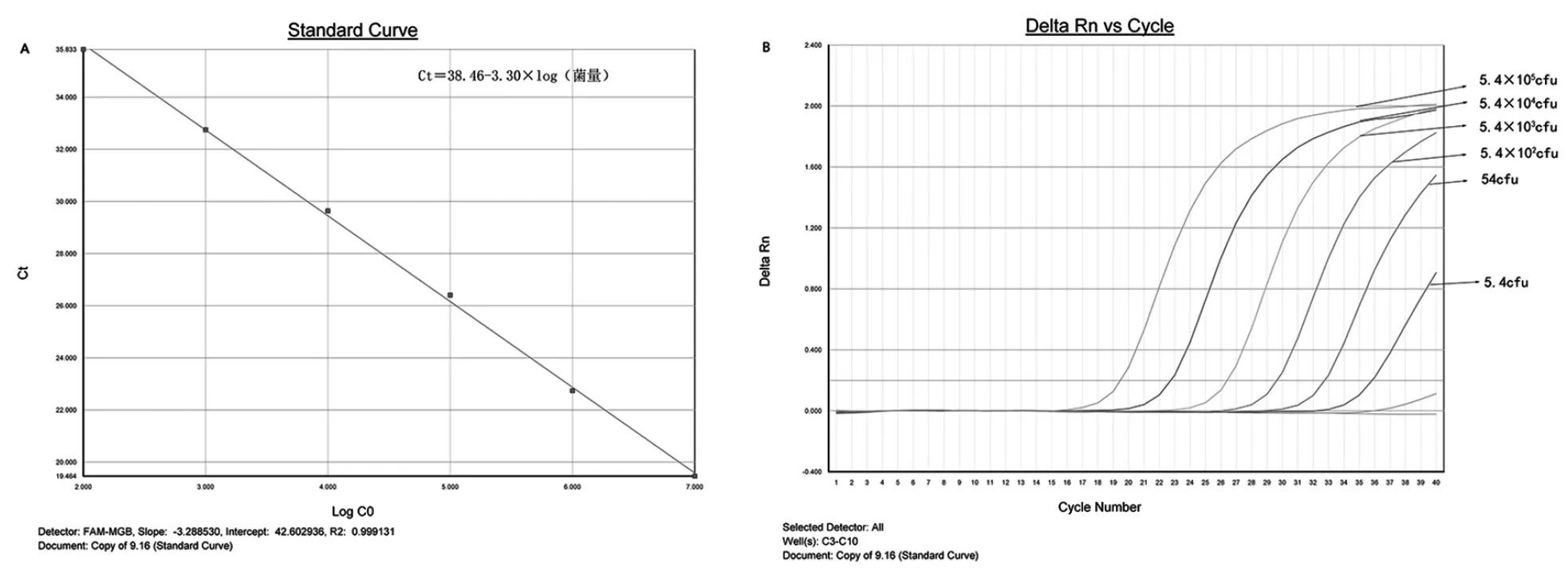
图1 单增李斯特菌EMA实时荧光PCR检测技术敏感性检测结果Fig.1 Detection susceptibility of EMA real-time fluorescence PCR method for Listeria monocytogenes
2.3对死菌抑制率检测结果 分别用以下8种单增李斯特菌死菌浓度为5.4×105cfu /反应、5.4×104cfu /反应、5.4×103cfu /反应、5.4×102cfu /反应、5.4×101cfu /反应、5.4 cfu /反应、5.4×10-1cfu /反应、5.4×10-2cfu /反应的培养物进行EMA实时荧光PCR检测,结果均判定为阴性,Ct值在26.36到无Ct值(呈一条线)。用Ct=(38.46-3.30)×log(菌量)计算出扩增浓度,计算结果上述浓度的死菌DNA均被有效抑制,抑制率大于等于99.98%(表2)。
表2 不同条件下对单增李斯特菌荧光定量PCR技术检测结果
Tab.2 Detection results of L.monocytogenes by using EMA real-time fluorescence PCR under different conditions

Lm菌浓度(cfu/反应)Lmconcentration(cfu/reaction)5.4×1055.4×1045.4×1035.4×102545.40.054Ct值Ctvalue31.3835.75-----实际扩增浓度(cfu/反应)Amplicationconcentration(cfu/re⁃action)1416.600000对死菌抑制率(%)Inhibitionrateofinactivatedstrains99.9999.98100100100100100
注:-表示无Ct值
Note: - means not detected
2.4特异性验证结果 对35株单增李斯特菌、13株英诺克李斯特菌、5株莫氏李斯特菌、4株威氏李斯特菌、1株格氏李斯特菌、1株无害李斯特菌、1株伊凡诺夫李斯特菌、92株其他非李斯特菌菌悬液,菌悬液进行EMA实时荧光PCR扩增结果显示,35株单增李斯特菌Ct值最低16.21,最高29.38,而25株其他李斯特菌、92株其他非李斯特菌的Ct值均大于35或无Ct值(呈一条线)。图2为部分菌株的扩增结果。
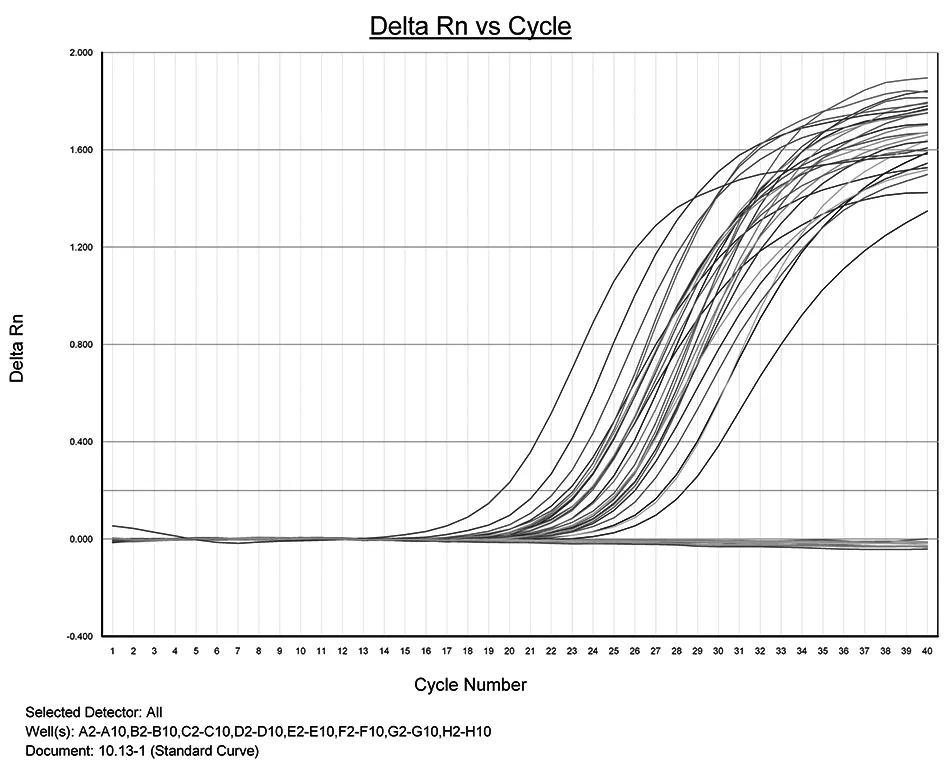
图2 单增李斯特菌EMA实时荧光PCR检测技术特异性检测结果Fig.2 Results of detection specificity for L. monocytogenes by using EMA real-time fluorescence PCR
2.5单增李斯特菌EMA实时荧光PCR检测技术重复性验证结果 隔天连续重复5次进行EMA实时PCR检测单增李斯特菌标准菌株(CMCC 54001)、单增李斯特菌分离株2株、沙门菌(CMCC 50013)1株和大肠埃希菌标准株(ATCC 25922)1株,结果如表3所示。由表3可见, 3种阳性菌和1种阴性菌Ct值的变异系数均lt;5%, 1种阴性菌部分结果无Ct值,无法计算其变异系数,结果显示阳性菌和阴性菌均能够正确判定。
2.6模拟样品检测结果 对30件模拟样品的检测结果显示, EMA实时荧光PCR检测和常规分离培养法结果完全一致,在每类样品中,添加了活的单增李斯特菌的6份样品检测结果均为阳性,其中4份样品添加了不同浓度的单增李斯特活菌,2份样品同时添加了单增李斯特活菌和死菌。其余样品则两种方法的检测结果均为阴性。
3 讨 论
单增李斯特菌是引起食物中毒并可在免疫受损的个体中导致严重疾病的食源性病原菌。九十年代以来,在美国、日本和欧洲等国由此菌造成的临床疾病和食物污染程度已大大超过了沙门氏菌。在33届世界食品法典委员会会议上已将此菌列为四大食源性致病菌之一。许多国家已将其作为进口食品必检菌。《食品安全国家标准 食品中致病菌限量》(GB 29921-2013)标准中也规定肉制品中单增李斯特菌不得检出。目前食品中单增李斯特菌检测方法主要有分离培养、酶联免疫法、PCR方法等。分离培养是基于表型测试,可操作性强、操作简单、成本低,但检验周期较长、特异性低,检测食品中单增李斯特菌不够及时、快速、灵敏。酶联免疫法特异性低,且操作不便。常规的PCR反应敏感快速,但无法鉴定区分活菌和死菌[7-10]。而食品中加工过程中已经死亡的单增李斯特菌的DNA却能在食品中保留很长时间,但PCR检测结果此时仍为阳性。因此,在加工食品中直接采用PCR方法检测,存在假阳性的风险。
表3 EMA实时荧光PCR技术重复性检测结果
Tab.3 Repepition assay for EMA real-time fluorescence PCR
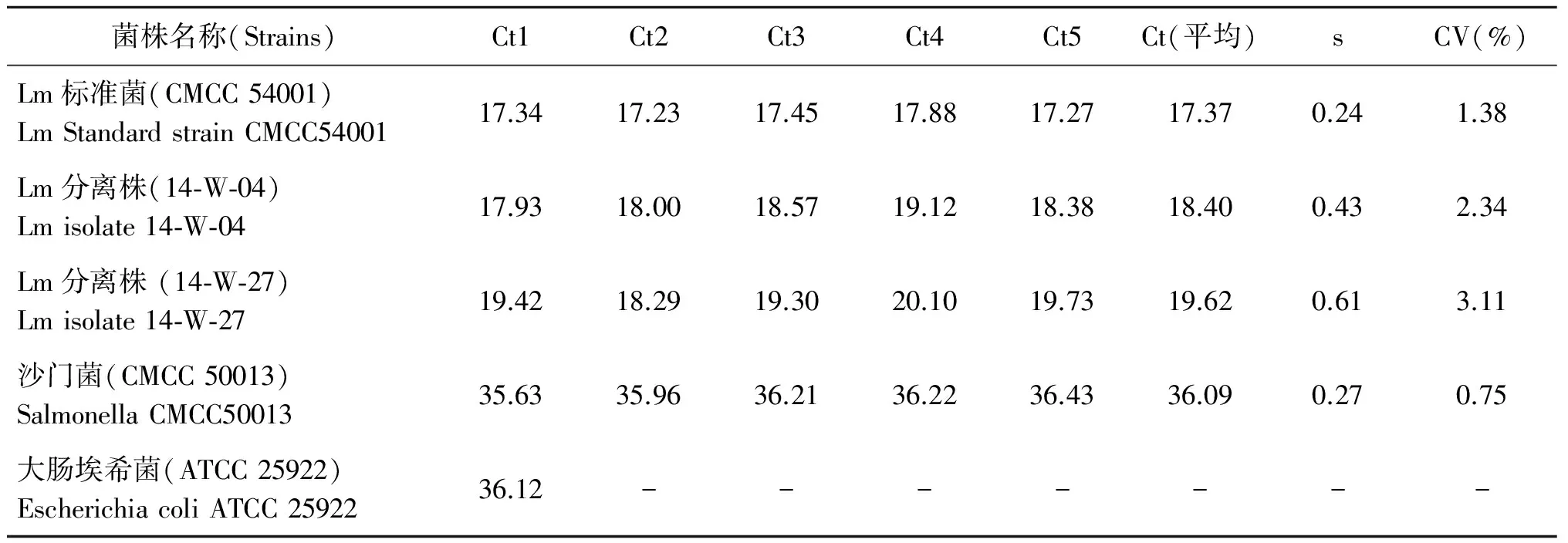
菌株名称(Strains)Ct1Ct2Ct3Ct4Ct5Ct(平均)sCV(%)Lm标准菌(CMCC54001)LmStandardstrainCMCC5400117.3417.2317.4517.8817.2717.370.241.38Lm分离株(14⁃W⁃04)Lmisolate14⁃W⁃0417.9318.0018.5719.1218.3818.400.432.34Lm分离株(14⁃W⁃27)Lmisolate14⁃W⁃2719.4218.2919.3020.1019.7319.620.613.11沙门菌(CMCC50013)SalmonellaCMCC5001335.6335.9636.2136.2236.4336.090.270.75大肠埃希菌(ATCC25922)EscherichiacoliATCC2592236.12-------
注:-表示无Ct值Note: - means not detected.
EMA能够穿过死细胞的细胞膜,并且在光激活的作用可以和细胞的DNA结合,使死菌DNA无法进行PCR扩增,这样就可以避免PCR结果中出现假阳性[9-10]。本文将操作简便、结果敏感、特异的实时荧光PCR技术与EMA相结合,建立一种快速并且有效的检测单增李斯特菌的方法。
本次研究结果显示,单增李斯特菌EMA实时荧光PCR检测技术Ct值与检测菌对数值呈较好的线性关系,相关系数(R2)为0.999。方法的灵敏度高,最低检测菌的浓度为54 cfu/反应,特性性强,对非李斯特菌金黄色葡萄球菌、腊样芽胞杆菌、非单增李斯特菌英诺克、莫氏李斯特氏菌的循环域值(Ct值)均可判定为阴性(大于35或无Ct,Ct值变异系数均lt;5%),且对死菌DNA能有效抑制,抑制率≥99.98%。对30件饮料或熟肉模拟样品的加标检测结果显示, EMA实时荧光PCR检测和常规分离培养法结果结果完全一致。且单增李斯特菌EMA实时荧光PCR检测技术简便、快速,且仅检测食品中的单增李斯特活菌,因此,这对将实时荧光PCR等DNA快速检测技术直接应用于检测食品中单增李斯特菌具有重要意义。
[1] Shen Y. Recent advance in research of safety of food contaminated withListeriamonocytogenes[J]. Chin Trop Med, 2008, 8(3): 484-487. (in Chinese)
沈莹.单核细胞增生性李斯特菌在食品安全中的研究近况[J]. 中国热带医学, 2008, 8(3): 484-487.
[2] Lian K, Ye SY, Ying YL,et al. Application of molecular genotyping in epidemiology analysis ofListeriamonocytogenes[J].Chin J Zoonoses, 2015,31(8):757-762.(in Chinese)
连凯,叶舒扬,殷月兰,等.分子分型方法在单核细胞增生性李斯特菌流行病学研究中的应用[J]. 中国人兽共患病学报,2015,31(8):757-762.
[3] Yu Y, Pan JC, Wang HQ,et al.Molecular genotyping of foodborneListeriamonocytogenesisolates from Hangzhou[J]. Chin J Zoonoses, 2017,33(3):264-270.(in Chinese)
俞骅,潘劲草,汪皓秋,等.杭州地区单核细胞增生李斯特菌食品分离株分子型别研究[J].中国人兽共患病学报,2017,33(3):264-270.
[4] Feng YF,Ran L,Zhang LS. Listeriosis cases reported in medical literatures in China, 2000-2009[J]. Dis Surveill, 2011, 26: 654-659. (in Chinese)
冯延芳,冉陆,张立实.2000-2009年中国李斯特菌病文献报告病例分析[J].疾病监测,2011,26:654-659.
[5] Li YX, Chen WW, Gu CR, et al. Recent advance in research ofListeriamonocytogenesdetection[J]. J Shanghai Normal Univ (Nat Sci), 2015, 44(6): 688-693. (in Chinese)
李云霞,陈雯雯,顾晨荣,等.单增李斯特菌的检测方法研究进展[J].上海师范大学学报(自然科学版),2015,44(6):688-693.
[6] Craw P, Balachandran W. Isothermal nucleic acid amplification technologies for point-of-care diagnostics: a critical review[J]. Lab Chip Miniaturisat Chem Biol, 2012, 12(14): 2469-2486.
[7] Jasson V, Jacxsens L, Luning P, et al. Alternative microbial methods: an overview and selection criteria[J]. Food Microbiol, 2010, 27(6): 710-730.
[8] Yeni F, Acar S, Polat T, et al. Rapid and standardized methods for detection of foodborne pathogens and mycotoxins on fresh produce[J]. Food Ctrl, 2014, 40(1): 359-367.
[9] Mei LL, Xu CP, Yang Y, et al. Alive foodborne pathogenShigelladetection by EMA real-time fluorescence PCR[J]. Dis Surveill, 2016, 31(11): 820-825. (in Chinese)
梅玲玲,徐昌平,杨勇,等.食品中志贺活菌EMA实时荧光PCR技术研究[J] .疾病监测,2016,31(11): 820-825.
[10] Zhu RG, Lü SX, Liu YP, et al. Quantification of pathogenic viable cells ofVibrioparahaemolyticusin seafood by ethidium bromide monoazide staining and real-time polymerase chain reaction[J]. Food Sci, 2011, 32(8): 219-225. (in Chinese)
祝儒刚,吕淑霞,刘月萍,等.基于DNA染料EMA的RT-PCR技术定量检测海产品中病原性副溶血弧菌活细胞[J].食品科学,2011,32(8):219-225.
NewEMAreal-timefluorescencePCRmethodfordetectionofaliveListeriamonocytogenesinfoods
ZHANG Jun-yan, MEI Ling-ling, XU Chang-ping, ZHAN Li, CHEN Hong-hu, ZHANG Yun-yi, CHEN Jian-cai, ZHANG Zhen, YANG Yong
(DepartmentofMicrobiology,ZhejiangProvincialCenterforDiseaseControlandPrevention,Hangzhou310051,China)
A new EMA real-time fluorescence PCR method was developed to detect aliveListeriamonocytogenesin foods. The specific primers and probe were designed based on the conservedinlAgene. The pretreatment conditions including EMA of different concentrations and irradiating times were optimized. The detection limit and inhibition rate to dead bacteria of this method were confirmed by using direct plating method. The detection specificity was evaluated by using 35L.monocytogenesstrains, 25 non-L.monocytogenesstrains and 92 non-Listeriastrains. Simulation detection experiments were performed on 15 beverage samples and 15 cooked meat samples supplemented separately with inactivatedL.monocytogenes, aliveL.monocytogenesandStaphylococcusaureus. Results showed that the Ct of EMA real-time fluorescence PCR for aliveL.monocytogeneswas Ct=38.46-3.30×log (R2=0.999). The detection limit was 55 cfu per reaction. Inhibition rate of DNA of inactivated strains was over 99.98%. The Ct of 35L.monocytogenesstrains were between 16.21 and 29.38, while 25 non-L.monocytogenesstrains and 92 non-Listeriastrains had Ct gt;35. The variation coefficient of CT was less than 5% when the experiments were repeated. Results of 30 simulation samples were consistent with that by using standard method. The test time by using newly developed EMA real-time fluorescence PCR was shortened from 3-5 days to about 10 h. The newly developed EMA real-time fluorescence PCR method for aliveL.monocytogenesis rapid, convenient, specific and sensitive and could be applyed in foods inspection.
Listeriamonocytogenes; alive bacteria; EMA; real-time fluorescence PCR
Mei Ling-ling, Email: llmei@cdc.zj.cn
10.3969/j.issn.1002-2694.2017.11.011
浙江省公益类科技计划项目(No.2015C37058)与浙江省医药卫生科技计划项目(No.2016KYB065)联合资助
梅玲玲,Email:llmei@cdc.zj.cn
浙江省疾病预防控制中心,杭州 310051
R378.99
A
1002-2694(2017)11-1007-06
Supported by the Public Welfare Technology and Application Project of Zhejiang Province (No.2015C37058), the Medical Scientific Research Foundation of Zhejiang Province (No.2016KYB065)
2017-05-05编辑王晓欢
