影响荧光假单胞菌J-8产蓝色色素的培养基成分及色素的稳定性研究
2017-12-11陈嘉敏刘云霞
魏 蜜,张 伟,陈嘉敏,周 飞,刘云霞
(1.湖北工程学院 特色果蔬质量安全控制湖北省重点实验室,湖北 孝感 432000;2.湖北工程学院 生命科学技术学院,湖北 孝感 432000)
影响荧光假单胞菌J-8产蓝色色素的培养基成分及色素的稳定性研究
魏 蜜1,2,张 伟1,2,陈嘉敏1,2,周 飞2,刘云霞2
(1.湖北工程学院 特色果蔬质量安全控制湖北省重点实验室,湖北 孝感 432000;2.湖北工程学院 生命科学技术学院,湖北 孝感 432000)
从芦荟的腐烂组织中筛选获得一株能产蓝色色素的荧光假单胞菌J-8。该菌株在不同培养基上产蓝色色素能力不同或者丧失,为找出促进J-8产蓝色色素的关键培养基成分,在固体培养条件下采用平板划线法研究了不同培养基配方、碳源、氮源、无机盐等对J-8菌株产蓝色色素的影响。结果表明:单糖是促进J-8菌株产蓝色色素的关键成分,且六碳糖比五碳糖更能促进J-8产蓝色色素。同时研究了pH、温度、氧化剂、还原剂、光照和金属离子对该菌株产生的蓝色色素稳定性的影响,结果表明:该色素不耐高温,在中性和避光条件下保存较好,在氧化剂和还原剂长时间存在下不稳定,Ca2+、Zn2+、Cu2+、Mg2+对该色素有一定的固色和增色作用。该研究为开发并保存新的天然微生物蓝色色素提供参考依据。
荧光假单胞菌J-8;蓝色色素;培养基成分;稳定性
荧光假单胞菌是一类常见于土壤中的革兰氏阴性杆状细菌[1],能够同时分泌多种色素,产生水解酶和铁载体等化合物,这些色素物质、水解酶和铁载体化合物有的还具有抗生素能力,能防治多种植物病害,因此也是一种重要的植物病害生防菌和根际促生菌[2-4]。1942年, “Pyoverdine”这一名称首次被Turfreijer提出,专指荧光性假单胞菌群能分泌黄绿色荧光,具有水溶性的色素,1958年,Elliott等[5]将泛指荧光性假单胞菌群分泌出的各色色素统称该名称。
微生物色素一般是菌体在生长后期合成的一种次级代谢产物。比如绿脓杆菌色素合成和调控需多个基因,操纵子和调控系统共同作用,其机制十分复杂。研究表明绿脓素的合成受多种因素影响,如细胞密度、营养条件、培养方式和抗生素的使用等[6]。自然界中,这种存在许多色素表达量差异巨大的菌株之间,其调控机制也未知[7]。
微生物色素相对于植物和动物色素具有较大优势,广泛应用于食品、药剂以及其他轻工业,具有重要的经济和社会效益[8-9]。国内外对荧光假单胞菌在生物防治方面有很多报道,但对其所产蓝色色素的条件及色素稳定性方面的报道相对较少[2,10]。本研究从芦荟的腐烂组织中筛选获得一株能产蓝色色素的荧光假单胞菌J-8,但该菌种在不同培养基上产蓝色色素能力不同或者丧失,因此,对J-8产蓝色色素的关键培养基成分及色素的稳定性展开研究,以期对天然微生物蓝色素的开发、利用与保藏提供理论基础和参考依据。
1 材料与方法
1.1菌种、试剂和培养基
荧光假单胞菌J-8由湖北工程学院特色果蔬质量安全控制湖北省重点实验室鉴定保藏。
硝酸钾、氯化钾、氢氧化钠、盐酸、硫酸铵、双氧水、抗坏血酸、硫酸镁、硫酸亚铁、氯化钙、硫酸铁、硫酸锌等,以上化学试剂均购于国药集团化学试剂有限公司,分析纯。
培养基参照文献配制[11],LB培养基:蛋白胨10 g,酵母粉5 g,氯化钠10 g,琼脂15~20 g,水1000 mL,pH7.0~7.2;牛肉膏琼脂培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂粉20 g,水1000 mL,pH7.0~7.2;PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉20 g,水1000 mL,自然pH;豆芽汁培养基:黄豆芽100 g,葡萄糖20 g,琼脂粉20 g,水1000 mL,自然pH。
1.2仪器与设备
高速冷冻离心机(北京时代北利离心机有限公司GT10-1T),生化培养箱(武汉一恒苏净科学仪器有限公司MJ-250),旋转蒸发仪(上海亚荣生化仪器厂SY-2000)。
1.3方法
1.3.1 菌种活化
将保存在 4 ℃ 的菌种转接至固体基础培养基上,于 25 ℃ 恒温光照培养箱中培养,使菌种充分活化。
1.3.2 关键培养基成分的研究方法
菌种在不同培养基上培养的方法均采用平板划线法,单因素分析。
(1) 不同基础培养基对蓝色色素产生的影响
挑选同一J-8单菌落分别接种在1.1中4种基础培养基上,每种培养基3个重复,将接种后的培养皿置于30℃的培养箱中培养,每隔6 h观察菌落的生长情况和颜色,并记录,下同。
(2) 氯化钠和蛋白胨对蓝色色素产生的影响
配制如下6种培养基,A:牛肉膏琼脂培养基去掉氯化钠;B:牛肉膏琼脂培养基中的氯化钠换成等量硝酸钾;C:牛肉膏琼脂培养基中的氯化钠换成等量氯化钾;D:牛肉膏琼脂培养基;E:PDA培养基中添加氯化钠;F:豆芽汁培养基中添加氯化钠。将菌种接种在A、B、C、D、E和F培养基中进行培养。
配制如下6种培养基,A:牛肉膏琼脂培养基;B:牛肉膏琼脂培养基去掉蛋白胨;C:牛肉膏琼脂培养基中蛋白胨换成等量黄豆粉;D:牛肉膏琼脂培养基中蛋白胨换成等量硫酸铵;E:PDA培养基加蛋白胨;F:豆芽汁培养基加蛋白胨。将菌种接种在A、B、C、D、E和F培养基中进行培养。
(3) 碳源对蓝色色素产生的影响
配制如下6种培养基,A:LB培养基加葡萄糖;B:LB培养基;C:牛肉膏琼脂培养基加葡萄糖;D:牛肉膏琼脂培养基;E:PDA培养基中不加葡萄糖;F:豆芽汁培养基中不加葡萄糖。将菌种接种在A、B、C、D、E和F培养基中进行培养。
配制如下8种培养基,A:PDA培养基;B:PDA培养基中的葡萄糖换成蔗糖;C:PDA培养基中的葡萄糖换成麦芽糖;D:PDA培养基中的葡萄糖换成淀粉;E:PDA培养基中的葡萄糖换成甘露糖;F:PDA培养基中的葡萄糖换成果糖;G:PDA培养基中的葡萄糖换成阿拉伯糖;H:PDA培养基中的葡萄糖换成木糖。将菌种接种在以上8种培养基中进行培养。
1.3.3 色素的粗提取及最大吸收波长的测定
将菌种接种于PDA液体培养基培养2 d后,得到含菌发酵液。8000 r/min离心10 min后取上清,旋转蒸发后用10 mL 甲醇溶解,得到色素粗提物。将色素提取液,用紫外分光光度计进行全波长扫描,以甲醇溶剂作为空白对照,确定该蓝色色素的最大吸收波长为390 nm。
1.3.4 蓝色色素的稳定性研究[12-14]
(1) 酸碱稳定性
取蓝色色素发酵液,用6 mol/L的HCl和4 mol/L的NaOH调节该色素的pH 值分别为1、3、5、7、9、11和13,30 ℃避光放置12 h后,在390 nm下测其吸光值。
(2) 热稳定性
取一定量的蓝色色素发酵液分别置于4、25、40、60、80和100 ℃的恒温水浴锅中保温120 min,在390 nm下测其吸光值。
(3) 对氧化剂还原剂的稳定性
取一定量的色素发酵液以1:1加入0.1% H2O2混匀,30 ℃避光放置,每隔30 min取样,在最大吸收波长下测其吸光度值。取一定量色素发酵液以1:1加入0.1%抗坏血酸混匀,30 ℃避光放置,每隔30 min取样,在390 nm下测其吸光值。
(4) 对白炽光和紫外光的稳定性
取等量的蓝色色素发酵液6份,3份置于紫外灯下照射,3份置于白炽灯下照射。每隔2 h分别取样,在390 nm下测其吸光值。
(5) 对金属离子的稳定性
取一定量的色素发酵液,分别以1:1加入浓度为0.05 mol/L的Ca2+、Zn2+、Fe2+、Fe3+、Mg2+的离子溶剂混匀,在4 ℃下避光放置24 h后取样,在390 nm下测其吸光值。
2 结果与分析
2.1 4种基础培养基对菌落产蓝色色素的影响
J-8接种在4种基础培养基上,培养24 h后,菌落颜色情况如图1所示。结果表明,PDA培养基,豆芽汁培养基中菌落颜色显蓝色,有蓝色色素产生;而LB培养基。牛肉膏琼脂培养基中菌落显示乳黄色,没有蓝色色素产生。可见,不同培养基对J-8是否产生蓝色色素有较大影响。A和B中相同的培养基成分是蛋白胨和氯化钠,可能是抑制菌株产蓝色色素的成分,同时也不排除酵母粉和牛肉膏的影响;C和D中相同的培养基成分是葡萄糖,可能是促进菌株产蓝色色素的成分,同时也不排除在土豆和豆芽的浸提液中的某些成分对菌株产蓝色色素的促进作用。因此,下面通过对培养基组成成分的逐一分析找出影响J-8是否产生蓝色色素的关键因子。
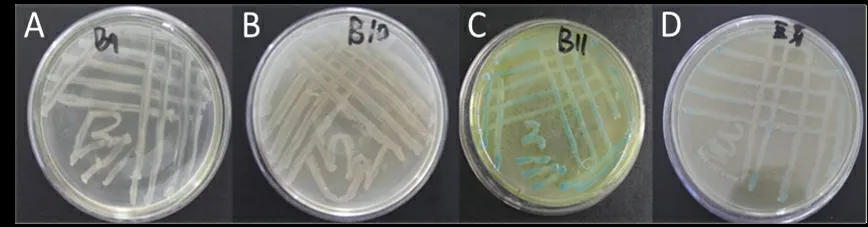
图1 4种培养基上J-8产蓝色色素的情况
2.2氯化钠和蛋白胨对菌落颜色的影响
为确定氯化钠是否是抑制菌株产蓝色色素的成分,将J-8接种在表1中6种培养基上,培养24 h后,结果表明,表1中A、B、C、D4种培养基上生长的菌落仍然都为乳黄色,而PDA和豆芽汁培养基中添加氯化钠后菌株仍然为蓝色,且色素深浅不变。这一现象说明氯化钠不是抑制菌株产蓝色色素产生的唯一因素,对菌株是否产蓝色色素无影响。

表1 氯化钠对菌株产蓝色色素的影响
为确定蛋白胨是否是抑制菌株产蓝色色素的成分,将J-8分别接种在表2中6种培养基上,培养24 h后,结果表明,表2中4种培养基的菌落都为乳黄色。PDA培养基和豆芽汁培养基中不含蛋白胨,这2种培养基上生长的菌株能产生蓝色色素,当添加蛋白胨组分到这2种培养基中后,E、F培养基上生长的菌株同样能产蓝色色素,且色素深浅不变,这些现象说明蛋白胨不是抑制菌株产蓝色色素产生的唯一因素,对菌株是否产蓝色色素无影响。

表2 蛋白胨对菌落颜色的影响
2.3葡萄糖对菌落颜色的影响
为确定葡萄糖是否是促进菌株产蓝色色素的成分,将J-8分别接种在表3中6种培养基上,培养24 h后,结果表明,菌株在LB和牛肉膏琼脂培养基上生长原本不产生蓝色色素,但在这2种培养基中添加葡萄糖后,菌株产蓝色色素;菌株在PDA和豆芽汁培养基上生长原本产生蓝色色素,但在这2种培养基中去掉葡萄糖后,菌株不产蓝色色素,由此说明,葡萄糖可能是影响菌落蓝色色素生成的关键因素。

表3 葡萄糖对菌落颜色的影响
2.4不同碳源对菌落产蓝色色素的影响
为进一步考察葡萄糖或其他碳源对菌株产蓝色色素的影响,将PDA培养基中的葡萄糖换成其他等量碳源如蔗糖、麦芽糖、淀粉、甘露糖、果糖、阿拉伯糖和木糖制作培养基,将J-8接种在这8种培养基上,培养24 h后观察菌落颜色情况,如图2所示。结果表明:将PDA培养基中的葡糖糖替换成蔗糖、麦芽糖、淀粉时,菌株J-8不产生蓝色色素;将PDA培养基中的葡萄糖替换成其他单糖物质如甘露糖、果糖、阿拉伯糖和木糖时,菌株产蓝色色素,且碳源为葡萄糖、甘露糖和果糖时比阿拉伯糖和木糖所产生的蓝色色素更多,菌株在六碳糖存在时产蓝色色素的能力更强。由此说明,碳源为二糖或多糖时,对菌落产生蓝色色素没有促进作用,而只有速效碳源单糖能促进菌落产生蓝色色素,其中六碳糖的促进菌株产蓝色色素的作用优于五碳糖的促进作用。有研究表明,10%~15%的葡萄糖对铁皮石斛内生真菌H1B1产生的红色素增色效应最为明显[15]。

表4 不同碳源对菌落颜色的影响

图2 碳源对菌株产蓝色色素的影响
注:A、B、C、D、E、F、G和H 8种培养基所对应的糖类分别是:葡糖糖、蔗糖、麦芽糖、淀粉、甘露糖、果糖、阿拉伯糖和木糖。
2.5 J-8产生的蓝色色素的稳定性分析
2.5.1 pH值对色素稳定性的影响
在最大吸收波长390 nm下,考察不同pH值对蓝色色素稳定性的影响。结果(见图3)表明,原液pH=4的吸光度最大,吸光值为1.028;pH在5~7时,吸光值减少不显著;而在偏酸(pH≤3)或者偏碱(pH≥9)条件下,色素均发生了较明显的褪色,且碱性条件下褪色更严重。说明该蓝色色素在近中性条件下有较好的稳定性,这一结果与郭瑞军报道的由一株放线菌产生的棕色色素的性质类似[16]。
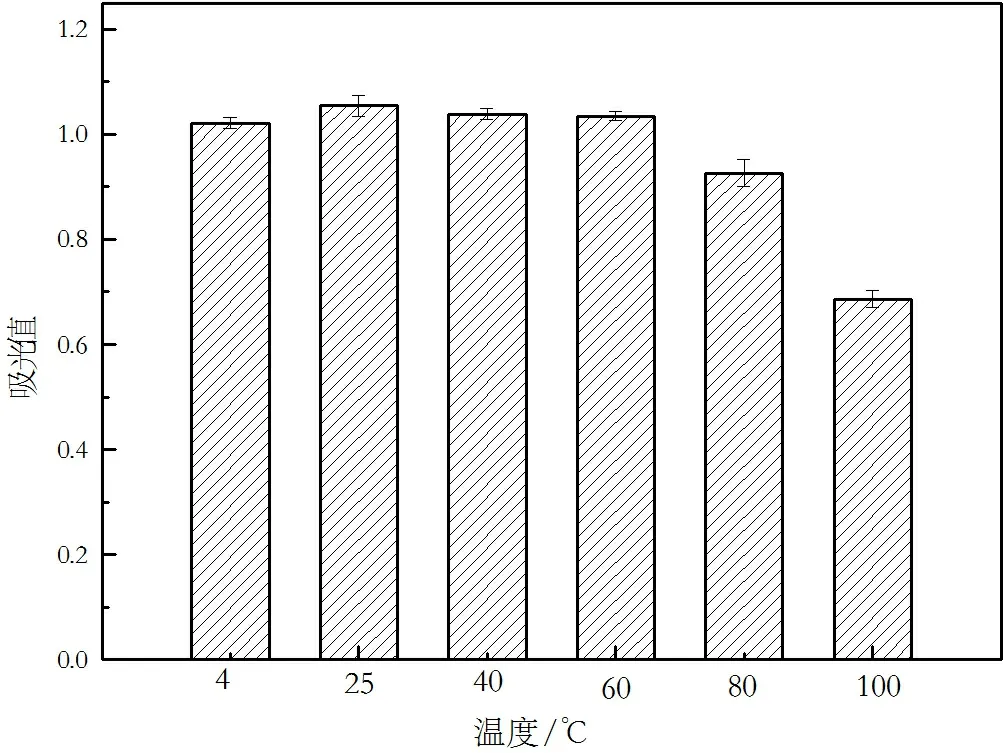
图3 pH对色素稳定性的影响
2.5.2 温度对色素稳定的影响
温度对蓝色色素稳定性的影响见图4,结果表明,25 ℃时吸光度最大,且经过60 ℃以下的温度处理其吸光值变化微量,在80 ℃条件下处理后下降12.3%,但经过100 ℃处理后吸光度值下降35.0%。说明该蓝色色素在低于60 ℃的环境下吸光度稳定,但高温条件下(>80 ℃)吸光度下降较快,色素稳定性较差。这与类球红细菌红色素及铁皮石斛内生真菌H1B1 产红色素对温度的稳定性结果相似[15,17]。建议此蓝色色素置于60 ℃以下保藏。
2.5.3氧化还原剂对色素稳定的影响
氧化剂和还原剂对蓝色色素稳定性的影响见图5。结果表明,随着氧化剂和还原剂存在时间增加,样品吸光值都呈下降趋势,在氧化剂和还原剂存在的前4小时内,样品的吸光值下降很缓慢,超过4小时后,吸光值直线下降,说明氧化剂和还原剂长时间存在均不利于该蓝色色素的稳定和保存。表明氧化剂和还原剂对不同色素稳定性的影响表现不同,张馨等报道还原剂Na2SO3对产紫青霉菌生产的红色色素有一定的增色作用[18],牛世全报道称氧化剂H2O2对放线菌产生的蓝色色素有较强的消色作用,而还原剂Na2SO3对该蓝色色素影响不大[19],因此氧化剂和还原剂对不同微生物产生的不同色素的影响应分别检测分析。

图4 温度对色素稳定性的影响

图5 氧化剂和还原剂对色素稳定性的影响
2.5.4 光照对色素稳定性的影响
紫外光和白炽光对蓝色色素稳定性的影响见图6,随着照射时间的延长,两种灯光照射都使菌株J-8产生的蓝色色素吸光值降低,且在白炽灯下,色素的吸光值降低的幅度更大,速度更快;这与牛世全等报道的放线菌产生的蓝色色素对光照的稳定性结论相反[19],可见不同的蓝色色素对光的敏感性不同,本实验结果表明,此蓝色色素对光的稳定性较弱,最好避光保持。
2.5.5 金属离子对色素稳定性的影响
金属离子对色素稳定性的影响见图7,大多数金属离子Ca2+、Zn2+、Cu2+、Mg2+对该蓝色色素的影响很小,且它们均使蓝色色素的吸光值略微增大,说明这4种金属离子对该色素有一定的固色和增色作用。但Fe2+和Fe3+的存在使该蓝色色素的吸光度增幅较大,尤其是Fe3+的影响十分显著,溶液呈红褐色,推测是荧光假单胞菌产生的噬铁素与Fe3+反应形成的,有研究报道,假单胞菌属细菌产生的铁载体主要有 3 种类型,其中脓青素与过量Fe3+会使其水溶液呈红褐色,使色素的吸光值显著增加[20]。
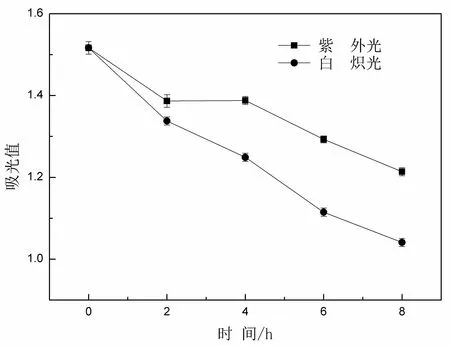
图6 紫外光和白炽光对蓝色色素稳定性的影响

图7 金属离子对色素吸光值的影响
3 结论
大多微生物在生长代谢过程中都能分泌多种显色物质,其中假单胞菌属细菌产色素物质的特性比其他微生物更为显著[21]。该属细菌产生的色素化合物颜色丰富,有红色、蓝色、黄绿色、黄色、褐色、黑色等[22]。近些年,对荧光假单胞菌引发的食品安全问题研究较多,Leonardo Caputo 报道了通过牛乳铁蛋白防止由荧光假单胞菌引起马苏里拉奶酪的蓝色变色及延迟相关的腐败细菌的生长[23]。Cenci-Goga等建立了一个体系来探究荧光假单胞菌引起的马苏里拉奶酪的腐败、颜色异常和储藏条件之间的联系[24]。本文从芦荟软腐组织中分离出一株能够产蓝色色素的荧光假单孢菌J-8,通过单因素实验找出了影响J-8产蓝色色素的关键培养基成分是碳源,并探究出单糖类的六碳糖是决定该菌种是否产蓝色色素的关键因素,这一结论对奶制品、肉类等日常食品的腐败变色是否由荧光假单胞菌引发有一定的指示作用。但是,六碳糖能够促进荧光假单胞菌J-8产生蓝色色素的原因及相关作用机制,现在尚不明确,有待进一步的研究。色素的稳定性是色素在应用中的一个重要问题,色素稳定性的好坏将直接影响到着色物质的色泽和品质,因此,色素的生产应用价值很大程度上取决于其稳定性[25]。本文研究了pH、温度、氧化剂、还原剂、光照和金属离子对该菌株产生的蓝色色素稳定性的影响,研究表明该色素不耐高温,在氧化剂和还原剂长时间存在的条件下不稳定,且应尽量避免光照,除Fe3+外,大多数金属离子Ca2+、Zn2+、Cu2+、Mg2+对该色素有一定的固色和增色作用。以后的工作可针对该蓝色色素的物质基础、呈色机理等方面展开进一步深入研究。
[1] 刘九成,黄红艳.荧光假单胞菌在生物防治中的应用[J].北京农业,2015(5):3-3.
[2] Cole B J,Fletcher M,Waters J,et al.Genetic control of plant root colonization by the biocontrol agent, Pseudomonas fluorescens[J].Thin Solid Films, 2015, 13(1):S13-S15.
[3] 张力群,张俊威.假单胞菌产生的抗生素[J].中国生物防治学报,2015,31(5):750-756.
[4] Redondo-Nieto M,Barret M,Morrisey J P,et al.Genome sequence of the biocontrol strain Pseudomonas fluorescens F113[J].Journal of bacteriology,2012,194(5):1273-1274..
[5] 孙广正,姚拓,赵桂琴,等.荧光假单胞菌防治植物病害研究现状与展望[J].草业学报, 2015, 24(4):174-190.
[6] 徐海津,单志英,林伟利,等.铜绿假单胞菌色素代谢相关基因的研究[J].微生物学报,2005,45(1):14-18.
[7] Andreani N A,Carraro L,Martino M E,et al. A genomic and transcriptomic approach to investigate the blue pigment phenotype in Pseudomonas fluorescens[J].International journal of food microbiology,2015,213:88-98.
[8] 李德英,李霖新,张国顺.一株产色素放线菌碳氮源的优化及其色素稳定性的初探[J].科学技术与工程,2015,35(28):125-128.
[9] 程雷,尹胜,孙宝国,等.高产靛蓝色素大肠杆菌基因工程菌的构建及其发酵条件优化[J].食品科学,2016, 37(23):184-190.
[10] Yang M M,Wen S S,Mavrodi D V,et al.Biological control of wheat root diseases by the CLP-producing strain Pseudomonas fluorescens HC1-07[J].Phytopathology,2014,104(3):248-256.
[11] 方中达.植病研究方法[M].北京:中国农业出版社,1998.
[12] Meyer J M,Abdallah M A.The fluorescent pigment of Pseudomonas fluorescens:biosynthesis,purification and physicochemical properties[J].Journal of General Microbiology, 1978, 107(107):319-328.
[13] 李德英,李霖新,张国顺.一株产色素放线菌碳氮源的优化及其色素稳定性的初探[J].科学技术与工程,2015,35(28):125-128.
[14] 张志东,楚敏,唐琦勇,等.一株蓝色素产生菌的鉴定及色素特性[J].食品科学,2012(19):236-239.
[15] 刘维,阮璐雅,管成林,等.一株铁皮石斛内生真菌 H1B1 产红色素稳定性的研究[J].中国食品添加剂, 2016(1):71-75.
[16] 郭瑞军,张明科,徐全乐,等.一株产棕色素放线菌的分离鉴定及其色素性质[J].西北农业学报,2013,22(7):181-186.
[17] 李健,张猛,李祖明,等.类球红细菌红色素稳定性研究[J].中国食品学报,2014 (1):80-86.
[18] 张馨,曹红,李春,等.产紫青霉菌的发酵条件及色素稳定性,安全性的研究[J].中国食品添加剂,2016 (2):68-74.
[19] 牛世全,韩彩虹,胡蛟龙,等.一株产蓝色素放线菌的分离,鉴定及其色素稳定性初步研究[J].食品工业科技,2016,37(1):134-137.
[20] 毛得奖,朱亚玲,韩宁.假单胞菌铁载体及色素研究[J].微生物学通报,2013,40(3):500-516.
[21] Moss MO.Bacterial pigments[J].Microbiologist,2002,3(4):10-12.
[22] 钱伯钦.形成黑色素的绿脓假单胞菌[J].国际检验医学杂志,1981(2):54-55.
[23] Caputo L,Quintieri L,Bianchi D M,et al. Pepsin-digested bovine lactoferrin prevents Mozzarella cheese blue discoloration caused by Pseudomonas fluorescens[J].Food microbiology,2015,46:15-24.
[24] Cenci-Goga B T,Karama M,Sechi P,et al. Evolution under different storage conditions of anomalous blue coloration of Mozzarella cheese intentionally contaminated with a pigment-producing strain of Pseudomonas fluorescens[J].Journal of dairy science,2014,97(11):6708-6718.
[25] 陈立立,洪巧妹,邱敏,等.一株银杏内生真菌红色素稳定性的研究[J].中国食品添加剂,2011(3):118-121.
(责任编辑:熊文涛)
StudyontheMediumComponentsAffectingtheProductionofBluePigmentandItsStabilityProducedbyPseudomonasfluorescensJ-8
Wei Mi1,2, Zhang Wei1,2, Chen Jiamin1,2, Zhou Fei2, Liu Yunxia2
(1.HubeiKeyLaboratoryofQualityControlofCharacteristicFruitsandVegetables,HubeiEngineeringUniversity,Xiaogan,Hubei432000,China;2.SchoolofLifeScienceandTechnology,HubeiEngineeringUniversity,Xiaogan,Hubei432000,China)
Abstract:A strain identified as Pseudomonas fluorescens and named J-8 was screened from decaying aloe in the laboratory. The ability to produce blue pigment was different or lost in different medium. In order to find the critical medium components which affect the production of blue pigment produced byPseudomonasfluorescens, the change of colony color in different medium with different carbon sources, nitrogen sources and inorganic salts were studied. The results suggested that mono-saccharose was the key factor to promote the production of blue pigment. And the hexose played a greater role than pentose. The stability of the blue pigment was also studied under different pH, temperates, oxidants, deoxidizers, illumination and metal ions. It indicated that the pigment was not resistant to high temperature. It was better preserved under the condition of neutral light and being kept in the dark. It was not stable in the long-time presence of oxidant and reducing agent. Metal ions Ca2+,Zn2+, Cu2+and Mg2+had certain fixing and color enhancement effects on this blue pigment. The study provided scientific basis for the development and preservation of the natural microbial blue pigment.
PseudomonasfluorescensJ-8; blue pigment; medium components; stability
TS201.3; TS202.3
A
2095-4824(2017)06-0011-07
2017-08-23
湖北省自然科学基金青年项目(2016CFB204);国家自然科学基金资助项目(31600055)
魏 蜜(1987- ),女,湖北孝感人,湖北工程学院特色果蔬质量安全控制湖北省重点实验室、生命科学技术学院讲师,博士。
