小麦雌蕊和雄蕊突变体与川麦28之间特异性ISSR标记筛选
2017-12-01,,,,2,,,,
, , , ,2, , , ,
(1.西华师范大学 a.西南野生动植物资源保护教育部重点实验室;b.环境科学与环境工程学院, 四川 南充 637009;2.西昌学院农业科学学院, 四川 西昌 615013)
小麦雌蕊和雄蕊突变体与川麦28之间特异性ISSR标记筛选
唐海峰1a,杨在君1a,路璐1b,彭正松1a,2,廖明莉1a,张莉1a,罗琴1a,代畅1a
(1.西华师范大学 a.西南野生动植物资源保护教育部重点实验室;b.环境科学与环境工程学院, 四川 南充 637009;2.西昌学院农业科学学院, 四川 西昌 615013)
利用42条ISSR标记对小麦三雌蕊突变体(TP)和雄蕊同源转化为雌蕊突变体(HTS-1)与川麦28之间特异性的ISSR分子标记进行筛选,为利用ISSR标记定位Pis1基因和控制雄蕊同源转化成雌蕊的hts1和hts2基因奠定基础。结果表明:42条引物共扩增403个条带,有9条引物能在TP和CM 28之间扩增出差异条带,占所用引物的21.4%。有20条引物能在HTS-1和CM 28之间扩增出差异条带,占所用引物的47.6%。有21条引物能在TP与HTS-1之间扩增出差异条带,占所用引物的50%。每条引物最多能扩增出4条差异条带,大部分产生1~2条差异性条带。差异条带大小主要集中在250~750 bp之间。这也证明了ISSR标记是一种简单有效的分子标记,可作为SSR的一种重要补充标记用于遗传图谱的构建。
小麦; ISSR标记; 雄蕊同源转化为雌蕊突变体; 三雌蕊突变体
小麦的复穗状花序,由多个小穗排列于主穗轴两侧构成,每个小穗由着生在小穗轴上的多个小花组成,并通过小穗轴与主穗轴相连。小花就是小麦的花,其结构与双子叶植物的花不同,但由外到内仍可区分为4轮:第1轮是外稃和内稃,第2轮是2个浆片,第3轮是3个雄蕊,第4轮是1个雌蕊。雌蕊是单心皮的,受精后发育成1粒种子(颖果)。小麦小花的结构稳定、突变体十分罕见。小麦三雌蕊突变体(TP)和小麦雄蕊同源转化型不育突变体(HTS-1)都是研究小麦花发育的珍稀材料。
1朵小花结3粒种子的突变体最初是陈济世先生发现的,并命名为“三粒小麦”,其亲本不能确定[1]。本实验室的彭正松教授等对“三粒小麦”进行了多年的改良,最后培育出“三雌蕊突变体TP”。TP是由1对显性核基因(Pis1)控制,与细胞质遗传无关[2-3]。由于TP中1朵小花能结3粒种子,显著增加了穗粒数,因而在杂交小麦制种中是可以利用的优良性状。利用微卫星(SSR)分析已将Pis1基因定位于2 D 染色体的长臂上,位于SSR标记Xgwm 539和Xgwm 349之间,即小麦缺失区段C-2 DL 3-0.49内。彭正松等[4]在培育的中国春三雌蕊近等基因系CSTP群体中,意外地发现了1株变异植株,其小花的雌蕊多于3个、雄蕊形态异常,且数目不足3个、甚至缺失。变异植株经多代自交繁育成了稳定的HTS-1突变,它的3个雄蕊原基不是发育成正常雄蕊,而是在原位置发育成雌蕊或雌蕊状结构。这种变异,从形态学上看属于雄蕊雌蕊化(pistillody), 在发育生物学上称为同源转变(homoetic transformation)。由于HTS植株小花内大多没有正常的雄蕊,不能产生花粉,因而是雄性部分不育的,遗传分析表明,HTS-1突变体至少由2对隐性基因控制(hts1和hts2)。
ISSR标记(简单重复序列间扩增)是一种在简单重复序列(SSR)标记的基础上发展起来的分子标记,由加拿大蒙特利尔大学的Zietkiewicz[5]等提出。该技术以锚定的微卫星DNA为引物,在SSR序列的3′或5′端加锚2~4个随机核苷酸,在PCR反应中,锚定引物可以引起特定位点退火,导致与锚定引物互补的间隔不太大的重复序列间DNA片断进行PCR扩增。所扩增的Inter-SSR区域的多个条带可通过聚丙烯酰胺凝胶电泳或者琼脂糖凝胶电泳得以分辨[6]。它结合RAPD标记技术以及SSR标记技术的优点,能够提供更多的基因组DNA信息。目前已广泛应用于药用植物种质资源鉴定[7]、进化与亲缘关系分析[8-9]、遗传多样性[10]、基因定位[11-12]、分子标记辅助育种等[13]方面的研究。
本试验对TP和HTS-1与川麦28之间特异性的ISSR分子标记进行筛选,为利用ISSR标记定位Pis1基因和控制雄蕊同源转化成雌蕊的hts1和hts2基因奠定基础。
1 材料与方法
1.1 实验材料
小麦三雌蕊突变体(TP)和小麦雄蕊同源转化型不育突变体(HTS-1)是由本实验室培育,小麦推广品种川麦28(CM 28)由四川省农业科院生物技术核技术研究所的杨武云研究员提供。所有实验材料均种植于西华师范大学生命科学学院实验田中。在小麦分蘖期取叶片,并将叶片剪碎后放入保鲜袋中,置于-80 ℃冰箱中保存备用。
1.2 小麦DNA的提取
利用Biotechnology公司的多糖多酚植物DNA提取试剂盒提取小麦DNA,具体操作参照试剂盒的说明书进行。将所得的DNA溶解在TE buffer中然后用2%琼脂糖凝胶电泳和NANODROP 2000 C紫外分光光度计检测DNA的浓度和纯度,-20 ℃保存备用。
1.3 PCR扩增
本试验选用42条ISSR引物对TP, HTS-1和CM 28进行PCR扩增,引物序列如表1所示,由生工生物工程(上海)有限公司合成。PCR反应体系为10μL,其中2×TaqPCR Master Mix 5μL,ISSR引物(10 ng/μL)1μL,模板DNA 1μL,剩余部分用ddH2O补齐。反应于BIO-RAD T 100扩增仪上进行。PCR反应程序为:94 ℃预变性5 min后进入PCR循环,即:94 ℃变性30 s,50~60 ℃退火30 s(退火温度根据具体的引物而定),72 ℃延伸1 min,共35个循环。循环完成后72 ℃继续延伸10 min,最后4 ℃结束并保存。
1.4 琼脂糖凝胶电泳分离
反应结束后,PCR 产物在1.5%琼脂糖凝胶中电泳40 min(电压100 V),EB 染色,利用BIO-RAD Gel DocTMXR+凝胶成像仪进行观察并拍照。
2 结果与分析
2.1 ISSR的检测结果
选择了42条可以在小麦基因组中扩增出产物的ISSR引物分别对TP,HTS-1和CM 28进行ISSR分析。结果表明,这42条引物一共扩增403个条带,这些条带大多在250~2 000 bp之间。扩增最少的引物(如UBC 840)仅能扩增出1个条带,扩增最多的引物(如UBC 878)能扩增出5个条带,其中大部分引物能扩增出3个条带(图1)。
表1 试验所用ISSR引物
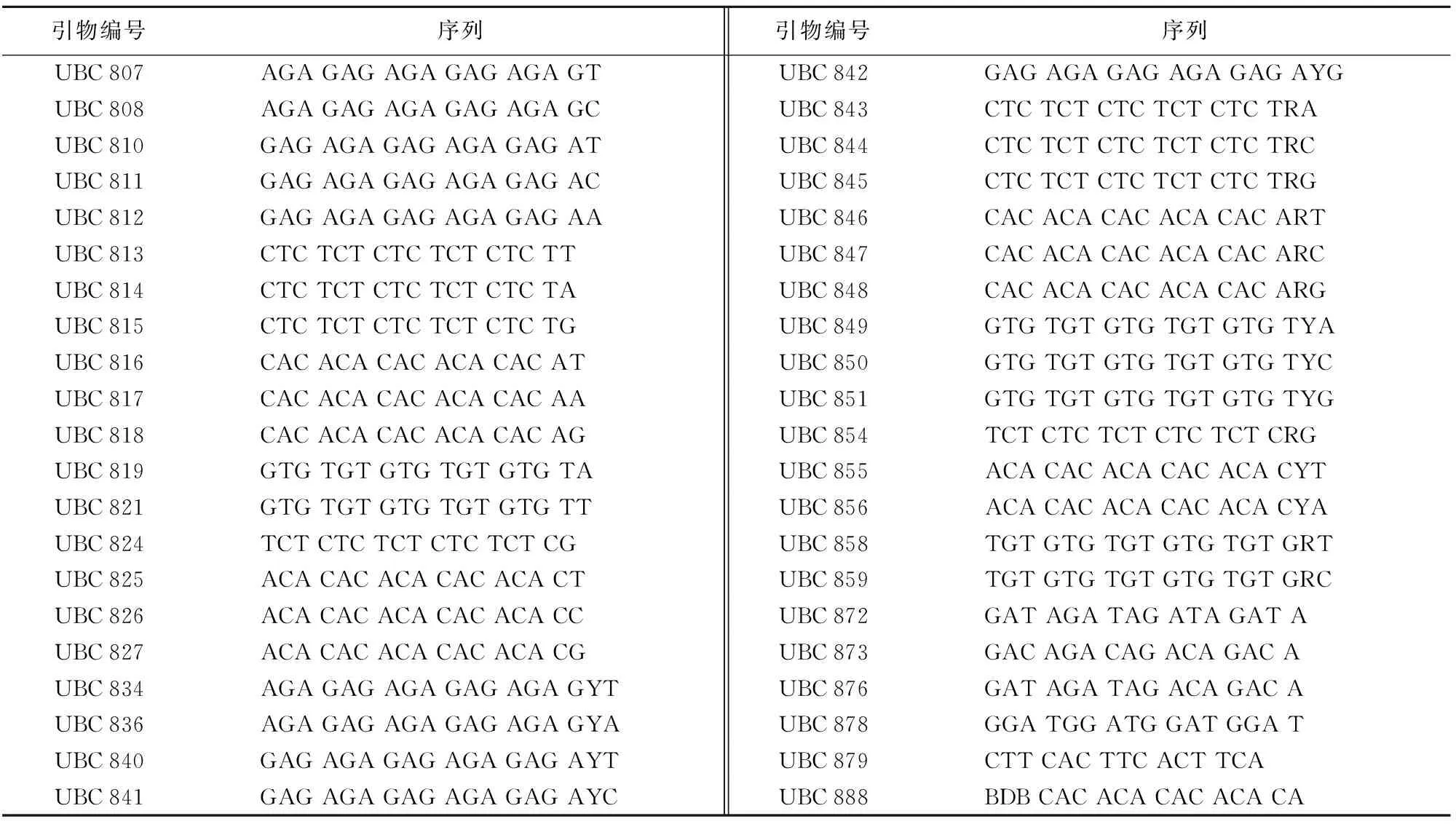
引物编号序列引物编号序列UBC807 AGAGAGAGAGAGAGAGTUBC842 GAGAGAGAGAGAGAGAYGUBC808 AGAGAGAGAGAGAGAGCUBC843 CTCTCTCTCTCTCTCTRAUBC810 GAGAGAGAGAGAGAGATUBC844 CTCTCTCTCTCTCTCTRCUBC811 GAGAGAGAGAGAGAGACUBC845 CTCTCTCTCTCTCTCTRGUBC812 GAGAGAGAGAGAGAGAAUBC846 CACACACACACACACARTUBC813 CTCTCTCTCTCTCTCTTUBC847 CACACACACACACACARCUBC814 CTCTCTCTCTCTCTCTAUBC848 CACACACACACACACARGUBC815 CTCTCTCTCTCTCTCTGUBC849 GTGTGTGTGTGTGTGTYAUBC816 CACACACACACACACATUBC850 GTGTGTGTGTGTGTGTYCUBC817 CACACACACACACACAAUBC851 GTGTGTGTGTGTGTGTYGUBC818 CACACACACACACACAGUBC854 TCTCTCTCTCTCTCTCRGUBC819 GTGTGTGTGTGTGTGTAUBC855 ACACACACACACACACYTUBC821 GTGTGTGTGTGTGTGTTUBC856 ACACACACACACACACYAUBC824 TCTCTCTCTCTCTCTCGUBC858 TGTGTGTGTGTGTGTGRTUBC825 ACACACACACACACACTUBC859 TGTGTGTGTGTGTGTGRCUBC826 ACACACACACACACACCUBC872 GATAGATAGATAGATAUBC827 ACACACACACACACACGUBC873 GACAGACAGACAGACAUBC834 AGAGAGAGAGAGAGAGYTUBC876 GATAGATAGACAGACAUBC836 AGAGAGAGAGAGAGAGYAUBC878 GGATGGATGGATGGATUBC840 GAGAGAGAGAGAGAGAYTUBC879 CTTCACTTCACTTCAUBC841 GAGAGAGAGAGAGAGAYCUBC888 BDBCACACACACACACA
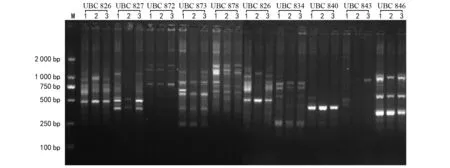
注:1为CM 28;2为HTS-1;3为TP。图1 UBC 826、BUC 827、UBC 872、UBC 873、UBC 878、UBC 826、UBC 834、UBC 840、UBC 843、UBC 846扩增结果
2.2 TP与CM 28之间差异条带分析
42条引物中有7条引物在TP和CM 28中扩增出差异条带。这9条引物共扩增出了17个差异条带,其中UBC 843产生的差异条带最多,为4条,大部分产生1~2条差异性条带。差异条带大小主要集中在250~750 bp之间。差异条带统计结果见表2。
2.3 HTS-1与CM 28之间差异条带分析
42条引物中有20条引物在HTS-1和CM 28中扩增出差异条带。这20条引物共扩增出了41个差异条带,其中UBC 812、UBC 808、UBC 836、UBC 843产生的差异条带最多,为4条,大部分产生1~2条差异性条带。差异条带大小主要集中在250~750 bp之间。差异条带统计结果见表3。
表2 TP与CM 28差异条带统计

引物差异条带数目差异条带大小UBC8082~1000bp、~250bpUBC8141~400bpUBC8271~500bpUBC8402~480bp、~400bpUBC8412~600、~750bpUBC8434~300bp、~450bp、~2200bp、~2000bpUBC8442~200bp、~250bpUBC8452~1000bp、~850bpUBC8731~750bp
表3 HTS-1与CM 28差异条带统计

引物差异条带数目差异条带大小UBC8072~700bp、~720bpUBC8084~1000bp、~250bp、~500、~700bpUBC8113~250bp、~400bp、~750bpUBC8124450bp、~400bp、~750bp、~1000bpUBC8133~1000bp、~1100bp、~1500bpUBC8141~625bpUBC8152~500bp、450bpUBC8191~650bpUBC8252~400bp、~350bpUBC8272~450bp、~500bpUBC8364~700bp、~600bp、500bp、~750bpUBC8434~300bp、~450bp、~2200bp、~2000bpUBC8451~850bpUBC8461~1000bpUBC8471~900bpUBC8511~750bpUBC8542~500、1000bpUBC8591~700bpUBC8731~750bpUBC8791~1800bp
2.4 TP与HTS-1之间差异条带分析
表4 TP与HTS-1差异条带统计
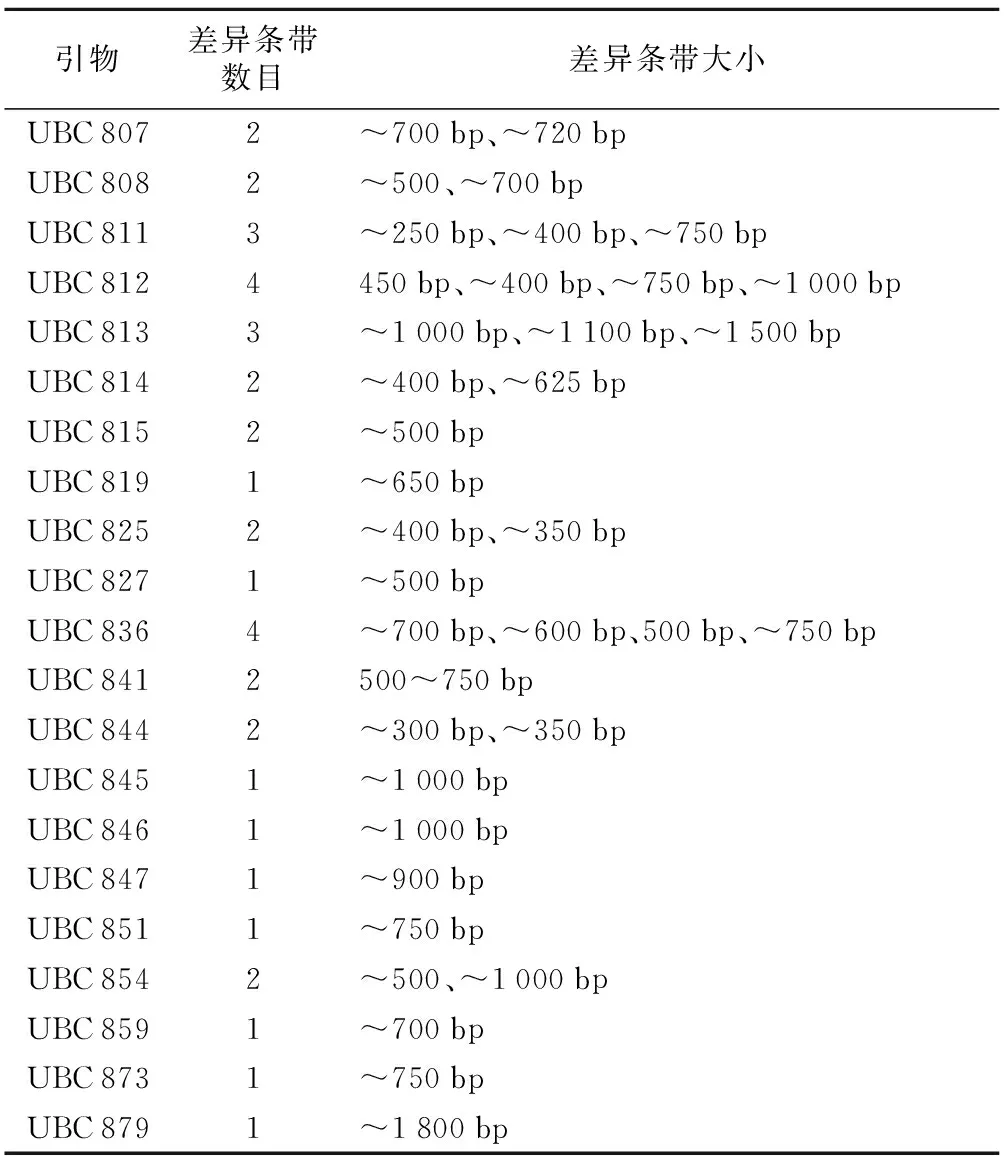
引物差异条带数目差异条带大小UBC8072~700bp、~720bpUBC8082~500、~700bpUBC8113~250bp、~400bp、~750bpUBC8124450bp、~400bp、~750bp、~1000bpUBC8133~1000bp、~1100bp、~1500bpUBC8142~400bp、~625bpUBC8152~500bpUBC8191~650bpUBC8252~400bp、~350bpUBC8271~500bpUBC8364~700bp、~600bp、500bp、~750bpUBC8412500~750bpUBC8442~300bp、~350bpUBC8451~1000bpUBC8461~1000bpUBC8471~900bpUBC8511~750bpUBC8542~500、~1000bpUBC8591~700bpUBC8731~750bpUBC8791~1800bp
42条引物中有21条引物在HTS-1和TP中扩增出差异条带。这21条引物共扩增出了39个差异条带,其中UBC 812、UBC 836产生的差异条带最多,为4条,大部分产生1~2条差异性条带。差异条带大小主要集中在250~750 bp之间。差异条带统计结果见表4。
3 讨 论
植物花发育是生物科学研究的热点领域之一,但前人研究主要集中在拟南芥和金鱼草2类模式植物和土豆等双子叶作物,近年来对单子叶作物水稻和玉米的研究逐渐增多,而对同属于单子叶作物的小麦研究极少[14]。其原因主要有2方面,一是小麦是异源六倍体,基因组庞大,约是人类基因组的5倍,且小麦中重复序列含量高,因此对功能基因的研究非常困难;另一方面,小麦中花器官的突变十分罕见,而花发育的研究主要依赖于新颖突变体的发现和利用。
小麦三雌蕊突变体(TP)1朵小花有3个正常的雌蕊,能结3粒,而正常小麦的小花中只有1个雌蕊,结1粒种子。因此,TP是研究小麦雌蕊发育的理想材料。而小麦雄蕊同源转化型不育突变体(HTS-1)是从TP中筛选出另一突变体,1朵小花中有1~3个雄蕊同源转化成雌蕊,因此,1朵小花中最多可以有6个雌蕊,但由于空间效应,目前只观察到1朵小花结4粒种子[4]。HTS-1是研究小麦雄蕊和雌蕊发育的好材料。目前TP和HTS-1的遗传背景基本清楚,但控制这些突变性状的基因尚未得到克隆。要准确克隆控制小麦三雌蕊性状和雄蕊同源转化为雌蕊性状的基因,目前行之有效的方法是图位克隆,而图位克隆的前提是对目的基因进行精细遗传作图,找到合适的与目的基因紧密连锁或共分离的分子标记。目前用于小麦基因定位的主要是SSR标记,由于SSR标记数量有限无法满足基因的精细定位要求,因此必须在小麦中开发新的分子标记。
本研究利用42条ISSR引物对TP、HTS-1和CM 28 TP之间特异性条带进行了筛选。结果发现,有9条引物能在TP和CM 28之间扩增出差异条带,占所用引物的21.4%。有20条引物能在HTS-1和CM 28之间扩增出差异条带,占所用引物的47.6%。有21条引物能在TP与HTS-1之间扩增出差异条带,占所用引物的50%。同时,该试验结果也说明,TP与CM 28之间的遗传多样性较小,而TP与HTS-1,HTS-1与CM 28之间的遗传多样性较大。这也说明ISSR具有较高的多态性鉴别能力,是一种简单有效的分子标记系统。因此,ISSR可作为SSR的一种重要补充标记用于遗传图谱的构建。本研究为进一步利用ISSR标记定位小麦三雌蕊基因Pis1和雄蕊同源转化为雌蕊基因hts1和hts2奠定了基础。
[1]陈济世,张岭华,吴秉.“三粒小麦”的发现及育种初报[J].作物学报,1983,9(1):69-72.
[2]Peng ZS.A New Mutation in Wheat Producing Three Pistils in a Floret[J].Agron.Crop.Sci.,2003,189:270-272.
[3]Peng ZS,Yang J,Wei SH,et al.Characterization of common wheat (TriticumaestivumL.) mutation line producing three pistils in a floret[J].Hereditas,2004,141:15-18.
[4]Peng ZS,Yang ZJ,Ouyang ZM,et al.Characterization of a novel pistillody mutant in common wheat[J].Aust.J.CropSci,2013,7:159-164.
[5]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat (SSR)-ancho red polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[6]周延清,景建洲,李振勇,等.怀区地黄遗传多样性的ISSR鉴定[J],中草药,2005,36(2):257-261.
[7]宗成堃,宋振巧,陈海梅,等.利用SSR、SRAP和ISSR 分子标记构建首张丹参遗传连锁图谱[J].药学学报,2015,50(3):360-366.
[8]钱剑林,俞文生.江浙地区杨梅主要品种的ISSR分析[J].植物资源与环境学报,2006,15(3):51-55.
[9]Sun J H,Li Z C,Jewet t D K,et al.Genetic diversity of Pueraria lobata (Kudzu) and closely related taxa as revealed by inter-simple sequence repeat analysis[J].Weed Res,2005,45(4):255-260.
[10]刘欢,慕平,赵桂琴.燕麦种质资源遗传多样性ISSR研究[J].草业学报,2012,21(4):116-124.
[11]李伦熊,永兴赵,玉霞吴,等.麻城福白菊的ISSR遗传图谱的构建[J].中国药师,2014,17(2):2 059-2 063.
[12]战晴晴,隋春,魏建和,等.利用ISSR和SSR分子标记构建北柴胡遗传图谱[J].药学学报,2010,45(4):517-523.
[13]Kojoma M,Iida O,Makino Y,et al.DNA Fingerprinting of Cannabis sativa using inter-simpl es equence repeat(ISSR) amplification[J].Planta Med,2002,68:60-63.
[14]Prokopyk DO and Ternovska TK.Homeotic genes and their role in development of morphological traits in wheat[J].Cytology and Genetics,2011,45(1):41-54.
由表4可知,皱果苋对含羞草茎叶水浸提液最为敏感,其化感综合效应平均值大小顺序为:皱果苋>柱花草>白菜>豇豆>萝卜>绿豆>苦瓜。
表4 含羞草对7种植物化感作用综合效应平均值
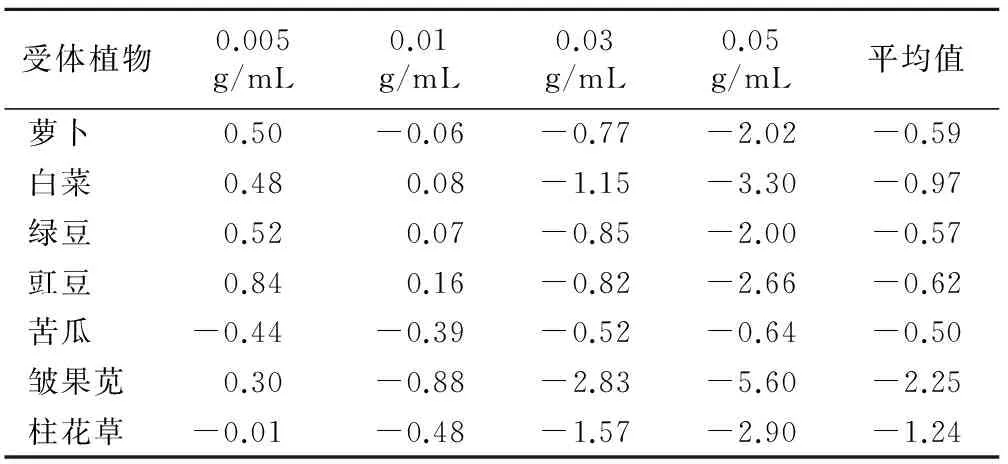
受体植物0.005g/mL0.01g/mL0.03g/mL0.05g/mL平均值萝卜0.50-0.06-0.77-2.02-0.59白菜0.480.08-1.15-3.30-0.97绿豆0.520.07-0.85-2.00-0.57豇豆0.840.16-0.82-2.66-0.62苦瓜-0.44-0.39-0.52-0.64-0.50皱果苋0.30-0.88-2.83-5.60-2.25柱花草-0.01-0.48-1.57-2.90-1.24
3 讨 论
本试验结果显示,含羞草茎叶存在化感物质,其水浸提液对7种受体植物均有一定的化感效应,但同一浓度浸提液处理下对不同受体植物的种子萌发和幼苗生长的化感效应不同。可表现出促进作用、抑制作用、促进/抑制双重作用等多种形式,但含羞草对7种受体植物的化感综合效应均为负值,即均表现出抑制作用,从而佐证了化感作用是含羞草成功入侵的机制之一。
含羞草对皱果苋和柱花草的抑制效果明显,含羞草的除草潜力值得关注。同一植物不同器官的化感物质也不完全相同,本研究只采用了含羞草茎叶的水浸提液对7种受体植物种子和幼苗生长的影响进行了研究,含羞草不同器官的化感作用差异有待进一步明确。
参考文献:
[1]芦站根,崔兴国,蒋文静.衡水湖黄顶菊的入侵情况的初步调查研究[J].衡水学院学报,2006,8(1):69-71.
[2]蒋红云,张燕宁,冯平章,等.石蒜对萝卜、黄瓜、番茄和油菜幼苗的化感效应[J].应用生态学报,2006,17(9):1 655-1 659.
[3]Ridenour W M,Callaway R M.The relative importance of allelopathy in interference:The effects of an invasive weed on a native bunchgrass[J].Oecologia,2001,126(3):444-450.
[4]Abhilasha D,Quintana N,Vivanco J,et al.Do allelopathic com-pounds in invasive Solidago canadensis s.l.restrain the native European flora[J].Journal of Ecology,2008,96(5):993-1 001.
[5]Vaughn S F,Berhow M A.Allelochemicals isolated from tissues of the invasive weed garlic mustard (Alliaria petiolata)[J].Journal of Chemical Ecology,1999,25(11):2 495-2 504.
[6]Zangerl A R,Berenbaum M R.Increase in toxicity of an invasive weed after reassociation with its coevolved herbivore[J].PNAS,2005,102(43):15 529-15 532.
[7]罗文启,符少怀,杨小波,等.海南岛入侵植物的分布特点及其对本地植物的影响[J].植物生态学报,2015,39(5):486-500.
[8]童毅,简曙光,陈权,等.中国西沙群岛植物多样性[J].生物多样性,2013,21(3):364-374.
[9]卢向荣,谭忠奇,林益明,等.入侵植物马缨丹对4种农作物的化感作用[J].厦门大学学报自然科学版,2013,52(1):133-138.
Screening of Specific Markers Among Wheat Line Three Pistils,Pistillody and Chuanmai 28 by ISSR Analysis
TANGHaifeng1a,YANGZaijun1a,LULu1b,PENGZhengsong1a,2,LIAOMingli1a,ZHANGLi1a,LUOQin1a,DAIChang1a
(1a.Key Laboratory of Southwest China Wildlife Resources Conservation (Ministry of Education),b.College of Environmental Science and Engineering,China West Normal University,Nanchong Sichuan 637009,China;2.School of Agricultural Sciences of Xichang College,Xichang Sichuan 615013,China)
In order to develop specific molecular markers between common wheat three pistils mutant (TP),pistillody mutant (HTS-1) and Chuanmai 28(CM 28),and lay the foundation for fine mapping ofPis1,hts1 andhts2 gene,the genetic diversities of TP,HTS-1 and CM 28 were compared and analyzed by using inter-simple sequence repeat (ISSR) marker.The results indicated that all the 42 ISSR primers amplified 403 bands.Nine ISSR primers (21.4%) were polymorphic between TP and CM 28.Twenty ISSR primers (47.6%) were polymorphic between HTS-1 and CM 28,and 21 primers (50%) were polymorphic between TP and HTS-1.A maximum of 4 different bands can be amplified by each primer and most of which produced 1-2 different bands.The difference bands were mainly with size in the range of 250-750 bp.These results showed that ISSR was simple,economic and effective molecular marker,and can be used as an important complement of SSR markers for the genetic map construction in wheat.
wheat; ISSR marker; pistillody mutant; three pistils mutant
2016-11-22
国家自然基金项目(31540041;31301319):四川省科技厅应用项目(16 JC 0022)。
唐海峰(1992—),男,四川成都人;硕士研究生,主要从事小麦遗传研究。
彭正松(1964—),男,四川安岳人;教授,主要从事小麦遗传学研究。
10.16590/j.cnki.1001-4705.2017.04.009
S 512.1
A
1001-4705(2017)04-0009-05
