枸杞果酒用非酿酒酵母的分离筛选及香气成分分析
2017-11-27剧柠赵梅梅柯媛陈玲赵智慧马艳
剧柠,赵梅梅,柯媛,陈玲,赵智慧,马艳
1(宁夏大学 农学院,宁夏回族自治区银川,750021) 2(宁夏红枸杞产业集团有限公司,宁夏回族自治区银川,750000)
枸杞果酒用非酿酒酵母的分离筛选及香气成分分析
剧柠1,2 *,赵梅梅1,柯媛2,陈玲2,赵智慧2,马艳2
1(宁夏大学 农学院,宁夏回族自治区银川,750021) 2(宁夏红枸杞产业集团有限公司,宁夏回族自治区银川,750000)
研究显示非酿酒酵母在果酒发酵前期可产生更多的香气成分,有助于果酒风味的提高。为获得适合枸杞果酒发酵的非酿酒酵母,从枸杞果园土壤、枸杞鲜果及枸杞果自然发酵液中分离出酵母82株。经香气初步筛选及耐受性研究,确定3株酵母各方面性能良好。经26S rDNA序列分析,确定GF-60和GF-80为葡萄汁有孢汉逊酵母(Hanseniasporauvarum),GB-1为戴尔有孢圆酵母(Torulasporadelbrueckii)。将GF-60与商用酿酒酵母以3∶1比例进行混合发酵枸杞果酒,经GC-MS测定分析,结果显示与酿酒酵母单独发酵相比,混种发酵含有更多种类的香气成分。
非酿酒酵母;耐受性;枸杞果酒;香气成分
枸杞含有丰富的营养成分及生物活性物质,具有增强人体免疫力, 以及抗衰老、防肿瘤等功效,被国家列为药食同源物品[1-3]。枸杞果酒是以宁夏枸杞果为原料,经酵母菌发酵制成的低度酒,较完整的保留了枸杞的主要营养成分[4-5]。近年来,随着人们对果酒接受度的提高,枸杞发酵果酒也越来越被大众所欢迎。然而,目前生产枸杞果酒使用的酵母多为葡萄酒专用的酿酒酵母。该类酵母具有较强的发酵能力,但产生香气的能力不足。此外,与其他果酒生产不同,考虑到季节性因素,枸杞果酒中生产中常使用枸杞干果复水的方法进行发酵;同时为去除表面农药残留,生产中枸杞原料发酵前需进行清洗,这使得大量枸杞果表面的非酿酒酵母被除去,发酵前期非酿酒酵母的作用无法得以发挥。因此,枸杞果酒存在着果香不突出、典型性欠佳的缺陷,影响了枸杞果酒的品质及销量。
大量研究表明,非酿酒酵母在葡萄酒酿制过程中,通过与酿酒酵母的共同发酵来控制酒体不理想的风味或者降低乙醇含量来赋予葡萄酒复杂的香气,从而增加葡萄酒感官质量特征的复杂性[6-8]。这些非酿酒酵母包括美极梅奇酵母(Metschnikowiapulcherrima)[9]、戴尔凯氏有孢圆酵母(Torulasporadelbrueckii)[10]、季也蒙有孢汉逊酵母(Hanseniasporaguilliermondii)[6]、嗜高压有孢汉逊酵母(Hanseniasporaosmophila)[11]、柠檬形克勒克酵母(Klockeraapiculata)[12]、德巴利酵母(Debaryomycesvanriji)[13]及葡萄汁有孢汉逊酵母(Hanseniasporauvarum)[14]等。 这些酵母在发酵过程中可产生一些高级醇、低级脂肪酸和酯类等芳香化合物,使得果酒的气味芬芳,酒体典型性更加突出。
为此,本项目从枸杞果表面、枸杞果园土壤及枸杞自然发酵醪液中分离出非酿酒酵母菌,经过感官评价及耐受性筛选获得性能较为优良的酵母,通过26S rDNA序列分析进行菌种鉴定确定其归属,并对其与酿酒酵母混种发酵的枸杞酒香气成分进行分析,从而筛选出能够改善枸杞酒香气的酵母菌。
1 材料与方法
1.1材料
1.1.1 样品采集
针对不同时节、不同树龄、不同从枸杞树品种的果园土壤、枸杞鲜果进行采样。样品无菌采集后送至实验室。
1.1.2 培养基与溶液配制方法
YPD(酵母膏胨葡萄糖)培养基:按葡萄糖2.0 %,蛋白胨2.0 %,酵母浸粉1.0 %,蒸馏水配置,自然pH值,121 ℃高压灭菌20 min;固体培养基则加入2.0 %琼脂粉。
PDA培养基:土豆去皮洗净,称取200 g马铃薯切成小块,加水煮烂,用双层纱布过滤,加热,再据实际实验需要加1~10 g琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入葡萄糖,搅拌均匀,稍冷却后在补足水分至1 000 mL,分装试管或者锥形瓶,加塞、包扎,121 ℃灭菌20 min后取出试管摆斜面或者摇匀,冷却后贮存备用。
1.1.3 菌种及主要仪器
酿酒酵母AC(Saccharomycescerecisiae522 Davis),由法国Laffort公司生产;日本岛津GCMS-TQ8040三重四极杆型气相色谱质谱联用仪;美国supelco 公司手动固相微萃取(SPME)装置。
1.2方法
1.2.1 酵母菌的分离
(1)土壤及枸杞果表面的分离
① 增菌:取5.0 g样品于45 mL YPD液体培养基中,28 ℃、200 r/min摇瓶培养24~48 h或更长时间,直至液体培养基变浑浊,镜检有活菌存在后进一步分离纯化。
② 计数:将经过增菌的液体进行10倍梯度稀释,并分别吸取0.1 mL均匀涂布于加有30 mg/L亚硫酸钠(以抑制细菌生长)的YPD培养基平板上,28 ℃培养48 h。
③ 分离:选取2天后生长于YPD培养基上的单个菌落,根据菌落形态特征及镜检结果,挑取单菌落于PDA培养基上划线培养分纯。
(2)枸杞自然发酵液中酵母菌的分离
① 自然发酵:无菌状态下称量约100 g新鲜成熟度好的枸杞,放入无菌的500 mL锥形瓶中,用无菌的研锤捣碎,用封口膜封好,置于28 ℃培养,每2 h观察1次。
② 计数:在发酵前、中、后3个时期,分别提取汁液进行10倍梯度稀释,取0.1 mL样品稀释液均匀涂布于酸化PDA培养基上,28 ℃ 培养48 h。
③ 分离:同1.2.1(1)。
(3) 保藏
镜检为纯种后进行4 ℃斜面保藏,每隔3个月转接1次;同时进行甘油-40 ℃菌种长期保藏。
1.2.2 产香酵母的筛选
将分离菌株划线接种于YPD 平板上, 28 ℃培养 3~5 d,通过嗅闻法[15]初步判断是否有酯香或醇香,筛选具有较浓酯香气或特殊果香气的菌株。将初筛获得的酵母菌接种于枸杞汁培养基中, 28 ℃活化培养24 h后,以4.0 %接种量接种于装有200 mL枸杞汁的三角瓶中,28 ℃培养 3~5 d,再次通过嗅闻法[15]判定具有较浓酯香气或特殊果香气的菌株。
1.2.3 产香酵母的耐受性研究
制备不同初始葡萄糖浓度、不同pH、不同SO2质量分数及不同乙醇体积分数的灭菌YPD液体培养基,按4.0 % 的接种量接种, 28 ℃培养48 ~72 h观察并记录结果。其中,乙醇耐受实验结果需通过分光光度计在560 nm下检测OD值获得。同时将相同接种量的枸杞汁培养基在不同温度下培养48 h ,观察并记录其产期情况。
1.2.4 26S rDNA基因序列测定及系统发育树分析
分离的酵母菌纯种送基因公司测序,将测序后结果在NCBI上进行BLAST比对,筛选相似度高的18序列,采用Neighbor-Joining(NJ)法构建系统发育树,使用Clustal X软件进行序列比对,MEGA 5.05绘制系统发育树。
1.2.5 枸杞果酒的酿制及操作要点

图1 枸杞果酒发酵工艺流程Fig.1 The fermentation process of wolfberry wine
操作要点:
(1)干果复水:干枸杞和水按照质量比为1∶10的比例进行混合复水。
(2)浸提:将复水好的液体煮沸30 min,冷却后留清汁备用。
(3)预处理:30~40 ℃下,添加30 mg/kg果胶酶和50 mg/kg果汁复合酶进行酶解。酶解后的枸杞汁,添加40 mg/kg SO2处理。
(4)调整成分:在枸杞汁中添加柠檬酸至酸度值为3 g/L;同时,为使目标酒精体积分数在8.0 %~10.0 %,在发酵前期及发酵中进行分批次补加白砂糖。
(5)酵母活化:将酵母菌分别接种于干果复水的枸杞汁培养基中活化。枸杞汁培养基按1.2.5(1)操作。
(6)发酵:采取清汁发酵的方式,发酵温度设为20 ℃。分别发酵两种酒,一种为单独接种酿酒酵母AC,另一种为葡萄汁有孢汉逊酵母GF-60与酿酒酵母AC以3∶1的比例同时接种发酵。接种量按体积分数8%接种。
(7)分离:当比重达0.992~0.996,残糖低于4 g/L时发酵结束,采用虹吸法进行分离。
(8)澄清过滤:抽滤机进行精滤。
(9)理化检测:测定挥发酸、残糖、酒度、总酸、游离SO2、总SO2。
1.2.6 香气成分分析
(1)挥发性化合物的萃取
利用手动顶空固相微萃取(HS-SPME)法对枸杞酒样品中挥发性物质进行富集,取20 mL顶空瓶,用无菌移液管加8 mL于40 ℃恒温磁力搅拌器上平衡10 min,插入CAR/DVB/PDMS纤维头40 ℃吸附15 min,GC解吸3 min,用于GC-MS分析。
(2)气相色谱质谱工作条件
色谱条件为:色谱柱为RTX-WAX (30 m×0.25 mm×0.25 μm ),程序升温:40 ℃保持2 min,以5 ℃/min 升至180 ℃,再以8 ℃/min 升至220 ℃,保持1 min。载气为He,体积流量为1.40 mL/min,进样口温度为210 ℃。质谱条件为:EI 电离源,电子能量为70 eV,灯丝流量为0.20 mA。检测器电压为350 V。扫描范围为20~450 AMU,离子源温度为200 ℃。
对采集到的质谱图利用NIST 02谱库进行检索。
2 结果与讨论
2.1产香酵母的分离及初筛结果
通过分离纯化共获得纯种酵母菌82株。其中6株分离自土壤,13株分离自枸杞果表面,63株分离枸杞自然发酵液的不同时期(发酵前期9株,中期48株,后期4株)。
通过嗅闻法初筛后获得24株酵母菌,进一步接入枸杞汁发酵后筛选出9株果香和酒香味较浓的酵母菌,分别为GB-1、GB-21、GB-23、GB-26、GB-40、GF-60、GF-65、GF-85、和GG-8。
2.2产香酵母的对葡萄糖的耐受性
针对上述9株产香酵母进行葡萄糖、pH、SO2及温度耐受性实验,实验结果见表1。从表1的结果可知,菌GB-1、GB-26、GB-40和GF-85在对糖的耐受性最好,在100~400 g/L的糖质量浓度下,24 h内生长旺盛。GG-8可耐受100 g/L的糖,24 h内生长旺盛;延长培养时间至48 h,GG-8在100~400 g/L 的糖质量浓度下可生长,且生长旺盛。GB-21和GF-60可在100~400 g/L 的糖浓度下生长,48 h后生长达到旺盛。100~400 g/L 的糖质量浓度下,GF-23和GF-60在24 h内未生长,然而在48 h后观察这2株菌可耐受在100~300 g/L 的糖质量浓度,且生长良好。GF-65在100~400 g/L的糖质量浓度下均无法生长。
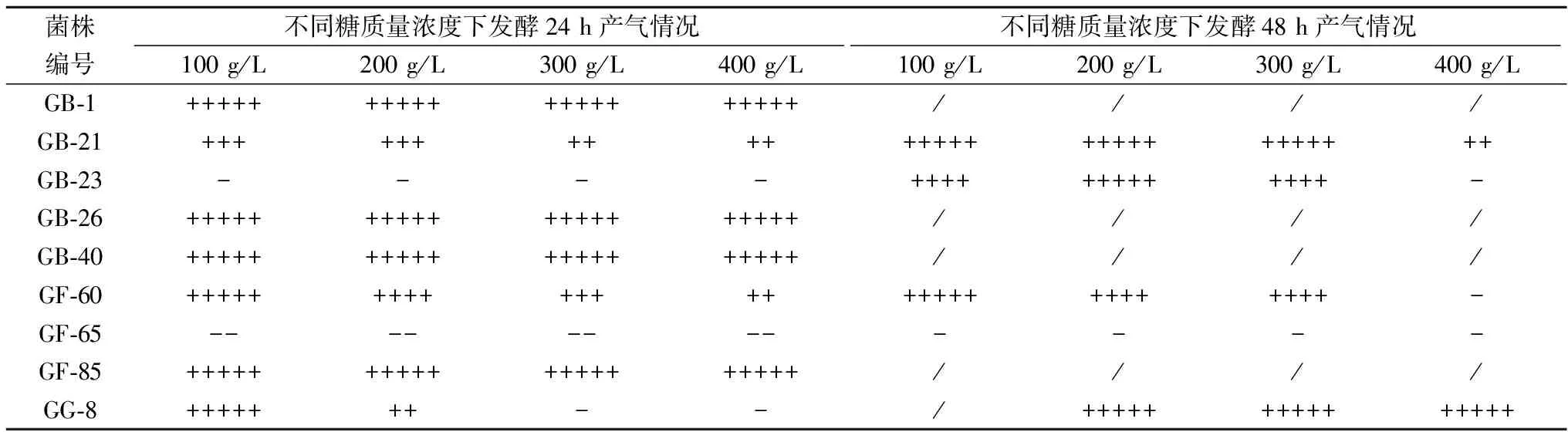
表1 不同酵母菌糖耐量实验结果
注:“+++++”表示气体充满整个杜氏管,“++++”表示气体充满杜氏管4/5,“+++”表示气体充满杜氏管3/5,“++”表示气体充满杜氏管2/5,“+”表示气体充满杜氏管1/5,“-”表示气体充满杜氏管lt;1/5,“--”表示未起酵。
2.3产香酵母的对SO2的耐受性
表2给出了菌株耐受SO2的情况。所有供试的9菌株耐受SO2的能力都很强。其中GB-1,GB-21,GB-23,GB-26和GB-40在24 h内即可在含100~250 mg/L SO2的培养基中旺盛生长。GF-60、GF-65、GF-85和GG-8在24 h内即可在含100~250 mg/L SO2的培养基中生长,48 h后生长达到旺盛。
2.4产香酵母的对乙醇的耐受性
酵母菌OD值越大,则表示该酵母菌生长越旺盛,即对该浓度乙醇的耐受性越强。因此,根据 OD 值测定结果,以酵母菌 OD 生长值的平均值为标准,将各类酵母菌生长情况设定为4个等级,即I不生长(0lt;ODlt;0.03),II生长(0.05lt;ODlt;0.09),III良好生长(0.150lt;ODlt;0.200),IV旺盛生长(ODgt;0.200),生长结果见表3。
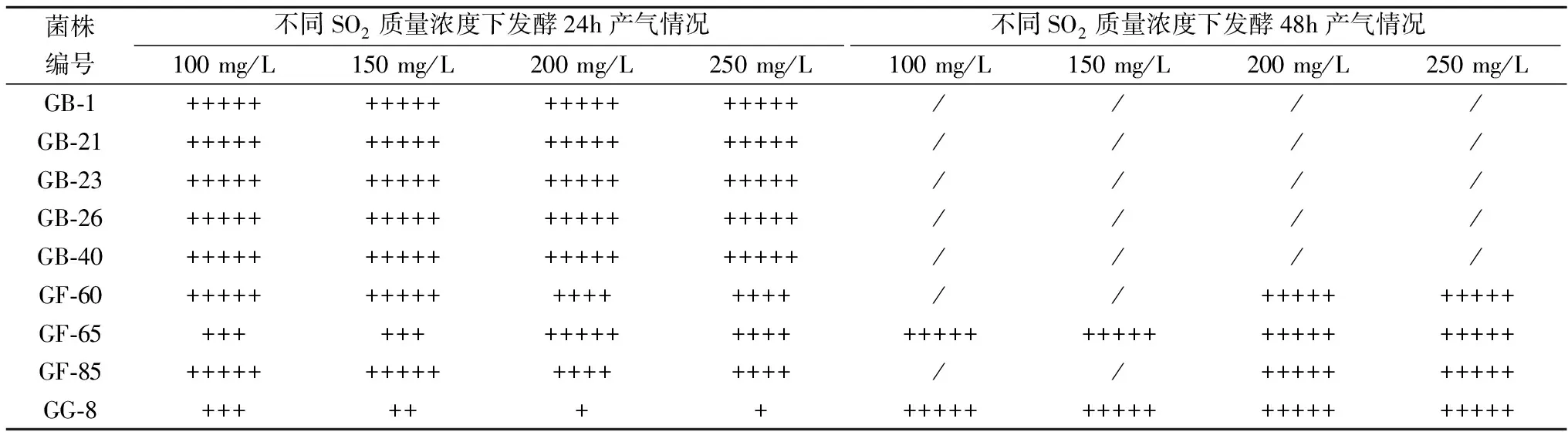
表2 不同酵母耐SO2实验结果
注:“+++++”表示气体充满整个杜氏管,“++++”表示气体充满杜氏管4/5,“+++”表示气体充满杜氏管3/5,“++”表示气体充满杜氏管2/5,“+”表示气体充满杜氏管1/5,“-”表示气体充满杜氏管lt;1/5,“--”表示未起酵。
从结果可以看出,GB-1和GF-60耐受乙醇的能力最强,即使在14%的乙醇体积分数下,24 h内依然可以旺盛生长。其次为GB-21、GF-65和GF-85,在12%的乙醇浓度下,24 h内依然可以旺盛生长。GF-40虽然生长不旺盛,但在10%~14%的乙醇体积分数下均可得以生长。其余菌株,GB-21、GB-23、GB-26、GG-8在10%~12%的乙醇下均可得以生长,不能耐受14%的乙醇。

表3 不同酵母耐受乙醇实验结果
2.5产香酵母的对温度的耐受性
表4给出了9株酵母对温度的耐受性。除GB-23、GF-60和GF-65在40 ℃下不生长外,所有菌株都可在10~40 ℃的范围内生长。GB-1在果酒常用的低温发酵的范围(15~20 ℃)24 h内即可达到旺盛生长。此外,GB-21、GB-23、GB-40、GF-65和GF-85在15~20℃的范围内,36 h产气充满杜氏管,说明生长旺盛。
2.6优良产香酵母的分子生物学鉴定结果
研究显示,非酿酒酵母在果酒发酵的前期发酵可以产生更多的香气成分,因此其发酵前期菌种本身的特性非常重要。根据耐受性结果,菌株GB-1,GF-85,GF-60性能较为优良。对该3株菌进行26S rDNA基因序列测定并构建系统发育树,结果见图 2。根据菌体形态、菌落形态特征以及序列对比分析,菌株GF-85与GF-60鉴定为葡萄汁有孢汉逊酵母(Hanseniasporauvarum),菌株GB-1鉴定为戴尔有孢圆酵母(Torulasporadelbrueckii)。
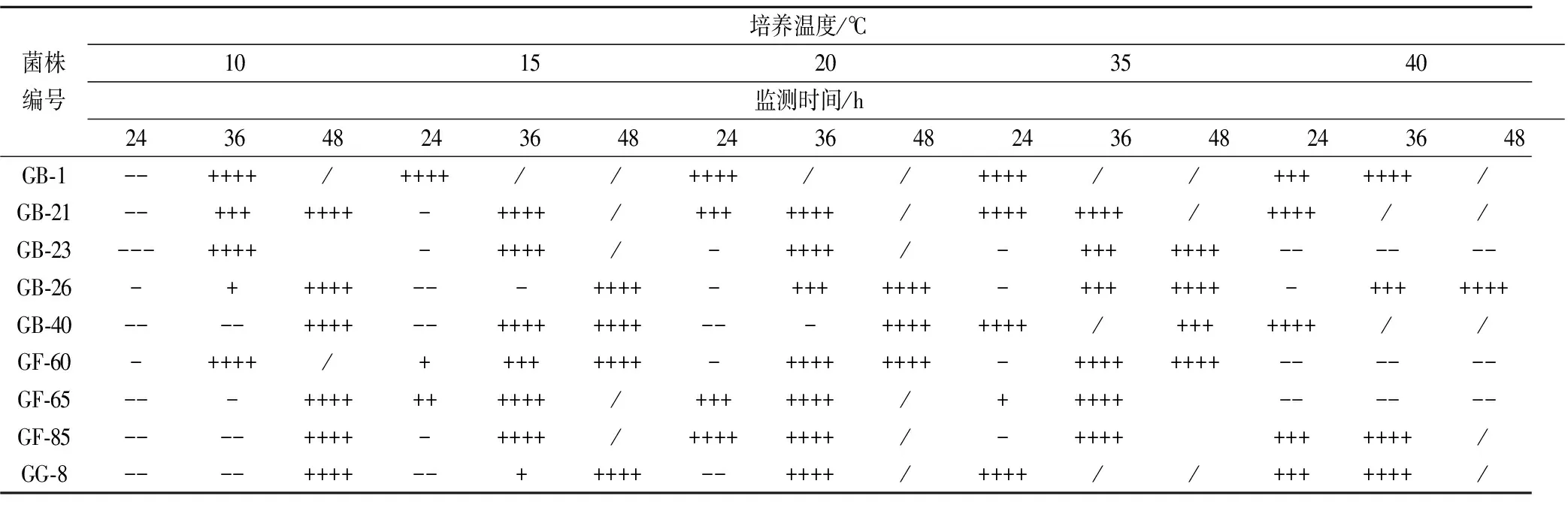
表4 不同温度下酵母菌的生长情况
注:“++++”表示气体充满整个杜氏管,“+++”表示气体充满杜氏管3/4“++”表示气体充满杜氏管2/4,“+”表示气体充满杜氏管1/4,“-”表示气体充满杜氏管lt;1/4,“--”表示未起酵。
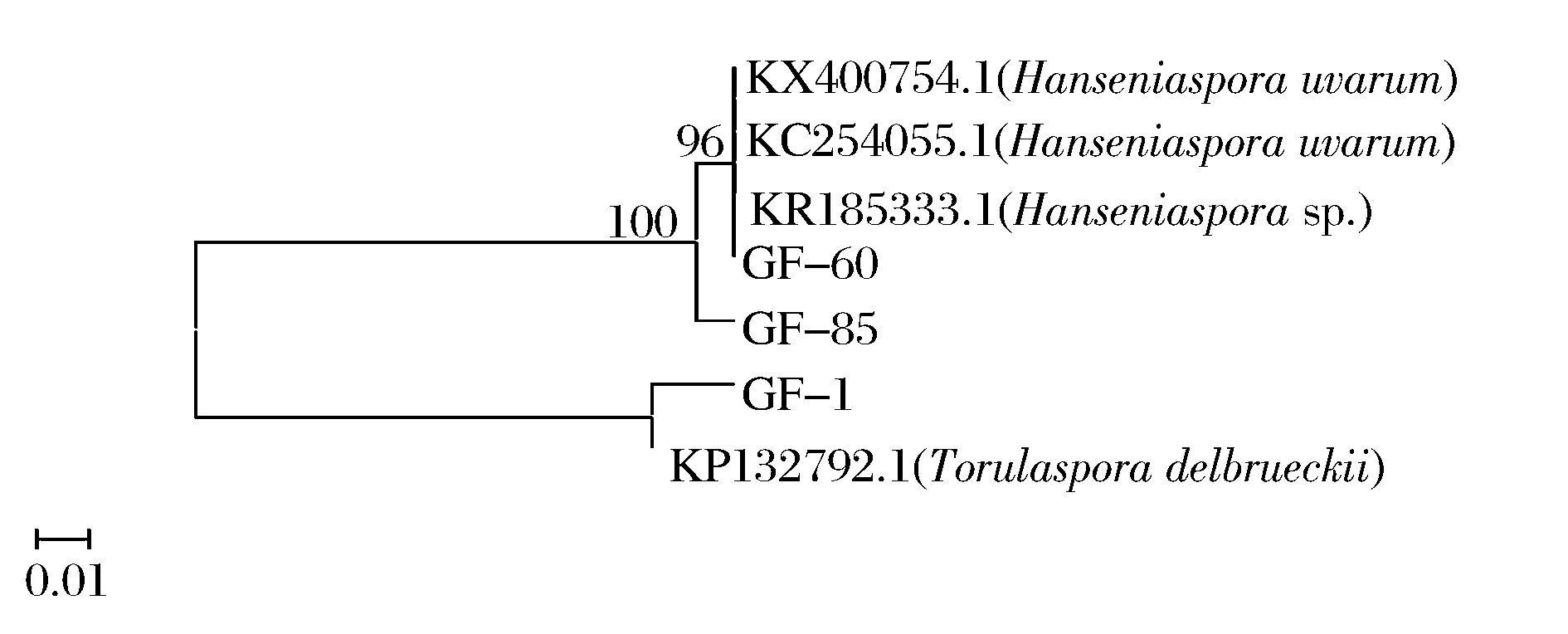
图2 基于26S rRNA D1 /D2 区域序列构建的酵母菌菌株系统进化树Fig.2 Phylogenetic tree of yeast strains based on 26S rRNA D1/D2 domain sequence analyses
2.7香气成分分析
采用酿酒酵母AC单独发酵及GF-60与AC以3∶1的方式进行混合发酵生产枸杞发酵果酒,发酵结束后采用GC-MS对其中的挥发性成分进行分析比较。总离子流图见图3,图4。
所检测到的质谱数据经过NIST标准谱库检索后,获得不同样品挥发性化合物的种类及相对含量见表5。实验共检测出挥发性化合物46种,其中酯类25种、醇类8种、烷烃类6种、酮类2种、酸类2种、烯烃类1种、醛类1种。与酿酒酵母AC单独发酵的枸杞酒样相比,葡萄汁有孢汉逊酵母GF-60与酿酒酵母AC混合发酵枸杞酒所检出的香气成分更为复杂。
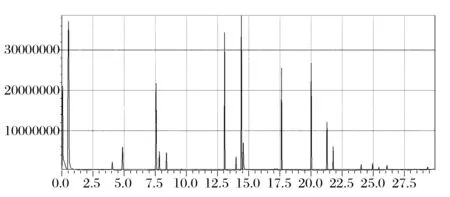
图3 酿酒酵母AC单独发酵枸杞果酒的GC-MS总离子流图Fig.3 Total ion chromatograms of wolfberry wines with Saccharomyces cerecisiae AC fermentation
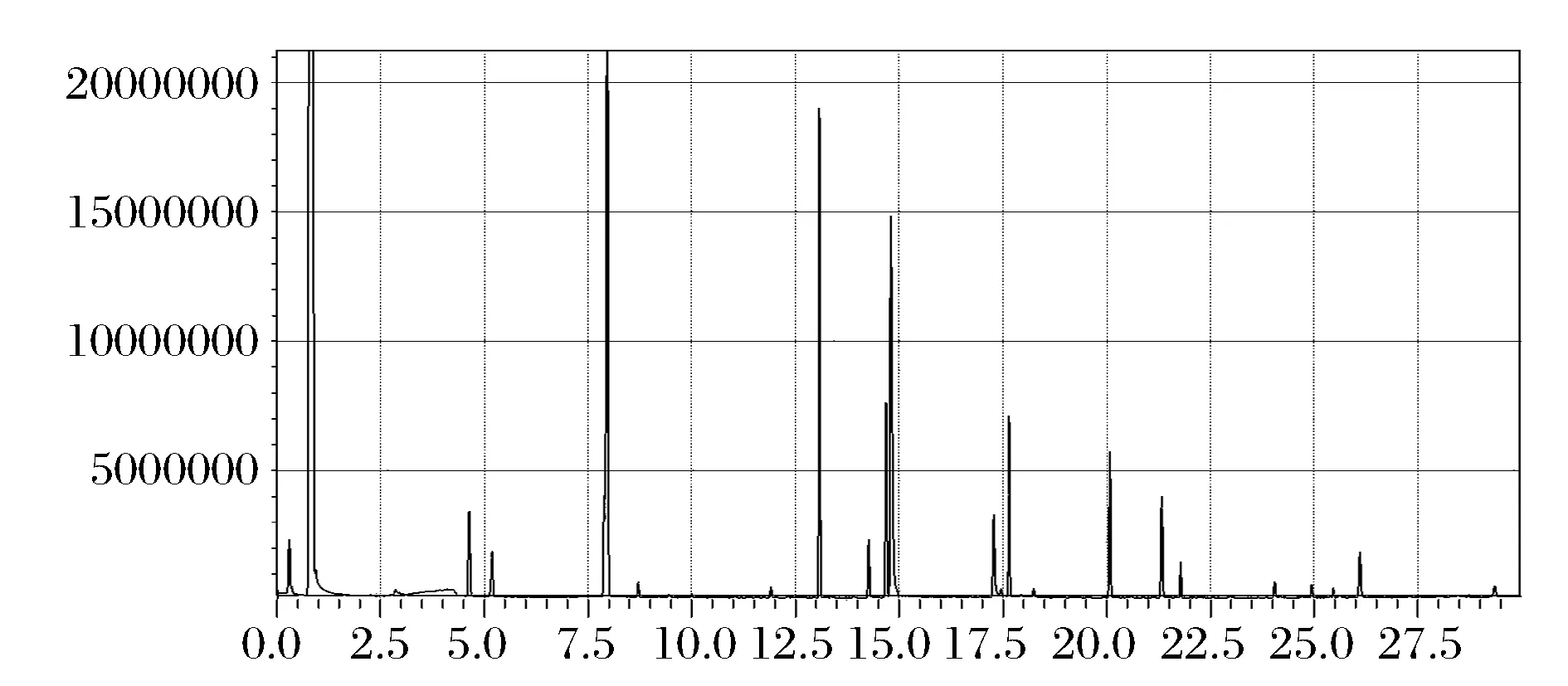
图4 葡萄汁有孢酵母GF-60与酿酒酵母AC(3∶1)混种发酵枸杞果酒的GC-MS总离子流图Fig.4 Total ion chromatograms of wolfberry wines with Hanseniaspora uvarum GF-60 and Saccharomyces cerecisiae AC mixed fermentation (3∶1)
酯类物质是构成枸杞酒香气的主要成分。混合发酵所检测到的酯类物质无论从种类(20种)还是含量(31.58%)均远远超出了酿酒酵母单独发酵时酒样中酯类种类(13种)及含量(15.14%)。且混合发酵产生的主要的酯类物质辛酸乙酯(13.00%)和癸酸乙酯(8.36%)均高于酿酒酵母单独发酵所产生的辛酸乙酯(9.21%)和癸酸乙酯(2.33%)。其中辛酸乙酯具有白兰地酒香气,癸酸乙酯具有果香和花香的香气。此外,混合发酵还检出多种单独发酵未检出的酯类,这些酯类物质大多具有花香和果香气,虽然含量很低,但较低的阈值使得混合发酵枸杞果酒具有比酿酒酵母单独发酵更为丰富的香气。因此,混合发酵的枸杞果酒具有更加浓郁的花香和果香味。
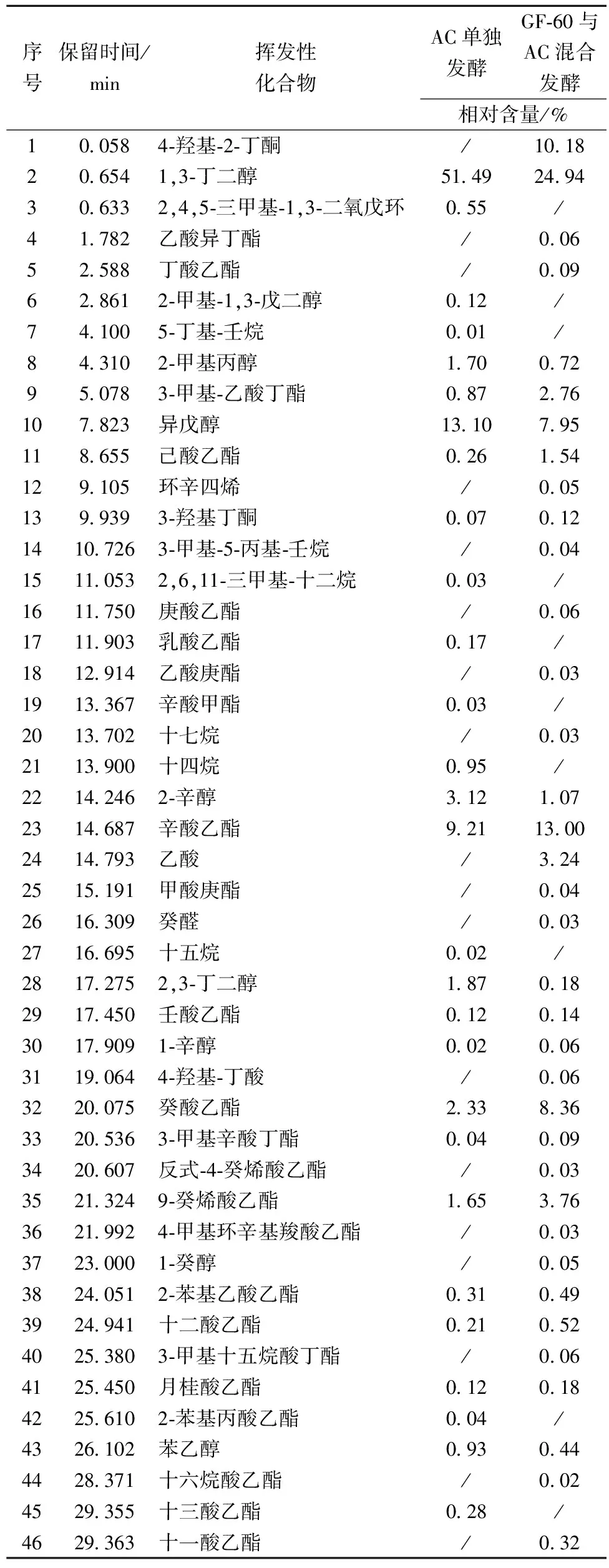
表5 两种枸杞果酒的主要香气成分
除酯类物质外,醇类物质也是枸杞酒挥发性成分的重要组成部分。混合发酵所检测到的醇类物质种类(7种)和含量(35.41%)低于酿酒酵母单独发酵的种类(8种)及含量(71.42%)。其中,枸杞果酒种主要的醇类物质1,3-丁二醇在混合发酵枸杞酒中含量(24.94%)远远低于酿酒酵母单独发酵的酒体(51.49%)。异戊醇是枸杞果酒种另一种主要醇类,同样其在混合发酵枸杞酒中的含量(7.95%)低于酿酒酵母单独发酵的酒体(13.10%)。1,3-丁二醇略有苦甜味,异戊醇具有酒香和果香的味道。因此,混合发酵酒体的苦味没有酿酒酵母单独发酵时的明显。
烷烃类化合物相对含量较低且烷烃香味阈值较高,对风味物质的直接贡献不大,但其可能是形成杂环化合物的重要中间体,有助于提高酒体的整体风味。
4-羟基-2-丁酮具有芳香气味,混合发酵酒样中相对含量为10.18%,而AC发酵酒样未检出。检出的另一物质,3-羟基2-丁酮具有令人愉快的奶香气,其在混合发酵酒样中的相对含量略高于单独发酵酒样。
此外,GF-60的混合发酵样品中还检测到乙酸和4-羟基-丁酸两种酸类,癸醛一种醛类,这些物质虽然含量低,但都对复杂的香气做出了贡献。
3 结论
从枸杞果园土壤、枸杞鲜果及枸杞自然发酵液中分离出酵母82株。经感官初筛获得9株果香和酒香味较浓的酵母菌。经葡萄糖耐受性、SO2耐受性、乙醇耐受性、温度耐受性实验,确定GF-60和GF-80和GB-1各方面性能良好。经26S rDNA序列分析,确定菌GF-60和GF-80为葡萄汁有孢汉逊酵母(Hanseniasporauvarum),GB-1为戴尔有孢圆酵母(Torulasporadelbrueckii)。将GF-60与商用酿酒酵母以3∶1进行混合发酵枸杞果酒,经GC-MS测定分析,结果显示与酿酒酵母单独发酵相比,混种发酵含有更多种类的香气成分;与酿酒酵母单独发酵相比,具有更加复杂的花香与果香气,原有苦味减弱,有助于提高改善枸杞酒的风味。
[1] 刘凌,孙慧,周明, 等.提取纯化工艺对枸杞多糖抗氧化功能的影响[J].食品与发酵工业,2009,35(7):156-159.
[2] 董静洲,王英.宁夏枸杞主要产区枸杞子总黄酮的测定与分析研究[J].食品研究与开发,2009,30(1):36-40.
[3] 如克亚·加帕尔,孙玉敬,钟烈州,等.枸杞植物化学成分及其生物活性的研究进展[J].中国食品学报,2013,13(8):161-171.
[4] 杨永利,明磊国,林浩,等. 枸杞养肝明目功效研究进展[J].中国食物与营养,2015,21(7): 75-78.
[5] 倪志婧,马文平.枸杞果酒酿造工艺研究[J].安徽农业科学,2009, 37(24): 11 712-11 713.
[6] MOREIRA N, MENDES F, de PINHO P G,et al. Heavy sulphur compounds, higher alcohols and esters production profile ofHanseniasporauvarumandHanseniasporaguilliermondiigrown as pure and mixed cultures in grape must[J]. International Journal of Food Microbiology, 2008, 124(3): 231-238.
[7] ASSIS M O, SANTOS A P C, ROSA C A,et al. Impact of a non-Saccharomycesyeast isolated in the equatorial region in the acceptance of wine aroma[J]. Food and Nutrition Sciences, 2014, 5(9): 759-769.
[8] JOHNSON E A. Biotechnology of non-Saccharomycesyeasts: the ascomycetes[J]. Applied Microbiology and Biotechnology, 2013, 97(2): 503-517.
[9] COMITINI F, GOBBI M, DOMIZIO P, et al.Selected non-Saccharomyceswine yeasts in controlled multistarter fermentations withSaccharomycescerevisiae[J]. Food Microbiology, 2011, 28(5): 873-882.
[10] RENAULT P, MIOT-SERTIER C, MARULLO P, et al. Genetic characterization and phenotypic variability inTorulasporadelbrueckiispecies: potential applications in the wine industry[J]. International Journal of Food Microbiology, 2009, 134(3): 201-210.
[11] VIANA F, GIL J V, VALLES S, et al. Increasing the levels of 2-phenylethyl acetate in wine through the use of a mixed culture ofHanseniasporaosmophilaandSaccharomycescerevisiae[J]. International Journal of Food Microbiology, 2009, 135(1): 68-74.
[12] 王星晨,胡 凯,陶永胜.葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学[J].食品科学,2016,37(3):103-108
[13] 朱一松, 赵光鳌, 帅桂兰.Debaryomycesvanriji和Saccharomycescerevisiae的混合培养及其对葡萄酒风味的影响[J].酿酒科技, 2003(4): 70-72.
[14] 韩姗姗,刘树文,张振文.柠檬形克勒克酵母对葡萄酒风味的影响[J]. 酿酒科技,2008(3): 56-58.
[15] 刘文丽,孙舒扬,贡汉生,等.不同酿酒酵母发酵的干红樱桃酒酒体成分及感官质量分析[J].食品与发酵工业,2016,42(1):157-166.
Isolation,screeningandanalysisofaromacomponentsofnon-Saccharomycesforwolfberrywine
JU Ning1,2*, ZHAO Mei-mei1, KE Yuan2, CHEN Ling2, ZHAO Zhi-hui2, MA Yan2
1 (School of Agriculture Ningxia University, Yinchuan 750021, China) 2 (Ningxia Hong Gouqi Industry Group Co., Ltd, Yinchuan 750000, China)
Studies have shown that nonSaccharomycescan produce more aroma components at the pre- fermentation stage of fruit wine, which contributes to the improvement of wine flavor. In order to obtain the non-Saccharomycessuitable for wolfberry wine, 82 strains of yeast were isolated from wolfberry orchard soil, fresh fruit of wolfberry and naturally fermented wolfberry liquid. 3 strains showed good performance in aroma and tolerance after preliminary screening and tolerance study. By the analysis of 26S rDNA sequence, GF-60 and GF-85 were identified asHanseniasporauvarum, GB-1 was identified asTorulasporadelbrueckii. Through GC-MS analysis, the wolfberry wine fermented by GF-60 and commercial yeast (ratio 3∶1) produced more kinds of aroma components than which was fermented only by commercial yeast.
non-Saccharomyces; tolerance; wolfberry wine; aroma components
10.13995/j.cnki.11-1802/ts.014953
博士,副教授(本文通讯作者,E-mail:juning1122@163.com。第1、第2单位对本文具有同等作用)。
中央财政支持地方高校改革发展资金项目(2017)
2017-06-13,改回日期:2017-08-05
