抗肿瘤血管形成药物的临床疗效研究
2017-11-23周文静
周文静
【摘要】 目的 研究人参皂甙2Rg3、姜黄素、青蒿琥酯、熊果酸4种中药对抗肿瘤血管形成的临床疗效。方法 132例肿瘤患者, 随机分为Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组, 每组33例。Ⅰ组使用人参皂甙2Rg3治疗, Ⅱ组使用姜黄素治疗, Ⅲ组使用青蒿琥酯治疗, Ⅳ组使用熊果酸治疗, 分别观察四组的抗肿瘤血管形成的临床疗效。结果 Ⅰ组(人参皂甙2Rg3)的有效率为88%, Ⅱ组(姜黄素)的有效率为91%, Ⅲ组(青蒿琥酯)的有效率為85%, Ⅳ组(熊果酸)的有效率为82%;四组有效率比较差异无统计学意义(P=0.9989>0.05)。结论 人参皂甙2Rg3、姜黄素、青蒿琥酯、熊果酸对抗肿瘤血管形成都有较好的临床疗效。
【关键词】 抗肿瘤血管形成;人参皂甙2Rg3;姜黄素;青蒿琥酯;熊果酸
DOI:10.14163/j.cnki.11-5547/r.2017.32.059
1971年Folkman在新英格兰医学杂志上首次提出肿瘤的生长和转移依赖于血管生成, 为肿瘤研究开辟了新天地, 通过对肿瘤血管生成进行治疗成为一项重要的治疗策略。通过对抑制肿瘤血管生成分子机制的研究[1, 2], 在寻找抗肿瘤血管形成药物方面取得了较大的进展, 在美国就已有20余种肿瘤血管生成抑制剂进入临床。另一方面, 近些年的热点之一是从植物中提取抗肿瘤血管形成药物, 如人参皂甙2Rg3、姜黄素、青蒿琥酯、熊果酸等, 也表现出较好的疗效性。因此, 研究中药对抗肿瘤血管形成的临床疗效有重要的研究意义。本文对本院进行治疗的肿瘤患者分别使用人参皂甙2Rg3、姜黄素、青蒿琥酯、熊果酸这4种抗肿瘤血管形成的中药进行治疗, 观察其对抗肿瘤血管形成的临床疗效。报告如下。
1 资料与方法
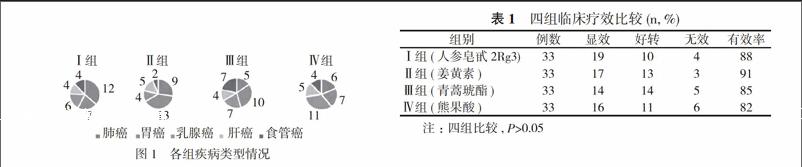
1. 1 一般资料 选取2016年1月~2017年7月在院治疗的132例肿瘤患者, 随机分为Ⅰ、Ⅱ、Ⅲ、Ⅳ组, 每组33例。Ⅰ组中男18例, 女15例, 年龄50~76岁, 中位年龄62岁, 其中肺癌12例, 胃癌7例, 乳腺癌6例, 肝癌4例, 食管癌4例。
Ⅱ组中男17例, 女16例, 年龄52~74岁, 中位年龄60岁, 其中肺癌9例, 胃癌13例, 乳腺癌4例, 肝癌5例, 食管癌2例。
Ⅲ组中男14例, 女19例, 年龄55~80岁, 中位年龄67岁, 其中肺癌5例, 胃癌10例, 乳腺癌7例, 肝癌4例, 食管癌7例。
Ⅳ组中男15例, 女18例, 年龄51~77岁, 中位年龄63岁, 其中肺癌6例, 胃癌7例;乳腺癌11例, 肝癌5例, 食管癌4例。四组患者一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。全部病例均经组织学或细胞学确诊。卡氏评分(KPS评分)均≥80分。各组疾病类型见图1。
1. 2 方法 Ⅰ组使用人参皂甙2Rg3作为抗肿瘤血管形成的中药进行治疗, 其主要机制经中国中医研究院广安门医院的研究证实[3], 是作用于血管内皮生长因子(VEGF)和碱性成纤维细胞生长因子(bFGF)两个肿瘤血管生长基因的位点, 抑制其蛋白质合成和基因的表达, 从而阻断肿瘤吸收养分和播散细胞的通道, 起到抗肿瘤转移的作用。Ⅱ组使用姜黄素作为抗肿瘤血管形成的中药进行治疗, 其主要机制是通过抑制人脐静脉内皮细胞(HUVEC)的增殖进而抵抗肿瘤血管的形成 [4]。而HUVEC在迁移、增殖和分化过程中易导致血管形成, 从而容易诱导和促进肿瘤发生。Ⅲ组使用青蒿琥酯作为抗肿瘤血管形成的中药进行治疗, 其主要机制经免疫组化结果表明, 具有抑制VEGF和KDR/ flk21在肿瘤组织中的表达作用[5]。Ⅳ组使用熊果酸作为抗肿瘤血管形成的中药进行治疗, 其主要机制推测可能通过与糖皮质激素受体或类似的核受体结合发挥作用。
1. 3 疗效判定标准 观察比较四组抗肿瘤血管形成的临床疗效。参照文献[4]制定疗效判定标准, 分为显效、好转、无效;有效率=(显效+好转)/总例数×100%。
1. 4 统计学方法 所有数据分析采用Matlab进行, 计量Ⅰ~Ⅳ组所使用的人参皂甙2Rg3、姜黄素、青蒿琥酯、熊果酸这4种抗肿瘤血管形成的有效率, 四组数据运用Kruskal-Wallis秩和检验。P<0.05 为差异有统计学意义。
2 结果
Ⅰ组(人参皂甙2Rg3)的有效率为88%, Ⅱ组(姜黄素)的有效率为91%, Ⅲ组(青蒿琥酯)的有效率为85%, Ⅳ组(熊果酸)的有效率为82%。四组有效率比较, 差异无统计学意义(P=0.9989>0.05)。见表1。
3 讨论
近年来研究证明, 新血管生成是肿瘤生长和转移的必要条件之一, 而断绝或减少肿瘤血管供应, 抑制肿瘤血管生成是控制肿瘤生长和转移的重要途径[6-8]。抑制肿瘤血管生成的关键在于条件血管生成因子或其受体, 包括VEGF和血管内皮生长因子受体(VEGFRs)。VEGF具有诱导血管通透性的能力, 通透性增强导致纤维蛋白沉积在细胞外基质, 作为血管内皮细胞迁移的一个支架, 而VEGFRs可与VRGF结合并激活导致血管通透性增强。内皮抑素(ES)是一种强烈抑制血管形成的因子, 能与VEGF竞争性结合, 通过抑制内皮细胞增值、促进内皮细胞凋亡等作用最终达到抑制肿瘤血管生成的作用[9, 10]。
研究表明, 人参皂甙2Rg3、姜黄素、青蒿琥酯、熊果酸等许多中药成分可以抑制VEGF, 增高ES, 从而抑制血管肿瘤血管生长。这为肿瘤的治疗提供了新的契机, 与传统的肿瘤治疗相比其具有特异性强、正常组织不易受损、不易发生耐药、抗瘤谱广等优势。除了本文中的4种中药外, 还可以使用鲨鱼软骨、红素、昆布硫酸多糖、苦参碱、参麦注射液等药物来抗肿瘤血管的生成[7]。当然, 目前抗肿瘤血管生成药物的临床应用, 多以扶正为主, 对其疗效评价无统一标准。相信, 随着科学技术的进步, 其在癌症治疗中将会起着越来越重要的作用。
参考文献
[1] Turner HE, Nagy Z, Gatter KC, et al. Angiogenesis in pituitary adenomas-relationship to endocrine function, treatment and outcome. Journal of Endocrinology, 2000, 165(2):475-481.
[2] 高文, 何彦津, 梁凤鸣. 姜黄素抗肿瘤血管生成分子机制研究进展. 国际眼科杂志, 2016, 16(3):466-468.
[3] 周逢仓, 金明. 肿瘤的分子诊断及其研究进展(综述). 安徽卫生职业技术学院学报, 2003, 2(1):54-56.
[4] Aggarwal BB, Sung B. Pharmacological basis for the role of curcumin in chronic diseases: an age-old spice with modern targets. Trends in Pharmacological Sciences, 2009, 30(2):85.
[5] 陈欢欢, 周慧君. 青蒿琥酯的抗血管生成作用. 药学学报, 2004, 39(1):29-33.
[6] 林洪生. 恶性肿瘤中医诊疗指南. 北京:人民卫生出版社, 2014.
[7] 张芷旋, 周清华. 中药抗肺癌血管生成药物的研究进展. 中国肺癌杂志, 2006, 9(1):96-99.
[8] 李湘洲, 栾芳菲, 张胜, 等. 黄酮类化合物的抗肿瘤和抗血管生成作用研究进展. 食品与机械, 2016(1):199-201.
[9] 张俊利, 李宜放. 中医药抗肿瘤血管生成研究现状. 医学综述, 2015, 21(8):1394-1395.
[10] 吴军, 王婧, 曹邦伟. 抗肿瘤血管生成药物不良反应的发生机制及处理. 医学综述, 2016, 22(16):3154-3157.
[收稿日期:2017-09-07]endprint
