EFS20/40和GP25玻璃化法冷冻保存小鼠体外受精2细胞期胚的效果
2017-11-17朴香丽杜文敬王春生尹洪哲朴善花吉林省和龙市动物卫生监督所吉林和龙33500东北林业大学生命科学学院黑龙江哈尔滨50040
朴香丽,杜文敬,王春生,尹洪哲,朴善花*(.吉林省和龙市动物卫生监督所,吉林 和龙 33500;.东北林业大学 生命科学学院,黑龙江 哈尔滨 50040)
实验研究
EFS20/40和GP25玻璃化法冷冻保存小鼠体外受精2细胞期胚的效果
朴香丽1,杜文敬2,王春生2,尹洪哲1,朴善花2*
(1.吉林省和龙市动物卫生监督所,吉林 和龙 133500;2.东北林业大学 生命科学学院,黑龙江 哈尔滨 150040)
为了筛选适合用于冷冻保存小鼠体外受精2细胞期胚胎的方法,本研究采用EFS20/40法和GP25法对体外受精小鼠2细胞胚进行冷冻保存,并经解冻后进行体外培养,观察其胚胎发育至扩张囊胚的能力。其结果,虽然两种方法冷冻解冻后的正常胚胎回收率相近,但采用EFS20/40法冷冻解冻的胚胎在体外发育至扩张囊胚比率(84.9%)显著高于GP25法的54.8%(P<0.05)。表明EFS20/40法适合用于小鼠体外受精2细胞期胚胎的冷冻保存。
小鼠;体外受精;2细胞期胚;玻璃化冷冻
自Rall等[1]发明了简便、快速和易于推广的胚胎玻璃化冷冻保存法以来,已先后开发多种胚胎玻璃化冷冻方法,其中EFS20/40法[2]和GP25法[3]是常用两种方法。为此,本研究分别利用EFS20/40法和GP25法对小鼠体外受精2细胞期胚胎进行冷冻保存, 并观察其在解冻后的体外发育能力, 以期筛选适用于小鼠不同发育时期胚胎的最佳冷冻保存方法。
1 材料与方法
1.1 小鼠体外受精和2细胞期胚胎获得
利用改良的M16培养液[4],在培养皿(35 mm×14 mm ) 中注入200 LL上述各培养液, 并用液体石蜡封盖, 在CO2培养箱(37℃、5%CO2、95%空气、加湿) 中平衡12 h以上。选择性成熟的雄性ICR系小鼠, 采用颈椎脱臼法处死, 取附睾尾导入预平衡的培养液中, 参照常规法配制体外受精用精子液(精子密度约为50万个/mL) , 并进行1~1.5 h 的预培养;与其同时, 选择性成熟的ICR雌性小鼠, 间隔48 h注射PMSG和hCG进行超排处理, 在注射hCG后的14~16 h , 从输卵管中采取卵丘卵母细胞复合体, 导入预培养的精子液中进行体外受精。经24 h体外受精后, 将发育至正常的2细胞者判定为受精卵, 用于以下的玻璃化冷冻保存。
1.2 冷冻保存液和解冻液的制备
(1)EFS20液: 用PB1溶液[5]配制含20%乙二醇V/V)、18% Fico ll70(W/V)和3 mol/L蔗糖的溶液;
(2)EFS40液: 用PB1溶液配制含40%乙二醇(V/V)、18% Ficoll 70(W/V)和3 mol/L蔗糖的溶液;
(3)GP10液: 用PB1溶液配制含10%甘油(V/V)和20%丙二醇(V/V)的溶液;
(4)GP25液: 用PB1溶液配制含25% 甘油(V/V)和25% 丙二醇(V/V)的溶液;
(5)解冻液:用PB1液配制含有0.5 mol/L蔗糖的溶液。
将已配制的上述溶液, 用0.45μm微孔滤器过滤后, 在4%下保存备用。
1.3 胚胎的玻璃化冷冻和解冻
1.3.1 胚胎的冷冻
将上述获得的2细胞期胚分别采用EFS20/40法和GP25法进行冷冻保存。
(1)EFS20/40法:将上述的2细胞期胚胎用EFS20液预处理2 min,然后用EFS液处理30 s并装入0.25 mL冷冻细管(参见下图)后, 直接投入液氮中保存。
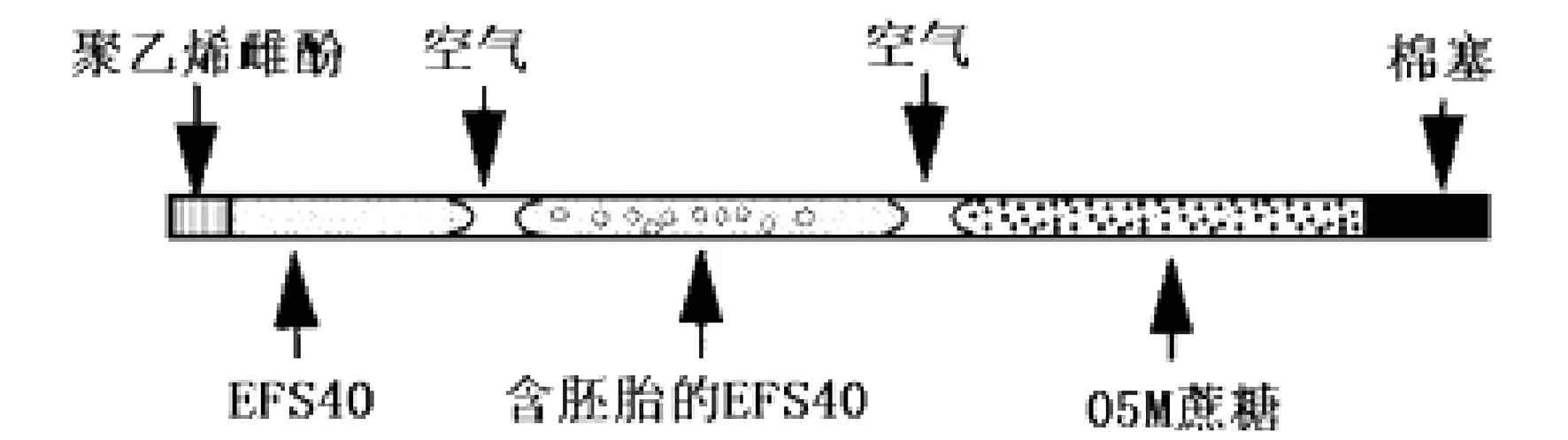
图1 含有胚胎的冷冻细管
(2)GP25法:将上述的2细胞期胚胎,用GP10液预处理10 min后,参照上述图法装入含有GP25的0.25 mL冷冻细管并直接投入液氮中保存。
1.3.2 冷冻胚胎的解冻
将冷冻细管从液氮中取出, 在约35%温水中快速解冻, 然后将管内的胚胎导入0.5 mol/L蔗糖溶液中并保持5 min, 将胚胎移入PB1液并用其清洗3次后进行下列体外培养。
1.4 胚胎的体外培养
将经冷冻-解冻的2细胞期胚,导入在二氧化碳培养箱(37%, 5%CO2, 95%空气,100% 湿度)预平衡12 h的35 mm培养皿内的改良M16培养液[4]液滴(200 μL)中, 并置于二氧化碳培养箱中进行培养, 观察发育至扩张囊胚的能力。
1.5 统计学处理
用χ2检验法对数据进行显著性检验。
2 结果
2.1 EFS20/40和GP25法冷冻-解冻后胚胎回收率
表1结果显示, 当用EFS20/40和GP25 两种方法冷冻保存小鼠2细胞期胚胎。对其进行解冻后,分别可回收96.1%和92.5%的正常2细胞期胚胎,两者差异不显著。

表1 用EFS法和GP25法冷冻-解冻后的胚胎回收率
2.2 EFS20/40和GP25法冷冻保存的小鼠2细胞期胚的体外发育
表2结果显示, 用EFS20/40法和GP25法冷冻保存的小鼠体外受精2细胞期胚胎,经体外培养后,发育至扩张囊胚的比率分别为84.9%和54.8%,EFS20/40法显著高于GP25法(P<0.05)。

表2 用EFS法和GP25法冷冻-解冻的2细胞期胚胎的体外发育能力
与GP25法相比差异显著*(P<0.05) 。
3 讨论
自玻璃化冷冻保存小鼠胚胎获得成功[1]以来, 胚胎冷冻保存技术获得了不断改良和完善,已相继开发了Kasai等的EFS20/40法[2]和EFS40法[6][乙二醇(ethylene glyco,l EG)、聚蔗糖70(Fico ll70)、和蔗糖(sucrose)制备冷冻]、Nakagata等[7]的DAP213法[用DMSO、乙酰胺(acetamide)和丙二醇(propy leneg lycol)制备冷冻保护剂]和Schefen等[3]的GP25法[用甘油和丙三醇制备冷冻保护液]等,并相应获得良好的小鼠胚胎冷冻保存效果。
据梁洋等[8]采用EFS40法、EFS20/40法、DAP213法和GP25对小鼠不同发育时期的体内受精胚胎进行冷冻保存效果进行比较的结果,EFS20/40法适合用于小鼠的2细胞期冷冻保存, 而EFS20/40和EFS40法均适合用于4~8细胞期胚和桑椹胚的冷冻。表明获得良好的冷冻效果与所采取的冷冻方法密切相关。
目前尚未见到玻璃化冷冻方法对体外受精胚胎冷冻效果影响的报道。为此,本研究分别利用EFS20/40法和GP25法对小鼠体外受精2细胞期胚胎进行冷冻保存, 并观察其在解冻后的体外发育能力。其结果,虽然两种方法冷冻解冻后的正常胚胎回收率相近,但采用EFS20/40法冷冻解冻的胚胎在体外发育至扩张囊胚比率(84.9%)显著高于GP25法(54.8%)(P<0.05)。结果表明,与GP25法相比EFS20/40法更适合用于小鼠体外受精2细胞期胚胎的冷冻保存。采用EFS40法和DAP213法是否可以提高小鼠体外受精2细胞期胚胎的冷冻效率有待于进一步探讨。
[1] Rall W F, Fahy G M. Ice-free cryopreservation of mouse embryos at-196℃ by vitrification[J]. Nature, 1985, 313: 573- 575.
[2] Mukaida T W, Takahashi K, et al. Vitrification of human embryos based on the assessment of suitable conditions for cell mouse embryos[J]. Human Reproductions, 1998, 13(10): 2874- 2879.
[3] Scheffen B, Zwalmen P M assip A. A simple and efficient procedure for preservation of mouse embryos by vitrification[J].Cryoletters,1986,7: 260- 269.
[4] 安铁洙,谭建华,岳占碰,等.小鼠体外受精及胚胎发育的影响因素[J]. 中国兽医学报,2002,22(2):191-103.
[5] Zhou G B, Zhu S E, Hou Y P,et al. Vitrification of mouse embryos at various stages by Open- pulled Straw (OPS) method[J] . Anim Biotechnol,2005,16:153-163.
[6] Kasai M, Komi JH, Takakamo A, et al. A simple method for mouse embryo cryopreservation in a low toxicity vitrification solution without appreciable loss of viability[J].J. Reprod. Fert, 1990, 89: 91- 97.
[7] Nakagata N. High survival rate of unfertilized mouse oocytes after vitrification[J]. Reproduction, 1989, 87: 479- 483.
[8] 梁洋, 杜文敬, 王春生,等. 小鼠早期胚胎的EFS20/40、EFS40、DAP213和GP25玻璃化法冷冻保存[J].江西农业大学学报, 2010, 32(6) : 1248- 1252.
TheEffectionofEarlyMouseEmbryoson2CellStageinVitroFertilizationbyVitrificationUsingEFS20/40andGP25Methods
PIAO Xiang-li1, DU Wen-jing2, WANG Chun-sheng2,YIN Hong-zhe1, PIAO Shan-hua2
(1.Helong City Animal Health Institute,Helong 133500, Jilin Province, China;2.College of Life Science, Northeast Forestry University, Harbin 150040, Heilongjiang Province, China)
2 cell stage embryos in vitro fertilization from mouse were vitrified using EFS20/40, and Schefen-GP25 methods followed by thawing the embryos to evaluate the ability of expanded blastocysts to filter the better suitable vitrification scheme. The results showed that the blastocyst formation rate by EFS20/40 method (84.9%) was significantly higher than those by Schefen-GP25 methods (P<0.05) after vitrication-thawing 2-cell embryos, though the recovery rate of normal embryos is similar. These results indicated that EFS20/40 method was the better suitable for the 2-cell stage embryos in vitro fertilization from mice cryopreservation.
mouse; in vitro fertilization; 2-cell-stage-embryo; vitrification
S814.3
A
1005-2739(2017)06-0003-03
2017-09-17
黑龙江自然基金项目(C2016012)
朴香丽(1975-),女,高级兽医师。
E-mail:hljd4220144@163.com
*通信作者: 朴善花,女,高级畜牧师。
E-mail:antiezhu@qq.com
