亚抑菌浓度庆大霉素对铜绿假单胞菌的影响
2017-11-16杨正贵季艳艳何照庆
杨正贵,季艳艳,何照庆
[贵州盘江投资控股(集团)有限公司总医院 检验科,贵州 六盘水 553536]
亚抑菌浓度庆大霉素对铜绿假单胞菌的影响
杨正贵,季艳艳,何照庆
[贵州盘江投资控股(集团)有限公司总医院 检验科,贵州 六盘水 553536]
目的 探讨亚抑菌浓度庆大霉素(GEN)对铜绿假单胞菌(PAO1)浮游菌和生物膜的影响。方法 采用微量肉汤稀释法检测PAO1对GEN的敏感性。采用96孔板比浊法检测亚抑菌浓度GEN对PAO1浮游菌生长的影响,并通过结晶紫染色法检测亚抑菌浓度GEN对PAO1生物膜形成的影响。采用化学反应比色法测定亚抑菌浓度GEN对PAO1毒力因子表达的影响。结果 GEN对PAO1的最低抑菌浓度为2 μg/ml;而当GEN浓度≤0.250 μg/ml时,不影响PAO1浮游菌的增殖;当GEN为0.125 μg/ml时,能促进PAO1生物膜的形成(P<0.05),且在一定范围内(0.125~0.250 μg/ml)随着GEN浓度增高,其促进生物膜形成的能力越强;0.125和0.250 μg/ml GEN能促进群体密度信号系统相关基因lasI、lasR、rhlI、rhlR、pqsC、pqsD和毒力因子青脓素、弹性蛋白酶、碱性蛋白酶的表达(P<0.05),且呈一定的剂量依赖性。结论 亚抑菌浓度GEN在一定浓度范围内能促进PAO1生物膜的形成,并进一步促进群体密度信号系统相关基因和毒力因子的表达。
庆大霉素;压抑菌浓度;铜绿假单胞菌;生物膜;青脓素;群体密度感应
铜绿假单胞菌(Pseudomonas aeruginosa,PAO1)是院内感染常见的一种革兰阴性兼性厌氧菌,常导致机会性感染[1]。近年来,随着抗生素的不合理应用,其耐药性不断增强,给临床治疗带来极大不便。
铜绿假单胞菌能黏附于物体或人体组织表面,形成生物膜[2]。因物理屏障、滞留菌形成、基因突变率增加等原因,使生物膜状态下铜绿假单胞菌的耐药性大大增强,传统抗生素难以根治生物膜[3]。然而,残留在体内的亚抑菌浓度(sub-minimal inhibitory concentration,sub-MIC)抗生素对PAO1浮游菌及生物膜的影响尚未完全阐明。
1 材料与方法
1.1 材料
1.1.1 菌株来源及培养条件 铜绿假单胞菌标准菌株PAO1由本实验室置入-20℃冰箱冷冻保存,使用前在羊血琼脂平板上传3代,以获得生理状态稳定的菌株。
1.1.2 主要试剂与设备 庆大霉素(Gentamycin,GEN)购自上海阿拉丁试剂生物科技有限公司,Luria-Bertani肉汤和Muller-Hinton肉汤购自北京陆桥有限公司,结晶紫颗粒购自天津市化学试剂一厂,96孔板、二氧化碳CO2培养箱、多功能酶标仪等设备均由贵州盘江投资控股(集团)有限公司总医院检验科提供。
1.2 方法
1.2.1 PAO1对GEN的敏感性检测 药敏试验参考微量肉汤稀释法进行[4]。Muller-Hinton肉汤倍比稀释GEN母液至100μl,加入96孔板。挑取平板上的单个菌落,用生理盐水调为0.5麦氏浊度,再用生理盐水按1∶20进行稀释,分别向GEN备用96孔板中加入10μl已稀释好的菌悬液,使最终实验菌浓度约为5×105集落形成单位(colony-forming units,CFU)/ml。置于恒温培养箱中37℃孵育16~20 h,最低抑菌浓度(minimal inhibitory concentration,MIC)终点即为肉眼所见,能完全抑制细菌生长的最低抗菌药物浓度。
1.2.2 sub-MIC对PAO1浮游菌生长的影响检测挑取血琼脂平板上过夜培养的单个菌落于Luria-Bertani肉汤中,37℃过夜摇菌孵育后,12 000 r/min离心1 min,去除上清液,用含不同亚抑菌浓度GEN的Luria-Bertani肉汤培养基调节菌沉淀至600 nm处,光密度(optical density,OD)值调节至 0.1,置于恒温摇床上37℃、180 r/min培养,每隔 4 h取200μl菌悬液于96孔板中,用酶标仪测600 nm处的OD值,监测24 h,绘制时间-生长曲线。
1.2.3 sub-MIC对PAO1生物膜的影响检测 挑取血平板上培养出的单个菌落,加入装有Luria-Bertani肉汤的离心管,混匀后置于恒温摇床37℃、180 r/min摇菌至对数生长期。用Luria-Bertani肉汤将各菌液600 nm处OD值调节至0.5,分别加入稀释的测试浓度GEN,加入200μl GEN稀释好的菌悬液于96孔板中,湿盒37℃静置培养24 h。用生理盐水漂洗,去除浮游菌后,分别加入0.1%结晶紫溶液,室温下染色10 min,去除未结合的结晶紫,并用生理盐水漂洗,室温晾干后分别加入200μl无水乙醇以洗脱与生物膜结合的结晶紫颗粒,在570 nm波长下测OD值。
1.2.4 RNA提取及实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR) 参照E.Z.N.A.Total RNA KitⅡ试剂盒说明书的步骤提取铜绿假单胞菌的总RNA,并用紫外分光光度计测定RNA的浓度。随后参照Green One-Step qRT-PCR Super Mix试剂盒说明书步骤进行RNA的逆转录和荧光定量,采用Light Cycler PCR仪进行扩增,反应条件为:45℃预变性5 min,94℃变性 30 s,94℃退火 5 s,60℃延伸 30 s,共45个循环。所用引物参考文献[5],见附表。
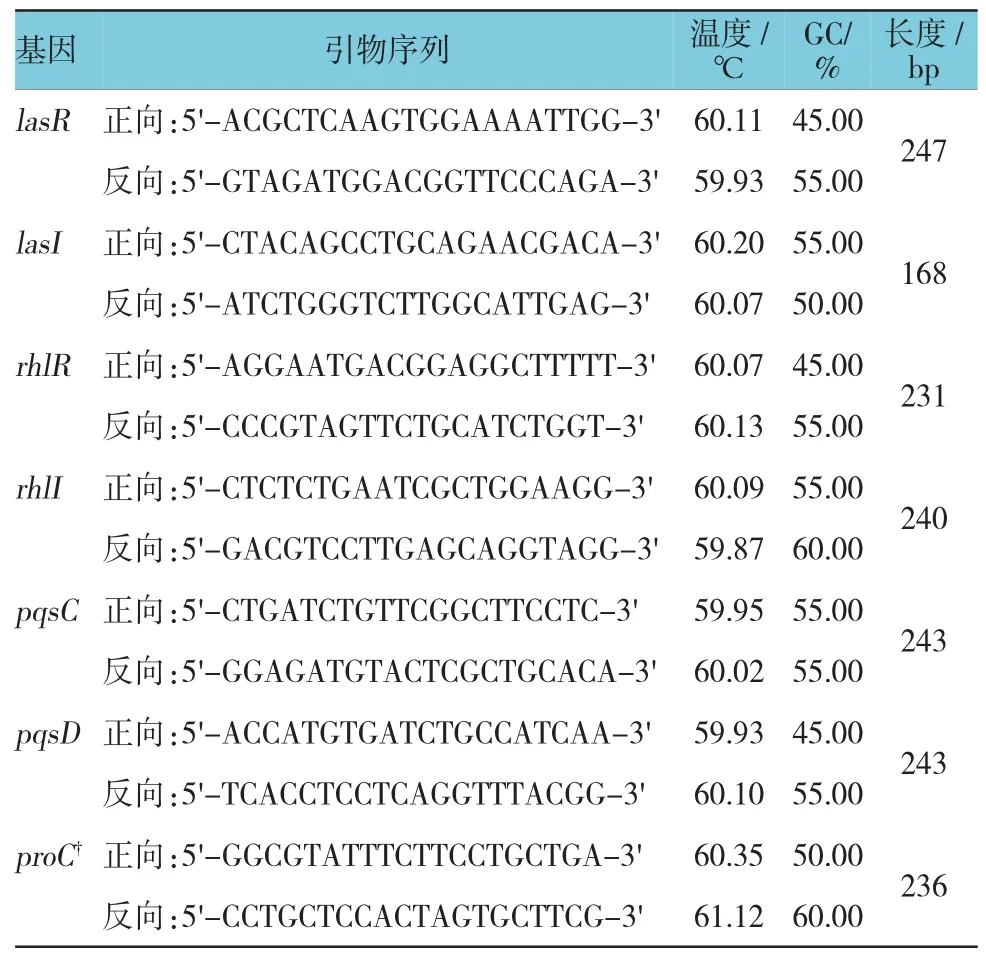
附表 PCR引物及相关参数
1.2.5 PAO1毒力因子的检测 ①青脓素的检测:刮取单个菌落至Luria-Bertani肉汤中,摇床过夜后,5 210 r/min离心15 min取上清液,加入氯仿,充分振荡混匀后取无机相于另一试管中,加入0.2 mol/L HCl溶液,混匀后静置5min,至上层变红。检测540nm处的OD值;②弹性蛋白酶的检测:摇菌过夜,离心取上清 750 μl,加入 250 μl 5 mg/ml弹性蛋白刚果红溶液,37℃、200 r/min摇菌 16 h后,3 000 r/min离心10 min。检测490 nm处的OD值,即为弹性蛋白酶的活性;③碱性蛋白酶的检测:摇菌过夜,离心取上清后,按1∶1(v/v)比例与2%偶氮酪蛋白溶液配比,37℃静置孵育1h,加入10%三氯乙酸溶液终止反应,检测400 nm处OD值,即为碱性蛋白酶的活性。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用方差分析,方差齐则两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 最低抑菌浓度
GEN对铜绿假单胞菌PAO1的最低抑菌浓度为 2 μg/ml。
2.2 亚抑菌浓度GEN对铜绿假单胞菌浮游菌的影响
当GEN浓度≤0.250 μg/ml时,不影响PAO1浮游菌的增殖。而当GEN浓度为0.500 μg/ml时,可部分抑制浮游菌的生长,且呈浓度依赖性。随着GEN的浓度升高至1.000 μg/ml时,可抑制PAO1浮游菌的生长,不同时间点600 nm处的OD值比未加药的对照组低(F=5.017,P=0.001)。见图 1。
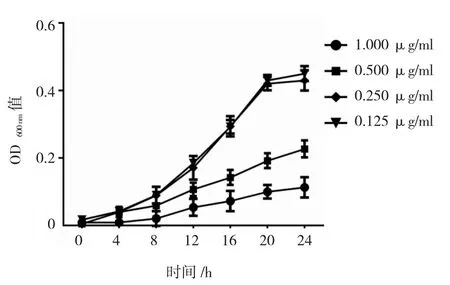
图1 亚抑菌浓度GEN对铜绿假单胞菌浮游菌的影响
2.3 一定范围内亚抑菌浓度GEN促进铜绿假单胞菌生物膜的形成
亚抑菌浓度GEN对PAO1的影响呈现多样性。当GEN浓度≥0.125 μg/ml时,能促进或抑制PAO1生物膜的形成,经方差分析,差异有统计学意义(F=84.230,P=0.000);当GEN浓度为0.125和0.250μg/ml时,能促进PAO1生物膜的形成,使OD570nm值从(2.43±0.05)分别增加到(2.98±0.26)和(3.57±0.10)(P<0.05);而当 GEN 的浓度上升至 0.5和1.0μg/ml时,能抑制生物膜的形成,与未加药的对照组比较,可使PAO1的生物膜总量分别从(2.43±0.05)减少到(2.09±0.24)和(1.34±0.11)(P <0.05)(见图2)。当GEN浓度≥0.5 μg/ml时,开始抑制PAO1浮游菌的生长,这可能是0.5 μg/ml GEN抑制生物膜形成的原因之一(见图1)。

图2 亚抑菌浓度GEN对铜绿假单胞菌生物膜形成的影响
2.4 亚抑菌浓度GEN促进铜绿假单胞菌QS系统相关基因的表达
铜绿假单胞菌QS系统相关组份主要包括lasI/R、rhlI/R及pqs系统。与未加抗生素的阴性对照组比较,0.125和0.250μg/ml GEN能促进QS系统相关基因 lasI、lasR、rhlI、rhlR、pqsC、pqsD 的表达(F=30.790、23.182、56.874、32.330、150.705 和 61.193,P=0.001、0.001、0.000、0.001、0.000 和 0.000)。0.125 μg/ml GEN 可分别使 lasI、lasR、rhlI、rhlR、pqsC 及pqsD基因的相对表达量上升至(1.30±0.18)、(1.60±0.17)、(1.80 ±0.26)、(1.68±0.37)、(1.98±0.15)和(2.03±0.24),经 SNK-q 检验,差异有统计学意义(P<0.05)。且随着GEN浓度上升到0.250 μg/ml时,其促进作用进一步增强,可分别使其相对表达量上升至(2.30±0.32)、(2.01±0.27)、(2.45±0.13)、(2.76±0.29)、(2.78±0.16)和(2.95±0.29),差异有统计学意义(P<0.05)。见图3。
2.5 亚抑菌浓度GEN促进铜绿假单胞菌毒力因子的表达
铜绿假单胞菌QS系统相关毒力因子主要包括青脓素、弹性蛋白酶及碱性蛋白酶(或蛋白酶)。0.125和0.250 μg/ml亚抑菌浓度的GEN能促进青脓素的表达,并能增加弹性蛋白酶和碱性蛋白酶的活性(F=140.902、48.733 和 26.515,均 P=0.000)。0.125 μg/ml GEN可分别使青脓素、弹性蛋白酶、碱性蛋白酶毒力因子的相对表达量上升至对照组的(1.54±0.09)、(1.24±0.02)和(1.35±0.14),经 SNK-q检验,差异有统计学意义(P<0.05)。且其促进作用有一定的剂量依赖性,即当GEN浓度上升到0.250μg/ml时,GEN抑制毒力因子的能力明显增强,可分别使青脓素青脓素活性增高至对照组的(1.87±0.04)、(1.56±0.09)和(1.65±0.07),经 SNK-q 检验,差异有统计学意义(P<0.05)。见图 4。
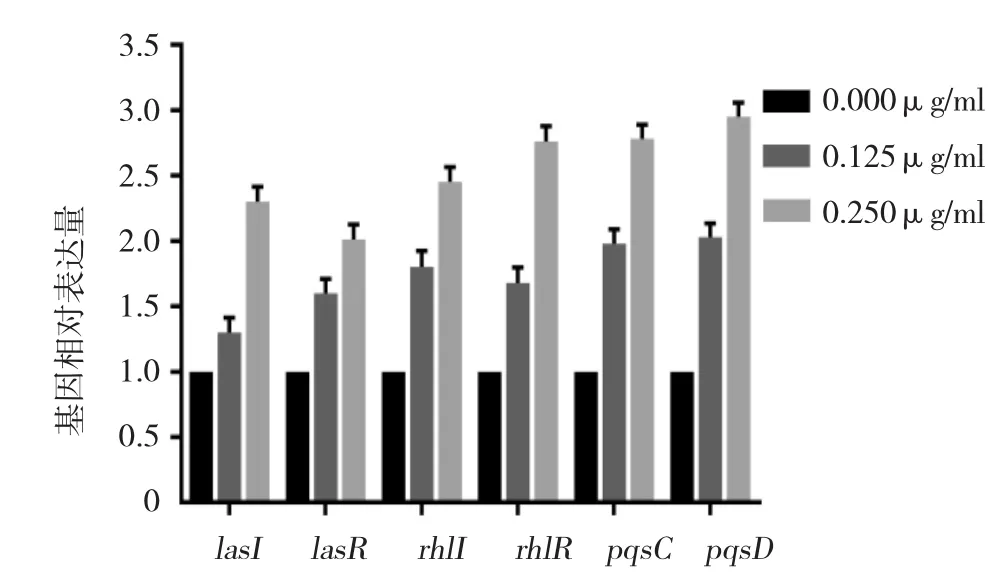
图3 亚抑菌浓度GEN对铜绿假单胞菌QS系统相关基因的影响
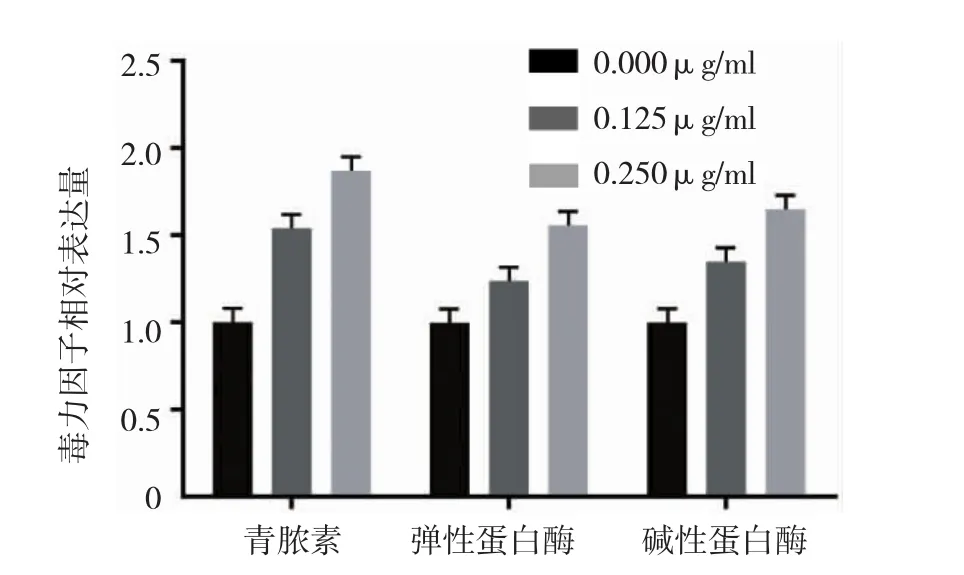
图4 亚抑菌浓度GEN对铜绿假单胞菌毒力因子的影响
3 讨论
近年来,呼吸道痰标本铜绿假单胞菌的分离率及耐药率在不断增加。除了固有耐药和基因水平获得性耐药,生物膜的出现进一步给临床诊疗带来极大不便。而不合理抗生素的使用常不能根治体内的细菌,残留的细菌在残留亚抑菌浓度抗生素的刺激下,耐药性进一步增加,甚至促进生物膜的形成。因此,阐明亚抑菌浓度抗生素对生物膜的影响及其作用机制,对指导临床合理使用抗生素至关重要。
本研究通过96孔板构建生物膜,检测亚抑菌浓度GEN对铜绿假单胞菌生物膜的影响。当GEN浓度为0.125~0.250 μg/ml时,可促进铜绿假单胞菌生物膜的形成;并进一步通过qRT-PCR和化学反应比色法发现亚抑菌浓度GEN能促进铜绿假单胞菌QS系统相关基因和毒力因子的表达。
通过基因点阵分析发现,亚抑菌浓度的氨基糖苷类抗生素能触发铜绿假单胞菌基因的广泛突变,而诱导生物膜的形成。有研究显示,亚抑菌浓度抗生素对铜绿假单胞菌的作用靶点是其内膜的氨基糖苷反应蛋白,该蛋白有环鸟苷二磷酸(c-di-GMP)二酯酶活性,可被亚抑菌浓度氨基糖苷类抗生素所诱导,使第二信使c-di-GMP失活,从而促进铜绿假单胞菌生物膜的形成[6]。
细菌群体密度感应系统是生物膜群体之间进行通讯的“语言系统”,调节整个生物膜形成的周期[7]。QS系统主要包括Las、Rhl及Pqs系统3个组份,主要由蛋白lasI/R、rhlI/R及pqsC/D蛋白构成,且分别由相应的基因编码[8]。QS系统一方面调节生物膜的形成,另一方面还调控着生物膜毒力因子的表达,如青脓素、弹性蛋白酶[9]及碱性蛋白酶活性[10]。本研究发现,亚抑菌浓度的GEN不仅能促进QS系统相关基因的表达,而且能促进铜绿假单胞菌毒力因子的分泌和活性,进一步证明亚抑菌浓度GEN促进QS系统的生理功能可能是其促进生物膜形成的主要原因之一。
本研究通过微孔板法构建铜绿假单胞菌生物膜,并结合结晶紫染色法发现一定范围内的亚抑菌浓度GEN可促进铜绿假单胞菌生物膜的形成,且能促进其相关毒力因子青脓素、弹性蛋白酶及蛋白酶的表达和活性。亚抑菌浓度GEN促进QS系统的相关表达可能是导致这些效应的主要原因。因此,临床治疗铜绿假单胞菌生物膜感染时,应考虑到亚抑菌浓度GEN对生物膜的影响,合理使用抗生素才能达到事半功倍的效果。
[1]POBIEGA M,MACIAG J,CHMIELARCZYK A,et al.Molecular characterization of carbapenem-resistant Pseudomonas aeruginosa strains isolated from patientswith urinarytractinfectionsin Southern Poland[J].Diagn Micro Infect Dis,2015,83(3):295-297.
[2]GUPTA P,SARKAR S,DAS B,et al.Biofilm,Pathogenesis and prevention-a journey to break the wall:a review[J].Arch Microbiol,2016,198(1):1-15.
[3]TAYLOR P K,YEUNG A T,HANCOCK R E.Antibiotic resistance in Pseudomonas aeruginosa biofilms:towards the development of novel anti-biofilmtherapies[J].J Biotechnol,2014,191:121-130.
[4]Clinical and Laboratory Standards Institute.Clinical and laboratory standards institute(CLSI)Performance standards for antimicrobial susceptibility testing[S].2013:1.
[5]KIM H S,LEE S H,BYUN Y,et al.6-Gingerol reduces Pseudomonas aeruginosa biofilm formation and virulence via quorum sensing inhibition[J].Sci Rep,2015,5:8656.
[6]VALENTINI M,FILLOUX A.Biofilms and cyclic di-GMP(c-di-GMP)signaling:lessons from Pseudomonas aeruginosa and other bacteria[J].J Biol Chem,2016,291(24):12547-12555.
[7]BRACKMAN G,COENYE T.Quorum sensing inhibitors as anti-biofilm agents[J].Curr Pharm Des,2015,21(1):5-11.
[8]SOLANO C,ECHEVERZ M,LASA I.Biofilm dispersion and quorum sensing[J].Curr Opin Microbiol,2014,18:96-104.
[9]BEN HAJ KHALIFA A,MOISSENET D,VU THIEN H,et al.Virulence factors in Pseudomonas aeruginosa:mechanisms and modes of regulation[J].Ann Biol Clin(Paris),2011,69(4):393-403.
[10]AYBEY A,DEMIRKAN E.Inhibition of quorum sensing-controlled virulence factors in Pseudomonas aeruginosa by human serum paraoxonase[J].J Med Microbiol,2016,65(2):105-113.
Effet of sub-minimal inhibitory concentration of Gentamycin onPseudomonas aeruginosa
Zheng-gui Yang,Yan-yan Ji,Zhao-qing He
(Clinical Laboratory,General Hospital in Panjiang Investment Holding Co.Ltd.,Liupanshui,Guizhou 553536,China)
Objective To study the effect of Gentamycin of sub-minimal inhibitory concentration(sub-MIC)onPseudomonas aeruginosa.Methods Microdilution method was used to detect the sensitivity ofP.aeruginosa to Gentamycin.And the turbidity method was used to check the effect of sub-MIC of Gentamycin on the growth ofP.aeruginosaplanktonic bacteria.Then,crystal violet method was used to explore the effect of sub-MIC Gentamycin on the biofilm formation ofP.aeruginosa.Finally,chemical colorimetric method was utilized to test the effect of sub-MIC Gentamycin on the virulence factor production ofP.aeruginosa.Results The MIC of Gentamycin onP.aeruginosawas 2 μg/ml.Gentamycin ≤0.250 μg/ml had no influence on the growth ofplanktonic bacteria.Gentamycin could significantly enhance the biofilm formation at the concentration of 0.125-0.250 μg/ml and in a dose-dependent manner(P < 0.05).At the same time,0.125 and 0.250 μg/ml Gentamycin could significantly promote the expressions of the quorum sensing system(QS)related geneslasI,lasR,rhlI,rhlR,pqsC andpqsD,and the virulence factors pyocyanin,elastase and alkaline protease in a dose-dependent manner(P<0.05).Conclusions sub-MIC Gentamycin could enhance the biofilm formation and the expressions of QS related genes and virulence factors.
sub-MIC;Gentamycin;Pseudomonas aeruginosa;biofilm;pyocyanin;quorum sensing
R96
A
10.3969/j.issn.1005-8982.2017.26.007
1005-8982(2017)26-0035-05
2016-09-20
(童颖丹 编辑)
