川芎嗪对刀豆蛋白A诱导的小鼠肝纤维化TNF—α、IL—6、IL—10表达的影响
2017-11-14严栋梁陈杰葛创钱益朱斌邵伟斌
严栋梁 陈杰 葛创 钱益 朱斌 邵伟斌
【摘要】 目的:观察不同剂量川芎嗪对刀豆蛋白A诱导的小鼠肝纤维化TNF-α、IL-6、IL-10表达的影响。方法:BALB/C小鼠随机分为5组,正常对照组(A组)10只;ConA模型(B组)15只;川芎嗪低剂量(100 mg/kg)组(C组)15只;川芎嗪中剂量(200 mg/kg)组(D组)15只,川芎嗪高剂量(800 mg/kg)组(E组)15只。采血及留取肝组织,HE法检测肝组织病理变化,ELISA法检测血清中肿瘤坏死因子(TNF-α),IL-6的水平,RT-qPCR检测肝组织中 IL-6、IL-10的表达。结果:刀豆蛋白A模型组小鼠肝纤维化明显,TNF-α、IL-6的表达明显增多,IL-10的表达明显减少,与其他组比较有差异显著(P<0.05);不同剂量的川芎嗪治疗干预后,肝纤维化减轻,伴TNF-α、IL-6表达下降,IL-10的表达增加,与刀豆蛋白A模型组比较差异明显(P<0.05),尤以高剂量组为著。结论:川芎嗪对刀豆蛋白A诱导的小鼠肝纤维化有保护作用,有剂量相关性,其机制可能与减少细胞凋亡的发生和通过抑制JAK-STATs信号通路的激活有关。
【关键词】 川芎嗪; 刀豆蛋白A; 肝纤维化; TNF-α; IL-6
doi:10.3969/j.issn.1674-4985.2017.19.006
肝纤维化在国内常是病毒性肝炎慢性进展的结果,其发生机制仍不完全清楚,特别是治疗和预防是困扰临床的难题[1-2]。肝纤维化动物模型很多,其中刀豆蛋白A(ConA)诱导的小鼠肝纤维化模型所造成的肝细胞损伤与和人病毒性肝炎的免疫机制相似,具有临床实用性[3]。川芎嗪(Tetramethylpyrazine,TMP)是从中药川芎中分离提纯的生物碱单体,具有活血化瘀、抗血小板凝集、扩张血管等多种作用[4],临床应用广泛。近年来有动物实验显示川芎嗪可能降低肝纤维化大鼠肝脏胶原蛋白水平,使肝纤维化延缓形成[5]。本文应用刀豆蛋白A(ConA)小鼠实验性肝纤维化模型,检测川芎嗪对肝组织内TNF-α、IL-6、IL-10表达的影响,以期进一步阐明川芎嗪抗肝纤维化的可能作用机理,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 BALB/C小鼠70只,雌雄不拘,7~9周龄,体重17~23 g,购自南通大学实验动物中心。所有小鼠饲养于南通大学实验动物中心,室温22 ℃,相对湿度55%,12 h昼夜节律,自由进食、饮水,适应环境2周后开始实验。
1.1.2 主要试剂 川芎嗪片50 mg/片(丽珠集团利民制药厂生产,批号:140306);刀豆蛋白A(Sigma Aldrich 公司);H&E染色试剂盒G1120(北京索莱宝公司);小鼠肿瘤坏死因子α(TNF-α)ELISA试剂盒(USCN公司);小鼠白介素6(IL-6)ELISA试剂盒(USCN公司)
1.2 方法
1.2.1 实验動物分组 BALB/C小鼠随机分为5组,正常对照组(A组)10只;ConA模型(B组)15只;川芎嗪低剂量(100 mg/kg)组(C组)15只;川芎嗪中剂量(200 mg/kg)组(D组)15只,川芎嗪高剂量(800 mg/kg)组(E组)15只。8周试验结束时B组小鼠死亡7只,C组小鼠死亡6只,D组小鼠死亡3只,E组小鼠死亡2只。
1.2.2 实验及给药方法 模型组和实验组均通过小鼠的尾静脉注射刀豆蛋白(10 mg/kg),2次/周,共8周,正常对照组则注射等量生理盐水。实验组分别按低剂量组川芎嗪100 mg/kg,中剂量组川芎嗪200 mg/kg,高剂量组川芎嗪800 mg/kg,给药方法为每天灌胃给药。实验结束后,眼眶采血法留取血清并处死小鼠,取出肝脏组织,一部分用10%福尔马林固定用于HE染色,一部分肝脏组织用于RT-qPCR分析。
1.3 观察指标和测定方法
1.3.1 肝脏组织染色 取不同组小鼠肝脏,10%甲醛的PBS溶液固定,脱水,石蜡包埋,5 μm组织切片,按常规进行HE染色,中性树胶封片,在光学显微镜下观察组织学改变及炎症细胞浸润。
1.3.2 ELISA检测小鼠血清TNF-α、IL-6的表
达 取血,放置30 min后,离心10 min (3500 r/min),所取得的血清用于TNF-α含量测定。取试剂盒中已经用小鼠单抗包被、封闭好的96孔板条,加入样品或不同浓度的标准品100μL,37 ℃孵育90 min后,甩尽孔内液体,每孔加入洗涤液350 μL,静置30 s后甩尽液体,拍干。洗涤板条4次后,加入检测剂工作液100 μL(内含生物素化的抗小鼠TNF-α抗体和辣根过氧化物酶标记的亲和素),37 ℃孵育60 min后,洗涤板条4次,然后加入显色剂溶液(100 μL/孔),避光,37 ℃,15~20 min。若反应孔中有小鼠TNF-α,则辣根过氧化物酶会使无色的显色剂显兰色,加终止液变黄。在450 nm处测OD值,通过标准曲线求出样品中TNF-α浓度。IL-6 ELISA检测参照上述步骤进行。
1.3.3 RT-qPCR检测小鼠肝组织中IL-6和IL-10的mRNA表达 收集肝脏细胞,加入1 mL TRIzol裂解液,反复吹打至细胞充分裂解,按说明书提取各组细胞总RNA,紫外分光光度计测量浓度后取1 μg按照试剂盒说明书进行逆转录及PCR扩增。PCR的扩增条件为93 ℃ 2 min预变性;然后按93 ℃ 45 s、55 ℃ 60 s,10个循环。
1.4 统计学处理 使用SPSS 20.0统计软件包进行统计分析,计量资料采用(x±s)表示,比较采用t检验,数据经方差齐性分析后组间分析使用方差分析,以P<0.05为差异有统计学意义。
2 结果endprint
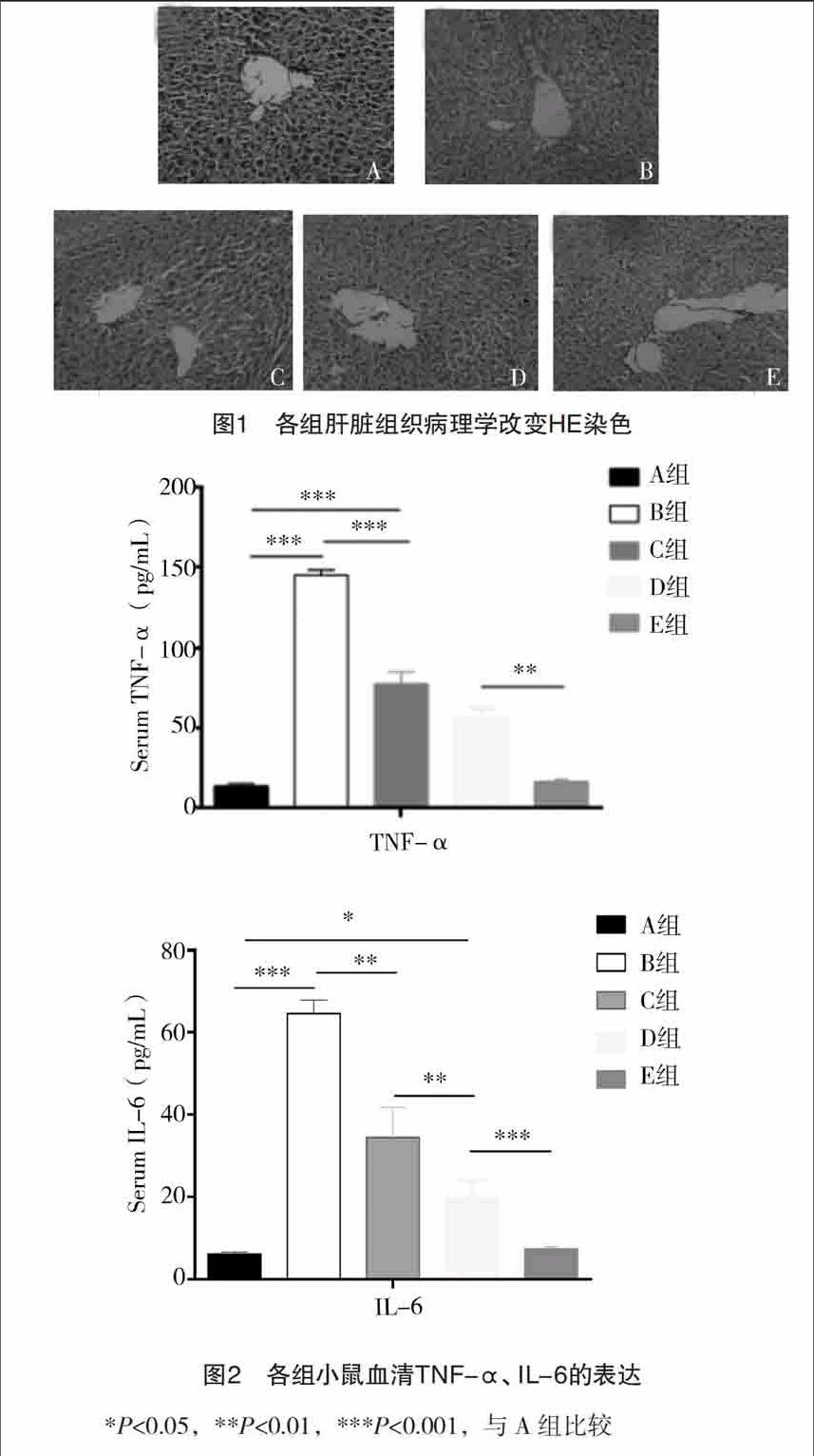
2.1 肝脏大体标本观察 各组肝组织大体标本观察显示:A组大鼠肝脏光泽红润,包膜光整,质地柔软;与A组相比,B、C组大鼠肝脏色泽暗淡,表面凹凸不平,质地较硬;D、E组外观相对光滑,光泽暗红,质地介于A组和B组之间。
2.2 肝脏病理学检查 肝组织HE染色结果显示,A组肝小叶结构完整,肝细胞排列规则,小叶内无细胞变性,无炎性细胞浸润(图1A);B组肝小叶结构破坏,可见明显纤维间隔形成(图1B);C组肝小叶结构破坏,可见明显纤维间隔形成(图1C);D组仍可见菲薄的纤维条索及少量炎细胞浸润(图1D);E组肝纤维化程度明显减轻,镜检结果与A组相近(图1E)。
2.3 不同剂量川芎嗪对血清TNF-α、IL-6表达的影响(ELISA法) 由图2可见,与A组比较,B组TNF-α表达明显增加(P<0.001),100、200、800 mg/kg川芎嗪可抑制血清TNF-α的表达,随药物浓度增大,TNF-α的抑制值增大,中剂量组和高剂量组间比较差异有统计学意义(P<0.01)。不同剂量的川芎嗪均可减少IL-6的表达,尤以高剂量组的IL-6表达最少(P<0.001)。
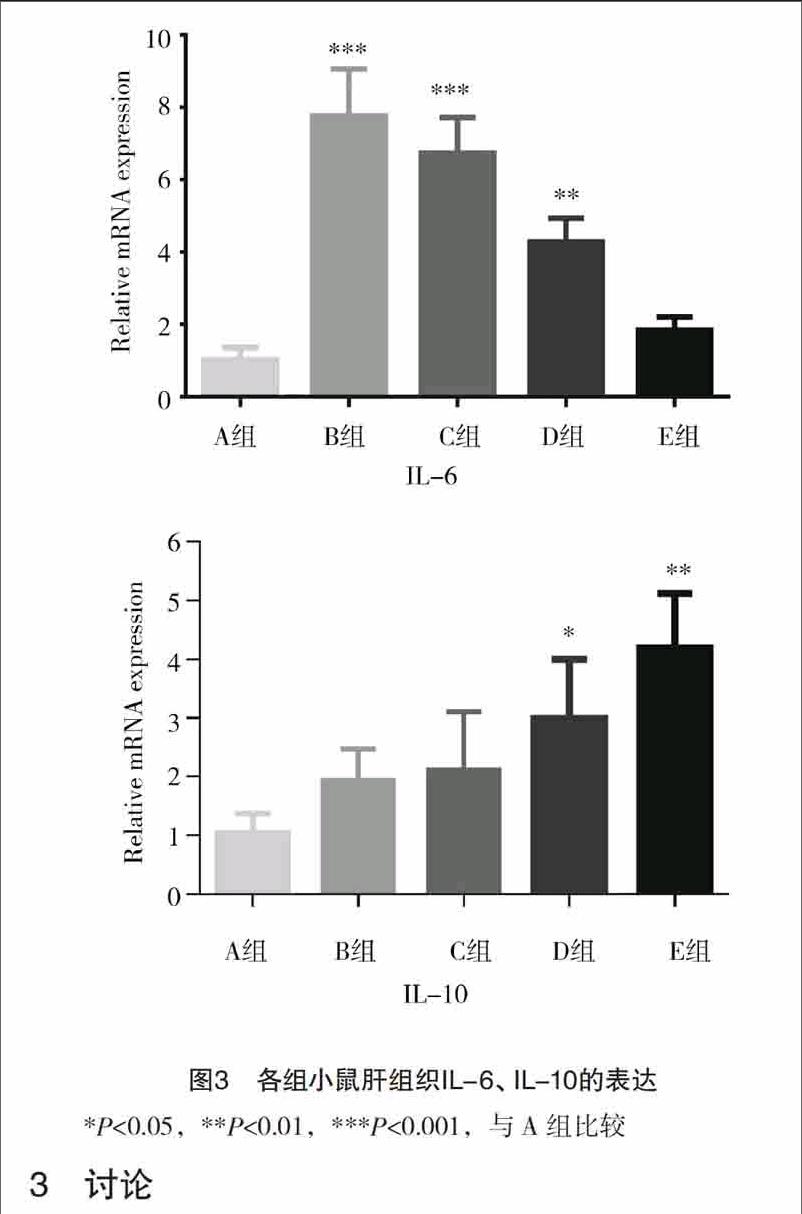
2.4 不同剂量川芎嗪对肝组织IL-6、IL-10表达的影响(QPCR法) 由图3可见,100、200、800 mg/kg
川芎嗪可抑制肝组织中IL-6的表达,随药物浓度增大,肝组织中IL-6的表达减少更明显(P<0.05)。不同剂量的川芎嗪均可使得肝组织中IL-10的表达增加,尤以高剂量组的IL-10表达最多(P<0.01)。
3 讨论
肝星状细胞(Hepatic stellate cell,HSC)的持续性活化,此后合成大量胶原为主的细胞外基质(Extracellular matrix,ECM),是肝纤维化发生的病理基础[6-7]。现认为,活化的HSC有两个去向,由活化狀态转回静止状态或发生细胞凋亡。研究显示,很多细胞因子、相关基因和蛋白都参与在纤维化的过程中,形成一个复杂的网络系统[8]。因此,逆转肝纤维化过程最重要的就是能够HSC活化,核心途径是发现能够靶向抑制HSC增殖及促进HSC凋亡的药物。
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是作用强大的致炎因子,主要由单核巨噬细胞、肝星状细胞及枯否细胞等产生,可诱导包括自身在内的多种致纤维化、致炎因子产生,与其他细胞因子等形成调节网络,对肝纤维化的启动及调控起重要作用[9]。研究发现,细胞因子TNF-α在ConA性诱导的小鼠肝纤维化中发挥了极为重要的作用,大量CD4+T细胞与巨噬细胞活化是产生TNF-α的关键环节[10]。在此模型中细胞因子TNF-α可能是直接启动了细胞凋亡的信号造成了肝细胞凋亡的发生。同时,TNF-α是激活HSC持续活化的核心细胞因子,也能加强HSC的趋化性,促进HSC增生。TNF-α可能增加肝脏组织的炎症反应而加重肝纤维化的发生。笔者实验研究结果显示,应用中、高剂量川芎嗪干预的治疗组TNF-α水平较模型组和低剂量组明显降低,差异有统计学意义(P<0.05),提示川芎嗪的抗纤维化作用可能是通过调节TNF-α来抑制细胞凋亡的发生和减缓肝纤维的启动。
IL-6在炎症反应中有核心作用,能加速肝脏细胞的炎性反应,也能通过激活细胞因子的级联反应从而介导肝细胞损伤的发生[11]。研究表明,IL-6可激活JAK-STAT信号通路中的STAT1和STAT3,引发慢性炎症,导致肝脏的病理生理改变。JAK2/STAT3信号通路是一条多种细胞因子共用的信号传导途径,广泛参与机体组织器官的细胞增殖、分化、凋亡以及免疫调节等过程[12-14]。研究表明,这一信号通路在机体组织器官的纤维化过程中也发挥了重要作用[15-16]。因此,肝组织内IL-6水平的升高可能是造成肝纤维化发生的始动因素。
IL-10主要由肝细胞及HSC、肥大细胞、肝巨噬细胞等产生,在抗炎症反应中有重要作用。IL-10可以有效抑制促纤维化因子TGF-β1的产生,抑制巨噬细胞合成分泌TNF-α,可以下调TNF-α下游效应物NF-kB表达,还可以重构细胞外基质,可能通过促进胶原蛋白酶基因表达及下调Ⅰ型胶原的合成实现的[17-18],因此IL-10具有减缓器官纤维化发生的功能[19]。有实验表明,IL-10水平的绝对或相对不足不能有效抑制促炎和促纤维化因子合成与表达,导致肝细胞损害加重,病情恶化,间接证明IL-10对肝炎肝硬化细胞损害具有保护作用,且可能与肝脏损害程度呈平行关系[20]。
本研究显示,B组大鼠肝组织纤维化程度明显高于A组,且肝组织中TNF-α、IL-6的表达也明显增加,IL-10表达减少;应用中、高剂量川芎嗪后,D、E组的肝组织纤维化程度降低,同时肝组织中TNF-α、IL-6的表达减少,而IL-10表达增加,这三者均可能参与调控和抑制肝纤维化形成。
本研究的结果证实川芎嗪对刀豆蛋白A实验性肝纤维化模型具有较为明显的抗纤维化作用,其可能的机制是调控TNF-α、IL-6,IL-10的表达,减少细胞凋亡的发生和通过抑制JAK-STATs信号通路的激活等多环节、多靶点的来发挥作用,具体作用机制待进一步深入研究。
参考文献
[1] Ellis E L,Mann D A. Clinical evidence for the regression of liver fibrosis[J].Journal of Hepatology,2012,56(5):1171-1180.
[2] Jiao J,Friedman S L,Aloman C.Hepatic fibrosis[J].Current Opinion in Gastroenterology,2009,25(3):223.
[3]陈丽,谭友文,叶云,等.刀豆蛋白A诱导小鼠肝纤维化动物模型的建立及机制探讨[J].肝脏,2012,17(4):250-260.endprint
[4]胡国芬,王建平.川芎嗪的药理作用及临床应用进展[J].中国药物与临床,2006,6(10):773-774.
[5]杜丽娟,徐军全,宋彬妤,等.川芎嗪对CCl-4诱导的肝纤维化大鼠肝组织Nrf2/ARE信号通路的影响[J].中国实用医药,2014,9(9):7-8.
[6] Bataller R,Brenner D A.Liver fibrosis[J].Journal of Clinical Investigation,2005,115(2):209-218.
[7] Puche J E,Saiman Y,Friedman S L.Comprehensive Physiology:Hepatic Stellate Cells and Liver Fibrosis[M].America:John Wiley & Sons,2007:1728-1734.
[8] Troeger J S,Mederacke I,Gwak G Y,et al.Deactivation of Hepatic Stellate Cells during Liver Fibrosis Resolution in Mice[J].Gastroenterology,2012,143(4):1073-1083.
[9] Pinzani M,Marra F,Carloni V.Signal transduction in hepatic stellate cells[J].Liver,1998,18(1):2-13.
[10] Wolf D,Hallmann R,Sass G,et al.TNF-alpha-induced expression of adhesion molecules in the liver is under the control of TNFR1-relevance for concanavalin A-induced hepatitis[J].
J Immunol,2001, 166(2):1300-1307.
[11] Wallis R S.Biologics and infections: lessons from tumor necrosis factor blocking agents[J].Infectious Disease Clinics of North America,2011,25(4):895-910.
[12] Jatiani S S,Baker S J,Silverman L R,et al.JAK/STAT pathways in cytokine signaling and myeloproliferative disorders:Approaches for targeted therapies[J].Genes Cancer,2010,1(10):979-993.
[13] Matsui F,Meldrum K K.The role of the Janus kinase family/signal transducer and activator of transcription signaling pathway in fibrotic renal disease[J].J Surg Res,2012,178(1):339-345.
[14] Seavey M M,Dobrzanski P.The many faces of Janus kinase[J].Biochem Pharmacol,2012,83(9):1136-1145.
[15] Mair M,Blaas L,?sterreicher C H,et al.JAK-STAT signaling in hepatic fibrosis[J].Frontiers in Bioscience,2011,16(2):2794-2811.
[16] Lakner A M,Moore C C,Gulledge A A,et al.Daily genetic profiling indicates JAK/STAT signaling promotes early hepatic stellate cell transdifferentiation[J].World Journal of Gastroenterology,2010,16(40):5047-5056.
[17] Chen Y X,Huang Y H,Zheng W D,et al.Interleukin-10 gene modification attenuates hepatocyte activation of rat hepatic stellate cells in vitro[J].Molecular Medicine Reports,2013,7(2):371-378.
[18]涂云忠,張坚,刘慧萍,等.白细胞介素10基因修饰的骨髓间充质干细胞抑制大鼠肝纤维化形成的实验研究[J].中华肝脏病杂志,2012,20(12):908-911.
[19] Hsieh H G,Huang H C,Lee F Y,et al.Kinetics of cytokine expression in cirrhotic rats[J].Journal of the Chinese Medical Association Jcma,2011,74(9):385.
[20]王小众,张莉娟.IL-10抗肝纤维化的实验研究及临床现状[J].世界华人消化杂志,2007,15(23):2469-2472.
(收稿日期:2017-05-19) (本文编辑:周亚杰)endprint
