微型月季组培快繁关键技术研究
2017-11-14贾民隆李永平段九菊王云山曹冬梅郑梅梅
梁 峥,贾民隆,李永平,段九菊,王云山,曹冬梅,郑梅梅
(1.山西省农业科学院园艺研究所,山西 太原 030031;2.山西梅芝园艺有限公司,山西 太原 030000)
微型月季组培快繁关键技术研究
梁 峥1,贾民隆1,李永平1,段九菊1,王云山1,曹冬梅1,郑梅梅2
(1.山西省农业科学院园艺研究所,山西 太原 030031;2.山西梅芝园艺有限公司,山西 太原 030000)
以微型月季带腋芽的幼嫩茎段为试材,对微型月季组培快繁中外植体消毒、愈伤组织诱导、丛芽增殖培养以及植株生根等关键技术进行研究。结果表明,用75%酒精消毒2 min后,再用HgCl2消毒10~15 min时,外植体存活率最高;培养基MS+2 mg/L6-BA+0.1 mg/LNAA的愈伤组织诱导率可达95%;愈伤组织增殖最适培养基为MS+1 mg/L6-BA+0.5 mg/LKT+0.2 mg/LNAA;丛芽分化增殖最适培养基为MS+3 mg/L 6-BA+0.2 mg/L KT+0.2 mg/LNAA;生根最适培养基为1/2 MS+0.1 mg/LNAA。
组织培养;微型月季;快繁
微型月季(Rosa hybrida)是蔷薇科蔷薇属多年生木本。与常见的灌木月季和藤本月季相比,其株型矮小,花小而多,全年都可以开放[1-2],作为盆花具有天然的优势[3-4],露地栽培也具有很高的观赏价值[5-9]。同时微型月季还可以用于提取香料、精油等产品。传统月季栽培以扦插为主[10-11],但微型月季茎秆比较细弱,繁殖效率不高,难以满足规模化生产的需要[12]。
近年来,对于微型月季的繁殖方法研究主要集中在对扦插方法方面的探讨上,包括不同品种不同基质不同激素等因素对扦插繁殖的影响[13-15]。而对于组培快繁方面的研究则鲜有报道。
本研究探讨使用组织培养的方法进行快速繁殖微型月季,旨在为工厂化生产育苗提供一定的技术支撑。
1 材料和方法
1.1 植物材料
微型月季带腋芽的幼嫩枝条。
1.2 试验方法
1.2.1 外植体消毒 剪取月季幼嫩枝条,除去叶片,留叶柄,用带腋芽的枝条茎段作外植体材料;将茎段冲洗干净,切带芽茎段约4 cm长度,放于烧杯中,滴少许洗洁精,加水摇匀流水冲洗2 h;后放入超净台,用无菌水冲洗外植体4次,每次1 min,然后将茎段切1.5 cm左右,用75%酒精消毒2 min,无菌水冲洗3次,每次2 min;用0.1%HgCl2分别消毒5,10,15,20 min,无菌水冲洗 4 次,每次 5 min。30 d后观察记录污染率、褐化率。
1.2.2 愈伤组织的诱导 将消毒后的茎段置入不
同激素组合的愈伤组织诱导培养基上,室温(25±2)℃培养,每天光照12 h,光照强度1 500 lx。30 d后记录愈伤组织诱导率(诱导率=诱导出愈伤组织的外植体数/接种外植体数×100%)。愈伤组织诱导培养基激素组合设置为:(1)MS+0.5 mg/L 6-BA+0.1 mg/L NAA;(2)MS+2 mg/L 6-BA+0.1 mg/L NAA;(3)MS+4 mg/L 6-BA+0.1 mg/L NAA;(4)MS+0.5 mg/L6-BA+0.2 mg/LNAA;(5)MS+2 mg/L 6-BA+0.2 mg/L NAA;(6)MS+4 mg/L 6-BA+0.2 mg/L NAA;(7)MS+0.5 mg/L 6-BA+0.1 mg/L IAA;(8)MS+2 mg/L6-BA+0.1 mg/LIAA;(9)MS+4 mg/L 6-BA+0.1 mg/L IAA;(10)MS+0.5 mg/L 6-BA+0.2 mg/L IAA;(11)MS+2 mg/L 6-BA+0.2mg/LIAA;(12)MS+4mg/L6-BA+0.2mg/LIAA。1.2.3 愈伤组织增殖培养 取状态一致,大小相似的微型月季愈伤组织于不同激素组合的增殖培养基上,温度(25±2)℃,每天光照12 h,光照强度1 500 lx。30 d后记录愈伤组织增殖情况,计算其增殖系数(愈伤组织增殖系数=增殖培养后的愈伤质量/接种愈伤质量)。愈伤组织增殖培养基激素组合设置为:(1)MS+1 mg/L 6-BA+0.2 mg/L KT+0.2 mg/LNAA;(2)MS+1 mg/L6-BA+0.5 mg/LKT+0.2 mg/LNAA;(3)MS+2 mg/L6-BA+0.2 mg/LKT+0.2 mg/LNAA;(4)MS+2 mg/L6-BA+0.5 mg/LKT+0.2 mg/LNAA;(5)MS+1 mg/L6-BA+0.2 mg/L KT+0.2 mg/LIAA;(6)MS+1 mg/L6-BA+0.5 mg/LKT+0.2 mg/LIAA;(7)MS+2 mg/L6-BA+0.2 mg/LKT+0.2 mg/LIAA;(8)MS+2 mg/L6-BA+0.5 mg/LKT+0.2 mg/LIAA。
1.2.4 丛芽分化增殖培养 将2 cm左右萌发的腋芽插入不同激素组合的丛芽分化培养基上,置于温度(25±2)℃,每天光照 12 h,光照强度 1 500 lx。30 d后观察统计丛芽增殖情况,计算其增殖系数(丛芽增殖系数=增殖培养后的芽数/接种芽数)。丛芽分化培养基激素组合设置为:(1)MS+0.1 mg/L 6-BA+0.2 mg/L KT+0.05 mg/L NAA;(2)MS+0.5 mg/L 6-BA+0.2 mg/L KT+0.05 mg/L NAA;(3)MS+1 mg/L 6-BA+0.2 mg/L KT+0.05 mg/L NAA;(4)MS+3 mg/L 6-BA+0.2 mg/L KT+0.05 mg/L NAA;(5)MS+0.1mg/L6-BA+0.2mg/LKT+0.2mg/L NAA;(6)MS+0.5mg/L6-BA+0.2mg/LKT+0.2mg/L NAA;(7)MS+1 mg/L6-BA+0.2 mg/LKT+0.2 mg/L NAA;(8)MS+3 mg/L6-BA+0.2 mg/LKT+0.2 mg/L NAA。
1.2.5 生根培养 将丛芽分离移入不同配方的生根培养基上,置于温度(25±2)℃,每天光照12 h,光照强度1 500 lx。30 d后统计生根数。生根培养基配方设置为:(1)MS+0.1 mg/L NAA;(2)1/2 MS+0.1 mg/L NAA;(3)1/3 MS+0.1 mg/L NAA;(4)1/4 MS+0.1 mg/LNAA;(5)MS(母液硝酸铵 800 mg/L);(6)1/2 MS(母液硝酸铵 800 mg/L);(7)1/3 MS(母液硝酸铵 800 mg/L);(8)1/4 MS(母液硝酸铵800 mg/L)。
2 结果与分析
2.1 外植体消毒
月季幼嫩枝条茎段的消毒试验表明,HgCl2消毒时间长短对外植体材料污染率和褐死率有显著的影响,其具体表现为:污染率随HgCl2消毒时间的延长而变小,褐死率随消毒时间的延长而增大;其中,HgCl2消毒时间为10~15 min时,外植体存活率最高,达到75%(表1)。

表1 不同HgCl2处理时间对微型月季茎段消毒的影响
2.2 愈伤组织的诱导
不同激素组合对微型月季愈伤组织诱导的试验结果表明,不同激素组合的诱导培养基均能够使外植体在茎段底部接触培养基的部分产生少量淡黄色的愈伤组织,其中,(2)号组合(MS+2 mg/L 6-BA+0.1 mg/LNAA)诱导率最高,达到了95%(表2);随着继代次数的增加,愈伤组织有所增大,但增殖速度非常缓慢,因此,有必要进行愈伤组织增殖培养的条件优化。茎段底部愈伤组织缓慢增殖的同时,腋芽萌发,并在茎段上形成1~2 cm的嫩芽,嫩芽在愈伤诱导培养基中稍出现玻璃化的现象,生长就会变缓。
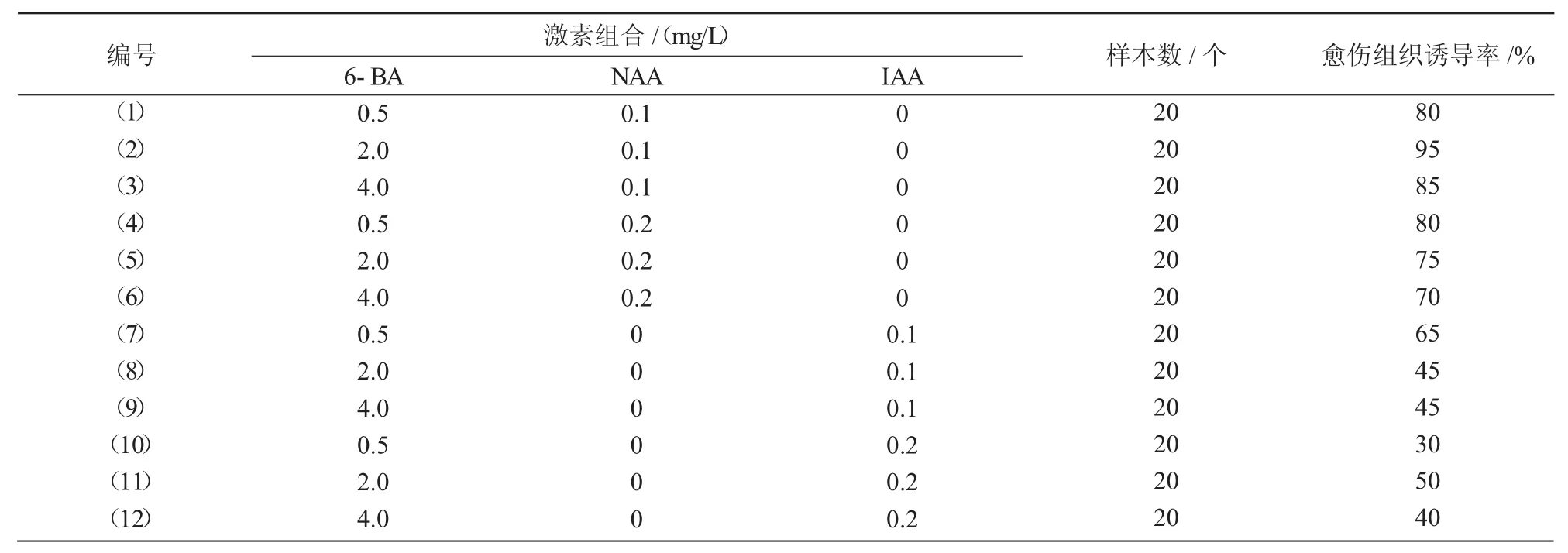
表2 不同的激素组合对微型月季愈伤组织诱导的影响
2.3 愈伤组织增殖培养
不同激素组合对微型月季愈伤组织的增殖试验结果表明,不同激素组合均能够诱导其增殖生长,产生浅黄色的愈伤组织。从所试组合总体上看,较高浓度的6-BA和KT有利于微型月季愈伤组织的增殖生长,并且相同条件下,NAA优于IAA;(2)号组合(MS+1 mg/L 6-BA+0.5 mg/L KT+0.2 mg/L NAA)的愈伤组织平均增殖系数最高,达到2.6,但最优组合并不是较高浓度6-BA的组合(表3)。因此认为,细胞分裂素在微型月季愈伤组织增殖作用上可能存在交互作用。
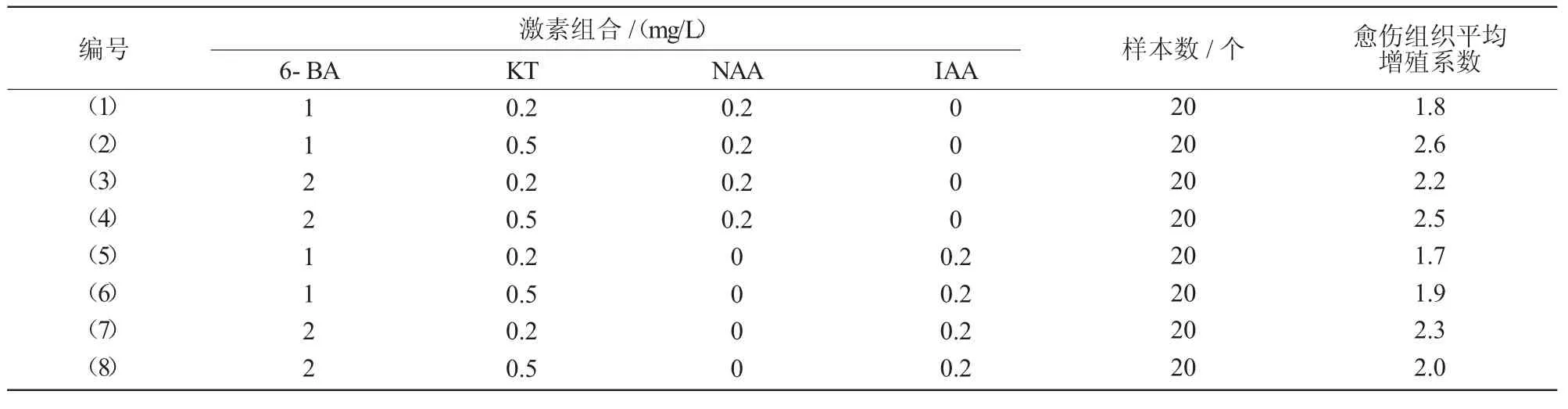
表3 不同的激素组合对微型月季愈伤组织增殖的影响
2.4 丛芽分化增殖培养
不同激素组合对微型月季丛芽分化增殖的试验结果表明,6-BA浓度在0.1~0.5 mg/L时,植株生长缓慢,丛芽分化很少;当6-BA浓度达到1 mg/L时,植株生长明显变得旺盛起来,并且产生比较多的丛生芽;随着细胞分裂素和生长素之比例的增大,微型月季丛芽增殖量有比较明显的增加,但过大的比例容易诱发丛生芽的玻璃化现象出现。其中,(4)号组合(MS+3 mg/L 6-BA+0.2 mg/L KT+0.05 mg/L NAA)的丛芽平均增殖系数最高,达到5.60,但新生丛芽存在玻璃化现象(表4)。综合考虑,认为(8)号组合(MS+3 mg/L 6-BA+0.2 mg/L KT+0.2 mg/LNAA)为最适丛芽分化增殖培养基。
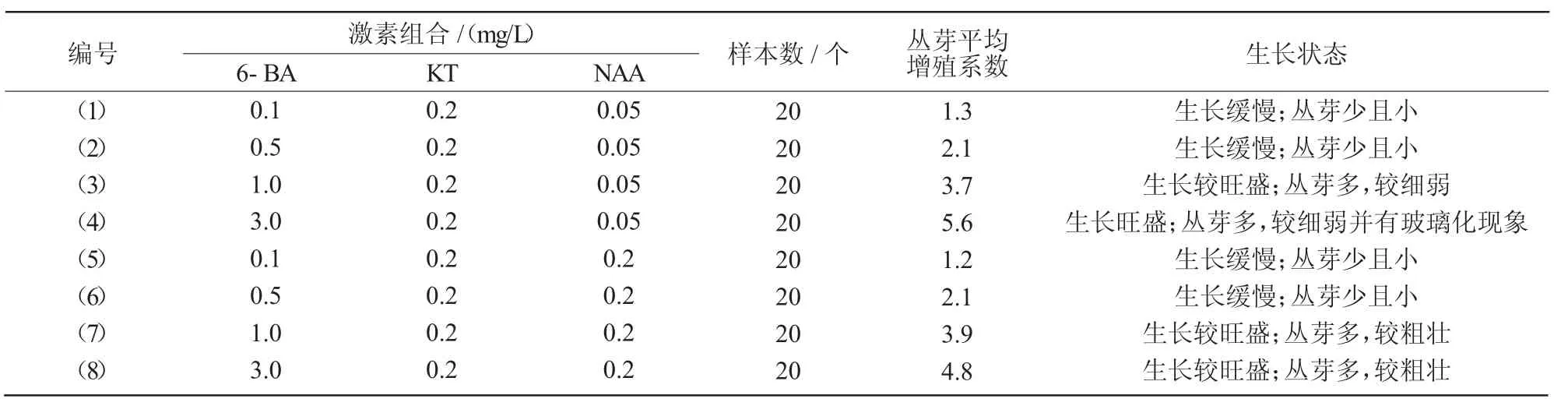
表4 不同的激素组合对微型月季丛芽分化增殖的影响
2.5 生根培养
不同培养基对微型月季生根的试验结果表明,减小培养基中硝酸铵含量、添加低浓度的生长素均有利于微型月季根系的分化。随着硝酸铵含量的降低,微型月季根的分化进程提前,其中,(5)号处理于继代后12 d最早出现不定根,当硝酸铵含量继续降低,根系分化所需时间不再缩短,并且根系出现发褐发黑现象;添加了NAA的处理根系较细长,呈白色(表5)。综合比较,认为(2)号培养基(1/2 MS+0.1 mg/LNAA)为最适微型月季生根培养基(图1)。
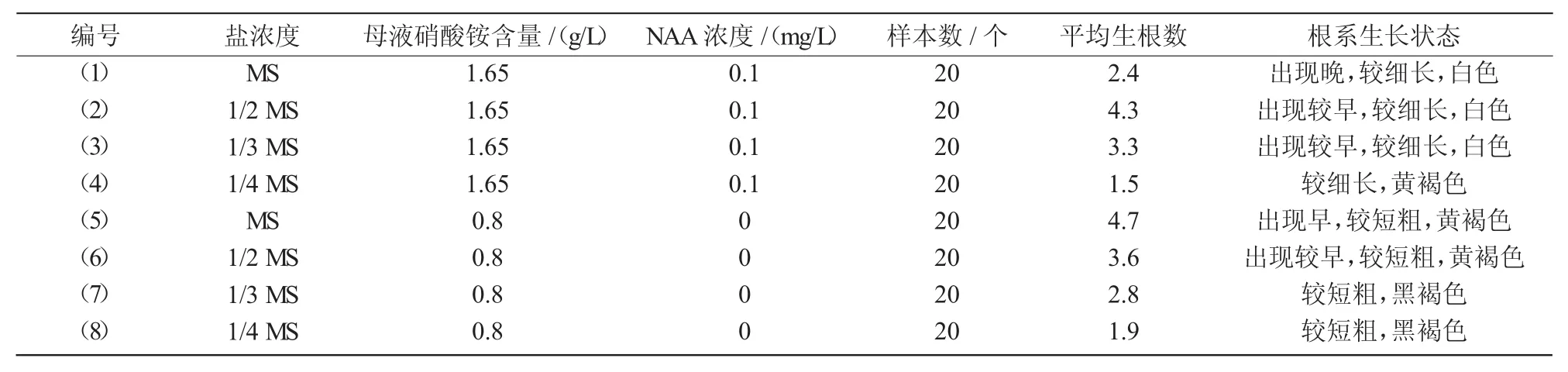
表5 不同的培养基对微型月季生根的影响

3 讨论
丛芽增殖培养中,细胞分裂素浓度过高会导致丛芽出现玻璃化,这与雷颖等[16]的报道一致,但是如果降低细胞分裂素6-BA的浓度,丛芽增殖速率就会受到明显的抑制。本试验中,当6-BA质量浓度上升至3 mg/L时,新生丛芽开始出现明显的玻璃化现象,玻璃化的细小丛芽剥离后,经过2~3次继代成长虽能够自行脱离玻璃化,但在恢复期间增殖速度会明显受到影响。在不改变6-BA浓度的情况下适当提高NAA的浓度,希望通过调节生长素与细胞分裂素之比的方法解决高增殖系数下玻璃化的影响。本试验证明,适当提高NAA浓度,能够较好地控制细胞分裂素浓度过高导致的丛芽玻璃化现象,抑制玻璃化现象的同时保持了比较高的增殖效率。
在继代过程中发现,底部较老的茎容易出现褐化现象。本试验中,只是在继代时将底部的褐化茎做了切除处理,茎底褐化现象对微型月季增殖快繁的影响还有待探究。利用添加活性炭、水解乳蛋白[17-18]等方法探究茎底部褐化现象对于微型月季组培快繁的影响,或许能够进一步提高微型月季的工厂化育苗水平。
丛芽分化培养过程中偶见花芽分化,说明微型月季在一定条件下能够在瓶内开花,这也表明,在组培条件下存在研究微型月季整个生活史的可能。关于微型月季试管开花的研究可见少量报道[19-20],微型月季在组培条件下完成生活史的适宜条件尚有待研究。
[1]李奎,胡晓雪.微型月季创造神奇价值[J].中国花卉园艺,2014(3):58-59.
[2]王耘.最佳阳台花卉——微型月季[J].中国花卉盆景,2009(10):9.
[3]吕金花.花卉业是前景广阔的优势产业[J].山西农业科学,2007(7):95-96.
[4]顾蓉,李燕,曹建琴.太原市年宵盆花调查[J].山西农业科学,2016,44(1):63-66.
[5]彭华,管帮富,彭火辉,等.江西南昌引种丰花及微型月季品种的鉴定评估[J].江西农业学报,2012(4):34-37.
[6]宋尚平.微型月季相关研究通过鉴定 [N].中国花卉报,2010-05-13.
[7]牟会斌,陆红梅.盆栽和地被好材料——微型月季[J].园林,2000(12):38-39.
[8]王松,付宝春,刘琛彬,等.太原市城区冬季园林植物调查与景观效果评价[J].山西农业科学,2014,42(1):48-53.
[9]付宝春,李志娟,刘琛彬,等.太原市城区园林植物应用现状调查与分析[J].山西农业科学,2013,41(6):594-598,649.
[10]刘和风,孟吉强,代经亮.微型月季出口生产管理[J].中国花卉园艺,2009(18):44-45.
[11]周家杏.微型月季扦插繁殖技术及扦插苗对温度的适应性研究[D].上海:上海交通大学,2008.
[12]陈兰芬.7个微型月季组织培养研究[J].北京农业职业学院学报,2015(2):35-39.
[13]汪有良.微型月季扦插生根能力初步研究 [J].江苏林业科技,2012(5):16-19,38.
[14]季春娟,曾丽,周家杏,等.不同基质对微型月季扦插繁殖的影响[J].上海交通大学学报(农业科学版),2010(3):275-279.
[15]闫小红.微型盆栽月季微体扦插快繁及其配套技术的研究[D].南京:南京农业大学,2006.
[16]雷颖,刘宇.微型月季快速繁殖与优化培养瓶内开花试验研究[J].现代园艺,2015(11):6-7.
[17]王芳,王娟,曾莉莎,等.微型月季组织培养探讨[J].现代农业科技,2014(6):187.
[18]郭艳,杨海玲.植物组织培养中的褐化现象及解决途径[J].山西农业科学,2009,37(7):14-16,31.
[19]周俊辉,杨寅桂,刘义存,等.微型月季的试管开花诱导研究[J].江西农业大学学报,2008(3):504-508.
[20]张作梅.微型月季组培快繁技术体系的研究[D].合肥:安徽农业大学,2009.
Study on Key Techniques of Tissue Culture and Rapid Propagation ofRosa hybrida
LIANGZheng1,JIAMinlong1,LI Yongping1,DUANJiuju1,WANGYunshan1,CAODongmei1,ZHENGMeimei2
(1.Institute ofHorticulture,Shanxi AcademyofAgricultural Sciences,Taiyuan 030031,China;
2.Shanxi Meizhi GardeningCo.,Ltd.,Taiyuan 030000,China)
Young stem segments with axillary buds from miniature rose(Rosa hybrida)were employed for studies of tissue culture,which included explant sterilization,callus induction,shoots regeneration and plant rooting.The results showed that the survival rate of explants was the highest when sterilized with 75%alcohol for 2 min and HgCl2for 10-15 min.The callus induction rate reached 95%when the mediumMS+2 mg/L6-BA+0.1 mg/LNAAwas used.The optimummediumfor callus proliferation was MS+1 mg/L6-BA+0.5 mg/L KT+0.2 mg/L NAA.The optimal medium for shoots increased was MS+3 mg/L 6-BA+0.2 mg/L KT+0.2 mg/L NAA.The optimummediumfor rootingwas 1/2 MS+0.1 mg/LNAA.
tissue culture;Rose hybrida;rapid propagation
S685.12
A
1002-2481(2017)11-1751-05
10.3969/j.issn.1002-2481.2017.11.05
2017-07-14
山西省科技成果转化引导专项二批(201604D132045);山西省农业科学院攻关项目(YGG1604)
梁 峥(1987-),女,河北邢台人,助理研究员,硕士,主要从事观赏植物生物技术研究工作。曹冬梅为通信作者。
