放疗与中药“君-佐”相伍的理论运用于肝癌细胞放疗增敏效果分析*
2017-11-13李星瑶蔡子墨党慧敏吴喜利
安 鹏,李星瑶 ,蔡子墨,党慧敏,李 林,吴喜利
1.西安交通大学第二附属医院(西安710004), 2.陕西中医药大学(西安712083)
放疗与中药“君-佐”相伍的理论运用于肝癌细胞放疗增敏效果分析*
安 鹏1,李星瑶1,蔡子墨1,党慧敏1,李 林2,吴喜利1
1.西安交通大学第二附属医院(西安710004), 2.陕西中医药大学(西安712083)
目的:分析采用放疗与中药“君-佐”相伍的理论对肝癌细胞放疗增敏效果,为临床应用提供依据。方法:将HepG2细胞分为5组,检测各组细胞克隆形成数及克隆形成率,检测各组细胞凋亡率,并分析HIF-1α、CA-9、VEGF或β-actin的蛋白及mRNA水平。结果:药物加放疗组HepG2细胞克隆形成数及克隆形成率显著低于其他组(P<0.05);药物加放疗组HepG2细胞凋亡率明显高于其他组,且差异存在统计学意义(P<0.05);药物加放疗组HepG2细胞HIF-1α/β-actin及VEGF/β-actin蛋白及mRNA水平显著低于其他组,但药物加放疗组HepG2细胞CA-9/β-actin蛋白及mRNA水平显著高于其他组。结论:采用放疗与中药“君-佐”相伍的理论对肝癌细胞处理后,可能提高细胞凋亡率及放疗增敏效果。
目前早期肝癌的治疗仍首选外科手术,但临床就诊患者多属中晚期病人,手术切除率低,即使早期切除,术后5 年复发率也在60%以上[1]。由于肝癌细胞的辐射抗拒性,使肝癌的放疗剂量明显高于肝脏的耐受,尤其有肝病基础的中晚期肝癌,又限制了放疗剂量,导致对于肝癌放疗效果不理想[2]。“君-佐”相伍的放疗增敏理论是我课题组根据传统中医药“君臣佐使”配伍理论设计而来的。“君臣佐使”理论是中药配伍的基础原理,也是祖国医学临床组方的基本原则。《神农本草经》载有“上药为君,中药为臣,下药为佐使,以相宣摄合和……”这主要是关于药性分类的论述。因而笔者对采用该理论对肝癌细胞放疗增敏效果进行分析,为临床应用提供依据。
材料与方法
1 材 料 本组研究中人肝癌HepG2细胞株购买自ATCC细胞库,黄芩素购买自曼斯特有限公司,纯度大于99%,丝裂酶原购买自浙江海正药业,新生胎牛血清及DMEM购买自GIBCO公司,MTT、碘化丙啶及二甲基亚砜购买自Sigma公司,RT-PCR试剂盒购买自福麦斯有限公司。
2 方 法
2.1 细胞培养及分组:快速将所冻存细胞于37℃水浴摇床60转/min慢摇复苏,复苏后800转/min离心5min,吸去上清加入10 ml含15%胎牛血清DMEM培养基,混匀后加入细胞培养板,每孔1 ml,共10孔,5% CO2温箱37 ℃培养。将所有细胞分为五组,即空白对照组:细胞+ 培养基、放疗组:细胞+培养基+放疗、药物组:药物+细胞+培养基、药物加放疗组:药物+细胞+培养基+放疗、肝细胞加药物组:肝细胞+药物+培养基,检测各组细胞克隆形成数及克隆形成率。
2.2流式细胞术:通过FCM检测实验,使用AnnexinV-FITC及PI染色双染分析各组细胞凋亡率。
2.3 Western Blotting 检测蛋白水平:各组细胞以细胞裂解液处理后,在冰上裂解静置30 min,后以BCA法测定蛋白质浓度。后行10%SDS聚丙烯酰胺凝胶电泳,再100 V湿转90 min,并将蛋白转移至PVDF膜上。以5% BSA封闭1 h,抗HIF-1α、CA-9、VEGF或β-actin抗体4℃孵育过夜,后用标记二抗孵育1 h,后使用天能凝胶成像系统检测蛋白水平。
2.4 mRNA表达水平检测:采用SYBR荧光实时定量法对不同组HepG2细胞中HIF-1α、CA-9、VEGF或β-actinmRNA进行检测,采用相对定量比较CT值基因表达,采用相对荧光值对mRNA相对表达量分析。反应体系为20 μl,上游及下游引物各1 μl,ddH2O 6 μl,10 μl Power SYBR Green PCR Master Mix,cDNA 2 μl。每个样本的RNA含量均根据各自的β-actin含量进行标准化。
3 统计学方法 本研究中使用的是SPSS 19.0软件处理数据,使用均值±标准差及百分率来计数资料,使用方差分析及卡方检验分析组间数据,P<0.05 表示差异有统计学意义。
结 果
1 细胞克隆形成 本组研究结果显示,药物加放疗组HepG2细胞克隆形成数及克隆形成率显著低于其他组(P<0.05),当仍显著高于肝细胞加药物组(P<0.05),详见表1。
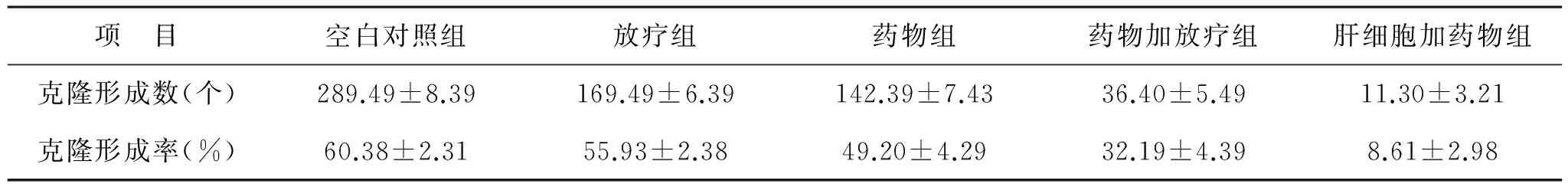
表1 细胞克隆形成结果(个)
2 细胞凋亡率检测结果 研究结果显示,药物加放疗组HepG2细胞凋亡率明显高于其他组,且差异存统计学意义(P<0.05),详见表2。

表2 细胞凋亡率检测结果(%)
3 蛋白表达水平结果 本组研究结果显示,药物加放疗组HepG2细胞HIF-1α/β-actin及VEGF/β-actin蛋白水平显著低于其他组,但药物加放疗组HepG2细胞CA-9/β-actin蛋白水平显著高于其他组,详见图1。
4 mRNA表达水平 本组研究结果显示,药物加放疗组HepG2细胞HIF-1α及VEGF mRNA水平显著低于其他组,但物加放疗组HepG2细胞CA-9 mRNA水平显著高于其他组,详见图2。
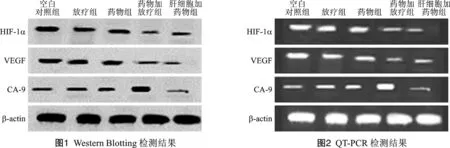
讨 论
祖国医学经过长期的临床实践、历代医家论述、总结,使“君臣佐使”理论日渐完善。目前,有很多学者越来越深入的对“君臣佐使”配伍理论的应用进行了研究与探讨,同时又有一些新的观点与“君臣佐使”配伍理论相结合,也出现了许多新思路和新模式。是否可以用“君臣佐使”的配伍理论指导中药与西药之间,甚至中药与其他治疗方法之间的配伍,这也是我们需要思考的。放射线杀死肿瘤细胞,同时对正常组织细胞也会引起明显的副反应,通过其产生的作用与副作用,中医思维推断放射线性专而力猛,具有辛温、大热、火毒等性质,十分类似于雄黄、砒霜、火硝一类中药。放疗中所产生的抗性以及其副反应的弊端,严重影响了其在治疗肿瘤过程中的疗效发挥。因此,放疗增敏研究也就显得尤为重要。而如果将放疗比做“君药”,那么增敏作用就如同“佐药”的作用。这种“君-佐”配伍的关系是否能在治疗肿瘤中发挥作用,那就需要我们实验得出。
放射线根据中医理论应类似于辛温有毒类的药物,如果把放射线作为“君药”,与之相伍的“佐药”清热解毒类的药物最为适合,再根据放疗的部位选取相应的归经药物[3]。经查阅文献已经有一些针对清热解毒类中药对放射增敏的研究,但对理论基础及作用机制的深入研究并不多见[4]。本组研究结果显示,采用放疗与中药“君-佐”相伍的理论配合使用对HepG2干预后,可显著降低HepG2细胞细胞克隆形成,并提高肿瘤细胞凋亡率。并可有效提高CA-9蛋白及mRNA水平基础上降低HIF-1α及VEGF水平。
乏氧诱导因子HIF-1α(Hypoxia-inducible factor-1α)在恶性肿瘤中是关键调控因子,68%的恶性肿瘤及癌前病变HIF-1α蛋白的表达均有提高[5]它是肿瘤适应缺氧、产生一系列适应乏氧行为的中心环节。因此,阻断HIF-1α表达已成为靶向杀伤乏氧肿瘤细胞的重要策略[5]。乏氧时的主要表现为其蛋白降解减少,而稳定性增加,最终蛋白表达水平提高;而给氧后,蛋白降解增加,最终蛋白表达水平下降[6-7]。在一般情况下,CA-9在正常组织的表达极少,在缺氧肿瘤中CA-9表达上升。碳酸酐酶-9(CA-9)是碳酸酐酶的一种,它可以调节细胞内的pH值,在缺氧肿瘤中CA-9可大量的表达[8]。CA-9是乏氧相关的内生蛋白,与肿瘤细胞乏氧以及微环境调整有关,CA-9高表达可表明肿瘤组织的乏氧及所属区域[9]。这也提示针对CA-9靶向治疗可以调整组织缺氧微环境、从而降低肿瘤侵袭性,这可能为肿瘤靶向治疗的未来提供新思路及新方案。
有研究指出,VEGF是人体内重要的内皮细胞特异性分裂剂,其也是重要的诱导肿瘤产生的新生血管因子[10]。一般情况下,癌基因、细胞因子、缺氧及抑癌基因产物等多种因素均可有效调控VEGF[11]。有研究结果表明,VEGF增强子内含可与HIF-1α结合的HRE,一方面增强子结合后可增强蛋白水平表达和转录,增强血管生成量,使血液达缺氧部位。此外,HIF-1可在缺氧情况下有效增强VEGF mRNA稳定性[12-13]。且VEGF在促进肿瘤血管生成因素中,起到最关键、最基础作用。
综上所述,采用放疗与中药“君-佐”相伍的理论对肝癌细胞处理后,可有效降低细胞干性,提高细胞凋亡率,并通过调控HIF-1α、VEGF、CA-9表达水平,提高肝癌细胞放疗增敏效果。但其具体作用靶点及基因调控过程还有待于后续深入研究。
[1] Tian F, Han Y, Yan X,etal. Upregulation of microrna‐451 increases the sensitivity of A549 cells to radiotherapy through enhancement of apoptosis[J]. Thoracic Cancer, 2016, 7(2):226-231.
[2] Nakajima A, Endo H, Okuyama H,etal. Radiation sensitivity assay with a panel of patient-derived spheroids of small cell carcinoma of the cervix[J]. International Journal of Cancer, 2015, 136(12):2949-60.
[3] Mccool JK, Ashamalla H, Graves LM,etal. Inhibition of CDK9 enhances radiation sensitivity of Non-small cell lung cancer cells, increases PARP cleavage, and reduces the level of antiapoptotic proteins[J]. International Journal of Radiation Oncology Biology Physics, 2015, 93(3):E530-E530.
[4] 郑学嵩, 王 映, 蒙以良,等. 肿瘤囊泡包装的甲氨蝶呤对肺癌A549细胞放疗增敏作用的体外研究[J]. 实用癌症杂志, 2017, 32(1):1-4.
[5] Wang W, Jiao L, Wen Q,etal. 4EGI-1 induces apoptosis and enhances radiotherapy sensitivity in nasopharyngeal carcinoma cells via DR5 induction on 4E-BP1 dephosphorylation[J]. Oncotarget, 2016, 7(16):21728-21741.
[6] 郭俊宇, 陈应超. 异甘草素对人鼻咽癌CNE2细胞裸鼠移植瘤模型的放疗增敏作用[J]. 河北医药, 2016, 38(24):3704-3707.
[7] Oorschot BV, Granata G, Franco SD,etal. Targeting DNA double strand break repair with hyperthermia and DNA-PKcs inhibition to enhance the effect of radiation treatment[J]. Oncotarget, 2016, 7(40):65504-65513.
[8] Mendes F, Sales T, Domingues C,etal. Effects of X-radiation on lung cancer cells: the interplay between oxidative stress and P53 levels[J]. Medical Oncology, 2015, 32(12):266.
[9] Barker HE, Paget JT, Khan AA,etal. The tumour microenvironment after radiotherapy: mechanisms of resistance and recurrence[J]. Nature Reviews Cancer, 2015, 15(7):409.
[10] Li D, Fu Z, Chen R,etal. Inhibition of glutamine metabolism counteracts pancreatic cancer stem cell features and sensitizes cells to radiotherapy[J]. Oncotarget, 2015, 6(31):31151-31163.
[11] 王 彤, 余熙彦, 娄 樱,等. 小剂量顺铂对中晚期非小细胞肺癌的放疗增敏疗效观察[J]. 实用癌症杂志, 2016, 31(11):1878-1880.
[12] Feng J, Zhang S, Wu K,etal. Combined effects of suberoylanilide hydroxamic acid and cisplatin on radiation sensitivity and cancer cell invasion in Non-small-cell lung cancer [J]. Molecular Cancer Therapeutics, 2016, 15(5):842.
[13] Yu S, Wang M, Ding X,etal. Testicular orphan nuclear receptor 4 is associated with the radio-sensitivity of prostate cancer[J]. Prostate, 2015, 75(14):1632.
RadiotherapyandtraditionalChinesemedicine“JunZuo”theorywereappliedtoenhancethesensitivityoflivercancercellstoradiotherapy
An Peng,Li Xingyao,Cai Zimo,et al.
Second Affiliated Hospital of Xi'an Jiaotong University(Xi’an 710004)
Objective:Analyze the sensitization effect of radiotherapy and traditional Chinese medicine “Jun Zuo” theory on liver cancer cells, and to provide basis for clinical application.Methods:HepG2 cells were divided into five group were assayed by colony formation and clone formation rate, apoptosis rate was detected, and the analysis of protein and mRNA levels of HIF-1, CA-9, VEGF alpha or beta-actin.Results:The drug plus radiotherapy group HepG2 cell colony formation and clone formation rate was significantly lower than that of other groups (P<0.05); drug plus radiotherapy group the apoptosis rate of HepG2 cells was significantly higher than other groups, and the difference was statistical significance (P<0.05); drug plus radiotherapy group HepG2 cells HIF-1 alpha beta -actin and VEGF/ beta / -actin protein and mRNA levels were significantly lower than other groups, but the content of HepG2 cells plus radiotherapy group CA-9/ beta -actin protein and mRNA levels were significantly higher than that in other groups.Conclusions:The use of radiotherapy and Chinese medicine “Jun Zuo” theory for treating liver cells, can effectively reduce the dry cell, improve the rate of cell apoptosis, and the expression level through the regulation of HIF-1 alpha and VEGF and CA-9, to improve the radiation sensitizing effect of hepatocellular carcinoma cells.
*陕西省科学技术研究发展计划项目(2013KW-26-03) 陕西省中医药管理局项目(JC38)
肝肿瘤/中医药疗法 放射疗法 @中药“君-佐”相伍的理论 辐射增敏药
R735.7
A
10.3969/j.issn.1000-7369.2017.11.058
KeywordsLiver neoplasms/ traditional Chinese medicine therapy Radiotherapy @Traditional Chinese medicine“ Jun Zuo” Radiation-sensitizing agents
(收稿:2017-06-22)
