猕猴桃SCoT遗传多样性分析及指纹图谱的构建
2017-11-09张安世张中海齐秀娟
张安世 张中海 齐秀娟 刘 莹 骆 扬
(1.焦作师范高等专科学校理工学院,焦作 454000; 2.中国农业科学院郑州果树研究所,郑州 450009)
猕猴桃SCoT遗传多样性分析及指纹图谱的构建
张安世1张中海1齐秀娟2刘 莹1骆 扬1
(1.焦作师范高等专科学校理工学院,焦作 454000; 2.中国农业科学院郑州果树研究所,郑州 450009)
利用SCoT标记对32个猕猴桃品种进行了遗传多样性分析。从47个SCoT引物中筛选了11个引物进行PCR扩增,共扩增出185个条带,其中多态性条带180个,多态性比率为97.30%。各引物Nei’s基因多样性指数(H)平均为0.238 4,Shannon’s信息指数(I)平均为0.377 8。利用UPGMA构建32份猕猴桃种质资源的聚类树状图。在遗传相似系数为0.78处可将32个猕猴桃品种分为5组,聚类结果与形态学分类基本一致。利用4条引物扩增的16个多态性位点构建了32个猕猴桃品种的DNA指纹图谱,可以将32个猕猴桃品种区分并准确鉴定。
猕猴桃; SCoT; DNA指纹图谱; 遗传多样性
猕猴桃(Actinidiasp.)为多年生雌雄异株落叶藤本植物,现有54个种、21个变种,共计75个分类单元,其中我国有52种,73个分类单元[1],已经育成的品种或品系达148个[2]。以往的研究表明,猕猴桃属植物从形态性状、营养成分、性别到染色体倍性变异都有很高的多样性[3]。但是,由于近年来栽培品种大面积推广,导致地方品种日趋减少,使得品种遗传多样性下降,遗传基础日益狭窄[1]。同时,由于猕猴桃资源的遗传背景复杂,种间杂交和种内多倍化的现象突出,研究者对猕猴桃种间及种内的亲缘关系有不同看法[3~4],因此,利用分子标记技术进行猕猴桃品种鉴定和遗传多样性评价十分必要。目前,已有RAPD、AFLP、ISSR、SSR、SRAP等多种分子标记技术成功应用于猕猴桃遗传多样性分析中[1,5~8],而猕猴桃的SCoT相关研究还鲜有报道。
目标起始密码子多态性(start codon targeted polymorphism,SCoT)是Collard和Mackill[9]首先在水稻上开发应用的基于SPAR(单引物扩增反应)新的目的基因分子标记技术。该技术不仅具备了ISSR和RAPD的操作简单、通用性良好、多态性丰富、成本低廉等优点,同时又能对性状进行跟踪,有利于分子辅助育种[10],已在多种园艺植物上得到成功应用[10~12]。本试验采用SCoT标记对我国32个猕猴桃品种进行遗传多样性分析,并构建DNA指纹图谱,为猕猴桃的品种鉴定、杂交育种亲本的选配等研究提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试验材料
猕猴桃材料全部采自中国农业科学研究院郑州果树研究所,包括4种32个品种(表1)。
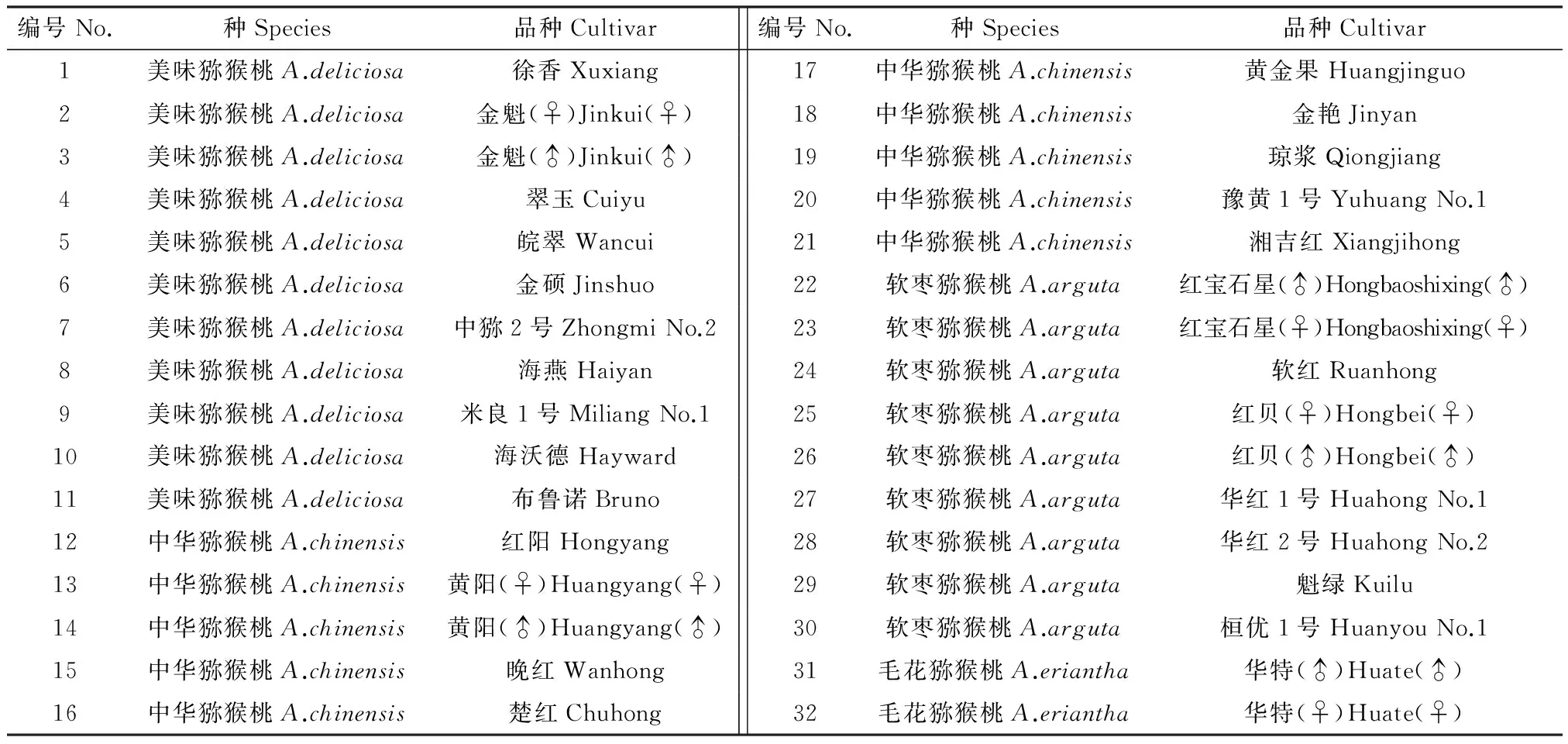
表1 供试材料
1.1.2 试剂
2×Taq MasterMix(含有Taq DNA Polymerase,2×Taq PCR Buffer,3 mmol·L-1MgCl2和400 μmol·L-1dNTP mix)购自北京康为世纪生物科技有限公司,SCoT引物由金唯智生物科技(北京)有限公司合成。
1.1.3 仪器
BIOFUGE PRIMO R型冷冻离心机,NANODROP 1000紫外分光光度计,PTC-200型PCR仪,G:BOX-HR凝胶成像系统。
1.2 方法
1.2.1 猕猴桃基因组DNA的提取
采用改良CTAB法[13]提取猕猴桃基因组DNA,并将模板DNA浓度稀释至20 ng·μL-1,保存于-20℃备用。
1.2.2 SCoT-PCR分析
选用40个SCoT单引物(从SC1到SC40)和7个由SCoT单引物搭配而成的引物组合(SC1+SC31,SC1+SC35,SC13+SC37,SC29+SC31,SC29+SC35,SC29+SC37,SC31+SC35)共计47个引物对供试材料进行扩增。反应体积10 μL,DNA 0.8 μL,引物0.8 μL,2×Taq MasterMix 5.0 μL,RNase-Free water 3.4 μL。SCoT-PCR扩增程序为:94℃,5 min;94℃,1 min,54℃,1 min,72℃,1.5 min,40个循环;72℃,8 min。4℃保存。扩增产物用1.5%琼脂糖凝胶分离。
1.3 数据统计与分析
选取条带清晰、多态性好的引物进行统计分析。以1或0表示同一引物的扩增产物在迁移距离相同的位置上条带的有或无,建立1,0矩阵,利用POPGENE1.32软件进行遗传多样性参数分析,计算多态性百分率(PPL)、Nei’s基因多样性(H)和Shannon’s多样性指数(I)。用NTSYS-pc 2.0软件构建UPGMA聚类图。同时,参照林青等[12]方法构建34个猕猴桃品种的数字指纹图谱。
2 结果与分析
2.1 SCoT引物筛选与多态性分析
以供试的32个猕猴桃材料对47个SCoT引物进行了筛选,最终筛选出了条带清晰、多态性高的11个引物,其中,包括9个SCoT单引物和2个引物组合。所用引物序列见表2。各引物的多态性统计结果见表3。11个引物共扩增出185个条带,多态性条带180个,多态性比率为97.30%,说明猕猴桃具有很高的SCoT多态性。在被统计的11个引物中,引物SC29扩增的位点数最多,为22个,引物SC13扩增的位点数最少,为13个,平均每个引物扩增的位点数为16.82个。引物组合SC29+SC31的扩增结果见图1。通过POPGENE1.32软件分析得到的猕猴桃遗传多样性参数表明(表3),各引物Nei’s基因多样性指数(H)的变化范围为0.164 0~0.288 3,平均值为0.238 4,H值最高的为引物SC31(0.288 3),H值最低的引物为SC23(0.164 0);各引物Shannon’s信息指数(I)的变化范围在0.284 5~0.437 2,平均值为0.377 8,I值最高的为引物SC29+SC31(0.437 2),I值最低的引物为SC23(0.284 5)。
2.2 遗传相似性和聚类分析
利用NTSYS-pc软件计算品种间的遗传相似系数(GS),结果表明,32个猕猴桃品种两两间的GS在0.529 7~0.962 2,平均值为0.707 4,变幅为0.432 5,说明供试品种间存在较大的遗传差异。其中金魁(雌)和金魁(雄)的GS最大(0.962 2),亲缘关系最近,布鲁诺和红贝(雄)的GS最小(0.529 7),亲缘关系最远。

表2 用于SCoT分析的引物序列
表311个SCOT引物及多态性分析
Table3TheelevenSCoTprimersusedforthisstudyandtheirpolymorphic
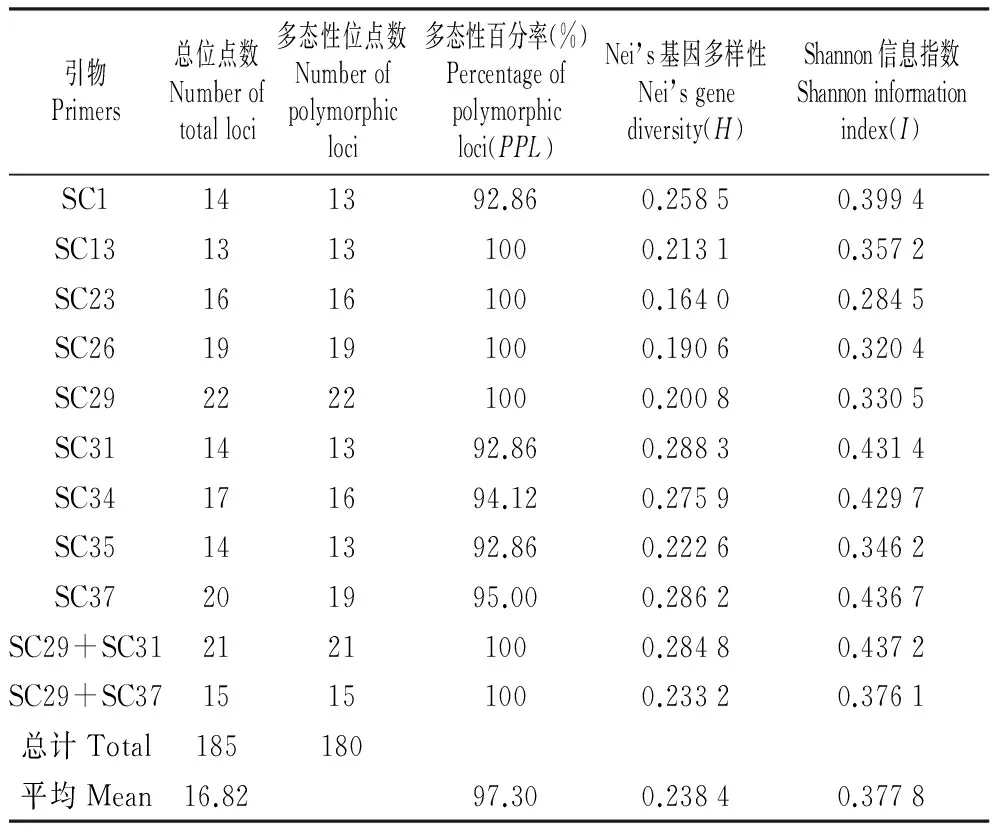
引物Primers总位点数Numberoftotalloci多态性位点数Numberofpolymorphicloci多态性百分率(%)Percentageofpolymorphicloci(PPL)Nei’s基因多样性Nei’sgenediversity(H)Shannon信息指数Shannoninformationindex(I)SC1141392.860.25850.3994SC1313131000.21310.3572SC2316161000.16400.2845SC2619191000.19060.3204SC2922221000.20080.3305SC31141392.860.28830.4314SC34171694.120.27590.4297SC35141392.860.22260.3462SC37201995.000.28620.4367SC29+SC3121211000.28480.4372SC29+SC3715151000.23320.3761总计Total185180平均Mean16.8297.300.23840.3778
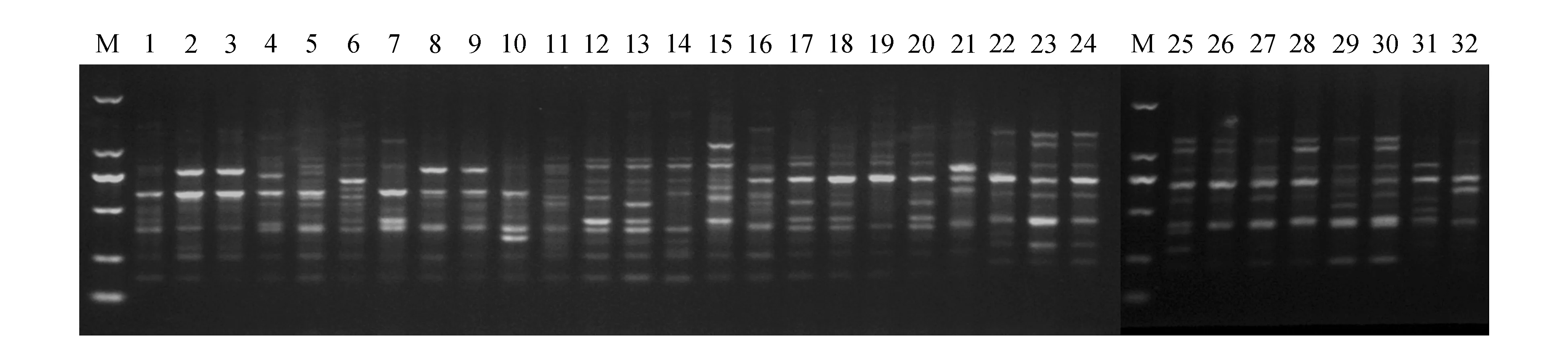
图1 引物组合SC29+SC31扩增结果 M.DNA Marker;1~32.材料编号同表1Fig.1 The SCoT amplification of primer combination SC29+SC31 M.DNA Marker;1-32.The same as table 1
利用NTSYS-pc软件对32个猕猴桃瓜品种进行聚类分析。结果表明(图2),在GS为0.78处可将32个猕猴桃品种分为5组。第1组包括13个猕猴桃品种:徐香、金魁(雌)、金魁(雄)、翠玉、皖翠、海沃德、中猕2号、海燕、米良1号、布鲁诺、金硕、楚红和湘吉红;第2组为华特(雌)1个猕猴桃品种;第3组包括8个猕猴桃品种:红阳、晚红、黄阳(雌)、黄金果、黄阳(雄)、金艳、豫黄1号和琼浆;第4组包括9个猕猴桃品种:红宝石星(雄)、软红、红宝石星(雌)、红贝(雌)、华红2号、华红1号、红贝(雄)、桓优1号和魁绿;第5组为华特(雄)1个猕猴桃品种。其中第1组除楚红和湘吉2个品种外均为美味猕猴桃系列,第3组为中华猕猴桃系列,第4组为软枣猕猴桃系列,而第2组和第5组为毛花猕猴桃系列,因此,该聚类结果与形态学分类基本一致。
同时,利用POPGENE1.32软件计算种间的遗传相似系数(GS),结果表明,中华猕猴桃与美味猕猴桃亲缘关系最近,GS为0.942 0,毛花猕猴桃与中华猕猴桃、美味猕猴桃、软枣猕猴的GS分别为0.851 5、0.860 3和0.807 2,因此,相对于软枣猕猴,毛花猕猴桃与中华猕猴桃和美味猕猴桃的亲缘关系更近,也与上述聚类结果基本一致。
2.3 DNA指纹图谱的构建
通过筛选的11个引物对32种猕猴桃品种的扩增结果分析,选取其中SC29、SC31、SC37和SC29+SC31 4个引物扩增的16个多态性位点构建了32个猕猴桃品种的DNA指纹图谱(表4)。每个品种都有唯一的指纹图谱,可以将32个猕猴桃品种区分并准确鉴定。
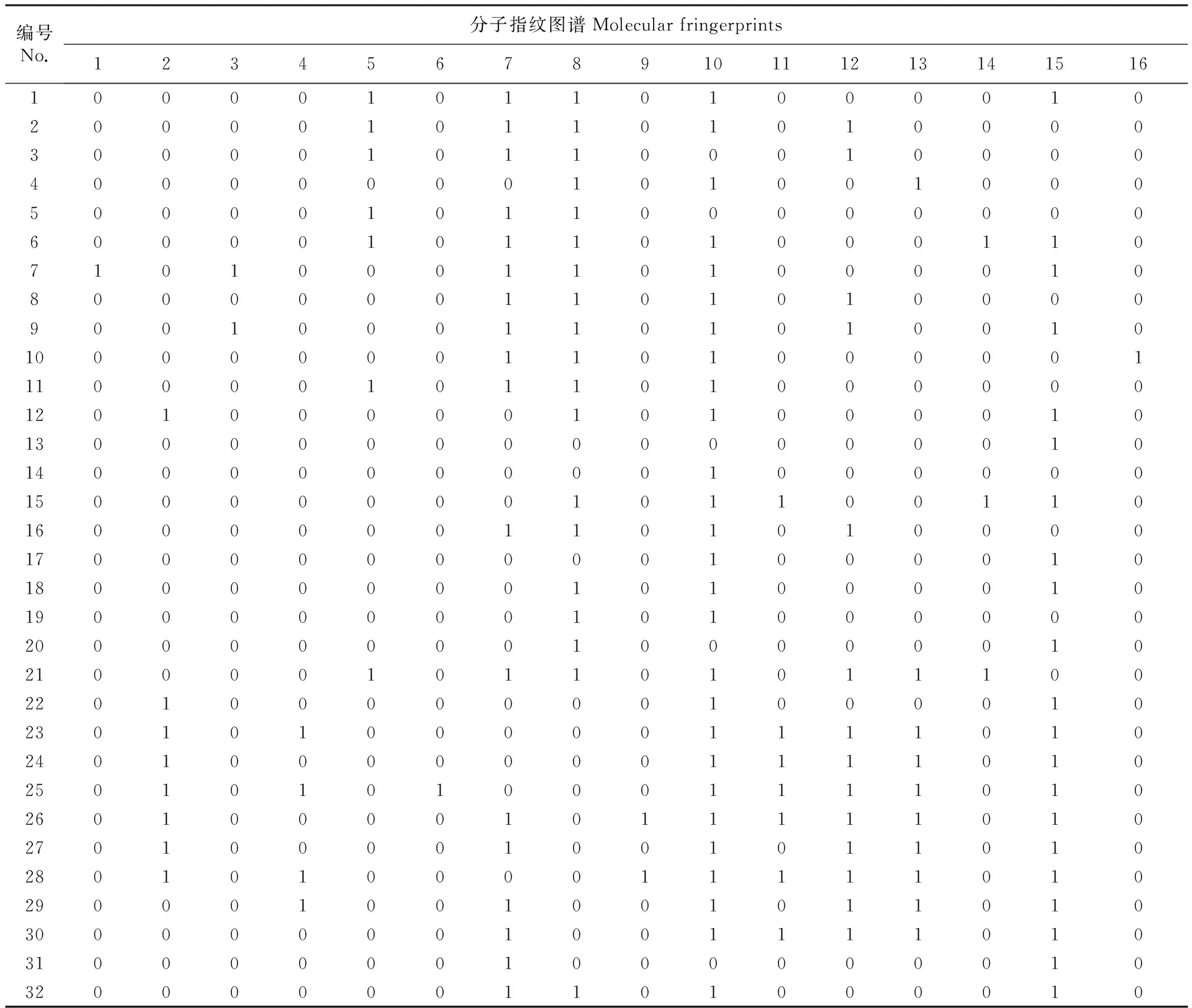
表4 32个猕猴桃品种的分子指纹图谱
注:1~32材料编号同表1;分子指纹1~16分别表示SC29-1189,SC29-589,SC29-522,SC29-387,SC29-311,SC31-1066,SC31-803,SC31-349,SC37-1699,SC37-1114,(SC29+SC31)-1166,(SC29+SC31)-811,(SC29+SC31)-788,(SC29+SC31)-674,(SC29+SC31)-447,(SC29+SC31)-349。
Note:1-32 are the same as table 1; Molecular fringerprints 1-16 represent SC29-1189,SC29-589,SC29-522,SC29-387,SC29-311,SC31-1066,SC31-803,SC31-349,SC37-1699,SC37-1114,(SC29+ SC31)-1166,(SC29+ SC31)-811,(SC29+ SC31)-788,(SC29+ SC31)-674,(SC29+ SC31)-447,(SC29+ SC31)-349.
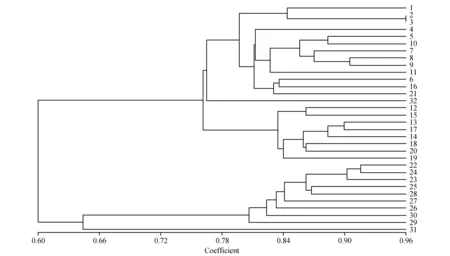
图2 32个猕猴桃品种的聚类图 1~32材料编号同表1。Fig.2 Dendrogram for 32 varieties of Actinidia based on SCoT marker 1-32 are the same as table 1.
3 讨论
3.1 SCoT标记的多态性分析
SCoT作为一种目的基因分子标记(Gene targeted markers,GTMs)[14],与传统意义上的随机DNA分子标记(Random DNA markers,RDMs)相比,SCoT能对性状进行跟踪,寻找与重要目标性状紧密连锁的基因,实现分子标记辅助选择育种[15],可避免传统标记的盲目性,正逐渐受到越来越多研究者的重视。多态性常常作为评价分子标记的一种重要依据,而评价多态性的主要参数包括DNA扩增的总位点数、多态性位点数、多态性百分率(PPL)、Nei’s基因多样性(H)、Shannon信息指数(I)等。在本研究中,利用SCoT标记分析32个猕猴桃品种,结果表明,被统计的11个引物共扩增出185条带,其中多态性条带180条,PPL值高达97.30%,高于前人利用其它分子标记对猕猴桃品种的检测结果。例如徐小彪等[16]利用EST-SSR标记分析33份猕猴桃得到的PPL值为72.7%;贾兵等[5]利用RAPD技术对猕猴桃10个种42个样品进行了分析,得到的PPL值为93.2%;邹游[17]等利用ISSR技术对14个猕猴桃品种分析结果表明,PPL值为82.41%;秦小波[6]等利用AFLP技术对西南50个猕猴桃品种的分析表明,其PPL值仅为66.3%。同样,在本研究中,Nei’s基因多样性(H)、Shannon信息指数(I)分别为0.238 4和0.377 8,也是处于高水平,与刘娟等[8]研究结果接近。因此,与其它分子标记相比,SCoT具有更丰富的多态性。
3.2 猕猴桃品种的遗传差异与聚类分析
评价猕猴桃品种的遗传多样性,了解不同猕猴桃品种之间的遗传差异,对于杂交育种中特异性亲本的选配具有重要意义。本研究结果显示,32个猕猴桃品种两两间的遗传相似系数(GS)在0.529 7~0.962 2,平均值为0.707 4,变幅为0.432 5,说明供试品种间遗传背景较宽,多样性比较丰富,可以为猕猴桃优良品种的选育提供理论依据。
本研究的聚类结果表明,在GS为0.78处可将32个猕猴桃品种分为5组。除毛花猕猴桃的两个品种华特(雌)和华特(雄)各自聚为单独一组外,中华猕猴桃、美味猕猴桃和软枣猕猴等3个猕猴桃品种系列基本各自聚为一组,因此,从整体结果来看,该聚类结果与形态学分类基本一致,说明,SCoT标记可以用于猕猴桃的遗传多样性分析。但是,从图2也可以看出,SCoT标记的分析结果与形态学分类也存在一定差异,如2个中华猕猴桃品种楚红和湘吉红聚在了美味猕猴桃一组,这可能是SCoT标记本身还有一定的局限性,也可能是中华猕猴桃和美味猕猴桃两者遗传关系的复杂性所致。中华猕猴桃和美味猕猴桃作为遗传近缘种,两者存在着极高的遗传相似性[3],有学者建议可将两者划归为一个种[5]。同时,聚类结果还显示,美味猕猴桃金魁品种雌、雄株首先聚类,中华猕猴桃黄阳品种的雌、雄株和软枣猕猴桃红宝石星雌、雄株虽没有首先聚类,但也表现了很近的遗传关系,与龚俊杰[18]的研究结果类似。毛花猕猴桃的华特(雌)和华特(雄)各自聚为一组,与预期并不一致。华特(雌)和华特(雄)均为野生选种,不属于一个姊妹系,两者未能聚在一组,可能与此有关,也可能与分子标记本身的局限性有关。另外,通过对中华猕猴桃、美味猕猴桃、软枣猕猴和毛花猕猴桃等4个种间遗传关系分析表明,中华猕猴桃与美味猕猴桃亲缘关系最近。聚类结果也表明,第1组的美味猕猴桃和第2组的中华猕猴桃首先聚类,显示了更近的亲缘关系,与相关研究结果一致[19~20]。
3.3 猕猴桃品种鉴定与DNA指纹图谱构建
应用DNA分子标记可直接反映植物品种间的遗传差异,具有不受环境因子和时空条件影响、高效、快捷等优点,逐渐取代了依据形态学特征的鉴别方法,已成为植物品种鉴定的最有效的方法。SCoT作为一种新型的DNA分子标记技术,在植物品种鉴定和DNA指纹图谱构建方面已经得到了初步应用。杨祥燕等[11]利用6个SCoT引物扩增的13个多态性位点构建了中国22个番木瓜主栽品种的分子指纹图谱,每个品种都有唯一的指纹图谱;林清等[12]通过对5个SCoT引物在46份供试芥菜种质中扩增所得的16个多态性DNA谱带进行统计,初步构建了芥菜种质的指纹图谱,能够准确地鉴定这46份芥菜种质;蒋林峰等[21]利用5个引物(包括4对SSR引物和1个SCoT引物)上的37条带构建了我国主栽的21个鸭茅品种的DNA指纹图谱。本研究利用SCoT技术,选用4条引物扩增的16个多态性位点构建了32个猕猴桃品种的DNA指纹图谱,为猕猴桃品种间的鉴别提供了重要的科学依据。
1.井赵斌,徐明,雷玉山.猕猴桃SRAP-PCR体系的建立及品种资源亲缘关系研究[J].园艺学报,2016,43(2):337-346.
Jing Z B,Xu M,Lei Y S.Construction and application of SRAP-PCR system to analyze genetic relationship ofActinidia[J].Acta Horticulturae Sinica,2016,43(2):337-346.
2.黄宏文.中国猕猴桃种质资源[M].北京:中国林业出版社,2013:2-3.
Huang H W.Actinidiagermplasm resources in China[M].Beijing:China Forestry Publishing House,2013:2-3.
3.黄宏文,龚俊杰,王圣梅,等.猕猴桃属(Actinidia)植物的遗传多样性[J].生物多样性,2000,8(1):1-12.
Huang H W,Gong J J,Wang S M,et al.Genetic diversity in the genusActinidia[J].Chinese Biodiversity,2000,8(1):1-12.
4.何子灿,钟扬,刘洪涛,等.中国猕猴桃属植物叶表皮毛微形态特征及数量分类分析[J].植物分类学报,2000,38(2):121-136.
He Z C,Zhong Y,Liu H T,et al.Quantitative taxonomic analyses ofActinidia(Actinidiaceae) in China based on micromorphological characters of foliar trichomes[J].Acta Phytotaxonomica Sinica,2000,38(2):121-136.
5.贾兵,朱立武,余兴,等.猕猴桃种质资源RAPD分析[J].安徽农业大学学报,2005,32(3):381-384.
Jia B,Zhu L W,Yu X,et al.RAPD analysis on germplasm resources in generaActinidia[J].Journal of Anhui Agricultural University,2005,32(3):381-384.
6.秦小波,高继海.利用AFLP分析西南特色猕猴桃的遗传多样性[J].热带亚热带植物学报,2013,21(4):315-322.
Qin X B,Gao J H.Studies on genetic diversity for specialty kiwifruits from southwestern regions of China using AFLP system[J].Journal of Tropical and Subtropical Botany,2013,21(4):315-322.
7.郑轶琦,李作洲,黄宏文.猕猴桃品种SSR分析的初步研究[J].武汉植物学研究,2003,21(5):444-448.
Zheng Y Q,Li Z Z,Huang H W.Preliminary study on SSR analysis in kiwifruit cultivars[J].Journal of Wuhan Botanical Research,2003,21(5):444-448.
8.刘娟,廖明安,谢玥,等.猕猴桃属16个雄性材料遗传多样性的ISSR分析[J].植物遗传资源学报,2015,16(3):618-623.
Liu J,Liao M A,Xie Y,et al.Genetic diversity of 16 maleActinidiacultivars based on ISSR[J].Journal of Plant Genetic Resources,2015,16(3):618-623.
9.Collard B C Y,Mackill D J.Start codon targeted(SCoT) polymorphism:a simple,novel DNA marker technique for generating gene-targeted markers in plants[J].Plant Molecular Biology Reporter,2009,27(1):86-93.
10.王健胜,贺军虎,陈华蕊,等.菠萝种质目标起始密码子(SCoT)遗传多样性分析[J].植物遗传资源学报,2015,16(4):848-856.
Wang J S,He J H,Chen H R,et al.Genetic diversity analysis of pineapple(Ananascomosus(L.) merr)germplasm with SCoT molecular markers[J].Journal of Plant Genetic Resources,2015,16(4):848-856.
11.杨祥燕,蔡元保,黄秋伟,等.番木瓜主栽品种SCoT指纹图谱构建及遗传变异分析[J].西北植物学报,2013,33(9):1756-1761.
Yang X Y,Cai Y B,Huang Q W,et al.SCoT fingerprints and genetic variations of the papaya(CaricapapayaL.) major cultivars[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(9):1756-1761.
12.林清,龙治坚,韩国辉,等.基于SCoT标记的芥菜种质遗传多样性与指纹图谱[J].中国蔬菜,2013(12):31-39.
Lin Q,Long Z J,Han G H,et al.Genetic diversity and fingerprint based on SCoT markers inBrassicajuncea(L.) czern.et coss[J].China Vegetables,2013(12):31-39.
13.张安世,邢智峰,刘永英,等.苔藓植物DNA不同提取方法的比较分析[J].河南科学,2009,27(5):559-562.
Zhang A S,Xing Z F,Liu Y Y,et al.Comparison and analysis on the different methods of DNA extration methods from bryophytes[J].Henan Sciences,2009,27(5):559-562.
14.Andersen J R,Lübberstedt T.Functional markers in plants[J].Trends in Plant Science,2003,8(11):554-560.
15.龙治坚,范理璋,徐刚,等.SCoT分子标记在植物研究中的应用进展[J].植物遗传资源学报,2015,16(2):336-343.
Long Z J,Fan L Z,Xu G,et al.Application advance of SCoT molecular markers in plants[J].Journal of Plant Genetic Resources,2015,16(2):336-343.
16.徐小彪,廖娇,黄春辉,等.基于EST-SSR标记分析猕猴桃种质遗传关系[J].果树学报,2012,29(2):212-216.
Xu X B,Liao J,Huang C H,et al.Genetic relationships from kiwifruit germplasms based on EST-SSR Markers[J].Journal of Fruit Science,2015,16(3):212-216.
17.邹游,黄敏,侯若彤,等.ISSR标记技术在猕猴桃遗传研究中的运用[J].西南师范大学学报:自然科学版,2008,33(1):111-115.
Zou Y,Huang M,Hou R T,et al.Analysis on inter-simple sequence repeats in 14Actinidiavarieties[J].Journal of Southwest China Normal University:Natural Science Edition,2008,33(1):111-115.
18.龚俊杰.猕猴桃属植物AFLP分析及其系统发育关系的研究[D].武汉:华中农业大学,2003.
Gong J J.Phylogenetic relationships among taxa of genusActinidiabased on amplified restriction fragment polymorphism(AFLP) marks[D].Wuhan:Huazhong Agricultural University,2003.
19.黄宏文.猕猴桃属——分类 资源 驯化 栽培[M].北京:科学出版社,2013:4-10.
Huang H W.Actinidia:classification,resources,domestication and cultivation[M].Beijing:Science Press,2013:4-10.
20.谢鸣,蒋桂华,柳国华,等.中华猕猴桃与美味猕猴桃生物学特性及生产性能比较[J].果树科学,1995,12(3):161-164.
Xie M,Jiang G H,Liu G H,et al.Comparison of the biologcal features and productivities ofA.chinensisandA.deliciosa[J].Journal of Fruit Science,1995,12(3):161-164.
21.蒋林峰,张新全,黄琳凯,等.中国鸭茅主栽品种DNA指纹图谱构建[J].植物遗传资源学报,2014,15(3):604-614.
Jiang L F,Zhang X Q,Huang L K,et al.Construction of DNA fingerprinting of dominant orchardgrass(Dactylisglomerata) varieties of China[J].Journal of Plant Genetic Resources,2014,15(3):604-614.
Special funds for science and technology innovation project of Chinese Academy of Agricultural Sciences(CAAS-ASTIP-2016-ZFRI)
introduction:ZHANG An-Shi(1965—),male,master,professor,Mainly engaged in plant molecular biology research.
date:2016-11-07
GeneticDiversityandFingerprintswithSCoTMarkersinActinidia
ZHANG An-Shi1ZHANG Zhong-Hai1QI Xiu-Juan2LIU Ying1LUO Yang1
(1.School of Science,Jiaozuo Teachers College,Jiaozuo 454000;2.Zhengzhou Fruit Research Institute,Chinese Academy of Agricultural Sciences,Zhengzhou 450009)
SCoT were used to analysis genetic diversity of the samples of 32Actinidiavarieties. The 11 primers were screened from 47 SCoT primers and 185 SCoT bands were obtained, including 180 polymorphic bands, with a polymorphism rate of 97.30%. The average Nei’s gene diversity(H) and Shannon’s information index(I) were 0.2384 and 0.3778. The cluster analysis conducted with UPGMA showed that 32Actinidiavarieties were divided into 5 groups at the genetic similarity coefficient of 0.78, and the constructed phylogenetic trees based on SCoT were consistent with the morphology results. The DNA fingerprints for 32Actinidiavarieties were established with 16 sites from 4 SCoT primers, and 32Actinidiavarieties could be identified by SCoT fringerprints.
Actinidia;SCoT;DNA fingerprint;genetic diversity
中国农业科学院科技创新工程专项经费项目(CAAS-ASTIP-2016-ZFRI)
张安世(1965—),男,硕士,教授,主要从事植物分子生物学研究。
2016-11-07
S663.4
A
10.7525/j.issn.1673-5102.2017.02.014
