用于植物基因研究的mCherry表达载体构建及定位表达
2017-11-09刘佳欣周美琪赵磊飞
于 颖 刘佳欣 周美琪 赵磊飞 王 超
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
用于植物基因研究的mCherry表达载体构建及定位表达
于 颖 刘佳欣 周美琪 赵磊飞 王 超*
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
荧光蛋白在生物学研究中具有广泛的应用和重要的作用,其中红色荧光蛋白mCherry因其颜色和良好的特性,对于植物基因研究具有重要的使用价值,本研究将mCherry基因构建到pBI121植物表达载体系统中,构建了pBI121MCS-mCherry载体。利用基因枪转化法转入洋葱表皮进行表达验证,显微镜观察结果显示整个洋葱细胞具有红色荧光,证明该载体能够在植物细胞中表达红色荧光蛋白。利用双酶切连接法将转录因子BpMYB4基因构建到该载体上,得到融合表达载体pBI121MCS-mCherry-BpMYB4,在洋葱表皮中表达,结果显示细胞核具有红色荧光,证明该载体能够准确表达融合蛋白,进行亚细胞定位。同时融合基因时不再需要中间载体,构建简便,引入的KpnⅠ酶切位点,增加了可选择性。因此该载体可用于植物基因表达定位及转基因植株筛选研究中,为今后的白桦基因组学研究提供了材料。
mCherry;红色荧光蛋白;植物表达载体构建;细胞定位
荧光蛋白的最早发现是在1962年,是Shimomura等人在维多利亚多管水母(Aequorea victoria)中发现的野生型绿色荧光蛋白(green fluorescent protein,avGFP)[1~2]。自荧光蛋白被发现以来,研究人员就从生物体内分离出了多种荧光蛋白,并在此基础上利用分子生物技术研究出几乎覆盖整个荧光光谱的突变体。按荧光蛋白的最大发射波长分类,可将荧光蛋白分为:蓝色荧光蛋白(BFPs;440.470 rim)、青色荧光蛋白(CFPs;471.500 rim)、绿色荧光蛋白(GFPs;501.520 nm)、黄色荧光蛋白(YFPs;521.550)、橙色荧光蛋白(OFPs;551-575 rim)、红色荧光蛋白(RFPs;576.610 nm)、远红外荧光蛋白(FRFPs;611-660 nm)[3~4]。荧光蛋白的研究可用于分子生物学、细胞生物学和生物医学等诸多方面,它还能够与荧光显微技术相结合产生荧光蛋白标签等诸多的生物学研究技术,从而使荧光蛋白成为生物学研究中非常重要的一项生物技术。
mCherry蛋白的最大激发光和发射光分别为587和610 nm[5~6],常用于标记和示踪某些分子和细胞组分,具有荧光强度及光稳定性良好的优点[7~9]。相对于其他荧光,mCherry的好处在于它的颜色可与BFPs、CFPs、GFPs、YFPs或OFPs组合,用于多荧光标记成像系统[10],并且mCherry相对于其他单体荧光蛋白来说也具有卓越的光稳定型。将mCherry荧光蛋白基因与目的基因蛋白进行融合,产生的新型蛋白可用于目的基因的细胞定位和组织定位[3]。在所有的红色荧光蛋白中mCherry相当受欢迎,已经被超过200篇文章引用。因此,构建一种通用的进行植物基因功能及表达研究的mCherry表达载体,具有一定的应用价值。
pBI121质粒是一种适用于植物遗传转化的表达载体[11],是双元T-DNA载体,它携带组成型强启动子:CaMV35S,具有在原核生物和植物中筛选的抗性标记,因此被广泛使用[12]。本研究将mCherry基因序列,构建到pBI121载体系统中,经过表达鉴定,构建了一种适用于植物的通用红色荧光蛋白表达载体,为植物基因细胞定位及转基因植株筛选研究提供材料。
1 材料与方法
1.1 pBI121-mCherry表达载体构建
根据pmCherry载体(Clontech,America)基因序列及pBI121MCS-GFP载体(本实验室保存)序列设计引物,同时在正向引物5′端插入一个KpnⅠ酶切位点,正向引物为:5′-GGGACTCTAGACGGGGTACCCTGGTACCCGGGTCGACTGACTAGTATGGTG-AGCAAGGGCGAGG-3′,反向引物为:5′-CGAGCTCTCACTTGTACAGCTCGTCCAT-3′,划线部分为KpnⅠ酶切位点。以pmCherry载体为模板,进行PCR扩增。
PCR的反应体系为20 μL,其中模板为0.5 μL,5′端引物1 μL,3′端引物1 μL,dNTP 0.4 μL,Ex 10×Buffer 2 μL,Ex Taq酶(TaKaRa,大连宝生物)0.25 μL,ddH2O 15 μL。反应程序是:94℃预变性5 min,94℃变性30 s,62℃退火30 s,72℃延伸43 s,变性、退火、延伸重复35次,72℃保温7 min。用胶回收试剂盒(Omega,America)回收目的片段。
用限制性内切酶SacⅠ和XbaⅠ(Promega,America)切割pBI121MCS-GFP载体,用纯化试剂盒(Omega,America)将得到的酶切产物纯化回收。将目的基因片段与线性载体用T4DNA连接酶(Promega,America)连接。连接产物转化大肠杆菌,筛选阳性克隆进行测序检验(华大,中国)。
1.2 mCherry:BpMYB4融合表达载体构建
根据本实验室克隆的白桦BpMYB4基因序列及pBI121MCS-mCherry载体序列设计引物,正向引物为:5′-CTAGTCTAGAATGGGAAGGTCTCCTTGCTG-3′,反向引物为:5′-CTAGACTAGTCACATTAATCCTGCAGCT-3′。以BpMYB4-T载体质粒为模板,进行PCR扩增。
PCR的反应体系及反应程序同1.1。用质粒提取试剂盒(Omega,America)提取pBI121MCS-mCherry质粒。
用限制性内切酶XbaⅠ和SpeⅠ(Promega,America)分别双酶切回收得到的BpMYB4目的基因片段和pBI121MCS-mCherry质粒,利用T4DNA连接酶(Promega,America)进行连接,得到pBI121MCS-mCherry-BpMYB4融合表达载体,并转化大肠杆菌,筛选阳性克隆进行测序检验(华大,中国)。
1.3 pBI121MCS-mCherry表达载体转化验证
撕取新鲜的洋葱表皮,在1/2MS培养基中,室温条件下,光培养1~2 d。用PDS-1000台式基因枪(Bio-Rad)将pBI121MCS-mCherry质粒和pBI121MCS-mCherry-MYB4质粒包埋的微载体以高压氦气为动力分别导入洋葱表皮细胞内部。黑暗条件下培养2~3 d。在激发波长为578 nm,发射波长为610 nm下,用激光共聚焦显微镜分别观察其表达效果。
2 结果与分析
2.1 pBI121MCS-mCherry表达载体构建
利用PCR扩增得到目的片段,通过EB/琼脂糖凝胶电泳,以Marker DL2000为对照检验扩增的片段大小。结果显示,扩增的基因片段与目的基因长短一致,约为711 bp(图1)。
用限制性内切酶SacⅠ和XbaⅠ双酶切PCR获得的mCherry基因片段和pBI121MCS-GFP载体,去除pBI121MCS-GFP载体上的GFP基因,得到线性载体。酶切后的载体经凝胶电泳检测,结果显示酶切成功(图2)。将双酶切得到的pBI121MCS线性载体与目的片段用T4DNA连接酶连接,将连接产物用热激法转化到大肠杆菌当中,在筛选平板中筛选阳性克隆,在筛选平板上挑取单克隆,进行菌液PCR,PCR产物经1%的EB/琼脂糖凝胶电泳检测(图3)。结果显示,PCR扩增的基因片段长度与目的基因长度一致。经华大科技测序检验,将测序结果与原基因序列利用Multiple Alignment Tool(https://www.ncbi.nlm.nih.gov/tools/cobalt/cobalt.cgi?)进行序列比对,一致性达到99%,表明pBI121MCS-mCherry表达载体构建成功(图4)。
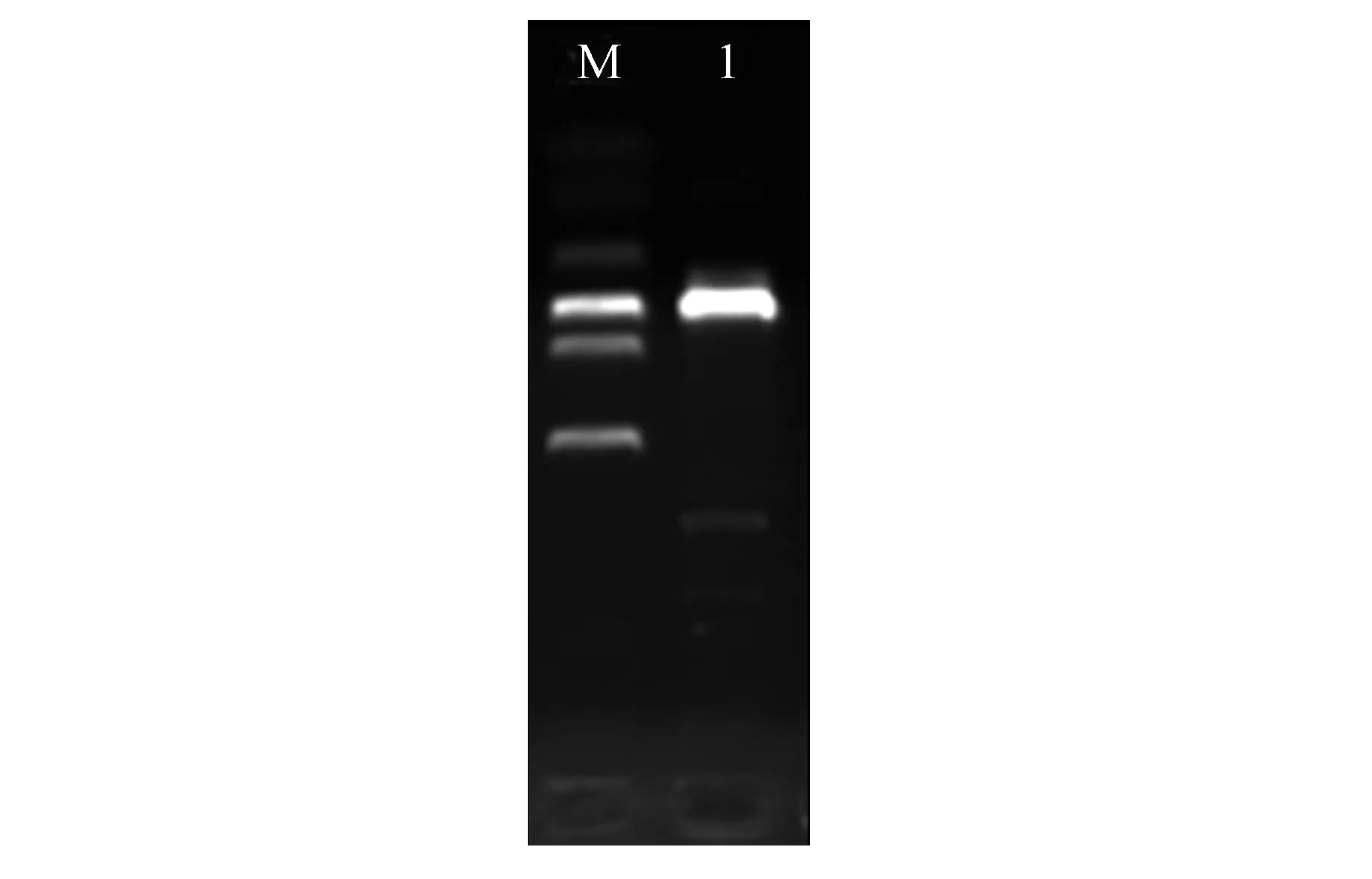
图1 mCherry-pBI121MCS PCR产物电泳图Fig.1 Electrophoretogram of mCherry-pBI121MCS PCR product M. DNA Maker DL2000; 1. mCherry-pBI121MCS

图2 pBI121MCS-GFP载体酶切检验图 1.未酶切载体;2.酶切后载体Fig.2 pBI121MCS-GFP vector digested pictures 1.Cyclic carrier;2.Linear vector

图3 mCherry-pBI121MCS菌液PCR结果Fig.3 mCherry-pBI121MCS broth PCR results M.DNA Maker DL2000; 1.mCherry-pBI121MCS

图4 mCherry基因与pBI121MCS载体融合示意图Fig.4 mCherry gene and pBI121MCS vector fusion diagram

图5 MYB4-pBI121MCS-mCherry PCR产物电泳图Fig.5 Electrophoretogram of MYB4-pBI121MCS-mCherry PCR product M. DNA Maker DL2000; 1.MYB4-pBI121MCS-mCherry

图6 pBI121MCS-mCherry载体酶切检验图 1.未酶切载体;2.酶切后载体Fig.6 pBI121MCS-mCherry vector digested pictures1.Cyclic carrier; 2.Linear vector

图7 MYB4-pBI121MCS-mCherry菌液PCR结果Fig.7 MYB4-pBI121MCS-mCherry broth PCR results M.DNA Maker DL2000; 1.MYB4-pBI121MCS-mCherry
2.2 mCherry:MYB4融合表达载体构建
利用PCR反应所扩增得到的目的片段,通过EB/琼脂糖凝胶电泳,以Marker DL2000为对照检验扩增的基因片段大小。结果显示,扩增的基因片段与目的基因大小一致,约为654 bp(图5)。
用限制性内切酶XbaⅠ和SpeⅠ双酶切PCR获得的MYB4基因片段和pBI121MCS-mCherry载体。酶切后的载体经凝胶电泳检测,结果显示酶切成功(图6)。将双酶切得到的pBI121MCS-mCherry线性载体与目的片段用T4DNA连接酶连接,将连接产物用热激法转化到大肠杆菌当中,在筛选平板中筛选阳性克隆,在筛选平板上挑取单克隆,进行菌液PCR,PCR产物经1%的EB/琼脂糖凝胶电泳检测(图7)。结果显示,PCR扩增的基因片段长度与目的基因长度一致。经华大科技测序检验,将测序结果与原基因序列利用Multiple Alignment Tool(https://www.ncbi.nlm.nih.gov/tools/cobalt/cobalt.cgi?)进行序列比对,一致性达到99%,表明pBI121MCS-mCherry-MYB4表达载体构建成功。
2.3 mCherry表达载体活性检测
用核酸测定仪检测用质粒提取试剂盒提取的pBI121MCS-mCherry载体和pBI121MCS-mCherry-MYB4载体的质粒DNA浓度,使其质粒DNA浓度达到1 μg·μL-1。利用基因枪转入洋葱表皮中。激光共聚聚焦显微镜下检查mCherry蛋白与mCherry-BpMYB4融合蛋白在洋葱表皮细胞中的表达情况(图8),可以看出pBI121MCS-mCherry载体能够在洋葱表皮细胞表达出红色荧光,且在整个细胞中表达,说明本研究构建的载体在植物细胞中具有表达活性。将与BpMYB4转录因子构建的融合表达载体在在洋葱表皮细胞中进行表达,可以看出,荧光主要出现在细胞核中,说明BpMYB4是核定位蛋白,这与其转录因子特性及之前的研究相符[13],以上结果证明本研究构建的pBI121MCS-mCherry载体能够对植物蛋白进行准确细胞定位并可以用来筛选转基因植株。

图8 激光共聚焦显微镜镜检结果 a. pBI121MCS-mCherry载体;b. pBI121MCS-mCherry-MYB4载体Fig.8 Laser scanning confocal microscopy results a. pBI121MCS-mCherry vector; b. pBI121MCS-mCherry-MYB4 vector
3 讨论
利用GUS基因来作为报告基团,在检测时存在对材料的破坏性,这一局限对于需要进一步做基因表达的材料来说很不方便[14]。因此大量的转基因植物筛选中,都应用了荧光蛋白报告基因,与GUS基因相比较,它不需要固定材料和前处理,并且可在各种荧光显微镜下观察到,同一细胞可在不同条件下进行反复观察[12,15~17]。与GFP基因相比较,其最大的优点在于其颜色的不同,可与广泛应用的绿色荧光蛋白(GFP)进行共同标记。其中mCherry荧光蛋白因其颜色,稳定性等优点具有广泛的应用。将mCherry与HPT载体进行融合,构建HPT-mCherry融合表达载体,转化到水稻中,可以快速有效地鉴定并得到转基因阳性植株[18~19]。在大豆的研究中,将目的基因同时与绿色荧光蛋白和内质网标记蛋白mCherry-HDEL进行共定位,可探究基因在细胞中的表达情况[20]。以mCherry红色荧光蛋白为报告基因,由玉米泛素启动子(P-Ubi)和豌豆T3A-poly A序列组成过量表达框的转基因载体,可将4个水稻类受体激酶的编码序列插入表达框转化水稻品种泰粳394。运用该载体系统,能够进行转基因后代大规模筛选,获得目的基因过量表达的转基因株系[21]。本研究构建的pBI121MCS-mCherry载体应用了pBI121载体系统,因其具有强启动子及在原核生物和植物中筛选的抗性标记,可以进行植物基因的组织定位和亚细胞定位研究,也可以进行植物过表达转基因研究。该pBI121MCS-mCherry载体,成功引入了一个KpnⅠ酶切位点,增加了酶切位点的可选择性,可使外源基因更有效的插入。因此本研究构建的pBI121MCS-mCherry载体,在进行植物基因表达及功能研究中具有一定的使用价值。
1.Kendall J M,Badminton M N.Aequoreavictoriabioluminescence moves into an exciting new era[J].Trends in Biotechnology,1998,16(5):216-224.
2.Morin J G,Hastings J W.Energy transfer in a bioluminescent system[J].Journal of Cellular Physiology,1971,77(3):313-318.
3.Pakhomov A A,Martynov V I.GFP family:structural insights into spectral tuning[J].Chemistry & Biology,2008,15(8):755-764.
4.赵艳华.红色荧光蛋白的改造与超分辨显微成像技术的改进[D].长沙:湖南大学,2013.
Zhao Y H.The development of RFP super-resolution imaging[D].Changsha:Hunan University,2013.
5.王博.表达红色荧光蛋白的重组B组3型柯萨奇病毒构建及初步应用[D].哈尔滨:哈尔滨医科大学,2010.
Wang B.Construction and preliminary application of recombinant Coxsackeivirus B3 with red fluorescent protein[D].Harbin:Harbin Medical University,2010.
6.陈茜,宋方丽,刘亚伟,等.His-TAT-mCherry融合蛋白的跨膜转导及其在细胞内的定位[J].解放军医学杂志,2009,34(2):147-150.
Chen X,Song F L,Liu Y W,et al.Membrane translocation and location in cells of red fluorescent protein fusion vector incorporated HIV-TAT protein[J].Medical Journal of Chinese People’s Liberation Army,2009,34(2):147-150.
7.金权鑫,许嘉珍,魏枫,等.MuSK-mCherry融合荧光蛋白的构建及对重症肌无力患者MuSK抗体的检测[J].中国免疫学杂志,2014,(10):1369-1373.
Jin Q X,Xu J Z,Wei F,et al.Construction of MuSK-mCherry fusion fluorescent protein and used for detection of MuSK antibodies inMyastheniagravis[J].Chinese Journal of Immunology,2014,(10):1369-1373.
8.赵文然,钟学宽,张淑娟,等.表达红色荧光蛋白重组柯萨奇病毒B组3型基因组稳定性分析[J].微生物与感染,2012,7(1):28-36.
Zhao W R,Zhong X K,Zhang S J,et al.Evaluation on the genome stability of the recombinant coxsackie virus B3 expressing red fluorescent reporter gene[J].Journal of Microbes and Infections,2012,7(1):28-36.
9.李亚丽.水稻Pi21基因RNAi植株的抗稻瘟病研究及转mCherry基因水稻的遗传分析[D].金华:浙江师范大学,2012.
Li Y L.Studies on Pi21 transgenic rice resistance to blast mediated by RNAi and genetic analysis of mCherry transgenic rice[D].Jinhua:Zhejiang Normal University,2012.
10.梁俊婷,李鹿之,陈少鹏,等.红色荧光蛋白mCherry中插入外源短肽位点的研究[J].生物技术通报,2013(5):144-148.
Liang J T,Li L Z,Chen S P,et al.Study on sites of the tolerate peptide insertion in the fluorescent protein of mCherry[J].Biotechnology Bulletin,2013(5):144-148.
11.张俊莲,王蒂,张金文,等.pBI121载体酶切位点添加及拟南芥Na+/H+逆向转运蛋白基因表达载体的构建[J].分子植物育种,2006,4(6):811-818.
Zhang J L,Wang D,Zhang J W,et al.Modification of pBI121 Vector and expression vector construction Na+/H+antiporter ofArabidopsisthaliana[J].Molecular Plant Breeding,2006,4(6):811-818.
12.Jefferson R A,Kavanagh T A,Bevan M W.GUS fusions:beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].The EMBO Journal,1987,6(13):3901-3907.
13.张楠,崔志远,孙丹,等.白桦BpMYB2基因及其启动子克隆、表达分析[J].南京林业大学学报:自然科学版,2014,38(3):24-28.
Zhang N,Cui Z Y,Sun D,et al.Cloning and cloning and expression analysis of the BpMYB2 gene and its promoter inBetulaplatyphylla[J].Journal of Nanjing Forestry University:Natural Sciences Edition,2014,38(3):24-28.
14.孙晓红,姚泉洪,陈明杰,等.含绿色荧光蛋白及trp3iar基因的草菇表达载体的构建[J].上海海洋大学学报,2006,15(1):12-16.
Sun X H,Yao Q H,Chen M J,et al.Construction of expression vector ofVolvariellavolvaceawith EGFP and trp3iargenes[J].Journal of Shanghai Fisheries University,2006,15(1):12-16.
15.吴学龙,何海燕,刘智宏,等.eGfp/Gus融合基因植物表达载体的构建和转化验证[J].浙江农业学报,2011,23(4):645-650.
Wu X L,He H Y,Liu Z H,et al.Construction and verification of a plant vector carrying aneGfp/Gusfusion reporter gene[J].Acta Agriculturae Zhejiangensis,2011,23(4):645-650.
16.袁思玮,黄锐之,罗红兵.GUS报告基因在植物功能基因研究中的应用[J].作物研究,2008,22(5):310-314.
Yuan S W,Huang R Z,Luo H B.Application of GUS reporter gene in plant functional gene research[J].Crop Research,2008,22(5):310-314.
17.薛丽香,童坦君,张宗玉.报告基因的选择及其研究趋向[J].生理科学进展,2002,33(4):364-366.
Xue L X,Tong T J,Zhang Z Y.Selection of reporter gene and its research[J].Progress in Physiological Sciences,2002,33(4):364-366.
18.陈娟,周洁,严成其,等.HPT-mCherry融合标签在水稻转基因筛选鉴定中的应用[J].生物技术通讯,2013,24(5):677-681.
Chen J,Zhou J,Yan C Q,et al.Application of HPT-mCherry fusion tag in rice transgenic screening[J].Letters in Biotechnology,2013,24(5):677-681.
19.李亚丽,刘中来,周洁,等.转mCherry基因水稻的遗传分析及T-DNA整合位点的研究[J].分子植物育种,2012,10(2):121-130.
Li Y L,Liu Z L,Zhou J,et al.Genetic analysis of mCherry transgenic rice and molecular characterization of T-DNA integration sites in the rice genome[J].Molecular Plant Breeding,2012,10(2):121-130.
20.周丹.大豆二酰甘油酰基转移酶(DGAT)基因克隆及其功能的初步研究[D].南京:南京农业大学,2012.
Zhou D.Cloning and primary characterization genes of diacylglycerol acyltransferase(Dgat) in soybean(Glycinemax)[D].Nanjing:Nanjing Agricultural College,2012.
21.高晓庆,徐国娟,袁正杰,等.基于mCherry荧光蛋白的植物基因过表达遗传转化系统的初步研究[J].浙江农业学报,2015,27(11):1865-1871.
Gao X Q,Xu G J,Yuan Z J,et al.A preliminary study on the genetic transformation system of plant gene overexpression based on a mCherry fluorescent protein vector[J].Acta Agriculturae Zhejiangensis,2015,27(11):1865-1871.
National High Technology Research and Development Program 863(2013AA102704)
introduction:YU Ying(1992—),female,master,mainly engaging in Forest genetic engineering.
date:2016-11-08
ConstructionandExpressionofmCherryExpressionVectorUsedinPlant
YU Ying LIU Jia-Xin ZHOU Mei-Qi ZHAO Lei-Fei WANG Chao*
(State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040)
Fluorescent proteins were widely used and played important roles in the biological research. The red fluorescent protein mCherry is valuable to the plant research because of its color and stability. The mCherry gene was inserted into pBI121 plant expression vector, and the pBI121MCS-mCherry vector was constructed. The vector were transferred into onion epidermis by particle bombardment, and the whole onion cells showed red fluorescence under the microscope, which suggested that the vector could express red fluorescent protein in plant cells. The transcription factor BpMYB4 gene was constructed in this vector using double enzyme digestion, and the fusion expression vector pBI121MCS-mCherry-BpMYB4 was obtained and expressed in onion epidermis. Only the nucleus showed red fluorescence, which indicated that the vector can be used to express the fusion protein and used in the subcellular localization accurately. While the fusion expression vector can be constructed simply, and the intermediate vectors are no longer required. TheKpnⅠ sites was introduced which can help the fusion of more genes. Therefore, mCherry vector can be used in cell localization of plant genes and screening of transgenic plants. This study would provide materials for genomics research of birch in future.
mCherry;red fluorescent protein;plant expression vector construction;cell localization
国家“863”课题(2013AA102704)资助
于颖(1992—),女,硕士研究生,主要从事林木基因工程研究。
* 通信作者:E-mail:nefuwangchao@yahoo.com
2016-11-08
* Corresponding author:E-mail:nefuwangchao@yahoo.com
Q75
A
10.7525/j.issn.1673-5102.2017.02.006
