城市污水中高效COD去除菌对微藻生长的促进作用研究*
2017-11-07陈洪一郭仕达金文标涂仁杰韩松芳
陈洪一 郭仕达 金文标 涂仁杰 韩松芳
(哈尔滨工业大学深圳研究生院,广东 深圳 518055)
城市污水中高效COD去除菌对微藻生长的促进作用研究*
陈洪一 郭仕达 金文标#涂仁杰 韩松芳
(哈尔滨工业大学深圳研究生院,广东 深圳 518055)
利用城市污水培养微藻生产柴油既有助于去除污染物,又可回收能源,是解决环境污染与能源危机的研究热点之一。从城市污水处理系统中筛选有利于微藻生长的高效COD去除菌,并考察其对微藻生长的促进作用。研究结果表明:在筛选的38株菌中有5株为高效COD去除菌,分别命名为L2、L8、L11、W2、W5,5个菌株对COD的去除率均达到80%左右。在原污水培养条件下,菌株L11对微藻的生长具有显著的促进作用,与空白组相比,稳定期微藻产量提高了97.7%,微藻平均生长速率提高了12.7%,油脂产量提高了75.8%。菌株L11与微藻共培养不仅可以提高微藻产量,同时有利于使污水中的COD维持在较低水平。
COD去除菌 微藻 菌藻共培养 城市污水
Abstract: The cultivation of microalgae using municipal wastewater for bio-diesel production is becoming a hotspot research to solve the problems of water pollution and energy crisis. The COD degrading strains were selected from the municipal wastewater treatment systems and its’ influence on the growth of microalgae in municipal wastewater was investigated. The results showed that five strains,which were named L2,L8,L11,W2 and W5,were good at removing COD,the COD removal efficiencies were about 80%. Under the cultivation with municipal wastewater,the strain L11 had a significant effect on the growth of microalgae. Compared with the control group,the production,growth rate and oil yield of microalgae in stable phase were increased 97.7%,12.7% and 75.8%,respectively. The co-culture of L11 and microalgae not only promote the yield of microalgae,but also kept the concentration of COD in wastewater at a low level.
Keywords: COD removal bacteria; microalgae; microalgae and bacteria co-culture; municipal wastewater
随着全球能源危机和水环境污染的加剧,利用城市污水培养微藻生产生物柴油工艺逐渐成为解决环境污染和能源危机的新兴研究热点[1]。微藻培养过程中会释放大量氧气,可作为好氧异养菌代谢过程的电子受体,有利于污水中有机污染物的去除。此外,微藻生长过程还需要吸收大量的氮、磷元素,有利于降低污水中的氮、磷含量。采用城市污水培养微藻既可获得能源,还可改善水质,符合我国对环境治理和节能减排的需求。
目前,制约城市污水培养微藻系统的关键问题是污水中含有较多的杂质和细菌,使微藻生长不够稳定,出现微藻产量低和出水水质差的问题。一般认为,微藻培养过程中细菌的存在对微藻生长具有不利影响,但近年来的研究发现,部分细菌对微藻的生长和絮凝沉淀都有积极作用[2]。细菌与微藻之间存在着互利共生、偏利共生等多种关系[3-7]。本研究从微藻与细菌互利共生的角度出发,从城市污水处理系统中筛选有利于微藻生长的高效COD去除菌,考察其对微藻生长的作用,以提高微藻产量和污水处理效果。
1 材料与方法
1.1 菌种的筛选、效果考察及鉴定
菌种分别来源于深圳市某污水处理厂A2/O工艺的二沉池回流段污泥、深圳市某污水处理厂改进型开普敦大学脱氮除磷(MUCT)工艺的二沉池回流段污泥以及利用城市污水培养微藻的藻液,本研究采用梯度稀释涂布平板分离污泥和藻液中的菌种。
以灭菌后的生活污水为基质,考察分离菌种的COD去除能力,具体方法如下:将150 mL灭菌生活污水加入到250 mL锥形瓶中,按5%(质量分数)的投加量投加菌液(菌密度108个/mL)。随后将锥形瓶置于30 ℃,120 r/min的恒温摇床培养箱内培养24 h,然后于7 000 r/min下离心5 min,取上清液测定COD。比较投加不同菌液后COD的降解效率,确定高效COD去除菌株。
对须鉴定的菌株基因组DNA进行提取,将得到的菌株基因组DNA利用16S通用引物27F/1492R进行扩增测序。得到的16S rDNA序列录入GenBank数据库,用Blast程序与数据库中所有序列进行比对分析,所得结果用Mega 5.0软件构建系统发育树分析。
1.2 实验藻种
本研究使用的微藻藻种为蛋白核小球藻,购买于中科院(武汉)水生生物研究所淡水藻种库,在中国普通微生物菌种保藏管理中心(CGMCC)的藻种保藏号为No.1448,前期经课题组离子注入法诱变筛选得到具有高油脂含量的藻种,适用于城市生活污水培养。
1.3 微藻培养
微藻培养在光照培养箱内,温度为(25.0±0.5) ℃,由40 W日光灯提供光照,强度约为10 000 lx,每天手动摇晃1~3次。微藻与细菌的共培养采用柱形反应器,反应器直径为5 cm,长度为50 cm,底端设有曝气口。菌藻培养过程中曝气量为50 mL/min,温度为(25.0±2.0) ℃,曝气口处接空气滤头,内含0.22 μm滤膜,可滤除空气中的细菌。向柱形反应器中加入600 mL微藻培养基,接入藻种液使反应器内藻液在680 nm的光密度(OD680)约为0.1,然后按特定比例投加藻密度为108个/mL的菌液与藻液共培养,每天测定微藻生物量和OD680,测定微藻生长稳定期的油脂含量。
1.4 测定方法
微藻生物量测定:取0.45 μm滤膜,置于105 ℃的烘箱内干燥24 h后转移至干燥器内冷却至室温,取出称重,重复上述过程直至滤膜两次称量的质量差<0.5 mg;取10 mL藻液样品于真空泵上0.45 μm滤膜抽滤,将滤膜放入锡纸盘内,置于105 ℃的烘箱4 h,转移至干燥器内冷却至室温,得到干燥滤膜与微藻的总质量。微藻生物量、微藻平均生长速率的计算分别见式(1)、式(2):
c=(m2-m1)/V
(1)
v=(c1-c0)/t
(2)
式中:c为单位体积藻液内所含微藻的生物量,g/L;m2为干燥滤膜与微藻总质量,mg;m1为干燥滤膜的质量,mg;V为藻液样品体积,mL;v为微藻平均生长速率,g/(L·d);c1为稳定期单位体积藻液所含的生物量,g/L;c0为实验初期单位体积藻液所含的生物量,g/L;t为微藻生长达到稳定期的时间,d。
微藻油脂提取测定:取适量藻液于离心管中,在7 000 r/min下离心10 min,弃去上清液;加入氯仿/甲醇(体积比为2∶1)混合溶液30 mL于离心管中,再加入300 μL的HCl(1 mol/L),将离心管横置于150 r/min摇床上振荡6 h,将振荡后的藻液加入10 mL NaCl(质量分数0.9%)溶液,旋涡振荡2 min使其混合均匀,然后在7 000 r/min下离心5 min,离心后用玻璃针筒将下层有机相转移至已干燥至恒质量的锡纸盘内,将锡纸盘放置至通风橱,待有机溶剂完全挥发后余下微藻油脂,再将锡纸盘转移至60 ℃烘箱内干燥到恒质量,微藻油脂产量及含油率分别由式(3)、式(4)计算:
y=(m4-m3)/V
(3)
l=y/c×100%
(4)
式中:y为单位体积藻液内微藻的油脂产量,g/L;m4为干燥锡纸盘与微藻油脂的总质量,mg;m3为干燥锡纸盘的质量,mg;l为微藻的含油率,%。
2 结果与分析
2.1 菌株的COD去除效果
选取城市污水处理厂二沉池回流段污泥和微藻培养系统的藻液,利用梯度稀释法分离其中的细菌,经过多次纯化后得到38株菌种,其中有6株菌无法在液体培养基中生长,对余下的32株菌进行COD去除效果考察实验,结果如表1所示。由表1可见,菌株L2、L8、L11、W2、W5对COD的去除效果较好,为高效COD去除菌,其对COD去除率均达到80%左右,其中W5的COD去除率最高,为84.3%。
2.2 高效COD去除菌对微藻生长的影响
为考察高效COD去除菌对微藻生长的影响,应首先排除微藻培养系统中存在的杂菌。为此,本研究采用组合抗生素处理藻液中的杂菌,然后利用SYBR green I核酸荧光染料对藻液染色,制作玻片后置于荧光倒置显微镜下观察,由于染色后核酸在荧光下显绿色,且微藻细胞核酸远大于细菌核酸,因此在荧光显微镜下可以明显观察到藻液中是否含有细菌。藻液灭菌处理前后的核酸染色镜检对比结果见图1,由图1可以看出,组合抗生素的灭菌效果良好,处理后的藻液中几乎不含杂菌。
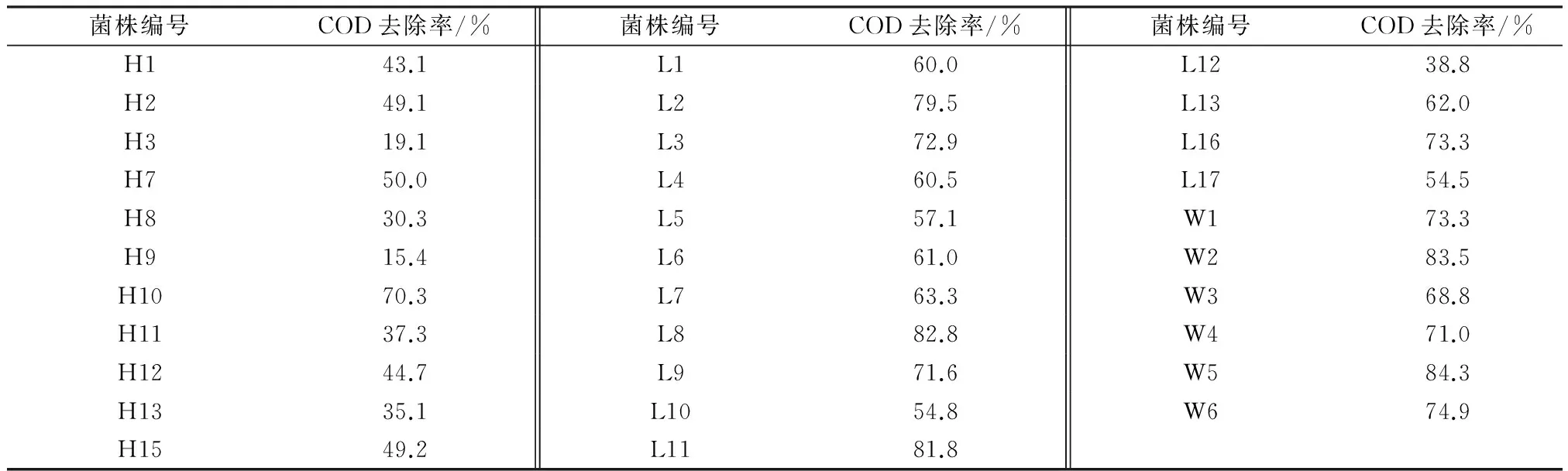
表1 不同菌株的COD去除效果考察

图1 灭菌处理前后核酸染色镜检对比Fig.1 The comparison of nucleic acid staining microscopy before and after sterilization
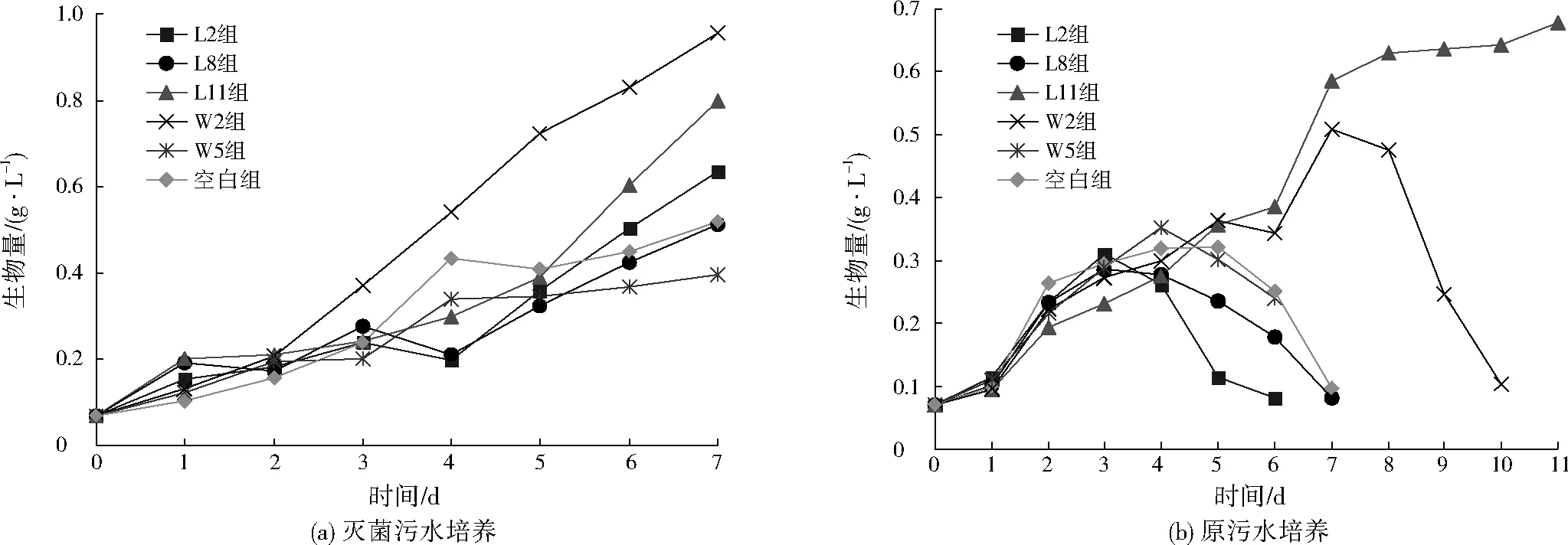
图2 高效COD去除菌对微藻生长的影响Fig.2 The effect of COD removal bacteria on microalgae growth
分别以灭菌污水与原污水为菌藻共培养的培养基,考察5株高效COD去除菌对微藻生长的影响,结果如图2所示。由图2可见,在灭菌污水培养下,菌株W2对微藻生长有明显的促进作用,接种3 d后W2组微藻生物量明显高于不添加菌株的空白组,7 d后微藻生物量达到0.957 g/L;L11组、L2组在培养第4天后微藻增长速度开始加快,培养7 d后微藻生物量分别达到了0.798、0.635 g/L,说明菌株L11、L2对微藻生长的调整期较长,使微藻在第4天后才开始对数生长;总体看来,L8组、W5组在整个培养周期内微藻生物量增长始终低于空白组,说明这两种菌株对微藻的生长没有促进作用。在原污水培养条件下,菌株L11、W2对微藻生长表现出一定的促进作用,L11组、W2组在培养第7天的微藻生物量分别达0.586、0.509 g/L。对比可知,菌株W2在原污水培养条件下对微藻生长的促进没有灭菌污水培养时显著,说明W2菌在原污水中的生长受到一定程度的抑制,在与其他细菌的竞争中处于劣势;而菌株L11在原污水中对微藻的生长仍有显著的促进效果,说明菌株L11在原污水中可以生长为优势菌。此外,L11组中微藻的稳定期更长,有利于后期微藻的收获。
考察不同菌株对稳定期微藻生物量以及微藻平均生长速率的影响,结果如图3所示。由图3可见,在灭菌污水培养下,W2组稳定期微藻生物量最高,为0.940 g/L,比空白组高出近120.0%,W2组微藻平均生长速率为0.137 g/(L·d),比空白组高25.7%;L11组微藻生物量稍低,为0.802 g/L,比空白组高出83.0%,W2组微藻平均生长速率0.114 g/(L·d),与空白组相比提高了4.7%。在原污水培养条件下,L2组与L8组的微藻平均增长速率最高,但其生长周期短,稳定期生物量不高,不利于后期微藻收获;L11组微藻平均增长速率较L2组与L8组略低,为0.090 g/(L·d),但其微藻生长周期长,稳定期时的微藻生物量可达0.629 g/L,比空白组高97.7%,平均生长速率比空白组高12.7%。
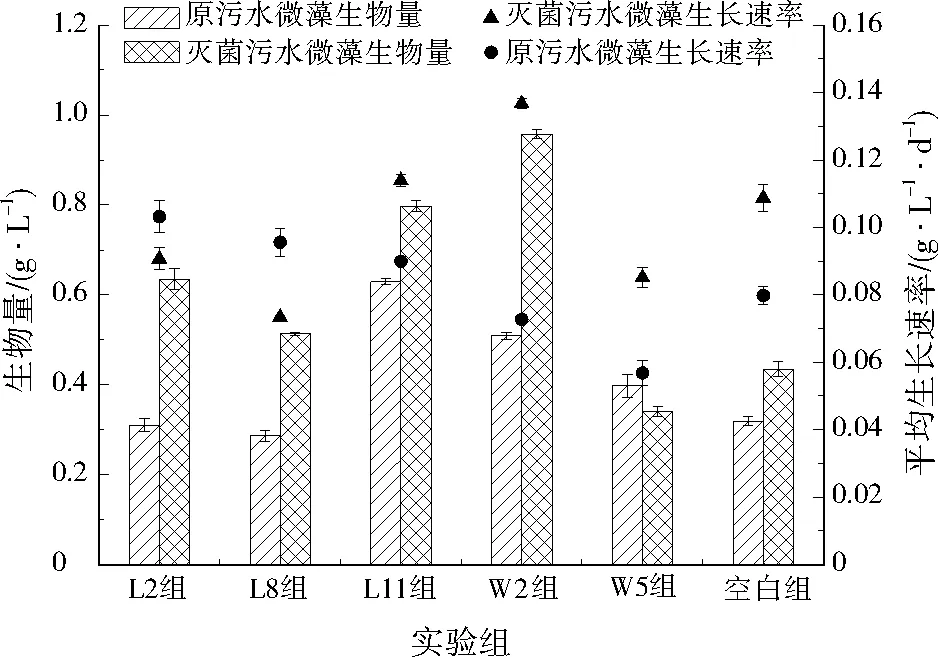
图3 不同菌株对微藻生物量与平均增长速率的影响Fig.3 The effect of different strains on production and growth rate of microalgae
研究中还考察了不同菌种对稳定期微藻油脂产量和微藻含油率的影响,结果见图4。在原污水培养下,空白组微藻含油率23.9%,L11组微藻含油率为21.8%,虽比空白组稍低,但油脂产量提高了67.3%。在灭菌污水培养下,空白组微藻含油率为28.5%,L11组微藻含油率为23.0%,也较空白组低,但油脂产量提高75.8%。综上所述,在5株高效COD去除菌中,菌株L11最适合用于促进原污水中的微藻生长。
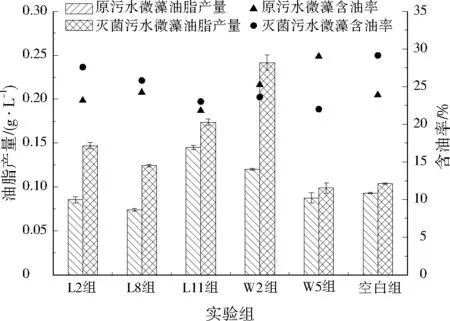
图4 不同菌株对微藻油脂产量和油脂含率的影响Fig.4 The effect of different strains on the fat yield and fat ratio of microalgae
2.3 菌种鉴定及作用机制分析
对菌株L11进行菌种鉴定,将菌株L11的16S rDNA序列上传到GenBank,经比较分析后发现该菌的16S rDNA序列与Paracoccus(副球菌属)的多株细菌相似性达到97%以上,其中与Paracoccushuijuniaestrain FLN-7、Paracoccusbengalensisstrain JJJ及Paracoccusmarinusstrain KKL-A5的相似性分别为98%、97%、97%,因此将菌株L11归类于Paracoccus属的置信度较高,基本可以确定为Paracoccus属。
Paracoccus属在自然界分布广泛,具有较多功能。SUN等[8]从污水生物处理系统分离筛选出细菌Paracoccushuijuniaesp.,其对酰胺类化合物具有良好的降解作用,这与本研究中菌株L11对于污水中COD具有高效降解能力相符。COD去除菌大多属于好氧异养菌,微藻生长过程中会不断分泌多糖及蛋白[9]等物质并通过光合作用释放氧气,COD去除菌可有效利用这些有机物和氧气进行生长,并释放出CO2供微藻进行光合作用,进而提高微藻的生长速率;TSAVKELOVA等[10]对兰科植物根系的细菌功能性进行分析,发现Paracoccus属细菌可以分泌植物激素吲哚-3-乙酸,这种植物激素对微藻的生长具有显著的促进作用,且植物激素浓度在细菌生长稳定期达到最高;FARIDHA等[11]利用气质联用色谱在Paracoccus属细菌胞外分泌物中发现了8种具有抗菌性能的化合物,说明Paracoccus属细菌可以在复杂的生长环境中具备较强的竞争能力。综合上述分析,菌株L11可能通过以下两种途径促进微藻的生长:一是释放CO2供微藻进行光合作用;二是分泌某种植物激素促进微藻生长。
2.4 菌藻共培养实验验证
将微藻与菌株L11同时接种到原污水中,考察共培养条件下微藻的生物量及污水COD的去除效果,结果如图5所示。由图5可见,与空白组相比,L11组对COD具有较快的降解速率,培养1 d污水COD即可迅速降至50 mg/L以下,说明加入菌株L11在培养初期对COD的降解起到显著的促进作用;培养第3~8天后,微藻处于快速生长期,空白组中COD浓度出现上升趋势,可能是由于微藻衰亡期细胞裂解导致微藻细胞内含物(如糖类、蛋白质、核酸等)释放到生长环境中,而L11组中COD的质量浓度始终维持在50 mg/L左右,说明L11菌对维持微藻培养系统中COD的稳定性具有一定作用,但培养9 d后,L11组COD的质量浓度也开始上升,说明菌株L11和微藻共培养的周期应控制在7~8 d。此外,L11组稳定期微藻生物量可达0.6 g/L以上,而空白组稳定期微藻生物量仅为0.3 g/L左右。综上,菌株L11有利于使污水COD维持在较低水平,并且提高微藻产量。
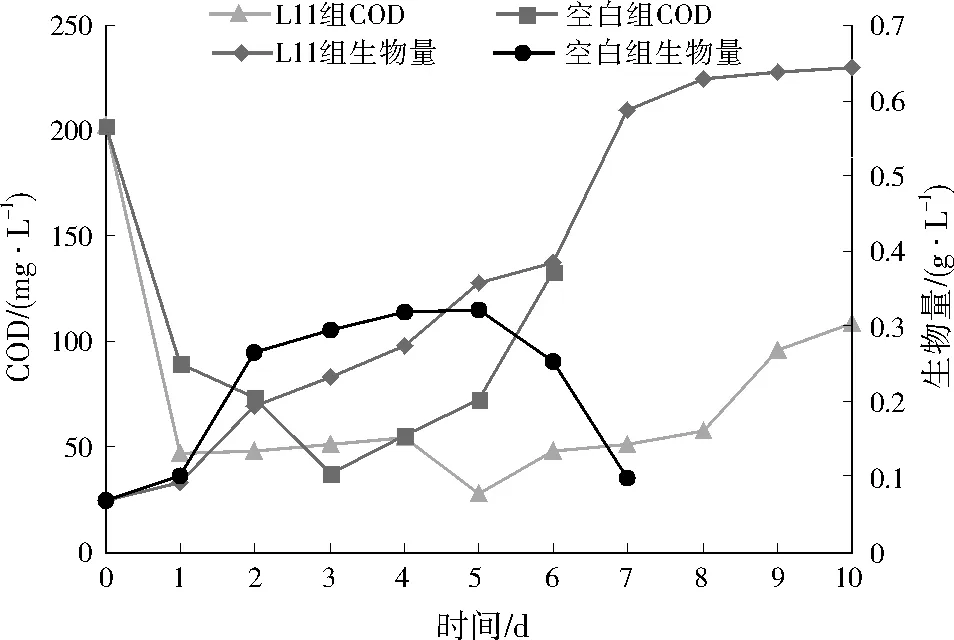
图5 菌藻共培养过程中微藻生物量与COD的变化规律Fig.5 The variation of microalgae biomass and COD concentration during the co-culture process
3 结 论
从城市污水处理厂的回流段污泥和微藻培养系统的藻液中筛选出38株细菌,其中5株对COD的去除效果较好,COD去除率可达80.0%左右;5株高效COD去除菌中,菌株L11最适合用于促进污水中的微藻生长,在原污水培养下,稳定期微藻生物量比空白组增加了97.7%,微藻平均生长速率提高了12.7%,油脂产量提高了75.8%;经鉴定,L11属于副球菌属,菌藻共培养过程中,菌株L11的投加有利于使污水中的COD维持在较低水平,并提高微藻产量。
[1] CHEN P,XIE Qinglong,ADDY M,et al.Utilization of municipal solid and liquid wastes for bioenergy and bioproducts production[J].Bioresource Technology,2016,215(30):163-172.
[2] LUIS F J,INÉS G,MARA C,et al.Impact of microalgae-bacteria interactions on the production of algal biomass and associated compounds[J].Marine Drugs,2016,14(5):100.
[3] PHILIPPOT L,RAAIJMAKERS J M,LEMANCEAU P,et al.Going back to the roots:the microbial ecology of the rhizosphere[J].Nature Reviews Microbiology,2013,11(11):789-799.
[4] RAMANAN R,KIM B H,CHO D H,et al.Algae-bacteria interactions: evolution,ecology and emerging applications[J].Biotechnology Advances,2016,34(1):14-29.
[5] HODSON S,CROFT M,DEERY E,et al.Algae acquire Vitamin B12 through a symbiotic relationship with bacteria[J].Nature,2005,438(7064):90-93.
[6] CHO D H,RAMANAN R,HEO J,et al.Enhancing microalgal biomass productivity by engineering a microalgal-bacterial community[J].Bioresource Technology,2015,175:578-585.
[7] KIM B H,RAMANAN R,CHO D H,et al.Role ofRhizobium,a plant growth promoting bacterium,in enhancing algal biomass through mutualistic interaction[J].Biomass & Bioenergy,2014,69(3):95-105.
[8] SUN Lina,ZHANG Jun,KWON S W,et al.Paracoccushuijuniaesp.nov.,an amide pesticide-degrading bacterium isolated from activated sludge of a wastewater biotreatment system[J].International Journal of Systematic & Evolutionary Microbiology,2013,63(3):1132-1137.
[9] CHU Huaqiang,HONG Yu,TAN Xiaobo,et al.Extraction procedure optimization and the characteristics of dissolved extracellular organic matter (dEOM) and bound extracellular organic matter (bEOM) fromChlorellapyrenoidosa[J].Colloids Surf B Biointerfaces,2015,125:238-246.
[10] TSAVKELOVA E A,CHERDYNTSEVA T A,BOTINA S G,et al.Bacteria associated with orchid roots and microbial production of auxin[J].Microbiological Research,2007,162(1):69-76.
[11] FARIDHA B I,MOHANKUMAR R,JEEVAN M,et al.GC-MS analysis of bio-active molecules derived fromParacoccuspantotrophusFMR19 and the antimicrobial activity against bacterial pathogens and MDROs[J].Indian Journal of Microbiology,2016,56(4):1-7.
ThefacilitationofCODremovalbacteriaonmicroalgaegrowthinmunicipalwastewater
CHENHongyi,GUOShida,JINWenbiao,TURenjie,HANSongfang.
(ShenzhenGraduateSchool,HarbinInstituteofTechnology,ShenzhenGuangdong518055)
2016-12-28)
陈洪一,女,1987年生,博士,主要从事污水处理研究工作。#
。
*深圳市环境科研计划《特种微生物菌剂在城市污水处理系统升级改造中的应用》;深圳市科技计划项目(No.JCYJ20150529114024234)。
10.15985/j.cnki.1001-3865.2017.08.017
