浙江省三个斑鳜野生群体线粒体DNA细胞色素b基因序列的遗传变异
2017-11-04许晓军孟庆辉陈小明
许晓军,孟庆辉,陈小明
(浙江省水产技术推广总站,浙江 杭州 310023)
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(10): 1637-1641
许晓军,孟庆辉,陈小明. 浙江省三个斑鳜野生群体线粒体DNA细胞色素b基因序列的遗传变异[J].浙江农业学报,2017,29(10): 1637-1641.
10.3969/j.issn.1004-1524.2017.10.06
2017-03-15
2013年度浙江省农业标准化研究项目“浙江省斑鳜种质特性研究”
许晓军(1979—),男,河南安阳人,博士研究生,高级工程师,从事水生生物遗传育种方向研究。E-mail: 24587980@qq.com
浙江省三个斑鳜野生群体线粒体DNA细胞色素b基因序列的遗传变异
许晓军,孟庆辉,陈小明
(浙江省水产技术推广总站,浙江 杭州 310023)
对钱塘江上游江山、乌溪江段和瓯江上游云和段3个斑鳜(SinipercascherzeriSteindachner)群体线粒体DNA细胞色素b(Cytb)基因片段进行了扩增和测序,比较并分析了其遗传多样性和群体遗传分化。结果显示,在斑鳜Cytb基因965 bp的部分序列中,A+T含量(52.11%)略高于G+C含量(47.89%),77个个体中发现了16个多态性位点,8种单倍型。江山群体、乌溪江群体和云和群体的单倍型多样性分别为0.570±0.078、0.668±0.067、0.667±0.032,核苷酸多样性分别为0.001 8±0.000 3、0.001 9±0.000 2、0.004 3±0.000 6。江山群体与乌溪江群体间的Fst为-0.005 16(P>0.05),表明同为钱塘江上游的两群体没有明显分化;但云和群体与江山群体、乌溪江群体间Fst分别为0.191 23(P<0.01)和0.178 10(P<0.01),表明瓯江上游与钱塘江上游斑鳜群体存在显著的分化。
斑鳜;细胞色素b基因;遗传变异
斑鳜(SinipercascherzeriSteindachner)隶属鲈形目(Perciformes)、鲈亚目(Percoidei)、鮨科(Serranidae)、鳜亚科(Sinipercinae)、鳜属(Siniperca),俗称肉鳜、褐鳜、岩鳜等,为东亚特有种类,广泛分布于我国内陆水域,在朝鲜和越南也有分布[1-2]。20世纪末期,国内学者从形态学层次对鳜亚科进行了重新整理,修正了斑鳜命名上的一些同物异名情况,基于同工酶的研究未能发现不同地区斑鳜存在显著差异[3]。
随着分子生物学技术的快速发展,21世纪初,线粒体基因测序技术被用于斑鳜的群体遗传学研究。mtDNA高度变异控制区(control region, CR)和细胞色素b(cytochrome b,Cytb)研究结果显示,我国各斑鳜野生群体具有较为丰富的遗传多样性,各群体间有明显的遗传分化,钱塘江群体的分化较为特别[4]。浙江省各主要水系上游区段均有较丰富的斑鳜野生资源分布。天然水域生态环境破坏以及过度捕捞,使斑鳜的野生资源正在下降[5]。加之斑鳜人工繁殖技术的成功和发展[6-7],人工繁育群体逃逸、无序的异地引种等现象日益突显。使各地天然斑鳜种质资源面临基因污染的严峻考验。mtDNACytb进化速度适中,是鱼类系统发育学、群体遗传学研究应用较多的重要分子标记[8]。因此,本研究拟通过对我省不同斑鳜野生群体mtDNACytb序列进行分析,初步了解其遗传多样性和遗传分化情况,为对其合理开发和保护管理提供资料和参考。
1 材料与方法
1.1 样品采集
斑鳜3个地理群体分别采自钱塘江上游江山港段(江山碗窑水库)、乌溪江段(遂昌乌溪江水库)和瓯江上游大溪云和段(云和紧水滩水库)。活体运输至实验室进行后续实验,采集地点及样品数量见表1。
1.2研究方法
1.2.1 基因组DNA提取
表1斑鳜样品采集情况
Table1Sampling information ofSinipercascherzeriSteindachner
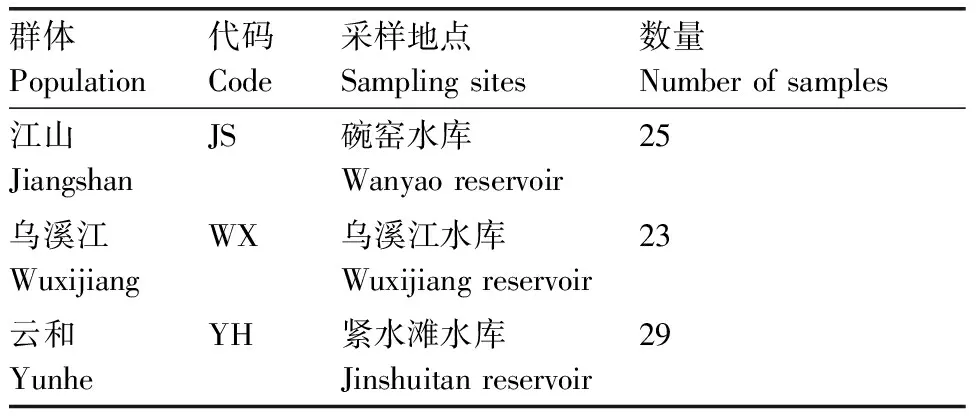
群体Population代码Code采样地点Samplingsites数量Numberofsamples江山JiangshanJS碗窑水库Wanyaoreservoir25乌溪江WuxijiangWX乌溪江水库Wuxijiangreservoir23云和YunheYH紧水滩水库Jinshuitanreservoir29
采用肝素钠溶液浸润的注射器尾静脉取血方法抽取200 μL抗凝血。以20 μL抗凝血为起始组织,采用天根血液基因组提取试剂盒进行基因组DNA提取,操作步骤按照试剂盒说明书进行。提取的基因组DNA经电泳检测后,稀释至100 mg·L-1于-20 ℃保存备用。
1.2.2 PCR扩增和测序
引物由上海生工生物工程技术服务有限公司合成,序列参考F: 5′-GACTTGAAAAACCACCGTTG-3′,R: 5′-CTCCGATCTCCGGATTACAAGAC-3′。PCR体系为50 μL: TaKaRaExTaq酶(5 U·μL-1) 0.25 μL,10×ExTaqBuffer 5 μL,dNTP Mixture(各2.5 mmol·L-1) 4 μL,模板DNA 1 μL,正反向引物(10 μmol·L-1)各1 μL,加灭菌超纯水至50 μL。反应条件为95 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min;4 ℃保存。
PCR扩增产物用1.5%琼脂糖电泳检测,确认样品扩增成功后,交由上海生工生物工程技术服务有限公司进行产物纯化测序。
1.3 数据分析
用BLAST软件将测序结果与GenBank相关序列进行同源性比较。利用DnaSP 5.0软件统计单倍型及单倍型多样性、核苷酸多样性、中性检验值(Tajima’s D)、群体间分化水平(Fst)。利用Arlequin 计算遗传分化指数(Fst),分子变异分析(AMOVA分析)。利用MEGA 6.0统计碱基组成并构建分子系统树。
2 结果与分析
2.1 mtDNA Cyt b基因片段碱基组成
对斑鳜3个群体77个体的mtDNACytb基因片段进行比对,除去两端部分模糊序列后,获得长度为965 bp的同源序列。经Mega 6分析,发现3斑鳜群体mtDNACytb基因片段碱基组成差异不大,平均碱基组成为A=24.42%,T=27.69%,C=32.90%,G=15.00%。A+T含量为52.11%,略高于G+C含量。详见表2。
2.2 群体内遗传多样性分析
在965 bp长度的核苷酸序列中共检测到16个多态位点,其中1个变异位点,15个简约信息位点。77个个体中共检出8种单倍型(GenBank登录号:KY608889-KY608896)(表 3)。其中,江山群体3种单倍型,乌溪江群体5种单倍型,云和群体3种单倍型。除1种单倍型为3群体共享,2种单倍型为江山群体与乌溪江群体共享外,其余6种单倍型中有1种为江山群体独有,3种为乌溪江群体独有,2种为云和群体独有(表3)。
表2斑鳜mtDNACytb基因片段碱基组成
Table2Base compositions forCytbsequences of three populations
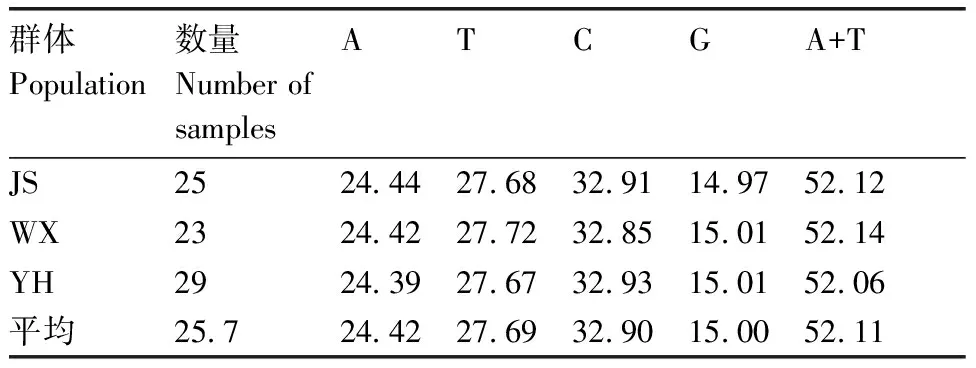
%
3个群体单倍型多样性为0.570~0.688,乌溪江群体具有最多的单倍型数(5),但云和群体较江山、乌溪江群体具有较高的核苷酸多样性(0.004 3)和平均核苷酸差异数(4.118)。Tajima’s D检验值在0.813 1~1.969 9,均无显著性差异。详见表4。
2.3 群体间遗传分化
不同群体间Fst遗传分化分析表明,3个斑鳜群体间遗传分化指数较低,江山群体和乌溪江群体间差异最小,为-0.005 16(P=0.393 43);云和群体与江山群体、乌溪江群体间差异较大,分别为0.191 23和0.178 10,达到了显著分化水平,见表5。
表3三个群体中的单倍型分布
Table3Haplotypes distribution of three populations

单倍型HaplotypeGenbankaccessionNo.江山Jiangshan乌溪江Wuxijiang云和YunheHap_1KY608889151111Hap_2KY60889078Hap_3KY6088912Hap_4KY6088921Hap_5KY6088931Hap_6KY6088943Hap_7KY60889511Hap_8KY6088967
表4三个群体遗传多样性参数统计
Table4Genetic diversity parameters of three populations

群体Population单倍型数NumberofHaplotype单倍型多样性(Hd)Haplotypediversity核苷酸多样性(π)Nucleotidediversity平均核苷酸差异数(K)AveragenucleotidedifferenceTajimasD检验值TajimasD江山Jiangshan30570±007800018±00003170008131乌溪江Wuxijiang50668±006700019±00002178709352云和Yunhe30677±003200043±00006411819699
根据Fst遗传分化分析,将江山群体和乌溪江群体归为一个组群,进行分子变异分析(AMOVA)。分析结果表明,遗传变异主要来源于群体内(74.05%),组群间遗传变异占比其次(25.31%),而组群内群体间遗传变异占比很小(0.64%)(表6)。
表5三个群体间Fst统计值
Table5Fstvalues of three populations
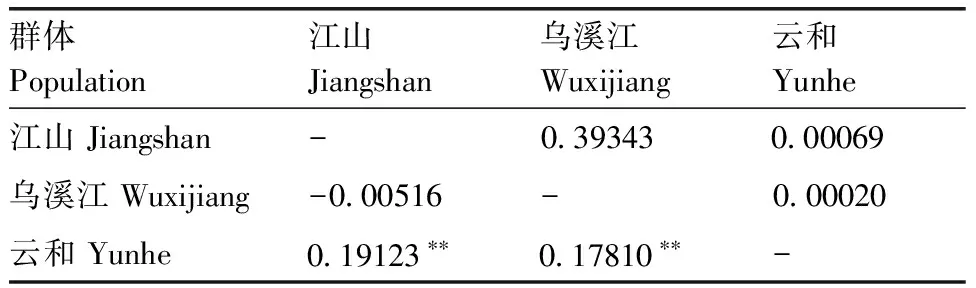
群体Population江山Jiangshan乌溪江Wuxijiang云和Yunhe江山Jiangshan-039343000069乌溪江Wuxijiang-000516-000020云和Yunhe019123∗∗017810∗∗-
对角线上方数值为显著性P值;对角线下方数值为Fst值。**表示分化水平达到极显著水平(P<0.01)。
The data above the diagonal showed significantPvalues; the data below the diagonal showedFstvalues. ** indicated that the differentiation level between populations was significant (P<0.01).
表6三个群体分子变异分析结果
Table6Analysis of molecular variance among three populations
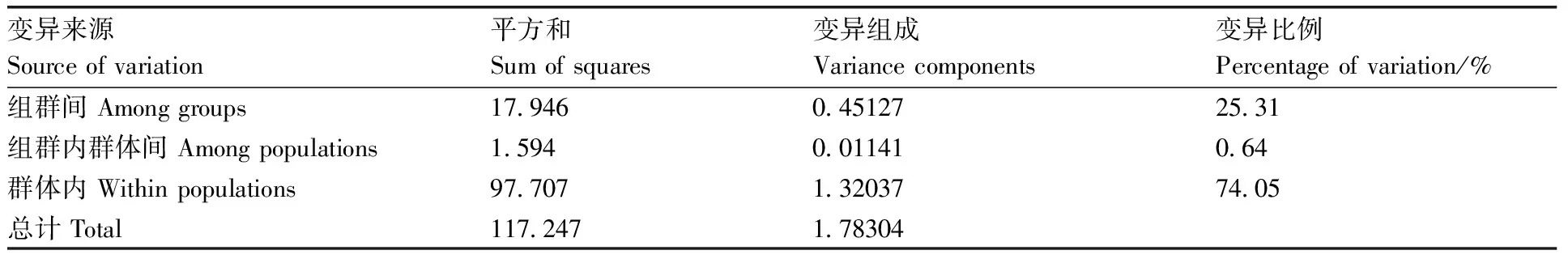
变异来源Sourceofvariation平方和Sumofsquares变异组成Variancecomponents变异比例Percentageofvariation/%组群间Amonggroups179460451272531组群内群体间Amongpopulations1594001141064群体内Withinpopulations977071320377405总计Total117247178304
3 讨论
3.1 斑鳜群体的遗传多样性
本研究中3个斑鳜群体Cytb序列的碱基组成为A占24.42%、T占27.69%、C占32.90%、G占15.00%,其中G含量显著低于其他碱基含量,显示出明显的Cytb基因共同特征[9]。该结果与在河川沙塘鳢、河鲈、秦岭细鳞鲑等Cytb中观察到的结果相似[10-12]。根据线粒体基因序列的单倍型多样性(Hd)和核苷酸多样性(π),将海洋鱼类的遗传多样性分为4 种类型:低Hd(<0.5)和低π(<0.5%),高Hd(>0.5)和低π(<0.5%),低Hd(<0.5)和高π(>0.5%),高Hd(>0.5)和高π(>0.5%)[13]。本研究中3个斑鳜群体遗传多样性表现属于第2种类型,具有较高的单倍型多样性,但其核苷酸多样性相对较低,私有单倍型较多。这可能是种群由于环境改变,导致有效种群数量降低,在“瓶颈效应”之后,种群经过短期快速扩张加速积累新突变所致[14]。此结果与斑鳜资源由于捕捞和环境污染,种群资源由各水系中上游广泛分布转为仅在上游分布的历史事实相符。
3.2 斑鳜群体遗传分化
群体遗传分化系数Fst是利用遗传信息反映各群体间遗传分化程度的指标,数值越大表示两个群体间遗传分化水平越高。若Fst<0.05,表示群体几乎没有遗传分化;若0.05
[1] 周才武,杨青,蔡德霖. 鳜亚科SINIPERCIXAE鱼类的分类整理和地理分布[J]. 动物学研究,1988,9(2):113-126.
ZHOU C W, YANG Q, CAI D L. On the classification and distribution of the Sinipercinae fishes (Family Serranidae)[J].ZoologicalResearch, 1988, 9(2):113-126. (in Chinese with English abstract)
[2] 李思忠. 鳜亚科鱼类地理分布的研究[J]. 动物学杂志,1991,26(4):40-44.
LI S Z. Geographic distribution of the Sinipercinae fishes[J].ChineseJournalofZoology, 1991, 26(4):40-44. (in Chinese with English abstract)
[3] 孔晓瑜,周才武. 鳜亚科Sinipercinae鱼类的LDH同工酶的比较研究[J]. 青岛海洋大学学报,1992,22(1):103-109.
KONG X Y, ZHOU C W. Comparative studies on LDH isozyme in Sinipercinae fishes of China[J].JournalofOceanUniversityofQingdao, 1992, 22(1):103-109. (in Chinese with English abstract)
[4] 王伟伟,赵金良,李思发. 我国斑鳜六个群体mtDNACytb序列的遗传变异[J]. 动物学研究,2006,27(6):589-593.
WANG W W, ZHAO J L, LI S F. Genetic variation of the mitochondrial DNACytbamong six populations ofSinipercascherzeriin China[J].ZoologicalResearch, 2006, 27(6):589-593. (in Chinese with English abstract)
[5] 梁旭方.国内外鳜类研究及养殖概况[J]. 水产科技情报,1996,23(1):13-17.
LIANG X F. Study on mandarin fish and its culture home and abroad[J].FisheriesScience&TechnologyInformation, 1996, 23(1):13-17. (in Chinese with English abstract)
[6] 曾可为,王青云,高爱银,等.斑鳜的生物学及繁殖生物学的研究[J]. 内陆水产,2005,30(2):21-23.
ZENG K W, WANG Q Y, GAO A Y, et al. Biology and reproduction study onSinipercascherzeri[J].InlandFisheries, 2005, 30(2):21-23. (in Chinese with English abstract)
[7] 凌继忠.斑鳜人工繁育技术总结[J]. 渔业致富指南,2004(16):33-34.
LING J Z. Artificial breeding technology ofSinipercascherzeri[J].FisheryGuidetobeRich, 2004(16):33-34. (in Chinese)
[8] 郭新红,刘少军,刘巧,等.鱼类线粒体DNA研究新进展[J]. 遗传学报,2004,31(9):983-1000.
GUO X H, LIU S J, LIU Q, et al. New progresses on mitochondrial DNA in fish[J].ActaGeneticaSinica, 2004, 31(9):983-1000. (in Chinese with English abstract)
[9] ROGERS A R, HARPENDING H. Population growth makes waves in the distribution of pairwise genetic differences[J].MolecularBiologyandEvolution, 1992, 9(3):552-569.
[10] 谢楠,冯晓宇,郭水荣,等.河川沙塘鳢线粒体细胞色素b(Cyt b)基因序列分析[J]. 现代农业科技,2010(19):288-290.
XIE N, FENG X Y, GUO S R, et al. Sequences analysis of mitochondrial cytochrome b gene fragment ofOdontobutispotamophila[J].ModernAgriculturalScienceandTechnology, 2010(19):288-290. (in Chinese with English abstract)
[11] 武菲,王翠华,胡文革,等.基于细胞色素b基因河鲈养殖群体与野生群体遗传多样性分析[J]. 淡水渔业,2015,45(6):16-21.
WU F, WANG C H, HU W G, et al. An analysis of the gene diversity based on the mitochondrial cytochromebgene sequence of wild and cultivated populations ofPercaFluviatilis[J].FreshwaterFisheries, 2015, 45(6):16-21. (in Chinese with English abstract)
[12] 张艳萍,王太,杜岩岩,等.秦岭细鳞鲑人工繁育群体与野生群体遗传变异分析[J]. 水生生物学报,2014,38(5):828-833.
ZHANG Y P, WANG T, DU Y Y, et al. Analysis of the genetic diversity of cultured and wildBrachymystaxLenokTsinlingensispopulations based on mtDNA D-loop and Cytb[J].ActaHydrobiologicaSinica, 2014, 38(5):828-833. (in Chinese with English abstract)
[13] GRANT W S, BOWEN B W. Shallow population histories in deep evolutionary lineages of marine fishes: insights from sardines and anchovies and lessons for conservation[J].Heredity, 1998, 89(5):415-426.
[14] AVISE J C. Phylogeography[M]. Cambrige, Massachusetts: Harvard University Press, 2000.
[15] WRIGHT S. The interpretation of population structure by F-Statistics with special regard to systems of mating[J].Evolution, 1965, 19(3):395-420.
GeneticvariationofmitochondrialDNACytbamongthreeSinipercascherzeripopulationsinZhejiangProvince
XU Xiaojun, MENG Qinghui, CHEN Xiaoming
(ZhejiangFisheriesTechnicalExtensionCenter,Hangzhou310023,China)
The mtDNACytbgene ofSinipercascherzeriSteindachner from the upper reaches of Qiantang River (Jiangshan population and Wuxijiang population) and the upper reaches of Oujiang River (Yunhe population) were amplified and sequenced to assess the genetic diversity and genetic structure. The results showed that the average content of A+T (52.11%) was higher than that of G+C (47.89%) in the aligned 965 bp partial sequences. A total of 16 polymorphic sites were detected and 8 haplotypes were recovered out of 77 individuals. The haplotype diversity of Jiangshan, Wuxijiang and Yunhe populations were 0.570±0.078, 0.668±0.067 and 0.667±0.032,respectively, while the nucleotide diversity of the three populations were 0.001 8±0.000 3、0.001 9±0.000 2、0.004 3±0.000 6,respectively. TheFstvalue between Jiangshan population and Wuxijiang population was low (Fst=-0.005 16,P>0.05), which indicated that the two upper reaches of Qiantang River populations did not have significant genetic differentiation. While statistically significant genetic differentiations were observed between Yunhe population and Jiangshan population (Fst=0.191 23,P<0.01), and between Yunhe population and Wuxijiang population (Fst=0.178 10,P<0.01), which indicated significant genetic differentiations between the upper reaches of Qiantang River and the upper reaches of Oujiang River.
SinipercascherzeriSteindachner; cytochrome b gene; genetic variation
S937;Q75
A
1004-1524(2017)10-1637-05
(责任编辑卢福庄)
