慢病毒介导的靶向沉默HPV16 E7⁃shRNA对SiHa细胞DNA甲基转移酶表达的影响
2017-11-02杨佳李黎明许翠龙嘉王尧杨雪源蒋明军
杨佳 李黎明 许翠 龙嘉 王尧 杨雪源 蒋明军
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所中心实验室 江苏省皮肤病与性病分子生物学重点实验室(杨佳、李黎明、许翠、龙嘉、杨雪源、蒋明军);南京农业大学生命科学与技术基地班(王尧)
·论著·
慢病毒介导的靶向沉默HPV16 E7⁃shRNA对SiHa细胞DNA甲基转移酶表达的影响
杨佳 李黎明 许翠 龙嘉 王尧 杨雪源 蒋明军
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所中心实验室 江苏省皮肤病与性病分子生物学重点实验室(杨佳、李黎明、许翠、龙嘉、杨雪源、蒋明军);南京农业大学生命科学与技术基地班(王尧)
目的 探讨慢病毒携带的靶向人乳头瘤病毒16(HPV16)E7基因的短发夹干扰RNA(shRNA)对HPV16阳性宫颈癌SiHa细胞中4种甲基转移酶(DNMT1、DNMT3A、DNMT3B、DNMT3L)表达水平的影响。方法 构建HPV16 E7基因靶序列的shRNA重组质粒,用BLOCK⁃iT™Lentiviral RNAi Expression System试剂盒进行慢病毒包装,分别转染293T细胞48、72 h后收集病毒上清液。分别用含靶向HPV16 E7⁃shRNA重组质粒的病毒上清液与完全培养基(1∶1)的混合液(shRNA组)、含空白质粒(即不含靶向HPV16 E7⁃shRNA序列)的病毒上清液与完全培养基(1∶1)的混合液(阴性对照组)、完全培养基(空白对照组)培养SiHa细胞。感染0、48、96 h后,用实时荧光定量PCR(qRT⁃PCR)检测3组SiHa细胞中HPV16 E7和4种甲基转移酶mRNA的表达,Western印迹检测4种甲基转移酶的蛋白表达。结果 感染0 h时,shRNA组、阴性对照组、空白对照组SiHa细胞HPV16 E7、DNMT1、DNMT3A、DNMT3B、DNMT3L mRNA相对表达量比较,差异无统计学意义(均P>0.05);感染48、96 h时,3组细胞间HPV16 E7和4种DNMT mRNA相对表达量比较,差异有统计学意义(均P<0.05)。shRNA组HPV16 E7、DNMT1、DNMT3A、DNMT3B和DNMT3L mRNA表达水平在48 h时的沉默效率分别为71.13%、50.53%、13.72%、46.27%和17.92%,96 h时分别为83.50%、74.2%、47.8%、64.7%和48.9%;而阴性对照组和空白对照组各时间点表达水平差异无统计学意义(均P>0.05)。慢病毒感染48、96 h时,3组细胞间上述4种DNMT蛋白表达量差异有统计学意义(均P<0.01)。shRNA组4种DNMT蛋白表达水平随感染时间的延长而逐渐下降,感染48 h时DNMT1、DNMT3A、DNMT3B和DNMT3L蛋白表达抑制率分别为84%、37.2%、59.8%、49.3%,96 h时分别为73.1%、68.7%,55.5%、65.5%。结论 靶向沉默HPV16阳性宫颈癌SiHa细胞E7基因能够干扰DNMT1、DNMT3A、DNMT3B、DNMT3L mRNA及蛋白的表达。
人乳头瘤病毒16;乳头瘤病毒E7蛋白质类;RNA,小分子干扰;甲基转移酶类;细胞系,肿瘤
近年来,多种研究提示,表观遗传学改变参与恶性肿瘤的发生发展,其中DNA甲基化是表观遗传学研究最为深入的一种机制[1]。DNA甲基转移酶(DNMT)是催化DNA异常甲基化过程的关键信号分子,其表达水平和功能改变是导致异常DNA甲基化模式的重要因素之一[2]。Burgers等[3]的研究表明,人乳头瘤病毒16(HPV16)E7可与DNMT1直接结合,从而激活DNMT1。高危型HPV感染和DNA异常甲基化均参与相关肿瘤的发生发展过程,我们推测,HPV16可能通过E7蛋白与DNMT发生作用,引起DNA异常甲基化,进而导致相关目的基因表达和功能发生改变。本研究以HPV16 E7为靶点设计短发夹RNA(shRNA)干扰序列,构建重组慢病毒表达载体,对病毒进行包装,提取病毒液感染HPV16阳性宫颈癌SiHa细胞,探讨体外靶向沉默HPV16 E7基因对DNMT1、DNMT3A、DNMT3B、DNMT3L基因转录和蛋白表达水平的影响。
材料与方法
一、试剂与材料
SiHa和293T细胞为本实验室保存,脂质体Lipofectamine 2000、Trizol试剂和慢病毒包装系统(BLOCK⁃iTTMLentiviral RNAi Expression System Kit)(美国Invitrogen公司),反转录试剂盒(Revert Aid First Strand cDNA Synthesis Kit)(美国Thermo Fisher Scientific公司),Quanti Fast SYBR Green PCR试剂盒(德国Qiagen公司),高糖型DMEM培养基、胎牛血清(FBS)、胰酶和opti⁃MEM无血清培养基(美国Gibco公司),人DNMT1、DNMT3A、β肌动蛋白抗体、蛋白显影液 20×LumiGLO®Reagent and 20× Peroxide(美国CST公司),人DNMT3B、DNMT3L抗体(英国Abcam公司)。
二、方法
1.HPV16 E7基因shRNA重组质粒构建:根据基因库提供的HPV16 E7基因序列,按照RNA干扰序列设计原则,通过BLOCK⁃iT RNAi Designer在线设计软件(http:∕∕rnaidesigner.thermofisher.com∕rnaiexpress∕design.do)选择长19个碱基的HPV16 E7基因特异性寡核苷酸序列为干扰靶点,靶序列如下:5′⁃AGGAGGATGAAATAGATGG⁃3′,由上海吉玛制药技术有限公司合成针对上述HPV16 E7基因靶序列的shRNA重组质粒(pLenti6∕BLOCK⁃iT⁃DEST expression plasmid)。
2.慢病毒包装:转染前24 h,选择生长状态良好的293T细胞,胰酶消化后传代接种于6孔培养板,待细胞覆盖率达60%~70%后用于转染。慢病毒包装操作流程参考慢病毒包装系统说明书,将制成的DNA⁃脂质体转染复合物逐滴加入293T细胞,37℃、5%CO2细胞培养箱中培养8 h后,更换为含10%胎牛血清(FBS)的完全培养基继续培养,分别在转染后48 h和72 h收获含病毒的上清液,4℃、1 409×g离心15 min去除细胞碎片,病毒液分装后-80℃冻存。
3.慢病毒感染SiHa细胞:用胰酶消化SiHa细胞后,以1.5×105个细胞∕孔接种于6孔培养板中,次日将培养液换成病毒液和完全培养基混合液(1∶1)2 ml进行病毒感染。实验分为shRNA组、阴性对照组和空白对照组:①shRNA组:含靶向HPV16 E7⁃shRNA重组质粒的病毒液培养SiHa细胞;②阴性对照组:含空白质粒(即不含靶向HPV16 E7⁃shRNA序列)的病毒液培养SiHa细胞;③空白对照组:完全培养基培养SiHa细胞。每组设3个复孔。
4.实时荧光定量PCR(qRT⁃PCR)检测HPV16 E7及4种甲基转移酶mRNA的表达情况:分别收集感染0、48、96 h的细胞,Trizol法提取细胞总RNA,使用Revert Aid First Strand cDNA Synthesis反转录试剂盒按照标准试验流程将总RNA反转录成cDNA,使用Quanti Fast SYBR Green PCR试剂盒按其说明书扩增目的基因。反应体系如下:cDNA模板1 μl,上下游引物各0.5 μl,SYBR Green Mix 10 μl及去离子水8 μl,引物序列见表1。反应条件如下:50℃2 min;95℃5 min;95℃20 s,60℃ 30 s,40个循环;95℃ 15 s,60℃1 min,95℃15 s。根据所得的Ct值,以β肌动蛋白为内参照,ΔCt=待测基因Ct-β肌动蛋白Ct;ΔΔCt=感染组ΔCt-空白对照组ΔCt,计算2⁃ΔΔCt,得到感染组样本待测基因相对于空白对照组样本基因的相对表达量。DNMT基因沉默效率=[1-(感染后甲基转移酶mRNA∕感染前甲基转移酶mRNA)]×100%。

表1 待测基因及内参照的引物序列
5.Western印迹测定4种甲基转移酶蛋白表达:分别于感染0、48、96 h后收集各组细胞,提取细胞总蛋白,BCA法测定蛋白浓度。取50 μg总蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS⁃PAGE),200 mA转膜2 h,含5%脱脂奶粉的TBST溶液室温封闭2 h,分别加入兔抗人DNMT1(1∶1 000)、DNMT3A(1∶1 000)、DNMT3B(1∶2 000)、DNMT3L(1∶2 000)抗体及兔抗人β肌动蛋白(1∶1 000)抗体4℃孵育过夜。TBST液洗膜,加入辣根过氧化物酶(HRP)-羊抗兔IgG(1∶5 000)室温孵育2 h,TBST液洗膜,用20×LumiGLO®Reagent and 20×Peroxide发光显影,凝胶成像系统曝光获取图像,用Quantity one软件对各个条带进行灰度值观察。待测蛋白表达量=待测蛋白条带灰度值∕β肌动蛋白条带灰度值。DNMT蛋白表达抑制率=[1-(感染后DNMT蛋白表达量∕感染前DNMT蛋白表达量)]×100%。
结果
一、各组SiHa细胞HPV16 E7 mRNA水平
表2 慢病毒感染SiHa细胞3组间HPV16 E7 mRNA表达水平比较(±s)
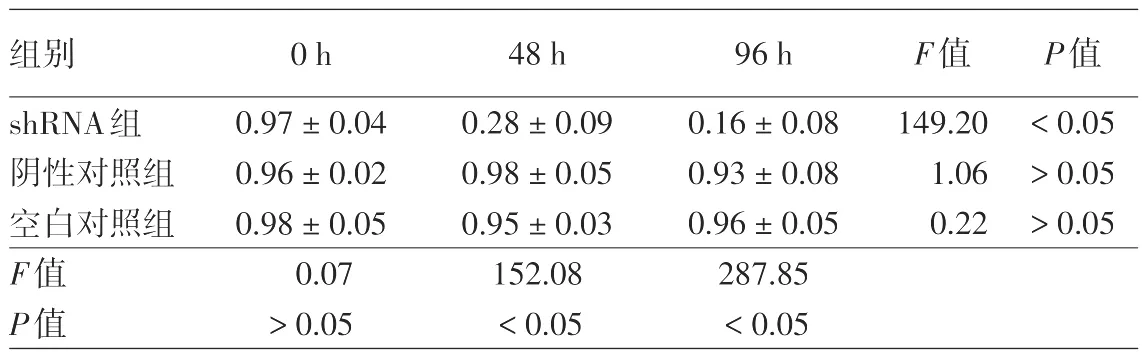
表2 慢病毒感染SiHa细胞3组间HPV16 E7 mRNA表达水平比较(±s)
注:n=3。时间主效应F=10.70,P<0.01;组间主效应F=22.01,P<0.01;交互效应F=6.15,P<0.01
组别shRNA组阴性对照组空白对照组F值P值0 h 0.97±0.04 0.96±0.02 0.98±0.05 0.07>0.05 48 h 0.28±0.09 0.98±0.05 0.95±0.03 152.08<0.05 96 h 0.16±0.08 0.93±0.08 0.96±0.05 287.85<0.05 F值149.20 1.06 0.22 P值<0.05>0.05>0.05
见表2。经多因素方差分析,3组细胞间HPV16 E7 mRNA相对表达量差异有统计学意义(F=22.01,P<0.01),各组HPV16 E7 mRNA相对表达量随感染时间的延长而降低(F=10.70,P<0.01),时间与组别间存在交互作用(F=6.15,P<0.01)。感染0 h时,3组细胞间HPV16 E7 mRNA相对表达量差异无统计学意义(P>0.05),而感染48、96 h时,3组细胞间HPV16 E7 mRNA相对表达量的差异有统计学意义(均P<0.05)。shRNA组HPV16 E7 mRNA表达水平随时间的延长而逐渐降低(P<0.05),48、96 h时的沉默效率分别为71.13%、83.50%,而阴性对照组和空白对照组各时间点HPV16 E7 mRNA表达水平差异无统计学意义(均P>0.05)。
二、HPV16 E7表达水平变化对SiHa细胞4种mRNA和蛋白的表达
1.经多因素方差分析,3组细胞间DNMT1、DNMT3A、DNMT3B、 DNMT3L mRNA相对表达量差异有统计学意义(F值分别为294.80、52.50、214.73、77.40,均 P<0.01)。各组细胞4种甲基转移酶mRNA相对表达量有随感染时间变化的趋势(F值分别为90.94、25.50、72.76、31.04,均P<0.01),时间与组别均存在交互作用(F值分别为78.82、19.93、57.22、22.74,均P<0.01)。见图1。

图1 慢病毒感染SiHa细胞后各组4种DNA甲基转移酶(DNMT)mRNA表达情况 shRNA组4种DNMT mRNA相对表达量均随感染时间的延长而逐渐下降,而阴性对照组和空白对照组未见明显变化
慢病毒感染SiHa细胞0 h时,3组细胞间4种甲基转移酶mRNA相对表达量的差异无统计学意义(F分别为0.16、0.33、0.27、0.11,均P>0.05);感染48、96 h时,3组细胞间4种甲基转移酶mRNA相对表达量的差异有统计学意义(均P<0.05)。此外,shRNA组上述4种甲基转移酶mRNA表达水平随感染时间的延长而逐渐下降(均P<0.01),感染48、96 h时4种DNMT的沉默效率分别为50.53%、74.2%,13.72%、47.8%,46.27%、64.7%,17.92%、48.9%。然而,阴性对照组和空白对照组各时间点4种甲基转移酶mRNA表达差异无统计学意义(均P>0.05)。

图2 Western印迹法检测感染48、96 h后3组SiHa细胞4种DNA甲基转移酶(DNMT)蛋白的表达 1:shRNA组;2:阴性对照组;3:空白对照组。感染48、96 h时,shRNA组4种蛋白表达水平均明显低于阴性对照组和空白对照组,而阴性对照组与空白对照组间无明显差异;此外,shRNA组4种DNMT蛋白表达水平随感染时间的延长而逐渐下降
表3 慢病毒感染48、96 h后3组SiHa细胞DNA甲基转移酶(DNMT)蛋白表达(±s)

表3 慢病毒感染48、96 h后3组SiHa细胞DNA甲基转移酶(DNMT)蛋白表达(±s)
注:n=3
组别shRNA组阴性对照组空白对照组DNMT1 48 h 0.08±0.05 0.54±0.04 0.50±0.06 96 h 0.07±0.01 0.29±0.03 0.26±0.05 DNMT3A 48 h 0.27±0.02 0.41±0.01 0.43±0.02 96 h 0.10±0.02 0.36±0.05 0.32±0.06 DNMT3B 48 h 0.37±0.06 0.92±0.04 0.92±0.06 96 h 0.20±0.02 0.50±0.05 0.45±0.05 DNMT3L 48 h 0.37±0.06 0.66±0.02 0.73±0.06 96 h 0.23±0.03 0.80±0.03 0.67±0.05
2.蛋白表达水平变化:见图2,表3。经多因素方差分析,3组细胞间4种DNMT蛋白表达水平的差异有统计学意义(F值分别为140.57、61.25、143.84、184.43,均P<0.01),且各组细胞4种DNMT蛋白表达量有随感染时间变化的趋势(F值分别为98.28、 41.89、230.83、51.56,均P<0.01),时间与组别间存在交互作用(F值分别为22.05、4.67、14.255、16.34,均P<0.05)。感染48 h时4种DNMT蛋白表达抑制率分别为84%、37.2%、59.8%、49.3%,96 h时为73.1%、68.7%,55.5%、65.5%。
讨论
流行病学和分子生物学资料[4]表明,高危型HPV持续感染两性生殖器部位皮肤黏膜易导致阴茎癌、女性外阴癌和宫颈癌,以高危型HPV16最为常见,其基因组基本结构分为3个功能区:早期转录区(E1、E2、E4、E5、E6、E7),晚期转录区(L1、L2)和非转录区(LCR)。早期转录区编码的基因主要参与病毒DNA的复制、转录、翻译调控和细胞转化等功能,其中E7基因编码的蛋白可导致多种细胞周期负向调控信号失效,如pRb介导的生长停滞、p16介导的细胞周期停滞等[5]。有学者[6]研究发现,E7蛋白能够通过激活EZH2基因表达增强DNMT的活性,表明HPV16 E7与DNA甲基化状态有密切联系。
DNMT是催化DNA异常甲基化过程的关键信号分子,其表达水平和功能的改变是导致异常DNA甲基化模式的重要内源性因素,主要包括DNMT1、DNMT3A、DNMT3B、DNMT3L。DNMT1是DNA进行复制并维持其正常甲基化的关键酶,DNMT3A和DNMT3B主要催化从头甲基化,DNMT3L并没有直接的甲基化作用,但可以通过蛋白之间的相互作用调节DNMT3A和DNMT3B的活性[7]。有研究表明,DNMT1、DNMT3A、DNMT3B mRNA表达水平在宫颈癌组织中高于正常宫颈组织,提示DNMT表达异常是引起宫颈癌发生发展的重要因素[8⁃9]。Au Yeung等[10]通过RNAi技术沉默宫颈癌细胞株中HPV16 E6基因后,观察到DNMT1蛋白表达水平下降,而过表达E6基因,DNMT1蛋白表达水平随之上升,提示HPV16 E6癌基因参与调节宫颈癌中DNMT的表达。Burgers等[3]研究发现,HPV16 E7可通过与DNMT1直接结合,形成E7∕DNMT1复合物,活化DNMT1,促进DNMT1与DNA和腺苷蛋氨酸结合,这是迄今为止唯一明确证实E7和DNMT有直接结合,进而激活酶活性的研究报道。
本研究选择HPV16阳性宫颈癌细胞株SiHa,应用靶向HPV16 E7的shRNA慢病毒载体介导的RNAi技术,选择性抑制细胞内HPV16编码的E7基因表达,并分别采用qRT⁃PCR和Western印迹法对E7蛋白及4种DNMT在转录水平及蛋白水平的表达情况进行分析,从而探索4种DNMT表达水平与HPV16 E7蛋白的依赖关系。数据表明,在慢病毒感染SiHa细胞48、96 h后,HPV16 E7 mRNA表达水平较感染前显著下降,提示靶向HPV16 E7干扰慢病毒构建成功,该慢病毒能够有效且特异地沉默E7基因,抑制其在转录水平的表达。本研究发现,在感染前3组细胞间4种甲基转移酶的表达水平均无明显差异,感染48、96 h时,shRNA组4种甲基转移酶mRNA和蛋白表达水平均逐渐下降。提示在SiHa细胞中,HPV16 E7基因可能通过某种直接或间接的机制参与调控DNMT的表达,进而导致相关基因的甲基化状态改变,促进细胞发生恶性转化。该研究为深入研究E7基因与DNMT的相互作用关系提供了依据。
[1]Dawson MA,Kouzarides T.Cancer epigenetics:from mechanism to therapy[J].Cell,2012,150(1):12⁃27.DOI:10.1016∕j. cell.2012.06.013.
[2]Ehrlich M.DNA hypomethylation in cancer cells[J].Epigenomics, 2009,1(2):239⁃259.DOI:10.2217∕epi.09.33.
[3]Burgers WA,Blanchon L,Pradhan S,et al.Viral oncoproteins target the DNA methyltransferases[J].Oncogene,2007,26(11): 1650⁃1655.DOI:10.1038∕sj.onc.1209950.
[4]PettM,ColemanN.Integrationofhigh⁃riskhumanpapillomavirus:a key event in cervical carcinogenesis[J].J Pathol,2007,212(4): 356⁃367.DOI:10.1002∕path.2192.
[5]Riley RR,Duensing S,Brake T,et al.Dissection of human papillo⁃mavirus E6 and E7 function in transgenic mouse models of cervical carcinogenesis[J].CancerRes,2003,63(16):4862⁃4871.
[6]Holland D,Hoppe⁃Seyler K,Schuller B,et al.Activation of the enhancer of zeste homologue 2 gene by the human papillomavirus E7 oncoprotein[J].Cancer Res,2008,68(23):9964⁃9972.DOI: 10.1158∕0008⁃5472.CAN⁃08⁃1134.
[7]Van Emburgh BO,Robertson KD.Modulation of Dnmt3b function in vitro by interactions with Dnmt3L,Dnmt3a and Dnmt3b splice variants[J].Nucleic Acids Res,2011,39(12):4984⁃5002.DOI: 10.1093∕nar∕gkr116.
[8]Robertson KD,Uzvolgyi E,Liang G,et al.The human DNA methyltransferases(DNMTs)1,3a and 3b:coordinate mRNA expression in normal tissues and overexpression in tumors[J]. Nucleic Acids Res,1999,27(11):2291⁃2298.DOI:10.1093∕nar∕27.11.2291.
[9]黄团明,王婉,闫晓欢,等.DNA甲基转移酶在宫颈癌组织中的表达及其与HPV的相关性分析[J].重庆医学,2015,44(13): 1752⁃1755.DOI:10.3969∕j.issn.1671⁃8348.2015.13.009.
[10]Au Yeung CL,Tsang WP,Tsang TY,et al.HPV⁃16 E6 upregula⁃tion of DNMT1 through repression of tumor suppressor p53[J]. Oncol Rep,2010,24(6):1599⁃1604.DOI:10.3892∕or_00001023.
Effects of lentivirus⁃delivered short hairpin RNA targeting human papillomavirus 16 E7 gene on the expression of DNA methyltransferases in SiHa cells
Yang Jia,Li Liming,Xu Cui,Long Jia,Wang Yao,Yang Xueyuan,Jiang Mingjun
Central Laboratory,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Jiangsu Key Laboratory of Molecular Biology for Skin Diseases and STIs,Nanjing 210042, China(Yang J,Li LM,Xu C,Long J,Yang XY,Jiang MJ);Life Sciences and Technology Base Class, Nanjing Agricultural University,Nanjing 210095,China(Wang Y)
Jiang Mingjun,Email:drmingjunjiang@163.com
Objective To evaluate the effects of lentivirus⁃delivered short hairpin RNA(shRNA)targeting human papillomavirus 16(HPV16)E7 gene on the expression of 4 kinds of DNA methyl⁃transferases(DNMTs),including DNMT1,DNMT3A,DNMT3B and DNMT3L,in HPV16⁃positive cervical cancer cell line SiHa.Methods The recombinant plasmid containing HPV16 E7 gene⁃targeting shRNA was constructed firstly.Then,the BLOCK⁃iTTM lentiviral RNAi expression system kit was used to package the lentiviral vector,which was transfected into 293T cells.The lentivirus⁃containing supernatants were collected at 48 and 72 hours after transfection.The SiHa cells were divided into 3 groups to be cultured with lentiviral supernatant containing HPV16 E7 gene⁃targeting shRNA recombinant plasmids mixed with complete medium at a ratio of 1∶1(shRNA group),lentiviral supernatant containing empty plasmids mixed with complete medium at a ratio of 1∶1(negative control group),and complete medium alone(blank control group),respectively.Real⁃time fluorescence⁃based quantitative PCR(qRT⁃PCR)was performed to measure mRNA expression of HPV16 E7 and 4 kinds of DNMTs in the above 3 groups at 0,48,96 hours after infection,and Western blot analysis to determine protein expression of the 4 DNMTs at 48,96 hours after infection.Results There were no significant differences in the mRNA expression of HPV16 E7 and the 4 DNMTs among the shRNA group,negative control group and blank control group at 0 hour after infection(all P>0.05).At 48,96 hours after infection,the mRNA expression of HPV16 E7 and the 4 DNMTs decreased significantly in the shRNA group compared with the negative control group and blank control group(all P<0.05),but did not differ between the negative control group and blank control group(all P>0.05).Additionally,E7,DNMT1,DNMT3A,DNMT3B and DNMT3L gene⁃silencing efficiencies in the shRNA group were 71.13%,50.53%,13.72%,46.27%and 17.92%at 48 hours,and 83.50%,74.2%, 47.8%,64.7%and 48.9%at 96 hours after infection,respectively.Western blot analysis showed that the protein expression of the 4 DNMTs significantly decreased in the shRNA group compared with the negative control group and blank control group at 48,96 hours after infection(all P<0.01).Moreover,the protein expression of DNMT1,DNMT3A,DNMT3B and DNMT3L in the shRNA group gradually decreased over time,and was inhibited by 84%,37.2%,59.8%and 49.3%at 48 hours respectively,and by 73.1%,68.7%, 55.5%and 65.5%at 96 hours after infection respectively.Conclusion Targeted silencing of E7 gene in HPV16⁃positive SiHa cells can interfere with the mRNA and protein expression of DNMT1,DNMT3A, DNMT3B and DNMT3L.
Human papillomavirus 16;Papillomavirus E7 proteins;RNA,small interfering;Methyl⁃transferases;Cell line,tumor
蒋明军,Email:drmingjunjiang@163.com
10.3760∕cma.j.issn.0412⁃4030.2017.02.002
国家自然科学基金(31470274);江苏省临床医学研究中心项目(BL2012003);中央级公益性科研院所基本科研业务费(2016RC310025)
Fund programs:National Natural Science Foundation of China(31470274);Clinical Research Center Program of Jiangsu Province(BL2012003);Special Fund for Basic Scientific Research Business of Central Public Research Institutes(2016RC310025)
2015⁃12⁃28)
(本文编辑:周良佳 颜艳)
