铈基复合氧化物催化剂在SiO2表面的失活机制
2017-11-01占林军孙晓燕朱秋莲陈银飞卢晗锋
占林军 孙晓燕 周 瑛 朱秋莲 陈银飞 卢晗锋
(浙江工业大学化学工程学院,杭州 310014)
铈基复合氧化物催化剂在SiO2表面的失活机制
占林军 孙晓燕 周 瑛*朱秋莲 陈银飞 卢晗锋
(浙江工业大学化学工程学院,杭州 310014)
以甲苯催化燃烧为模型反应,通过调节不同Cu-Mn-Ce (CMC)复合氧化物在多孔SiO2(KIT-6)上的负载量,研究了SiO2表面与CMC作用对催化剂物理化学性能的影响。发现低负载量下CMC氧化物出现明显失活现象,与SiO2接触会抑制氧化物活性相的形成,SiO2量的减少可使CMC复合氧化物活性得到逐步恢复。X射线衍射(XRD)、程序升温还原(H2-TPR)、N2吸附(BET)和透射电镜(HRTEM)等表征表明,SiO2不对CMC晶相结构产生影响,这种失活机制是由于SiO2表面的丰富羟基作用,导致表面氧化物高度分散,活性氧物种从晶格氧转变为表面氧。复合氧化物的晶格氧对催化燃烧起到关键性作用,通过焙烧去除SiO2表面羟基和减少SiO2用量,可使复合氧化物晶格氧的数量增加,恢复复合氧化物催化剂活性。
SiO2;Cu-Mn-Ce复合氧化物;失活;载体效应;催化燃烧
1 引 言
在氧化物材料中,SiO2可构造性最强,通过自组装技术,可以构建不同规整孔道结构的介孔材料1−3,如 MCM-414−7,SBA-158−10,KIT-611−13等。这些材料的合成为新型催化剂发展提供了强有力的推动力。尤其是一些难以合成介孔结构的活性金属氧化物材料14,可以以这些介孔SiO2作为硬模板剂,通过纳米铸造(Nanocasting)技术来合成高比表面积的规整的氧化物介孔材料,从而进一步提高比表面积和催化活性位的分散,并为反应物和产物分子提供扩散通道,提高氧化物催化剂的催化性能15−17。这个技术虽然得到相当广泛的应用,但也发现,在以SiO2为模板构筑过程中,需要把 SiO2模板通过碱液或 HF洗涤掉18,19。但多次洗涤总是会有SiO2残留20,21,这些残留的SiO2会对活性金属氧化物物理化学特性产生怎样的影响?目前还没有系统的研究。
另外许多文献认为,SiO2是相对较为惰性的载体,以高比表面积的介孔SiO2作为活性氧化物催化剂载体,使活性金属氧化物在表面充分暴露,是目前新型氧化物催化剂构筑方面的一个热点研究方向22−24。但我们前期研究发现,SiO2虽然惰性,但也会对表面活性氧化物组分结构产生特定的影响,尤其是铈基复合氧化物催化剂,在极低的负载量情况下,铈基氧化物催化剂会出现明显的失活现象25。而这种失活现象是怎样产生的,SiO2和铈基氧化物之间的作用机制如何?都需要进一步研究和探索。
而论文正是基于此,通过浸渍法制备了以KIT-6为载体的负载型 Cu-Mn-Ce复合氧化物(缩写为 CMC)催化剂并用碱液多次洗涤去除 SiO2,以甲苯催化燃烧为模型反应,考察SiO2对铈基复合氧化物催化特性影响,并利用 XRD,BET,HRTEM,H2-TPR等表征手段揭示SiO2和铈基氧化物之间的失活作用机制。
2 实验部分
2.1 催化剂的制备
将6 g P123溶解在217 g蒸馏水中,并加入11.8 g的36%的盐酸。在35 °C下,向溶液中加入6 g正丁醇,连续搅拌1 h;加入12.9 g正硅酸乙酯,在35 °C下搅拌24 h。将得到的混合溶液转入晶化釜中,在100 °C下水热晶化24 h后得到白色悬浮液,过滤,在100 °C 下干燥12 h,然后在550 °C下焙烧3 h,得到KIT-6介孔分子筛26,27。
负载型 Cu-Mn-Ce/KIT-6 (SiO2载体质量分数量分别为 79%,65%,34%)催化剂的制备采用浸渍法制备。以Cu、Mn和Ce的硝酸盐为原料,配制Cu/Mn/Ce物质的量之比为1 : 2 : 4混合溶液,再加入与总金属离子等物质量的柠檬酸,搅拌溶解成均一溶液。然后向溶液中加入一定量的KIT-6载体,室温搅拌12 h,在真空旋转蒸发仪中挥发水分,在100 °C下干燥12 h、研磨、500 °C焙烧3 h制得催化剂,标记为CMC/w%-KIT-6,w为载体量(%)。
SiO2的去除在70 °C,浓度为2 mol·L−1的NaOH溶液中进行,将制得的CMC/w%-KIT-6催化剂浸入NaOH溶液中搅拌洗涤N次(N = 1、2、3、4、5),每次洗涤30 min,去除不同质量的SiO2,之后过滤、去离子水洗涤3次、100 °C下干燥12 h后得到的催化剂,标记为 CMC/w%K-N,N为碱洗次数。
2.2 催化剂的表征
样品的晶相结构在荷兰 PNAlytical公司 Xʹ Pert Pro型X射线衍射仪(Ni滤波,Cu Kα辐射源)上测定,管电压为45 kV,管电流为40 mA,扫描范围 2θ = 10°−80°,步长为 0.02 (°)·s−1。
催化剂的织构性质(比表面积、孔体积和吸附脱附等温线)的测定采用低温(−196 °C)氮气吸附法,在Micromeritics公司的3Flex型表面性质分析仪测试。吸附测定前,样品先在250 °C脱气预处理6 h。
H2-TPR实验在衢州泛泰生产的FINESORB-3010E型化学吸附仪上进行。活性组分装填量为0.2 g,CuO作为标样。首先在Ar气氛下200 °C预处理1 h,冷却至100 °C,然后通入5% H2/Ar的还原气,催化剂在100 °C下吹扫20 min,再以 10 °C·min−1的速率升温至 750 °C,最后又通过Ar气吹扫降温,其中载气流速均为30 mL·min−1。热导检测器(TCD)检测,TCD 池温度为60 °C,TCD电流为60 mA。
样品的微观形貌采用荷兰Philips-FEI公司生产的Tecnai G2 F30 S-Twin 300 kV高分辨率透射电子显微镜观察,加速电压为30 kV。
2.3 催化剂的活性评价
催化剂活性测试在常压连续流动气固相反应装置上进行,石英反应管内径为6 mm,按照计算催化剂活性组分用量0.3 g,甲苯气体发生器置于冰水物(0 °C)中,甲苯进料浓度控制在 3000 mg·m−3。反应空速为 24000 mL·g−1·h−1。反应气氛为甲苯-空气混合气。反应尾气采用捷岛 GC1620色谱仪六通阀直接进样在线检测出口有机物浓度,FID检测器检测出口有机物浓度。
3 结果与讨论
3.1 SiO2对CMC复合氧化物活性影响
图1(a)是以KIT-6介孔分子筛为载体的CMC催化燃烧甲苯活性图,图中催化剂在测试时保持活性物质CMC反应空速不变(以CMC为重量基准来计算空速)。发现随着载体KIT-6用量增加,其活性出现显著下降,当载体量(SiO2含量)为 79%时,催化剂完全失活。这是一个非常有趣的实验现象。为进一步考察SiO2量的影响,通过NaOH碱洗方式,把三个 CMC/SiO2中SiO2溶解去除,每个催化剂都在2 mol·L−1的NaOH溶液中洗涤3次,得到的催化剂再次进行活性测试(见图 1(b)),发现当把SiO2去除后,其活性都得到了恢复。图1(c, d)中测试了 CMC/65%KIT-6催化剂碱洗次数和活性之间的关联,随着碱洗次数增加SiO2量的减少,催化剂活性得到逐步恢复,到第4、5次基本去除SiO2下,完全恢复单一CMC催化剂的活性。这充分表明,SiO2的存在抑制了CMC氧化物活性相的形成,导致催化剂失活。
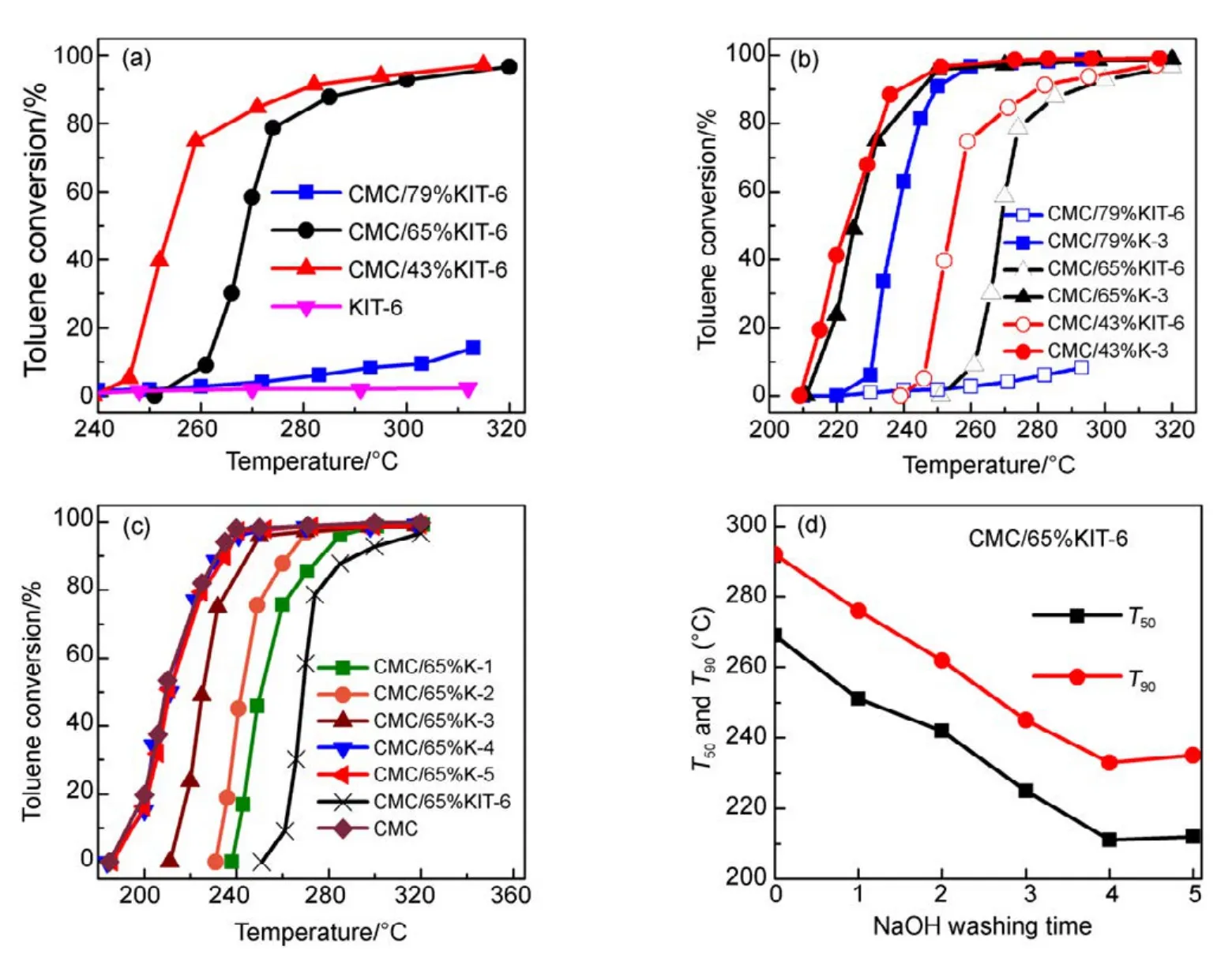
图1 KIT-6载体对CMC复合氧化物催化活性影响Fig.1 Effect of KIT-6 on catalytic activity of CMC catalysts.
同样,把CMC催化剂负载在同为SiO2基材的SBA-15和硅胶(silica)表面,测试了不同 CMC负载量催化剂的催化燃烧甲苯的特性(见图2),发现随着SiO2载体量增加,同样出现迅速失活的现象(图2(a, c))。采用70 °C NaOH碱洗三次,把SiO2去除掉,无论是硅胶还是SBA-15,其催化活性均得到一定程度的恢复。这说明只要是SiO2为基底的载体,均会导致铈基复合氧化物催化剂失活。
3.2 SiO2对复合氧化物物相织构影响
为进一步研究SiO2载体对CMC结构的影响,图3和表1给出了65%载体量的催化剂在不同碱洗次数后样品的XRD表征数据。发现经过1、3、5次减洗后,CMC催化剂主晶相仍为立方相的CeO2,催化剂的晶胞参数与纯的CeO2(0.5410 nm)相比均减小,晶粒大小和峰的强度均没有变化,文献28报道这是由于 Cu、Mn离子进入了 CeO2晶格中发生了同晶取代的结果,因为 Cu、Mn离子的半径(Cu2+:0.072 nm、Cu+:0.077 nm;Mn4+:0.056 nm、Mn3+:0.062 nm、Mn2+:0.080 nm)均小于Ce离子的半径(Ce4+:0.092 nm)。这说明碱洗后的催化剂仍然为铜锰铈的固溶体结构28,SiO2并没有改变 CMC复合氧化物的物相结构,CMC本征结构与载体SiO2量没有关系。
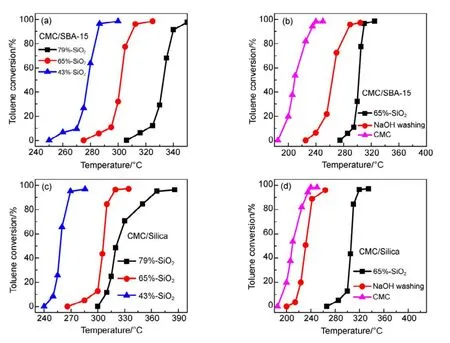
图2 SBA-15和硅胶载体对CMC复合氧化物催化活性影响Fig.2 Effect of SBA-15 and Silica on the catalytic activity of CMC catalysts.
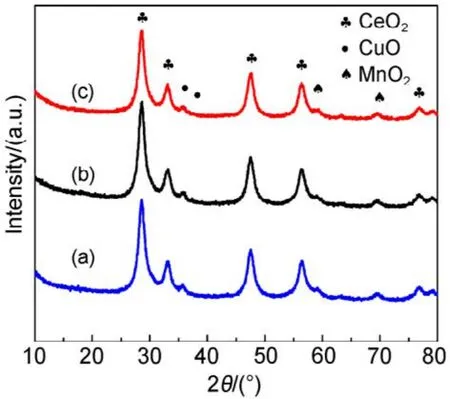
图3 不同碱洗次数的CMC/65%KIT-6催化剂XRD图谱Fig.3 XRD patterns of CMC/65%KIT-6 catalysts after NaOH washing.
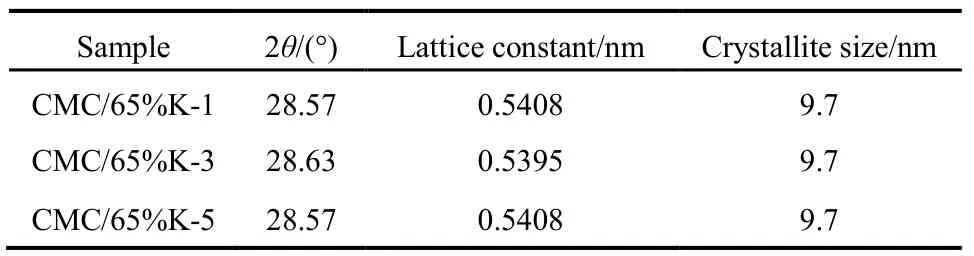
表1 不同碱洗次数的CMC/65%KIT-6催化剂的晶体结构Table 1 Crystal structure of CMC/65%KIT-6 catalysts.
图4(a)和图4(b)分别为KIT-6载体和不同碱洗次数的CMC/65%KIT-6催化剂的吸脱附等温线和孔径分布图。表 2为载体和不同碱洗次数的CMC/65%KIT-6催化剂的比表面积和孔容数据,通过碱洗后催化剂比表面积大幅度减小,表明CMC/65%KIT-6催化剂通过简单的碱洗基本除去了 KIT-6载体。但随着碱洗次数的增加,SiO2的含量继续减少,CMC/65%K-N催化剂的等温线基本没有变化,都属于第IV类型吸附等温线,具有H3型滞后环,介孔结构以及部分堆积孔结构,且催化剂的比表面积和孔容无明显变化,这表明微量SiO2对CMC复合氧化物的比表面积、孔容等织构性质没有大影响。
图5为不同碱洗次数的CMC/65%KIT-6催化剂的HRTEM电镜扫描图,由图可知,去除SiO2后的催化剂仍然具有CMC复合氧化物晶相结构,催化剂中主要成分仍然以CeO2晶相(d = 0.312 nm)和少量的CuOx(0.253 nm)和MnOx(0.187 nm)29组成。结合XRD表征,说明了Cu、Mn离子并没有全部进入CeO2晶格中,部分 Cu-Mn在催化剂表面形成了混合晶相结构。通过表面能谱分析,随着碱洗次数从1次增加到5次,催化剂中SiO2含量的均值由3.41%下降到1.22%,结果如图5(a−c)所示。由图5(d−f)可知,随着碱洗次数增加,SiO2含量减少,CMC复合氧化物相变为明显,碱洗5次后基本呈现复合氧化物混合晶相,这表明,SiO2不会改变CMC复合氧化物的晶相结构,通过碱洗去除SiO2后,CMC复合氧化物的活性位就会重新暴露出来,催化剂的活性得到恢复,这与甲苯催化燃烧的活性规律也是相一致的。
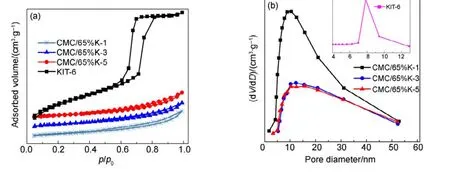
图4 不同碱洗次数的CMC/65%KIT-6催化剂及载体的N2吸脱附等温线和孔径分布图Fig.4 N2 adsorption-desorption isotherm and pore size distribution for CMC/65%KIT-6 catalysts after NaOH washing and KIT-6.

表2 不同碱洗次数CMC/65%KIT-6催化剂比表面积与孔结构Table 2 Surface area and pore characterization of CMC/65%KIT-6 catalysts after NaOH washing.

图5 不同碱洗次数的CMC/65%KIT-6催化剂的HRTEM图Fig.5 HRTEM images of CMC/65%KIT-6 catalysts with different treating times.
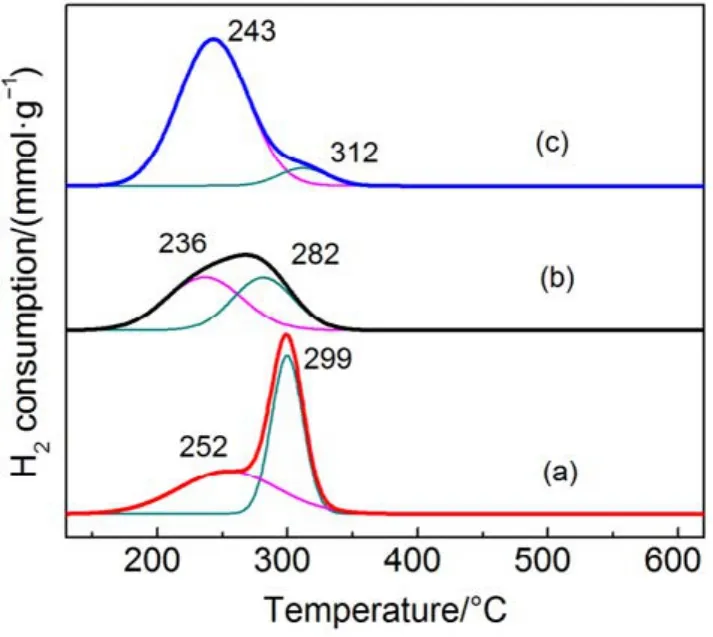
图6 不同催化剂的H2-TPR图谱Fig.6 H2-TPR profiles of different catalysts.
3.3 SiO2对催化剂氧化-还原性能的影响
图6为不同载体量催化剂的H2-TPR谱图,表 3为相应催化剂的还原峰的温度以及耗氢量,图中催化剂在测试时保持活性物质CMC量不变。由图6可知,当载体量从43%增加到79%,低温还原峰从252 °C偏移至243 °C,且低温还原峰面积逐渐增加,低温耗氢量从1.60 mmol·g−1增加至3.27 mmol·g−1,但催化剂的活性降低,根据文献30报道,催化剂的H2-TPR还原温度越低,其氧化还原性能越佳。但在这里却发现完全相反的结果,CMC/79%-KIT-6虽然具有更低的还原温度,并且其活性氧数量大,但催化活性却表现不佳,甚至出现明显的失活(见图 1(a))。而 CMC/43%-KIT-6高温还原峰面积大,低温还原峰面积小,却表现出高的活性。对于复合氧化物催化剂参与氧化还原反应,其活性氧起到整个氧化过程中关键性作用。一般我们把活性氧种类分成两个种类,一是表面活性氧,二是体相的晶格氧。从图 6分类,低温还原峰应为表面氧脱除,高温还原峰为体相的晶格氧脱除。因此,在SiO2载体含量大的催化剂中,复合氧化物高度分散,表面氧数量更多,而SiO2载体含量小的催化剂中,复合氧化物存在聚集,显示出更多的晶格氧数量。而这些晶格氧对整个催化完全氧化过程起到更为关键的作用。
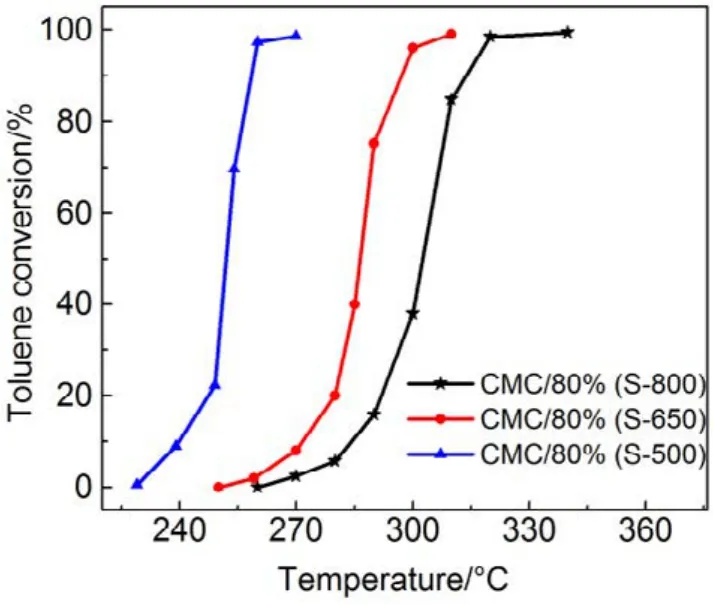
图7 CMC/80%(S-T)催化剂催化燃烧甲苯活性曲线Fig.7 Activity curves of toluene combustion over CMC/80%(S-T) catalysts.
3.4 SiO2载体效应机制验证
为了验证SiO2对催化剂的载体效应,我们将硅胶(SiO2)载体在500、650、800 °C下分别焙烧3 h (标记为 Silica-T,T为温度),以此来调节 SiO2比表面积大小和表面羟基数量,并把焙烧后的SiO2作为 CMC催化剂载体(标记为 CMC/80%(S-T),S为硅胶,T为温度),考察其催化燃烧甲苯特性,催化燃烧结果如图7所示,800 °C焙烧的硅胶负载催化剂活性要明显好于500 °C焙烧载体的催化剂活性。对样品进行BET分析(表4),发现焙烧温度由500 °C升高到800 °C,载体的比表面积和孔容有所下降,但变化不大。对样品进行H2-TPR表征(图8),发现800 °C焙烧的硅胶载体高温还原峰的峰面积更大。同时,对CMC/80%(S-500)和 CMC/80%(S-800)两个样品进行XPS表征(图9),O 1s结果如表5所示,从中可知,CMC/(80%S-800)催化剂中晶格的含量为0.22,CMC/80%(S-500)催化剂中晶格氧的含量为0.12,结果表明CMC/80%(S-800)催化剂中晶格氧物种含量更多。通过对硅胶进行TG表征(图10),以及硅胶高温焙烧前后的红外谱图(图 11),可以看出硅胶经过高温焙烧后,其表面的羟基大量减少。综合上述表征结果,可以发现硅胶载体经过高温焙烧后,消除载体表面的羟基,使CMC的分散度下降,提高催化剂体相中晶格氧的含量,与表面氧相比,晶格氧需在更高的温度被还原,因此其H2-TPR还原峰往高温移动。这充分说明羟基数量的减少,更有利于复合氧化物表面构建具有丰富晶格氧的活性相。由此说明,在复合氧化物催化甲苯燃烧中,复合氧化物中的晶格氧是至关重要的,SiO2表面丰富的羟基不利于催化剂的催化活性,会导致CMC复合氧化物高度分散在SiO2表面,使活性氧物种主要以表面氧物种形式存在,降低CMC复合氧化物的催化活性。
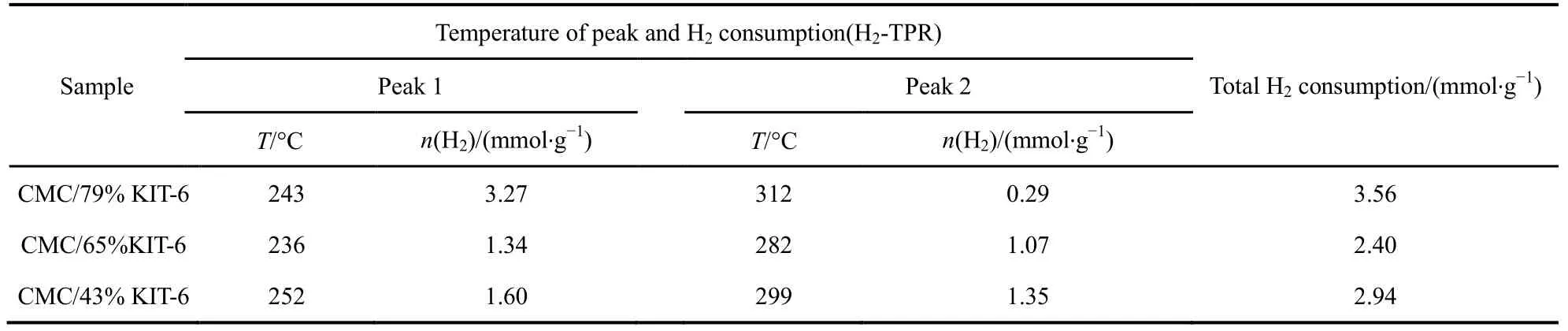
表3 不同载体量的催化剂的H2-TPRTable 3 H2-TPR of catalysts of different carrier weight.

表4 不同焙烧温度的硅胶及CMC/80%SiO2催化剂的比表面积和孔道表征Table 4 Specific surface area and pore characterization of silica and CMC/80%SiO2 catalysts.

表5 不同催化剂的的O 1s结合能Table 5 O 1s binding energies of different catalysts.
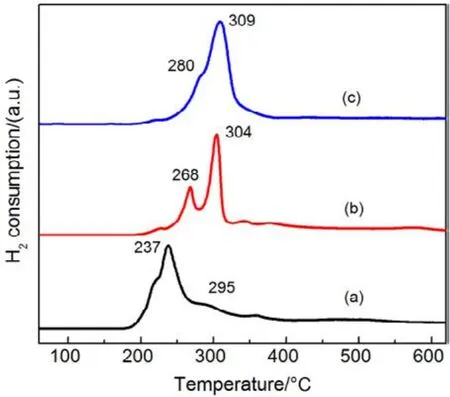
图8 CMC/ 80%( S-T)催化剂的H2-TPR图谱Fig.8 H2-TPR profiles of CMC/ 80%( S-T) catalysts.
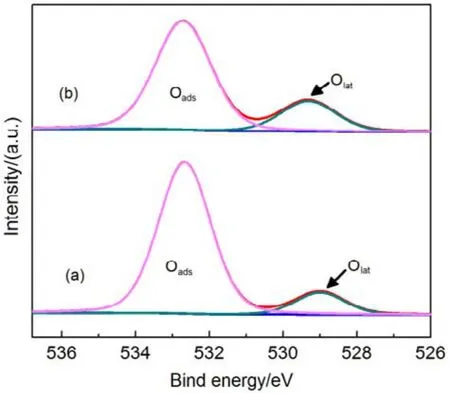
图9 CMC/ 80%( S-T)催化剂的XPS图谱Fig.9 XPS spetra of CMC/80%(S-T) catalysts.
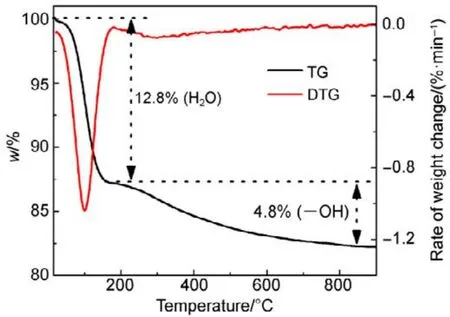
图10 硅胶的TG和DTG曲线图Fig.10 TG and DTG curves of silica.
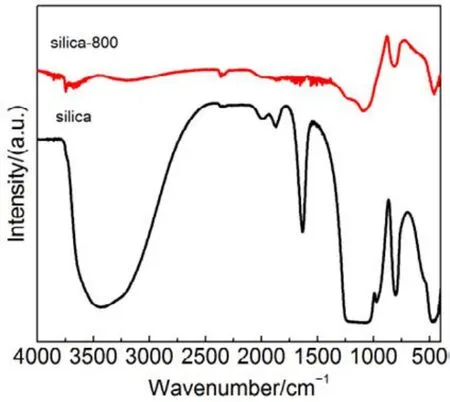
图11 高温焙烧后的硅胶的傅里叶变换红外光谱图Fig.11 FTIR spectra of silica gel after high temperature roasting.
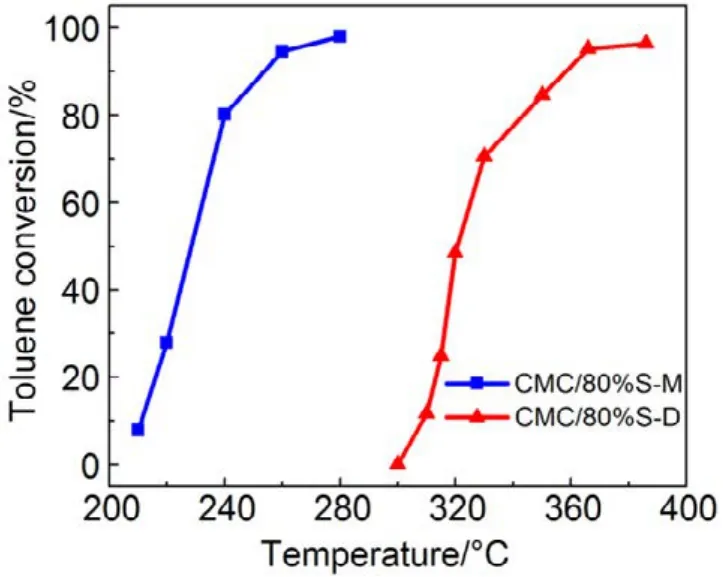
图12 机械混合和浸渍法制备催化剂催化燃烧甲苯Fig.12 Toluene combustion over catalysts prepared with different methods.
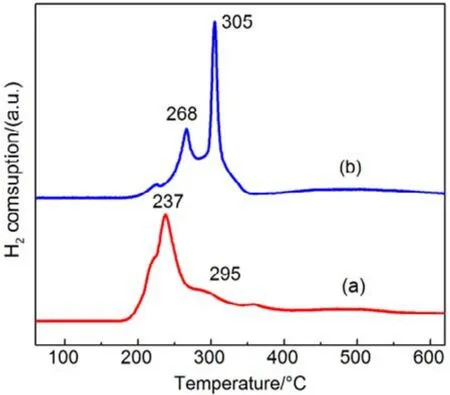
图13 机械混合和浸渍法制备催化剂H2-TPR图Fig.13 H2-TPR profiles of catalysts prepared with different methods.
同样,为进一步验证 SiO2表面羟基和高分散影响,我们把CMC复合氧化物与硅胶(SiO2)机械混合得到的催化剂,标记为 CMC/80%S-M,并将其与浸渍法制备的催化剂(标记为CMC/80%S-D)进行活性对比,结果如图12所示,采用机械混合法制备的负载型催化剂的活性有了很大的提升,甲苯完全燃烧由365 °C降低至260 °C,而其低温还原峰面积更小,高温还原峰面积更高,体相中的晶格氧含量更多,如图13所示,这与上文的结果都是相一致的。这进一步证明了 SiO2表面的羟基对复合氧化物活性的抑制作用,复合氧化物的高度分散反而会影响晶格氧生成,降低复合氧化物的催化活性。
4 结 论
铈基复合氧化物与载体或模板剂SiO2表面接触,并不会改变铈基复合氧化物催化剂的物理结构,但SiO2表面丰富的羟基会使低负载量的铈基氧化物在表面高度分散,导致复合氧化物晶格氧数量减少,表面氧数量增加,催化活性迅速下降。通过碱洗去除SiO2或高温焙烧去除SiO2表面羟基,都可以使负载的铈基复合氧化物保持丰富的晶格氧数量,恢复高的催化氧化活性。
(1) Mesa, M.; Sierra, L.; Patarin, J.; Guth, J. L. Solid State Sci. 2005, 7(8), 990. doi: 10.1016/j.solidstatesciences.2005.04.006
(2) Tsung, C. K.; Fan, J.; Zheng, N.; Shi, Q.; Forman, A. J.; Wang, J.;Stucky, G. D. Angew. Chem. Int. Ed. 2008, 47 (45), 8682.doi: 10.1002/anie.200802487
(3) Brezesinski, T.; Groenewolt, M.; Antonietti, M.; Smarsly, B. Angew.Chem. Int. Ed. 2006, 45 (5), 781. doi: 10.1002/anie.200502332
(4) Kresge, C. T.; Leonowicz, M. E.; Roth, W. J.; Vartuli, J. C.; Beck, J.S. Nature 1992, 359 (6397), 710. doi: 10.1038/359710a0
(5) Hammami, R.; Aissa, S. B.; Batis, H. Appl. Catal. A-Gen. 2009, 353(2), 145. doi: 10.1016/j.apcata.2010.05.048
(6) Beck, J. S.; Vartuli, J. C.; Schmitt, K. D.; Olson, D.H.; Sheppard, E.W.; McCullen, S. B.; Higgins, J. B.; Schlenker, J. L.; Roth, W. J.;Leonowica, M. E.; Kresge, C. T; Chu, C. T. W. J. Am. Chem. Soc.1992, 114 (27), 10834. doi: 10.1021/ja00053a020
(7) Ying, J. Y.; Mehnert, C. P.; Wong, M. S. Angew. Chem. Int. Ed.1999, 38 (1−2), 57. doi: 10.1002/(SICI)1521-3773(19990115)38:1/2<56::AID-ANIE56>3.0.CO;2-E
(8) Zhao, D.; Feng, J.; Huo, Q.; Melosh, N.; Fredrickson, G. H.;Chmelka, B. F.; Stucky, G. D. Science 1998, 279, 548. doi: 10.1126/science.279.5350.548
(9) Wang, Y. G.; Wang, Y. Q.; Liu, X. H.; Guo, Y.; Guo, Y. L.; Lu, G. Z.J. Nanosci. Nanotechno. 2009, 9 (2). 933.doi: 10.1166/jnn.2009.C057
(10) Asefa, T.; Lennox, R. B. Chem. Mater. 2005, 17 (10), 2481.doi: 10.1021/ cm047800j
(11) Kleitz, F.; Choi, S. H.; Ryoo, R. Chem. Commun. 2003, 9 (17), 2136.doi: 10.1039/b306504a
(12) Kleitz, F.; Liu, D.; Anilkumar, G. M.; Park, I. S.; Solovyov, L. A.;Shmakov, A. N.; Ryoo, R. J. Phys. Chem. B 2003, 107 (51), 14296.doi: 10.1021/jp036136b
(13) Ryoo, R.; Kim, J. M.; Ko, C. H.; Shin, C. H. J. Phys. Chem. 1996,100 (45), 17718. doi: 10.1021/jp9620835
(14) Dickinson, C.; Zhou, W.; Hodgkins, R. P.; Shi, Y.; Zhao, D.; He, H.Chem. Mater. 2006, 18 (13), 3088. doi: 10.1021/cm060014p
(15) Yue, X. L.; Liu, L.; Zhang, M.; Yang, M.; Dong, Y. L.; Cheng, M.J. Chinese J. Catal. 2009, 30 (2), 95. [岳响玲, 柳 林, 张 敏,董永来, 程谟杰. 催化学报, 2009, 30 (2), 95.]doi: 10.3321/j.issn:0253-9837.2009.02.005
(16) Zhu, J. J.; Xiao, D. H.; Li, J.; Yang, X. G. Catal. Lett. 2009, 129(1−2). 240. doi: 10.1007/s10562-008-9807-8
(17) Laha, S. C.; Ryoo, R. Chem. Commun. 2003, 9 (17), 2138.doi: 10.1039/b305524h
(18) Yang, H.; Zhao, D. J. Mater. Chem. 2005, 15 (12), 1217.doi: 10.1039/b414402c
(19) Wang, Y.; Yang, C. M.; Schmidt, W.; Spliethoff, B.; Bill, E.; Schüth,F. Adv. Mater. 2005, 17 (1), 53. doi: 10.1002/adma.200400777
(20) Jun, S.; Sang Hoon, J.; Ryoo, R.; Kruk, M.; Jaroniec, M.; Liu, Z.;Ohsuna, T.; Terasaki, O. J. Am. Chem. Soc. 2014, 122 (43), 10712.doi: 10.1021/ja002261e
(21) Fan, J. X.; Yang, S.; Qian, W.; Shi, F. T.; Huang, H. F. Chin. Med.J.-Peking 2016, 129 (7). 785.doi: 10.4103/0366-6999.178954
(22) Jermy, B. R.; Kim, S. Y.; Bineesh, K. V.; Selvaraj, M.; Park, D. W.Korean J. Chem. Eng. 2009, 26 (5), 1235.doi: 10.1007/s11814-009-0199-2
(23) Tüysüz, H.; Salabaş, E. L.; Weidenthaler, C.; Schüth, F. J. Am. Chem.Soc. 2008, 130 (1), 280. doi: 10.1021/ja075528j
(24) Mizoshita, N.; Tani, T.; Inagaki, S. Chem. Soc. Rev. 2011, 40 (2),789. doi: 10.1039/c0cs00010h
(25) Zhang, J.; Zhang, G.; Gao, Y.; Sun, R.; Wong, C. P. J. Mater. Sci.2016, 51 (17). 7966. doi: 10.1007/s10853-016-0066-6
(26) Kim, T. W.; Kleitz, F.; Paul, B.; Ryoo, R. J. Am. Chem. Soc. 2005,127 (20), 7601. doi: 10.1021/ja042601m
(27) Kleitz, F.; Bérubé, F.; Guillet-Nicolas, R.; Yang, C. M.; Thommes,M. J. Phys. Chem. C 2010, 114 (20), 9344. doi: 10.1021/jp909836v
(28) Lu, H.; Huang, J.; Zhou, Y.; Zhu, Q.; Chen, Y. CIESC Journal 2015,66 (6), 2105. [卢晗锋, 黄金星, 周 瑛, 朱秋莲, 陈银飞. 化工学报, 2015, 66 (6), 2105.] doi: 10.11949/j.issn.0438-1157.20141930
(29) Okumura, K.; Kobayashi, T.; Tanaka, H.; Niwa, M. Appl. Catal.B-Environ. 2003, 44 (4), 325. doi: 10.1016/s0926-3373(03)00101-2
(30) Tang, W.; Wu, X.; Li, S.; Shan, X.; Liu, G.; Chen, Y. Appl. Catal.B-Environ. 2015, 162, 110. doi: 10.1016/j. apcatb.2014.06.030
Deactivation Mechanism of CeO2-Based Mixed Oxide Catalysts Supported on SiO2
ZHAN Lin-Jun SUN Xiao-Yan ZHOU Ying*ZHU Qiu-Lian CHEN Yin-Fei LU Han-Feng
(College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, P. R. China)
Here we reported the effect of the Cu-Mn-Ce-SiO2(CMC-SiO2) interaction on the physical and chemical aspects of the catalytic combustion of toluene by adjusting the loading amount of the CMC mixed oxide on SiO2. Notably, the CMC/KIT-6 catalyst with low CMC loading performed poorly with an obvious deactivation, owing to the inhibition of the metal oxides active sites, while the activity recovered after washing away some SiO2. The catalysts were characterized by X-ray diffraction (XRD), H2temperature-programmed reduction (H2-TPR), N2adsorption, and high-resolution transmission electron microscopy (HRTEM). Although there is no change in crystal structure after loading on SiO2, active oxygen species immigrate from lattice to surface for SiO2surface rich in hydroxyl groups and having high dispersion of CMC, leading to deactivation of the CMC catalyst. However, it is worth mentioning that the lattice oxygen played a key role in catalytic combustion. The activity of the CMC catalyst recovered when the quantity of lattice oxygen increased upon removing surface ―OH groups by calcination or removing some SiO2by alkali washing.
SiO2; Cu-Mn-Ce mixed oxide; Deactivation; Supporting effect; Catalytic combustion
January 13, 2017; Revised: March 10, 2017; Published online: March 31, 2017.
O643
10.3866/PKU.WHXB201703312 www.whxb.pku.edu.cn
*Corresponding author. Email: wifx@zjut.edu.cn; Tel: +86-571-88320767.
The project was supported by the National Natural Science Foundation of China (21506194, 21676255), and Natural Science Foundation of Zhejiang Province, China (Y14E080008, Y16B070025).
国家自然科学基金(21506194, 21676255)和浙江省自然科学基金(Y14E080008, Y16B070025)资助项目
© Editorial office of Acta Physico-Chimica Sinica
