金纳米棒
——从可控制备与修饰到纳米生物学与生物医学应用
2017-11-01胡雪娇高冠斌张明曦
胡雪娇 高冠斌 张明曦
(武汉理工大学,材料复合新技术国家重点实验室,武汉 430070)
金纳米棒
——从可控制备与修饰到纳米生物学与生物医学应用
胡雪娇 高冠斌*张明曦*
(武汉理工大学,材料复合新技术国家重点实验室,武汉 430070)
金纳米棒因其独特的光学活性(纵向和横向两个等离子体共振吸收峰, 可调范围从可见光区到近红外区)、长径比可调,表面易于修饰,生物相容性良好而使得其在纳米生物学和生物医学等领域具有广泛的应用前景。金纳米棒的合成及表面修饰直接决定着其物理化学性质,进而影响其生物相容性及其在生物医学中的应用。本文综述了金纳米棒的可控制备方法(包括模板法、电化学法、光化学法和晶种法)、表面可控修饰方法及其在纳米生物学和生物医学中的应用新进展,重点总结了金纳米棒的表面可控修饰及其在分子探针、生物传感、生物成像、药物载体、基因载体和光热疗法的最新研究进展。最后针对金纳米棒在生物应用过程中的一些瓶颈问题(如:特异性识别能力需要增强和荧光量子产率尚待提高等)提出了将手性分子或智能聚合物引入到金纳米棒表面进行可控修饰,以期增强其特异性识别能力并提高荧光量子产率,为金纳米棒的发展提供了新的思路。
金纳米棒;可控制备;可控修饰;纳米生物学应用;生物医学应用
1 引 言
金纳米材料因其独特的表面等离子体共振效应、介电限域效应、小尺寸效应、量子隧道效应和光学效应等特殊效应1−3而使其产生电化学特性、吸附特性、荧光特性、超分子和分子识别等特性。并因此被广泛应用于光电子学、催化、信息存储、生物标记、生物传感和表面增强拉曼等领域2−8。对金纳米材料的研究,包括制备、性质和应用等一直都是材料科学的热点。随着技术的发展,研究者们已经制备出多种形貌各异的金纳米材料9,10,包括金纳米球、金纳米星、金纳米立方、金纳米线、金纳米棒等。
在这些形貌各异的金纳米材料中,金纳米棒的研究最为广泛深入。这是由于金纳米棒(gold nanorod,AuNRs/GNRs)制备简单(如种子法11,12)、产率高13(可达 97%)、长径比(aspect ratio,AR)可调(AR在1.5−20之间)14−17,且具有独特的荧光性质2,4,18。因此金纳米棒在纳米生物学和生物医学领域具有广阔的应用前景。本文综述了金纳米棒的可控合成方法(包括模板法、电化学法、光化学法和晶种法等),可控表面修饰方法(包括配体置换法、无机物包覆法和多级修饰法等)及其在纳米生物学(包括分子探针、生物传感和生物成像等)及生物医学(包括药物载体、基因载体和光热治疗等)方面的最新应用。

2 金纳米棒的可控制备
自1994年,Martin等19首次用模板法制备出金纳米棒,经过近几十年的发展,AuNRs已经发展出多种合成方法,其中可以较好地控制金纳米棒长径比的制备方法主要有以下四种:模板法19,电化学方法20,光化学方法21以及晶种生长方法22等。现简要介绍如下:
2.1 模板法
模板法主要是利用多孔氧化铝薄膜的孔道,在孔道内将金原子还原让其受限沉积直至填满孔道,然后用氢氧化钠溶解掉氧化铝薄膜并再用超声得到分散性较好的AuNRs。1994年,Martin等19首次使用模板法合成出AuNRs。他们通过电化学沉积将 Au3+还原并沉积到多孔氧化铝薄膜的孔道内,然后溶解掉多孔氧化铝薄膜(模板)并去除反应过程中产生的杂质即得到AuNRs。在用模板法合成AuNRs的过程中,AuNRs的生长受到模板孔径束缚,故而模板孔的尺寸直接决定了 AuNRs的直径和长度,因此可以用不同的模板合成尺寸不同的AuNRs。模板法的优点是 AuNRs的长径比可以通过孔径大小、孔道长度、电化学沉积时间来调控。
2.2 电化学法
1997年,电化学法首次被Wang等20用来制备AuNRs,在该方法中用到了两种表面活性剂:十六烷基三甲基溴化铵(CTAB)和四辛基溴化铵(TCAB)。
Wang等人构建了一个电解池,电解液为CTAB和TCAB,阴阳二极分别为铂片和金片,在超声的情况下电解。阳极的金原子失去电子变成金离子进入溶液中,溶液中金离子一部分被CTAB还原成中间体,另一部分在阳极的铂片处得到电子被还原成金单质,在超声的作用下,CTAB修饰的中间体在电解质溶液与铂片界面上包裹阳极还原的金单质形成金纳米棒。其中,CTAB不仅可以防止金纳米粒子聚沉,而且还可以充当电解质。而TCAB同样可以诱导形成AuNRs。AuNRs的长径比可通过CTAB和TCAB的比例来控制。电化学法的优点是AuNRs的形貌易控且尺寸均匀。


2.3 光化学法
2002年,Franklin Kim等21率先采用光化学法来制备 AuNRs。该法首先准备 CTAB,四十二烷基胺和氯金酸(HAuCl4)模板剂水溶液体系,然后将适量丙酮和环己胺加入上述水溶液体系中,可使胶束结构散开,有利于形成AuNRs。然后再加适量硝酸银(AgNO3)溶液,用紫外照射(254 nm)整个水溶液体系约30 h,在这个过程中利用紫外诱导激发,所制备的AuNRs分散性好,长径比均匀。并且观察到 Ag+的量越多,AuNRs的长径比越大,而不加入 Ag+则不能生成 AuNRs。因此光化学法制备的AuNRs的长径比可通过Ag+的量来调节。
2.4 晶种法
2001年 Murthy等22首次采用晶种法来制备AuNRs,该方法对环境和设备的要求低,制备过程简单。Murphy课题组起初是在制备金纳米粒子(AuNPs)时引入“seed”的概念,在CTAB溶液体系下研究尺寸可控的AuNPs。他们利用NaBH4制备出晶种,也就是尺寸较小的胶体金。然后将晶种加入到生长液中,生长液含弱还原剂和金属盐可避免二次成核。因此,反应只能在晶种表面进行,这种方法制备的AuNPs尺寸均一23。而且该课题组已能成功调控尺寸在5−40 nm的AuNPs。后来,Murphy课题组将晶种法引入到金纳米棒的制备,得到不同长径比的 AuNRs24。为提高金纳米棒的产率,他们向反应液中加入银离子溶液,但其产率仍然只有40%−50%22。2003年,El-Sayed课题组采用改进的晶种法制备出长径比小于 5的金纳米棒,其产率达 95%以上,他们主要调整了种子和银的比例,并去掉反应液中的丙酮。该方法可用于大批量制备金纳米棒16。此后金纳米棒的制备方法大多以此为基础,进行微量调整。据报道,目前有一种改进的晶种法来合成AuNRs,即:通过向对苯二酚(HQ)还原剂溶液中添加水杨酸(SA),可以制得 LSPR峰值波长更大(最高达到1273 nm),长径比更大且单分散性更好的金纳米棒25−29。总的来说,近十多年来金纳米棒的种子合成法主要有两大类:一类是Murphy课题组提出的“三步”晶种法;另一类是El-Sayed16课题组提出的“一步”银离子介导晶种法30。晶种法经过持续的改进,目前已发展成为广泛使用的制备金纳米棒的方法。
3 金纳米棒的可控修饰
金纳米棒表面必须修饰一定数量的配体才能稳定存在,如果缺少表面配体,金纳米棒将发生不可逆转的聚集。CTAB是金纳米棒上最为常见的表面配体,然而 He等31报道在 AuNRs溶液中的CTAB具有高毒性,吸附在AuNRs表面的CTAB会干扰生物过程,阻碍AuNRs与生物分子的偶联32。因此发展不同配体修饰的金纳米棒,即对金纳米棒表面改性,对于扩展金纳米棒在纳米生物学和生物医学中的应用有重要的意义。
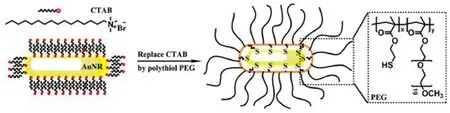
图1 用PEG基共聚物置换AuNRs表面的CTAB的示意图Fig.1 Schematic representation of surface modification of CTAB capped AuNRs with polythiol PEG based copolymer.
3.1 AuNRs的修饰方法
3.1.1 配体置换法
配体置换法是用配体将金纳米棒表面的CTAB置换出来的一种方法,如 Shobhit小组33使用壳聚糖置换CTAB制成探针,可用于无创成像。Liu等34用聚乙二醇(PEG)替换金纳米棒表面的CTAB,制成一种有效的近红外光热剂(如图1),能消融体内肿瘤。常贯儒课题组35通过配体置换法制备出两性离子半胱氨酸修饰的金纳米棒(Cys-AuNRs)。L-半胱氨酸(Cysteine,Cys)是生命体中二十种天然 α-氨基酸之一,其可以通过分子中的巯基与金原子形成金硫键(Au―S)而被修饰到AuNRs表面,金硫键是一种较强的配位键,其稳定性远大于 CTAB与Au原子之间的相互作用力。因此将L-半胱氨酸与CTAB修饰的金纳米棒混合溶液在剧烈搅拌的条件下经过一段时间的配体交换,L-半胱氨酸可充分置换 AuNRs表面的CTAB。这种通过配体置换的方法得到的半胱氨酸修饰的AuNRs不仅可以保留原有的长径比,而且其细胞毒性降低,生物相容性得以提高。更重要的是,由于含巯基的分子非常多,例如:十二硫醇、巯基丙酸、氨基硫醇、半胱氨酸衍生物、含半胱氨酸的二肽、三肽及多肽等,这些化合物未来都可以根据实际需要通过这种配体置换的方法修饰到不同长径比的金纳米棒表面,这将极大的拓展金纳米棒的应用范围。
3.1.2 无机物包覆
为了提高金纳米棒的稳定性,使用无机材料如四氧化三铁(Fe3O4)、氧化亚铜(Cu2O)和二氧化硅(SiO2)等包覆金纳米棒是一种比较好的解决方案。其中SiO2包覆法因其良好的水溶性和生物相容性以及表面易修饰等优点而得到广泛使用。
Rothberg课题组36首先使用 Nikoobakht和El-Sayed16所报道的种子生长法合成金纳米棒,然后通过聚电解质在金纳米棒的表面层层组装,再由原硅酸四乙酯(TEOS)的水解和缩合而制得二氧化硅包裹的金纳米棒(AuNRs@SiO2)。在此过程中,主要是通过静电作用将聚苯乙烯磺酸钠(PSS)、聚烯丙胺盐酸盐(PAH)、聚乙烯吡咯烷酮(PVP)等聚电解质分子逐层组装在AuNRs的表面,随后通过调节TEOS的用量来控制AuNRs表面包覆的SiO2厚度。透射电镜显示AuNRs表面包覆了厚度均匀的SiO2层,形成了明显核-壳结构(图2)。孙宏浩等37的紫外图谱显示 AuNRs在 SiO2包覆前后均有可见强吸收峰,表明SiO2包覆后的金纳米棒的光学性质没有改变。Gao等38报道AuNRs@SiO2的细胞毒性相比 CTAB修饰的AuNRs明显降低,这些都表明AuNRs@SiO2在生物医学领域有着良好的应用前景。包裹有SiO2的AuNRs如图2b所示。
3.1.3 多级修饰
多级修饰就是在已经过修饰的金纳米棒的表面继续修饰的一种方法。Hyejin等39首先将巯基吡啶连接在AUNRs表面,然后用聚4-苯乙烯磺酸钠对其进行处理使其表面带负电,接着通过静电相互作用将免疫球蛋白修饰到AUNRs表面,制成功能化的纳米探针,用于癌细胞表面膜的高灵敏的特定标记和成像。佟倜等40通过在包覆了金纳米棒的介孔硅表面修饰生物相容性的透明质酸,得到了具有肿瘤靶向性的多功能药物载体,表现出对肿瘤细胞特异性杀伤作用,有望解决化疗带来的副作用以及耐药性。Gao等38首先应用种子生长法合成出长径比为3.5的同质AuNRs (40 ± 5)nm,然后由溶胶-凝胶的方法成功地合成 SiO2包覆的 AuNRs核壳结构。AuNRs@SiO2-NH2和AuNRs@SiO2-FA是通过在 AuNRs@SiO2表面分别修饰氨基和叶酸制得的,如图 3所示。AuNRs@SiO2首先由氧等离子体净化处理。接下来,净化过的AuNRs@SiO2在混有氨丙基三甲氧基硅烷(APTS)的无水乙醇里再分散放置24 h。然后,将混合物放置在80 °C的烤箱反应2 h,以维持官能团的稳定。在60 °C的真空干燥箱干燥3 h后得到中间产物(GNRs@SiO2-NH2)。接下来,将AuNRs@SiO2-NH2加到三乙胺(TEA)和n[β-maleimidopropyloxy]琥珀酰亚胺酯(BMPS)中孵化30 min。洗涤干燥后,将底物加到叶酸半胱氨酸中反应 2−3 h,改性后就制得AuNRs@SiO2-FA。然后用声波和离心法收集AuNRs@SiO2-FA样本。

图2 (a) CTAB包覆的金纳米棒(b) SiO2包覆的金纳米棒透射电镜图Fig.2 Transmission electron micrographs of (a) CTAB-coated gold nanorods and (b) silica-capped gold nanorods.
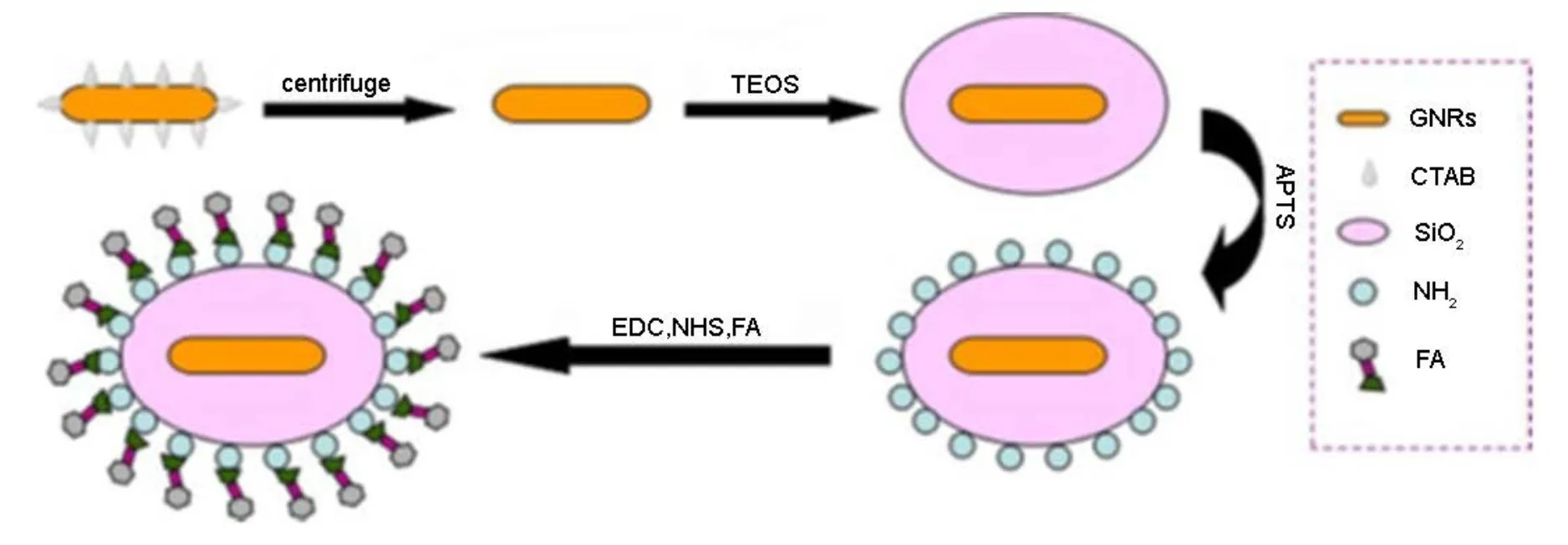
图3 AuNRs@SiO2-FA的合成过程Fig.3 Procedure for the synthesis of AuNRs@SiO2-FA.
3.2 AuNRs的表面可控修饰
AuNRs常用双层CTAB作表面活性剂稳定存在水溶液中43−45。金纳米棒两端的 CTAB密度比侧面低,允许一些分子(如硫醇)在低浓度下选择性取代金纳米棒两端的CTAB46,还可以通过控制条件在金纳米棒的侧面进行选择性修饰。
Wang等46通过控制不同配体加入时间及浓度来选择性修饰金纳米棒的两端和侧面。起始时金纳米棒在水溶液中和CTAB双分子层稳定存在(图4a)48,49由于金纳米棒两端曲率半径较大,两端连有的CTAB双分子层少于端面50,51。原硅酸四乙酯(TEOS)的水解形成硅涂层。在路线1中,由于二氧化硅涂层动态可控,硅可以选择性地包覆在金纳米棒的两端(图4b),这是因为在金纳米棒的两端CTAB比较少,二氧化硅涂层只需要很少的能量就可以把两端的CTAB分子移除。继续加金盐,随后金属就会在端面过度生长,形成两端修饰有二氧化硅的金纳米棒。在路线2中,金纳米棒的侧面包覆的是二氧化硅涂层。这种方法首先运用路线1中的方法将甲氧基聚乙二醇巯基(mPEG-SH)修饰到金纳米棒的两端,后续硅涂层选择性地修饰在金纳米棒的侧面。在阻止金属过度生长方面,硅涂层比mPEG-SH更强,在继续加金盐的条件下,金选择性地沉积在金纳米棒的两端,就形成端面修饰有二氧化硅的金纳米棒。
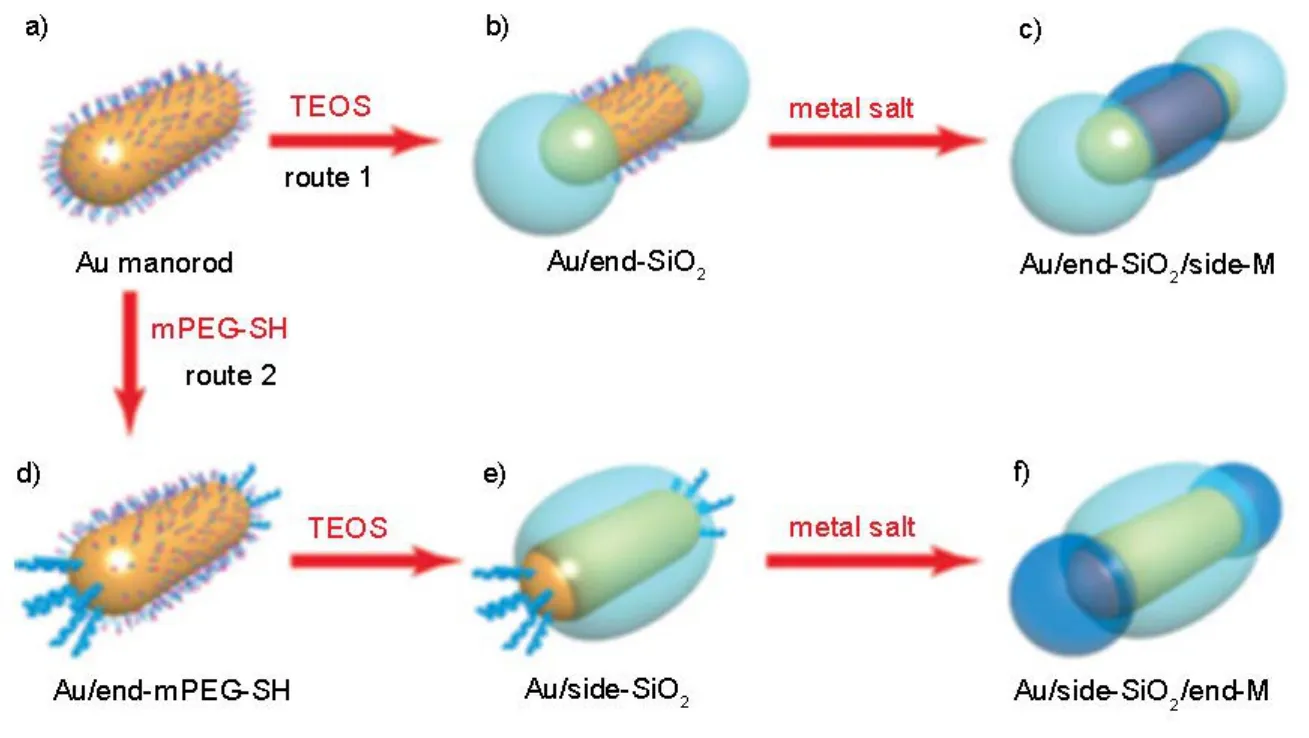
图4 两端和中间分别修饰有硅的金纳米棒Fig.4 Nanorod coated with silica at the ends or on the side surface.
这些两端或中间修饰有基团或聚合物的金纳米棒还可以通过分子间特殊的相互作用组装成有序的纳米结构,比如end-to-end,side-by-side,甚至可以组装成更高级的结构,实现多维组装体。在某些方面,这些组装成的结构比单个金纳米棒性能更优,其性质是所有金纳米棒之间光性质的加和,表现出更加优异的协同性质,扩大了金纳米棒的使用范围。
4 在纳米生物学中的应用
AuNRs因其独特的光学活性,使其在分子探针、生物传感和细胞成像等纳米生物学领域有着广泛应用。
4.1 分子探针
AuNRs分子探针灵敏度较高,不同长径比的AuNRs分子探针可将其表面微弱的折射率的变化转化成可测量的波长偏移,对待测物的检测极限可低至纳摩尔级。胡家文课题组52将对巯基苯甲酸(MBA)连接在AuNRs表面,制成表面增强拉曼散射(SERS)标记的AuNRs探针,进行SERS免疫检测研究,由于AuNRs的SPR峰位置可调,可通过激发光和SPR的共同作用来提高SERS信号,从而增强 SERS探针的灵敏度。Luong等53开发出一种新的用于DNA杂交的金纳米棒灵敏探针,这种生物传感器用于DNA杂交的浓度更低,而且反应也更快。Ye等54使用基于光度计和金纳米探针的金属波导毛细管(MWC)高度灵敏检测凝血酶,金纳米棒作为信号传输探针,图 5为基于光度计的MWC原理图。Ye课题组采用7 cm长的MWC,将最有可能的检测极限提高了 68倍,以致低如0.02 nm的凝血酶也可被检测到。此外,可通过流动注射模式减少样品注射体积等方法提高分析性能。该课题组使用的光度计简便且成本低,在生命科学和环境监测跟踪分析方面可广泛应用,它可能对生物发现过程的细胞和分子水平有巨大的影响。

图5 基于光度计的MWC原理图Fig.5 Schematic diagram of the MWC based photometer.
4.2 生物传感
AuNRs因其独特的表面等离子体共振特性,对溶液环境中的电介质非常敏感,AuNRs周围电解质的微小改变会引起局部折射率的改变进而导致AuNRs等离子体共振频率的改变,而这种改变可通过紫外吸收光谱检测到,故而可利用这种特性将AuNRs用于生物传感。何鑫等55利用金硫键构建了固相金纳米棒免疫传感器,其能够通过表面等离子共振波峰的移动来检测不同感染周期的日本血吸虫循环抗原,并分析宿主体内抗体的消长变化。Jie等56用巯基十一烷酸(MUA)修饰金纳米棒制成无标记的局部表面等离子体共振的生物传感器,基于人类免疫球蛋白检测反人类免疫球蛋白,并且可检测到0.4 nmol·L−1的极限,可用于医学,化学和生物化学等领域。
有数据显示,在发展中国家和发达地区乳腺癌仍是女性最常见的癌症57。目前正在大量研究乳腺癌的早期诊断和治疗方法58。在2003年,美国国家综合癌症网确定穿刺活检(NB)作为“首选”(一个手术切除乳房诊断)方案59,60。虽然NB拥有无痛、廉价和简单的优势,但提取分析样本需要大量的手术经验,严重限制了其应用61,62。
AuNRs可用于生物传感器检测人类乳腺癌MCF-7细胞。Li等63将金纳米棒修饰后用于来检测乳腺癌(图6)。因AuNRs具有独特的光学性质,可通过控制他们的形态,从可见到近红外区方便地调节纵向等离子共振峰。由于近红外(NIR)窗口的存在,AuNRs视为成像或体内治疗潜在候选者,可达到深层渗透到软组织的目的,更不要说细胞,这是Li等63目前的研究设计。已报道的夏团队之前的工作提供了进一步的证据,金纳米结构的LSPR属性不会干扰细胞64。Li等63的假设结合了寡核苷酸适配子和金纳米棒的优点,这个优点在MCF-7细胞的检测可能蕴含着巨大的希望。据报道,粘蛋白-1蛋白(MUC-1)作为人类癌症生物标志物,广泛存在肿瘤细胞的表面,如乳腺癌、卵巢癌、肺癌和胰腺癌等,特别是初级和转移性乳腺癌的特殊标志65。
2016年,Li小组63发现人类乳腺癌 MCF-7细胞上的MUC-1与寡核苷酸低聚糖4-16(5ʹ-GCA GTT GAT CCT TTG GAT ACC CTG G-3ʹ)之间存在特定的相互作用,而这种相互作用是可以被检测到的。Li等63通过Au―S化学键将寡核苷酸低聚糖共价结合到AuNRs的表面,用来检测乳腺癌细胞表面的 MUC-1,如图 6,从检测结果可以直接看到AuNRs的局部表面等离子体共振(LSPR),根据 MUC-1与寡核苷酸低聚糖之间特殊的相互作用可以检测乳腺癌。总之,一种MUC-1适配子功能化的 AuNRs被开发和应用于人类乳腺癌MCF-7细胞的检测。这种方法灵敏度高,稳定性好,操作简单,成本低,并且这种生物传感器可能阐明人类乳腺癌在早期临床诊断中的应用,相信随着医学技术的发展,这种生物传感技术可能应用于乳腺癌的主要诊断和治疗,尤其是在 NB的应用上。
4.3 生物成像
AuNRs由于强的吸收信号,LSPR可调,无光漂白现象等能够进行多功能成像技术,可精确地预测和诊断疾病。LSPR效应可使AuNRs表面的电场增强,再加上AuNRs之间的耦合电场强度,可得到远大于入射光电场的电磁场(如表面增强荧光、表面增强吸收、表面增强瑞利散射和SERS等),通过提取增强的电磁场信号,可进行成像与分析检测66。
Luo等67提出用硅包覆的吲哚菁绿色嵌入式的金纳米棒进行双模式CT和近红外荧光成像。12小时瘤内后注射1.5 mg·mL−1的金纳米棒改性液200 mL,CT扫描显示,该方法可增强成像质量尤其是可提高对比度,而染料产生的近红外荧光仍然存在。因此,金纳米棒具有发展成为一种双模式成像染色剂的潜力。Zhang等68首先用种子生长法合成金纳米棒,然后将硫醇盐甲氧基聚乙二醇(MeO-PEG-SH)和SiO2连接在AuNRs表面,用于细胞的多光子荧光成像,在生物成像方面的潜在应用可进一步探索,Joshi等69首先用甲氧基聚乙二醇巯基(mPEG-SH)替换AuNRs表面的CTAB双分子层,然后使用配体交换法用硫醇盐抗体分子置换mPEG-SH,再经过大多数抗体的交联,二硫酚使抗体直接连接在金表面,如图7所示,这种方法形成的生物轭合物既没有聚合也无细胞毒性,合成的连有抗体的AuNRs轭合物可用于癌症细胞培养模型里表皮生长因子受体(EGFR)分子的特定光学与光声成像,在肿瘤成像方面具有潜在应用价值。
5 在生物医学中的应用
AuNRs因其独特的光学活性和良好的生物相容性,使其在药物载体、基因载体、光热疗法等生物医学领域有着广泛应用。
5.1 药物载体
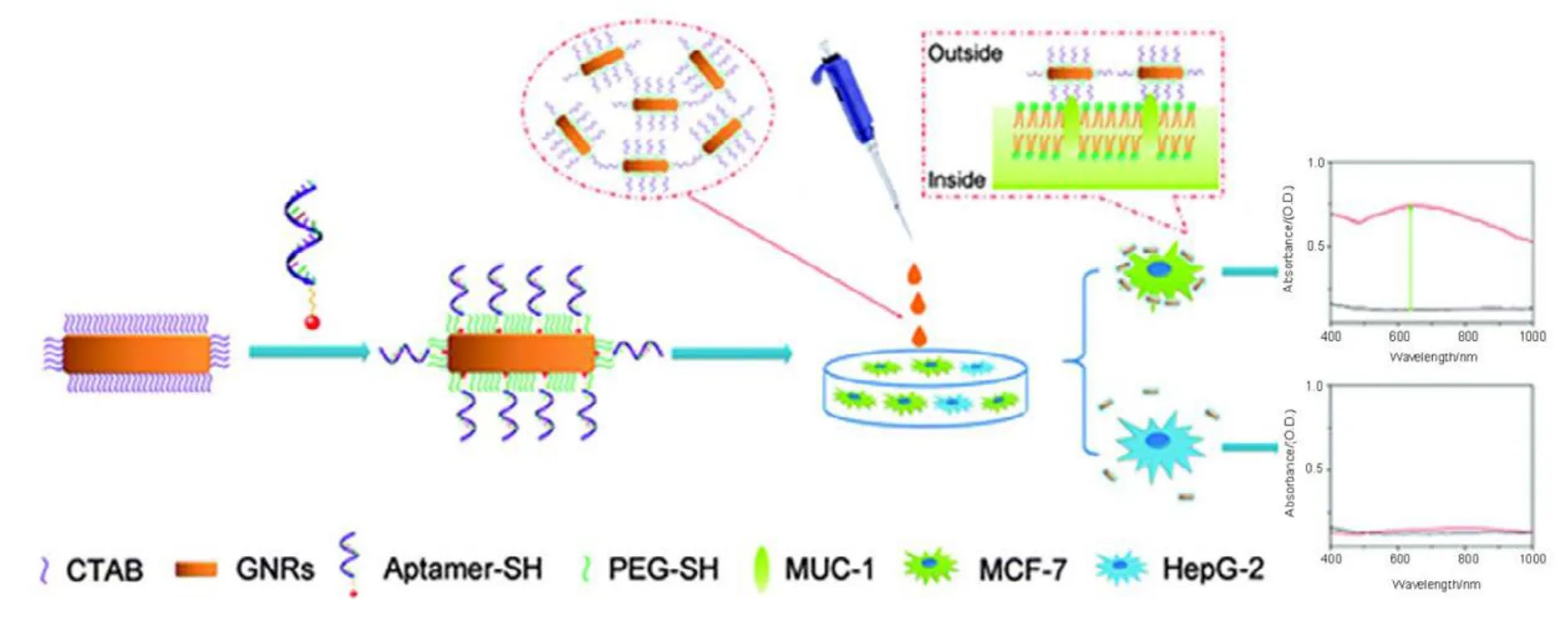
图6 检测机制的示意图Fig.6 Schematic representation of the detection mechanism.
药物控释体系因其用药量少、治疗效果好、副作用小的优势已成为药剂学的研究热点,具有控制药物释放的特点。如今,纳米载药系统越来越受到研究者的青睐。研究表明,可用物理吸附或化学键的方法将药物装载于AuNRs的表面,纳米粒子所产热量既能使周围环境变化,又能使药物释放,使药物能够进入细胞内部70−73。用近红外激光照射时,可使AuNRs产生表面等离子共振特性和光热效应,从而达到远程光控运载和释放药物的目的。
Park等74制备了一个可以生物相容性的药物载体:微型有机凝胶通过使用植物油和自组装凝胶因子纤维乳化制得。氟比洛芬封装在金纳米棒的微型有机凝胶里可缓慢释放,当用近红外荧光照射时,金纳米棒周围温度升高,凝胶转换为液体,释放加速,这种系统可有效地用于多功能按需给药体系。Ali等75将AuNRs与利福平(RF)共轭连接制成一个载药体系治疗结核病,其实验结果表明AuNRs@RF有望在保证宿主细胞安全的情况下有效攻击和杀死结核。
在过去的十年中,许多研究表明金纳米棒在等离激元光热治疗(PPTT)中应用广泛,特别是PPTT在抗击癌症方面有巨大的应用前景76−78。与金纳米粒子相比,PPTT应用AuNRs独特的物理化学特性78−80,即:AuNRs能吸收近红外光并通过非放射过程(包括电子与电子和电子与光子之间的相互作用)将其迅速转换成热量81−84。因此,当AuNRs作用于癌细胞时,电磁辐射与光学激光产生足够的热量来选择性地破坏癌细胞85−90。PPTT主要通过坏死和凋亡致癌细胞死亡91,92。但大剂量的纳米颗粒或激光照射会导致过热,易使细胞坏死,并可能诱发肿瘤转移和生长93−95,也可能会损害临近的健康细胞。因此,开发一种新的方法治疗癌细胞至关重要。
研究表明,槲皮素(HSP70)可以直接通过阻止细胞色素c/dATP调解半胱天冬酶活性来抑制细胞凋亡96,并结合多个其他休克蛋白调节蛋白质重折叠97,Ali等98对多个细胞系进行了PPTT检测,发现HSP70浓度与PPTT响应呈正相关关系。但当他们用siRNA移除HSP70观察到PPTT的响应增强。Ali等98的测试结果表明可制造出新颖并具有AuNRs共轭作用的HSP70抑制剂,相比非共轭的 AuNRs,新的共轭抑制剂显示防止热阻的优越性能,导致更高比例的细胞凋亡。因此,AuNRs作为整体运载槲皮素到癌细胞与作为细胞凋亡的PPTT的诱导物一样。
Ali等98在三个不同的细胞株HSC (人类鳞状癌细胞),MCF-7 (乳腺癌细胞)和Huh7.5 (肝癌细胞)里进行PPTT检测。观察到初始HSP70浓度越少,应用PPTT后凋亡的细胞增多,在所有的细胞系被测试时减少HSP70蛋白浓度以增强细胞凋亡。Ali等98通过用热休克蛋白抑制剂与AuNRs共轭作用来扩展这些结果,使敏感细胞进行PPTT,从而促进细胞作为非炎症癌症细胞死亡(图8)。在成功地展示HSP70抑制剂与AuNRs接合后,这些新AuNRs增强癌细胞凋亡的能力会显著增强。与直接添加HSP抑制剂到细胞中不同,Ali等98使用AuNRs作为药物输送系统,而AuNRs是一个高效的配送系统,可以将目标药物直接运送到肿瘤细胞表面,而且HSP抑制剂的量很少可以消除HSP抑制,减少非癌细胞的副作用,这种方法大大促进了PPTT体外诱导细胞凋亡。如果将这些结果推广到体内模型,则下一步可能以最小的副作用有效地切除肿瘤。
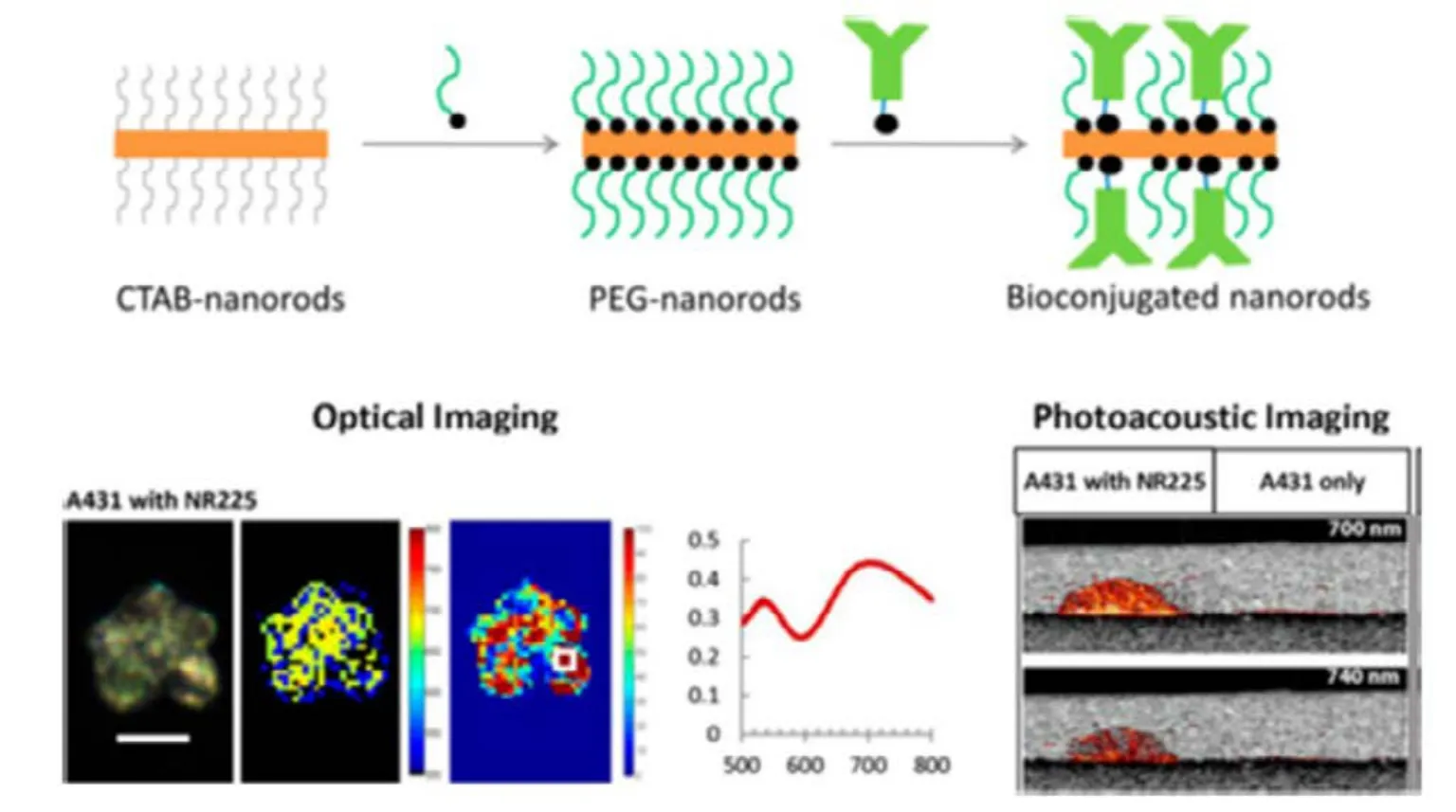
图7 金纳米棒的光学和光声成像Fig.7 Optical and photoacoustic imaging of gold nanorods.
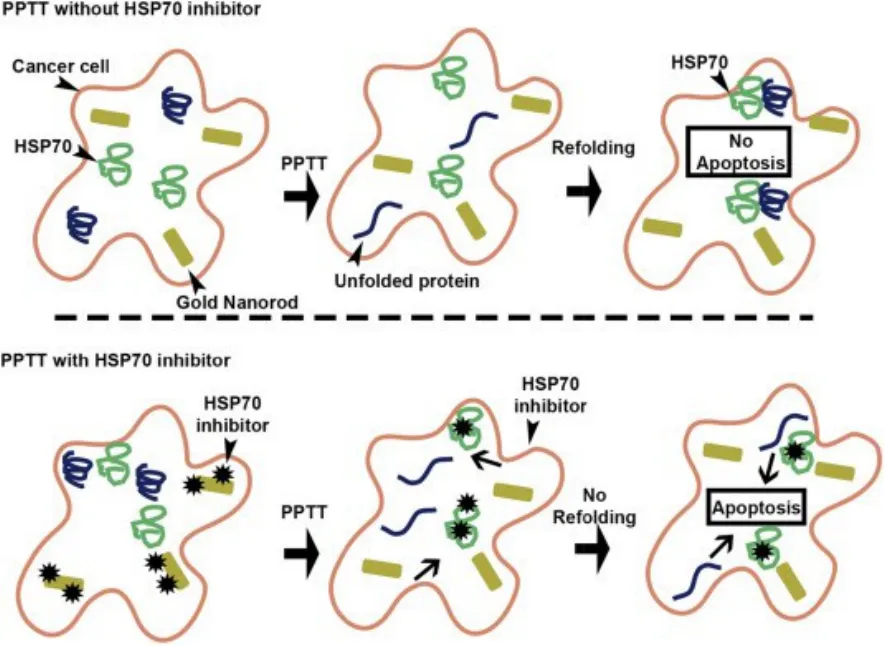
图8 HSP70抑制剂优化PPTT的模型98Fig.8 A model for HSP70 inhibitor optimized PPTT98.
5.2 基因载体
基因疗法由于弥补了蛋白治疗的缺陷,能够治疗如传染病、遗传病、癌症等多种疾病,因此成为一种新的治疗方法,引起了多方关注,并在介入治疗领域应用广泛。但是,如何制备安全高效的基因载体成为基因治疗的一个关键性要素。基因载体通常分为两大类:病毒类和非病毒类。非病毒基因载体具有病毒载体无法比拟的优点,如低细胞毒性和低免疫原性、好的生物相容性、容易生物降解等,从而受到广泛应用,非病毒基因载体有脂质体、阳离子聚合物和纳米颗粒等99−103。金纳米棒由于比表面积大及其独特的光电性质104,以及化学性质稳定、合成方法简单、毒性低、产率高等优点,在运载DNA、SiRNA方面,应用前景良好。AuNRs能充分吸收红外光能量并使局部受热,使蛋白质变性并杀死细胞,因此在治疗疾病中展示出特殊的优越性 105−107。
聚乙烯亚胺(PEI) (阳离子聚合物)中的氨基能够与DNA或SiRNA等生物分子通过静电作用缔合成复合物。其“质子海绵效应”可避免核酸酶降解DNA,促进与细胞的结合和摄取,在许多体内外基然PEI的毒性减弱,但转染效率降低110,113−116。王倩等117致力于提高PEI转染效率的同时降低其毒因转染与治疗研究中效果显著108−112。但PEI对细胞毒性大,并且不可降解,而降低相对分子质量虽性,利用低分子量的PEI与AuNRs相结合。一方面利用 PEI的低分子量来降低阳离子聚合物对细胞的毒性,另一方面利用AuNRs的大比表面积扩大 PEI运载基因的能力,从而形成AuNRs/MUA/PEI (图 9)。AuNRs/MUA/PEI既能够降低阳离子聚合物对细胞的毒性,又能够提高整体的转染率。利用MTT法检测AuNRs/MUA/PEI对 MCF-7细胞的毒性,实验结果显示AuNRs/MUA/PEI对细胞的毒性可以忽略不计,将加入的聚合物浓度增加,细胞存活率仍很高,而相同条件下的 PEI细胞存活率却很低。由于AuNRs/MUA/PEI制备简便,毒性低和表面积大,将作为高效的纳米载体运送基因及药物,在生物医学领域展示出良好的应用前景。图 9为AuNRs/MUA/PEI 纳米载体的制备原理示意图。
5.3 光热疗法
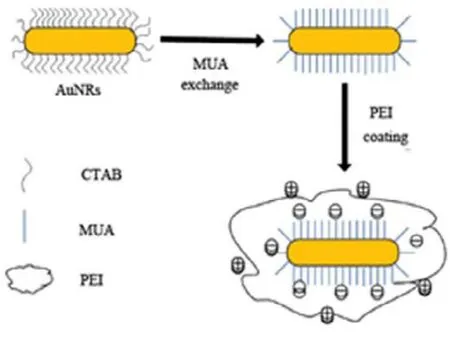
图9 AuNRs/MUA/PEI纳米载体的制备原理示意图117Fig.9 Synthetic scheme of AuNRs/MUA/PEI117.
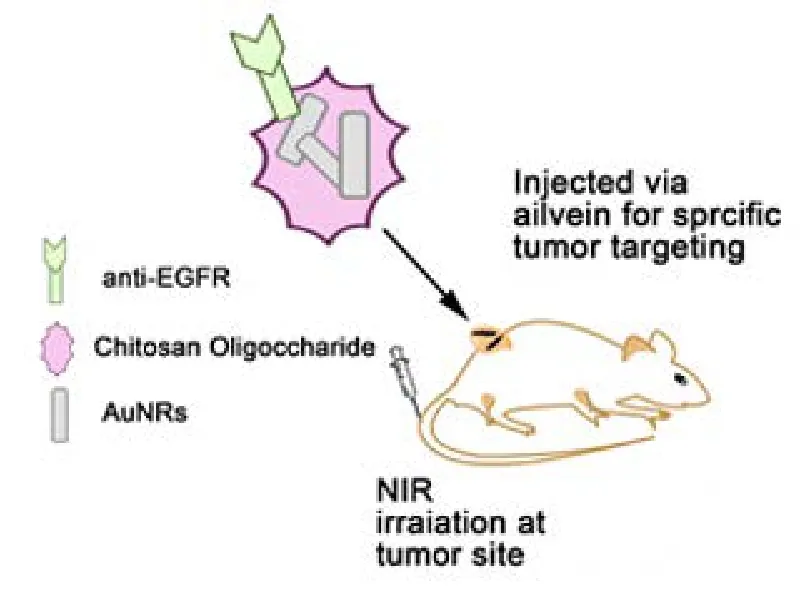
图10 壳聚糖修饰的金纳米棒用于癌症的光热治疗Fig.10 Gold nanorods modified by Chitosan used in photothermal therapy for cancer.
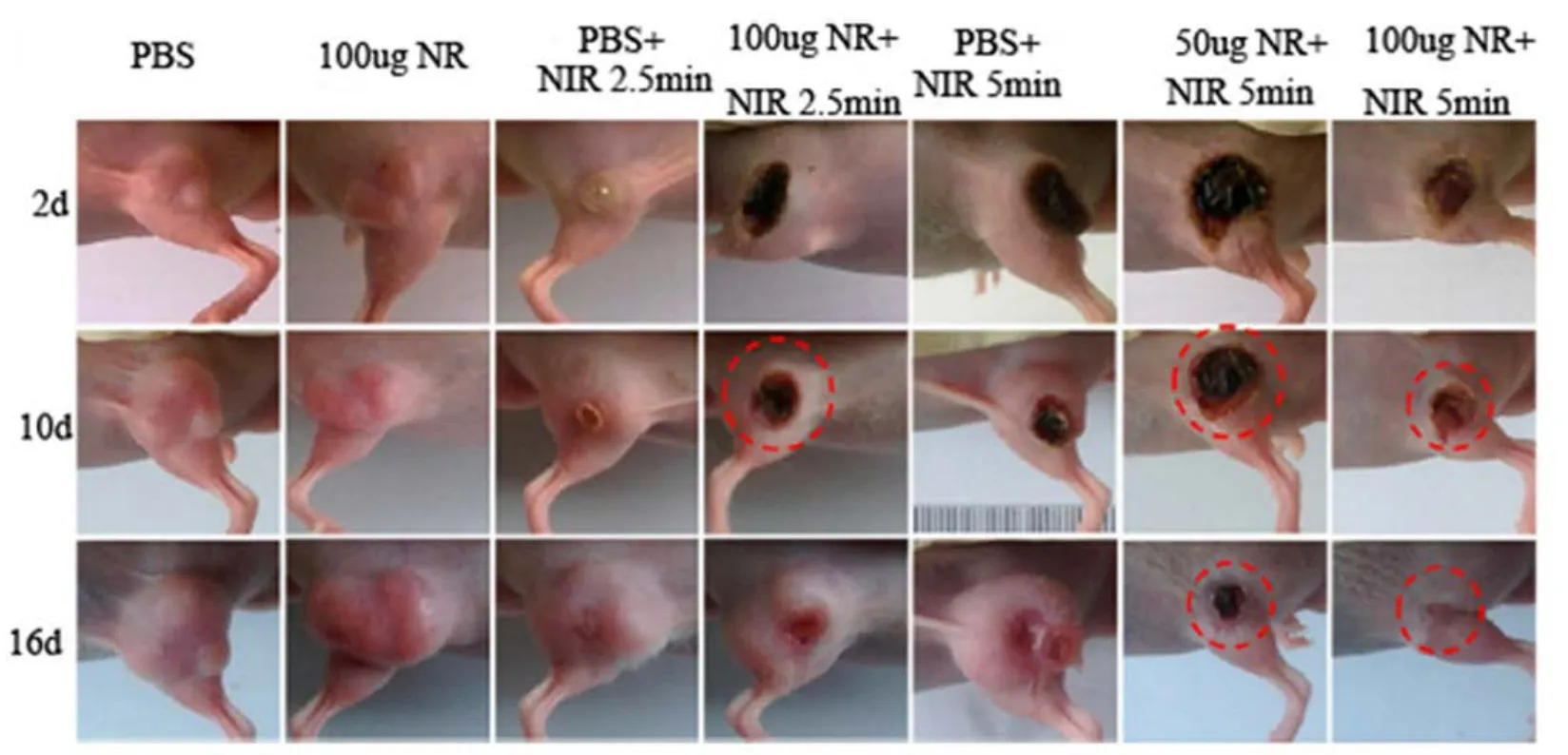
图11 多齿PEG改性的金纳米棒用于小鼠肿瘤的光热疗法Fig.11 Multidentate PEG modified AuNRs used in photothermal therapy for mice’s tumors.
近红外激光具有穿透性好,对人体组织损伤轻的优点118。而金纳米棒生物相容性好,毒性低,光稳定性好,光热转换功能高,还能吸收在700−1000 nm近红外区的波长,这些优势使金纳米棒在光热治疗(photothermltherapy)方面可充当良好的介质119。近年来,在肿瘤及感染性疾病的治疗中越来越多地应用金纳米棒的光热疗法120。Charan小组33使用壳聚糖修饰金纳米棒(图10),制成生物相容性好、无毒的生物探针,使用光热疗法基于局部高热可无创成像,为体内靶向治疗提供了良好的前景。liu34等人用PEG改性金纳米棒,可在体内进行光热疗法,能消融体内肿瘤。该小组设置如图11所示的体内动力学实验,用近红外连续波激光发射器照射小鼠大腿部位的肿瘤,跟踪肿瘤变化情况,结果表明:注入PEG改性的金纳米棒进行光热治疗16 d后,肿瘤可被一次性彻底治愈不复发34。
隐球菌病是由于隐球菌侵染中枢神经而引起的一种深部真菌病121,这种疾病死亡率极高。通常使用两性霉素进行治疗,然而这种治疗方式需鞘内辅助注射,且副作用大不能长期使用122。而氟康唑、伊曲康唑等抗真菌药具有耐药性,治疗效果也不好123,124。肖琴等125用隐球菌的荚膜抗体特异性标记AuNRs,在体外接受近红外激光照射进行介导光热治疗,发现抗体标记后的AuNRs可以明显降低隐球菌的细胞活性。由于抗体对抗原的靶向性,抗体标记的AuNRs更易聚集在隐球菌感染的组织区域,这样可以在集中杀死已感染的细胞的同时避免AuNRs在光热治疗时对周围正常组织细胞的损伤和破坏。更重要的是该疗法可以替代抗真菌药物,从而避免过度使用抗真菌药物而出现的副作用。虽然目前的实验尚处于体外阶段,但成功制备的 AuNRs-Ab对隐球菌的特异性靶向性及光热效应,为光热方法治疗隐球菌感染提供一定的实验基础和新的思路。
6 结论与展望
经过近三十年的发展,金纳米棒的合成方法已经非常成熟,其长径比已经可以自由调控,且已陆续应用于生物感应、癌症治疗和药物载体、基因载体和光热疗法等生物医学领域。本文综述了金纳米棒的合成方法、表面改性及其在生物医学中的应用新进展。重点阐述了金纳米棒的可控修饰及其在生物感应、癌症治疗和药物载体、基因载体和光热疗法等领域的最新进展。尽管金纳米棒在生物医学领域已经有了一些初步的应用,但仍然有许多问题需要研究者们继续探索和研究。例如如何提高金纳米棒的选择性或特异性识别能力?如何解决金纳米棒与无机纳米载体在疾病治疗中的瓶颈问题?如何解决金纳米棒荧光量子产率低的问题?如何精确控制金纳米棒表面的修饰?还有AuNRs的生长机理和不对称修饰及其在生物活体内的应用等至今仍不清楚。这些问题都将成为未来几年乃至几十年的研究热点。
针对上述问题,我们认为将分子手性或智能聚合物引入到金纳米棒表面,制备出手性金纳米棒或智能聚合物修饰的金纳米棒,也许会成为一种新的思路。手性识别是生物分子之间的一种非常普遍而重要的识别途径,因此越来越多的研究者将分子手性引入到纳米材料表面得到手性纳米材料。例如我们之前的工作将手性分子引入到金团簇的表面,得到手性金团簇可以作为一种新型近红外荧光探针126,127。受此启发,我们同样可以将手性分子引入到金纳米棒表面来制备手性金纳米棒,这种具有潜在手性识别能力的金纳米棒将在药物载体和生物探针领域具有非常广阔的应用前景。另一方面,智能聚合物是指可以对环境中力、热、光、电、pH、溶剂等因素变化表现出响应性的一类大分子,如果可以将这类大分子修饰到金纳米棒表面,那么这种兼具金纳米棒独特光学活性和智能聚合物智能响应性能力的新型金纳米棒将在环境监控、污水检测、大气治理等领域有着非常广阔的应用前景。
(1) Shen, L. M.; Yao, J. L.; Gu, R. A. Spectrosc. Spect Anal. 2005, 25,1998. [沈理明, 姚建林, 顾仁敖. 光谱学与光谱分析杂志, 2005,25, 1998.] doi: 10.3321/j.issn:1000-0593.2005.12.024
(2) Liu, M.; Yang, P. H.; Cai, J. Y. Prog. Biochem. Biophy. 2009, 11,1402. [刘 媚, 杨培慧, 蔡继业. 生物化学与生物物理进展, 2009,11, 1402.] doi: 10.3724/SP.J.1206.2009.00194
(3) Ke, S. L.; Kan C. X.; Mo, B.; Cong, B.; Zhu, J. J. Acta Phys.-Chim.Sin. 2012, 28, 1275. [柯善林, 阚彩侠, 莫 博, 从 博, 朱杰君. 物理化学学报, 2012, 28, 1275.]doi: 10.3866/PKU.WHXB201203162
(4) Ma, Z. F.; Tian, L.; Di, J.; Ding, T. Prog. Chem. 2009, 21, 134. [马占芳, 田 乐, 邸 静, 丁 腾. 化学进展, 2009, 21, 134.]
(5) Dubertret, B.; Calame, M.; Libchaber, A . J. Nat. Biotechnol. 2001,19, 365. doi:10.1038/86762
(6) Imahori, H.; Fukuzumi, S. Adv. Mater. 2001, 13, 1197.doi: 10.1002/1521-4095(200108)13:15<1197::AID-ADMA1197>3.0.CO;2-4
(8) Nie, S.; Eniory, S. R. Science 1997, 275, 1102.doi: 10.1126/science.275.5303.1102
(9) Gao, G. B.; Zhang, M. X.; Gong, D. J.; Chen, R.; Hu, X. J.; Sun, T.L. Nanoscale 2017, 9, 4107. doi: 10.1039/c7nr00699c
(10) Thakor, A. S.; Jokerst, J.; Zavaleta, C.; Massoud, T. F.; Gambhir, S.S. Nano Lett. 2011, 11, 4029. doi: 10.1021/nl202559p
(11) Lu, W. S.; Wang, H. F.; Zhang, J. P.; Jiang, L. Prog. Chem. 2015, 27,785. [鲁闻生, 王海飞, 张建平, 江 龙. 化学进展, 2015, 27, 785.]doi: 10.7536/PC150111
(12) Wang, P. B.; Song, Y. Z.; Du X. Y.; Liu, G. H. Rare Met. Mat. Eng.2010, 39, 1672. [王平波, 宋玉哲, 杜雪岩, 刘国汉. 稀有金属材料与工程, 2010, 39, 1672.]
(13) Sau, T. K.; Murphy, C. J. Langmuir 2004, 20, 6414.doi: 10.1021/la049463z
(14) Lohse, S. E.; Murphy, C. J. Chem. Mater. 2013, 25, 1250.doi: 10.1021/cm303708p
(15) Zhou, H. Y.; Zhou, R.; Xiong, B.; He, Y. Chin. J. Anal. Chem. 2012,40, 1807. [周海英, 周 瑞, 熊 斌, 何 彦. 分析化学, 2012, 40,1807.] doi: 10.3724/SP.J.1096.2012.20793
(16) Nikoobakht, B.; El-Sayed, M. A. Chem. Mater. 2003, 15, 1957.doi: 10.1021/cm020732l
(17) Gao, Q.; Qian, Y.; Xia, Y.; Jiang, C. Y.; Qian, W. P. Acta Chim. Sin.2011, 69, 1617. [高 倩, 钱 勇, 夏 炎, 蒋彩云, 钱卫平. 化学学报. 2011, 69, 1617.]
(18) Luo, J. J.; Guo, Y. J.; Tang, Y. J.; Zhang, L.; Wang, J. H.; Yang, P. H.Chin. J. Anal. Chem. 2013, 41, 1413. [骆健俊, 郭颜杰, 唐艳娟,张 璐, 王锦慧, 杨培慧. 分析化学, 2013, 41, 1413.]doi: 10.3724/SP.J.1096.2013.30148
(19) Martin, C. R. Science 1994, 263, 1961.doi: 10.1126/science.266.5193.1961
(20) Yu, Y. Y.; Chang, S. S. Lee, C. L.; Wang, C. C. J. Phys. Chem. B.1997, 101, 6661. doi: 10.1021/jp971656q
(21) Kim, F.; Song, J. H.; Yang, P. D. J. Am. Chem. Soc. 2002, 124,14316. doi: 10.1002/chin.200313016
(22) Jana, N. R.; Gearheart, L.; Murphy, C. J. Adv. Mat. 2001, 13, 1389.doi: 10.1002/1521-4095(200109)13:18<1389::AID-ADMA1389>3.0.CO;2-F
(23) Jana, N. R.; Gearheart, L.; Murphy, C. J. Langmuir 2001, 17, 6782.doi: 10.1021/la0104323
(24) Jana, N. R.; Gearheart, L.; Murphy, C. J. J. Phys. Chem. B 2001,105, 4065.doi: 10.1021/jp0107964
(25) Nguyen, T. N.; Nguyen, T. L.; Luong, T. T. Adv. Nat. Sci. 2016, 7,015006. doi: 10.1088/2043~6262/7/1/015006
(26) Zhang, L.; Belova, V.; Wang, H. Q.; Dong, W. F.; Moehwald, H.Chem. Mater. 2014, 26, 2244. doi: 10.1021/cm404194n
(27) Vigderman, L.; Zubarev, E. R. Chem. Mater. 2013, 25, 1450.doi: 10.1021/cm303661d
(28) Wang, Y.; Wang, F. H.; Guo, Y.; Chen, R. J.; Shen, Y. Y.; Guo, A. J.;Liu, J. Y.; Zhang, X.; Zhou, D. J.; Guo S. R. J. Nanopart. Res. 2014,16, 2806. doi: 10.1007/s11051-041-2806-3
(29) Sirajuddin.; Mchler, A.; Torriero, A. A.; Nafady, A.; Lee, C. Y.;Bond, A. M.; Mullane, A. P.; Bhargava, S.K. Colloids Surf., A 2010,370, 35. doi: 10.1016/j.colsurfa.2010.08.041
(30) Lohse, S. E.; Murphy, C. J. Chem. Mater. 2013, 25, 1250. doi:10.1021/cm303708p
(31) Zhan, Q. Q.; Qian, J.; Li, X.; He, S. L. Nanotechnology 2010, 21,055704. doi: 10.1088/0957-4484/21/5/055704
(32) Connor, E. E.; Mwamuka, J.; Gole, A.; Murphy, C. J.; Wyatt, M. D.Small 2005, 1, 325. doi: 10.1002/smll.200400093
(33) Charan, S.; Sanjiv, K.; Singh, N.; Chien, F. C.; Chen, Y. F.; Nergui,N. N.; Huang, S. H.; Kuo, C. W.; Lee, T. C.; Chen, P. L.Bioconjugate Chem. 2012, 23, 2173. doi: 10.1021/bc3001276
(34) Liu, X. S.; Huang, N.; Li, H.; Wang, H. B.; Jin, Q.; Ji, J. ACS Appl.Mater. Interfaces 2014, 6, 5657. doi: 10.1021/am5001823
(35) Chang, G. R.; Lu, X. Y; Hu, F. K.; Chen, L.; Pan, C. Fine Chem.2016, 33 ,491. [常贯儒, 鲁信勇, 胡逢恺, 陈 龙, 潘成兵. 精细化工, 2016, 33, 491.] doi:1 0.13550 /j. jxhg.2016.05.002
(36) Chang, C. S.; Rothberg, L. J. Chem. Mater. 2015, 27 , 3211.doi: 10.1021/cm504086z
(37) Wang, Y.; Zhou, F. Z.; Sun, H. H. New Chem. Mater. 2016, 44, 84.[王 怡, 周凤珍, 孙宏浩. 化工新型材料, 2016, 44, 84.]
(38) Gao, B.; Xu, J.; He, K. W.; Shen, L.; Chen, H.; Yang, H. J.; Li, A.H.; Xiao, W. H. Mol. Imaging Biol. 2016, 18, 667.doi: 10.1007/s11307-016-0938-9
(39) Park, H.; Lee, S.; Chen, L.; Lee, E. K.; Shin, S. Y.; Lee, Y. H.; Son,S. W.; Oh, C. H.; Song, J. M.; Kang, S. H.; Choo, J. Phys. Chem.Chem. Phys. 2009, 11, 7444. doi: 10.1039/B904592A
(40) Jin, X. T.; Liu,G.; Li, J. Z.; Sun, L. L.; Wang, J. R.; Li, J. F.; Li, P.;Chen, W. Q.; Wang, Q.; Tong, T. Chem. J. Chin. Univ. 2016, 37,224. [金新天, 刘 刚, 李君哲, 孙丽丽, 王俊荣, 李俊锋, 李 沛,陈文庆, 王 强, 佟 倜. 高等学校化学学报, 2016, 37, 224.]doi: 10.7503/cjcu20150662
(41) Tong, L.; He, W.; Zhang, Y. S.; Zheng, W.; Cheng, J. X. Langmuir 2009, 25, 12454. doi: 10.1021/la902992w
(42) Bickford, L.; Sun, J.; Fu, K.; Lewinski, N.; Nammalvar, V.; Chang,J.; Drezek, R. Nanotechnol 2008, 19, 315102. doi:10.1088/0957-4484/19/31/315102
(43) Liu, M. Z.; Guyot-Sionnest, P. J. Phys. Chem. B. 2005, 109, 22192.doi: 10.1021/jp054808n
(44) Johnson, C. J.; Dujardin, E.; Davis, S. A.; Murphy, C. J.; Mann, S.J. Mater. Chem. 2002, 12, 1765. doi: 10.1039/B200953F
(45) Nikoobakht, B.; El-Sayed, M. A. Langmuir 2001, 17, 6368.doi: 10.1021/la010530o
(46) Wang, Y. L.; DePrince, A. E., III; Gray, S. K.; Lin, X. M.; Pelton,M. J. Phys. Chem. Lett. 2010, 1, 2692. doi: 10.1021/jz1010048
(47) Wang, F.; Cheng, S.; Bao, Z. H.; Wang, J. F. Angew. Chem. Int. Ed.2013, 52, 10344. doi: 10.1002/anie.201304364
(48) Nikoobakht, B.; El-Sayed, M. A. Langmuir 2001, 17, 6368.doi: 10.1021/la010530o
(49) Lee, S.; Anderson, L. J. E.; Payne, C. M.; Hafner, J. H. Langmuir 2011, 27, 14748. doi: 10.1021/la202918n
(50) Kou, X. S.; Zhang, S. Z.; Yang, Z.; Tsung, C. K.; Stucky, G. D.;Sun, L. D.; Wang, J. F.; Yan, C. H. J. Am. Chem. Soc. 2007, 129,6402. doi: 10.1021/ja0710508
(51) Kou, X. S.; Sun, Z. H.; Yang, Z.; Chen, H. J. ; Wang, J. F.Langmuir 2009, 25, 1692. doi: 10.1021/la802883p
(52) Guo, H. Y.; Lu, L, H.; Wu, C.; Pan, J. G.; Hu, J. W. Acta Chim. Sin.2009, 67, 1603. [郭红燕, 芦玲慧, 吴 超, 潘建高, 胡家文. 化学学报, 2009, 67, 1603.] doi: 10.3724/SP.J.1096.2013.30148
(53) Li, C. Z.; Male, K. B.; Hrapovic, S.; Luong, J. H. Chem. Commun.2005, 31, 3924. doi: 10.1039/b504186d
(54) Ye, J. Q.; Zhang, Y.; Huang, H.; Wang, J.; Jiang, Z.; Bai, M. Sens.Actuators, B 2017, 243, 1255. doi: 10.1016/j.snb.2016.12.098
(55) He, X.; Wang, S. P.; Zhou, Y. F.; Huang, C. M.; Lyuqiu, S. J.; Ning,S. B. Chin. J. Zoonose 2016, 32, 315. [何 鑫, 汪世平, 周云飞, 黄成铭, 闾丘思嘉, 宁水兵. 中国人兽共患病学报, 2016, 32, 315.]doi: 10.3969/j.issn.1002-2694.2016.04.001
(56) Cao, J.; Galbraith, E. K.; Sun, T.; Grattan, K. T. Sens. Actuators, B 2012, 169, 360. doi: 10.1016/j.snb.2012.05.019
(57) Ferlay, J.; Shin, H. R.; Bray, F.; Forman, D.; Mathers, C.; Parkin, D.W. Int. J. Cancer. 2010, 127, 2893. doi: 10.1002/ijc.25516
(58) Stout, N. K.; Lee, S. J.; Schechter, C. B.; Kerlikowske, K.; Alagoz,O.; Berry, D.; Buist, D.S.; Cevik, M.; Chisholm, G.; de Koning, H.J.; Huang, H.; Hubbard, R. A.; Miglioretti, D. L.; Munsell, M. F.;Trentham-Dietz, A.; van Ravesteyn, N. T.; Tosteson, A. N.;Mandelblatt, J. S. J. Natl. Cancer. Inst. 2014, 106, 092.doi: 10.1093/jnci/dju092
(59) Bevers, T. B.; Anderson, B. O.; Bonaccio, E.; Buys, S.; Daly, M. B.;Dempsey, P.J.; Farrar, W. B.; Fleming, I.; Garber, J. E.; Harris, R.E.; Heerdt, A. S.; Helvie, M.; Huff, J.G.; Khakpour, N.; Khan, S. A.;Krontiras, H.; Lyman, G.; Rafferty, E.; Shaw, S.; Smith, M. L.;Tsangaris, T. N.; Williams, C.; Yankeelov, T. J. Natl. Compr. Cancer Network 2009, 7, 1060.
(60) Moran, M. S.; Kaufman, C.; Burgin, C.; Swain, S.; Granville, T.;Winchester, D. P. J. Oncol. Pract. 2013, 9, e62.doi: 10.1200/JOP.2012.000636
(61) Steve, H. P. Cancer 1994, 74, 256. doi: 10.1002/cncr.2820741309
(62) Calhoun, K. E.; Anderson, B. O. J. Clin. Oncol. 2014, 32, 2191.doi: 10.1200/JCO.2014.55.6324
(63) Li, Y.; Zhang, Y. L.; Zhao, M.; Zhou , Q. Q.; Wang, L. L.; Wang, H.Z.; Wang, X. H.; Zhan, L. S. R. Soc. Chem. 2016, 52, 3959.doi: 10.1039/C6CC01014H
(64) Cho, E. C.; Liu, Y.; Xia, Y. N. Angew. Chem. Int. Edit. 2010, 49,1976. doi: 10.1002/anie.200906584
(65) Yu, C. C.; Hu, Y.; Duan, J. H.; Yuan, W.; Wang, C.; Xu, H. Y.; Yang,X. D. Plos One 2011, 6 ,e24077. doi: 10.1371/journal.pone.0024077
(66) Yang, Y. D.; Liu, G, Z.; Li, D. Z.; Xu, J. H.; Yang, L. M. Chin. Sci.Bull. 2015, 60, 817. [杨玉东, 刘公召, 李冬至, 徐菁华, 杨林梅.科学通报, 2015, 60, 817] doi: 10.1360/N972014-00887
(67) Luo, T.; Huang, P.; Gao, G.; Shen, G.; Fu, S.; Cui, D.; Zhou, C.;Ren, Q. Opt. Express 2011, 19, 17030. doi: 10.1364/OE.19.017030
(68) Zhang, J. B.; Balla, N. K.; Gao, C.; Sheppard, C. J.; Yung, L. Y.;Rehman, S.; Teo, J. Y.; Kulkarni, S. R.; Fu, Y.H.; Yin, S. J. Aust. J.Chem. 2012, 65, 290. doi: 10.1071/CH12037
(69) Joshi, P. P.; Yoon, S. J.; Hardin, W. G.; Emelianov, S.; Sokolov, K.V. Bioconjugate Chem. 2013, 24, 878. doi: 10.1021/bc3004815
(70) Lajunen, T.; Viitala, L.; Kontturi, L.S.; Laaksonen, T.; Liang, H.;Vuorimaa-Laukkanen, E.; Viitala, T.; Le Guével, X.; Yliperttula, M.;Murtomäki, L.; Urtti, A. J. Controlled Release 2015, 203, 85.
(71) Mayer, G.; Heckel, A. Angew. Chem., Int. Ed. Engl. 2006, 45, 4900.doi: 10.1002/anie.200600387
(72) Zhong, Y. N.; Wang, C.; Cheng, L.; Meng, F. H.; Zhong, Z. Y.; Liu,Z. Biomacromolecules 2013, 14, 2411. doi: 10.1021/bm400530d
(73) Wijaya, A.; Schaffer, S. B.; Pallares, I. G.; Hamad-Schifferli, K. .ACS Nano 2009, 3, 80. doi: 10.1021/nn800702n CCC: $40.75
(74) Park, H.; Yang, S.; Kang, J. Y.; Park, M. ACS Med. Chem. Lett.2016, 7, 1087. doi: 10.1021/acsmedchemlett.6b00293
(75) Ali,H. R.; Ali, M. R.; Wu, Y.; Selim, S. A.; Abdelaal, H. F.; Nasr, E.A.; El-Sayed, M. A. Bioconjugate Chem. 2016, 27, 2486.doi: 10.1021/acs.bioconjchem.6b00430
(76) Dickerson, E. B.; Dreaden, E. C.; Huang, X. H.; El-Sayed, I. H.;Chu, H. H.; Pushpanketh, S.; McDonald, J. F.; El-Sayed, M. A.Cancer Lett. 2008, 269, 57. doi: 10.1016/j.canlet.2008.04.026
(77) Li, W. Q.; Sun, C. Y.; Wang, F.; Wang, Y. C.; Zhai, Y. W.; Liang, M.;Liu, W. J.; Liu, Z. M.; Wang, J.; Sun, F. Nano Lett. 2013, 13, 2477.doi: 10.1021/nl400536d
(78) Bagley, A. F.; Hill, S.; Rogers, G. S.; Bhatia, S. N. ACS Nano 2013,7, 8089. doi: 10.1021/nn4033757
(79) Zhou, T.; Yu, M. F.; Zhang, B.; Wang, L. M.; Wu, X. C.; Zhou, H.J.; Du, Y. P.; Hao, J. F.; Tu, Y. P.; Chen, C. Y.; Wei, T. T. Adv. Funct.Mater. 2014, 24, 6922. doi: 10.1002/adfm.201401642
(80) Huang, X. H.; EI-Sayed, I. H.; EI-Sayed, M. A. Methods Mol. Biol.2010, 624, 343. doi: 10.1007/978-1-60761-609-2_23
(81) Alkilany, A. M.; Thompson, L. B.; Boulos, S. P.; Sisco, P. N.;Murphy, C. J. Adv. Drug Delivery Rev. 2012, 64, 190.doi: 10.1016/j.addr.2011.03.005
(82) Ali, M. R. K.; Snyder, B.; El-Sayed, M. A. Langmuir 2012, 28,9807. doi: 10.1021/la301387p
(83) Huang, X. H.; Neretina, S.; El-Sayed, M. A. Adv. Mater. 2009, 21,4880. doi: 10.1002/adma.200802789
(84) Shi, P.; Li, M.; Ren, J. S.; Qu, X. G. Adv. Funct. Mater. 2013, 23,5412. doi: 10.1002/adfm.201301015
(85) Sun, M. M.; Liu, F.; Zhu, Y. K.; Wang, W. S.; Hu, J.; Liu, J.; Dai, Z.F.; Wang, K.; Wei, Y.; Bai, J.; Gao, W. P. Nanoscale 2016, 8, 4452.doi: 10.1039/c6nr00056h
(86) Shen, J. L.; Kim, H. C.; Mu, C. F.; Gentile, E.; Mai, J. H.; Wolfram,J.; Ji, L. N.; Ferrari, M.; Mao, Z. W.; Shen, H. F. Adv. Healthc Mater. 2014, 3, 1629. doi: 10.1002/adhm.201400103
(87) Huang, X. H.; Kang, B.; Qian, W.; Mackey, M. A.; Chen, P. C.Oyelere, A. K.; El-Sayed, I. H.; El-Sayed, M. A. J. Biomed. Opt.2010, 15, 7. doi: 10.1117/1.3486538
(88) Yang, X. J.; Liu, X.; Liu, Z.; Pu, F.; Ren, J. S.; Qu, X. G. Adv Mater.2012, 24, 2890. doi: 10.1002/adma.201104797
(89) Zhu, Z. F.; Zou, Y. S.; Hu, W. D.; Li, Y. B.; Gu, Y.; Cao, B. Q.; Guo,N.; Wang, L.; Song, J. Z.; Zhang, S. L.; Gu, H. S.; Zeng, H.B. Adv.Funct. Mater. 2016, 26, 1793. doi: 10.1002/adfm.201504884
(90) Shao, J. X.; Xuan, M. J.; Dai, L. R.; Si, T. Y.; Li, J. B.; He, Q.Angew. Chem., Int, Edit, 2015, 54, 12782. doi:10.1002/anie.201506115
(91) Kannadorai, R. K.; Chiew, G. G. Y.; Luo, K. Q.; Liu, Q. Cancer Lett. 2015, 357, 152. doi: 10.1016/j.canlet.2014.11.022
(92) Perez-Hernandez, M.; del Pino, P.; Mitchell, S. G.; Moros, M.;Stepien, G.; Pelaz, B.; Parak, W. J.; Galvez, E. M.; Pardo, J.; de la Fuente, J. M. ACS Nano 2015, 9, 52. doi: 10.1021/nn505468v
(93) Orosz, P.; Echtenacher, B.; Falk, W.; Rüschoff, J.; Weber, D.;Männel, D. N. J. Exp. Med. 1993, 177, 1391. doi:10.1084/jem.177.5.1391
(94) Kudryavets, Y. I. Exp. Oncol. 1998, 20, 114.
(95) Bonfil, R. D.; Bustuoabad, O. D.; Ruggiero, R. A.; Meiss, R. P.;Pasqualini, C. D. Clin. Exp. Metastasis. 1988, 6, 121.doi: 10.1007/bf01784843
(96) Ali, M. R. K.; Panikkanvalappil, S. R.; El-Sayed, M. A. J. Am.Chem. Soc. 2014, 136, 4464. doi: 10.1021/ja4124412
(97) Miyako, E.; Deguchi, T.; Nakajima, Y.; Yudasaka, M.; Hagihara, Y.;Horie, M.; Shichiri, M.; Higuchi, Y.; Yamashita, F.; Hashida, M.;Shigeri, Y.; Yoshida, Y.; Iijima, S. Proc. Natl. Acad. Sci. U. S. A.2012, 109, 7523. doi: 10.1073/pnas.1204391109
(98) Ali, M. R. K.; Ali, H. R.; Rankin, C. R.; El-Sayed, M. A.Biomaterials 2016, 102, 1. doi: 10.1016/j.biomaterials.2016.06.017
(99) Zuckerman, J. E.; Choi, C. H. J.; Han, H.; Davis, M. E. Proc. Natl.Acad. Sci. U. S. A. 2012, 109, 3137. doi: 10.1073/pnas.1200718109
(100) Videira, M.; Arranja, A.; Rafael, D.; Gaspar, R.Nanomed-Nanotechnol. Biol. Med. 2014, 10, 689.doi: 10.1016/j.nano.2013.11.018
(101) Novo, L.; van Gaal, E. V. B.; Mastrobattista, E.; van Nostrum, C. F.;Hennink, W. E. J. Controlled Release. 2013, 169, 246.doi: 10.1016/j.jconrel.2013.03.035
(102) Kwok, A.; Hart, S. L. Nanomed-Nanotechnol. Biol. Med. 2011, 7,210. doi: 10.1016/j.nano.2010.07.005
(103) Novo, L.; Mastrobattista, E.; van Nostrum, C. F.; Hennink, W. E.Bioconjugate Chem. 2014, 25, 802. doi: 10.1021/bc500074a
(104) Yin, F.; Yang, C. B.; Wang, Q. Q.; Zeng, S. W.; Hu, R.; Lin, G. M.;Tian, J. L.; Hu, S. Y.; Lan, R. F.; Yoon, H. S.; Lu, F.; Wang, K.;Yong, K. T. Theranostics 2015, 5, 818. doi: 10.7150/thno.11335
(105) Sun, G. M.; Yang, P. H.; Sun, J. H.; Cai, J. Y. Chin. J. Lumin. 2011,32, 636. doi: 10.3788/fgxb20113206.0636
(106) Han, L.; Zhao, J.; Zhang, X.; Cao, W. P.; Hu, X. X.; Zou, G. Z.;Duan, X. L.; Liang, X. J. ACS nano. 2012, 6, 7340.doi: 10.1021/nn3024688
(107) Lee, S. K.; Han, M. S.; Asokan, S.; Tung, C. H. Small 2011, 7, 364.doi: 10.1002/smll.201001314
(108) Troiber, C.; Kasper, J. C.; Milani, S.; Scheible, M.; Martin, I.;Schaubhut, F.; Kuchler, S.; Radler, J.; Simmel, F. C.; Friess, W.;Wagner, E. Eur. J. Pharm. Biopharm. 2013, 84, 255.doi: 10.1016/j.ejpb.2012.08.014
(109) Xue, H. Y.; Wong, H. L. ACS Nano 2011, 5, 7034.doi: 10.1021/nn201659z
(110) Park, J. S.; Yang, H. N.; Woo, D. G.; Jeon, S. Y.; Do, H. J.; Lim, H.Y.; Kim, J. H.; Park, K. H. Biomaterials 2011, 32, 3679.doi: 10.1016/j.biomaterials.2011.01.063
(111) TrosdeIlarduya, C. T.; Sun, Y.; Duezguenes, N. Eur. J. Pharm. Sci.2010, 40, 159. doi: 10.1016/j.ejps.2010.03.019
(112) Lee, Y.; Miyata, K.; Oba, M.; Ishii, T.; Fukushima, S.; Han, M.;Koyama, H.; Nishiyama, N.; Kataoka, K. Angew. Chem. Int. Edit.2008, 47, 5163. doi: 10.1002/anie.200800963
(113) Tsai, L. R.; Chen, M. H.; Chien, C. T.; Chen, M. K.; Lin, F. S.; Lin,K. M. C.; Hwu, Y. K.; Yang, C. S.; Lin, S. Y. Biomaterials 2011, 32,3647. doi: 10.1016/j.biomaterials.2011.01.059
(114) Tang, G. P.; Guo, H. Y.; Alexis, F.; Wang, X.; Zeng, S.; Lim, T. M.;Ding, J.; Yang, Y. Y.; Wang, S. J. Gnne. Med. 2006, 8, 736.doi: 10.1002/jgm.874
(115) Goula, D.; Remy, J. S.; Erbacher, P.; Wasowicz, M.; Levi, G.;Abdallah, B.; Demeneix, B. A. Gene Ther. 1998, 5, 712.doi: 10.1038/sj.gt.3300635
(116) Vicennati, P.; Giuliano, A.; Ortaggi, G.; Masotti, A. Curr. Med.Chem. 2008, 15, 2826. doi:10.2174/092986708786242778
(117) Wang, Q.; Liu L. W.; Zhu, L. X.; Zou, P.; Hu, S. Y.; Bu, C. F. Chin.J. Lumin. 2015, 36, 1271. [王 倩, 刘丽炜, 朱伶西, 邹 鹏, 胡思怡, 卜承飞. 发光学报, 2015, 36, 1271.]doi: 10.3788/fgxb20153611.1271
(118) Weissleder, R.; Ntziachristos, V. Nat. Med. 2003, 9, 123.doi: 10.1038/nm0103-123
(119) Naik, G. V.; Shalaev, V. M.; Boltasseva, A. Adv. Mater. 2013, 25,3264. doi: 10.1002/adma.201205076
(120) Jabeen, F.; Najam-ul-Haq, M.; Javeed, R.; Huck, C. W.; Bonn, G. K.Molecules 2014, 19, 20580. doi: 10.3390/molecules191220580
(121) Orsini, J.; Blaak, C.; Mahmoud, D.; Young-Gwang, J. J. Community Hosp. Intern. Med. Perspect. 2015, 5, 26098.doi: 10.3402/jchimp.v5.26098
(122) Ostrosky-Zeichner, L.; Marr, K. A.; Rex, J. H.; Cohen, S. H. Clin.Infect. Dis. 2003, 37, 415. doi: 10.1086/376634
(123) Arndt, C.; Walsh, T. J.; McCully, C. L.; Balis, F. M.; Pizzo, P. A.;Poplack, D. G. J. Infect. Dis. 1988, 157, 178. doi:https://doi.org/10.1093/infdis/157.1.178
(124) Van Peer, A.; Woestenborghs, R.; Heykants, J.; Gasparini, R.;Gauwenbergh, G. Eur. J. Clin. Pharmacol. 1989, 36, 423.doi: 10.1007/bf00558308
(125) Xiao, Q.; Chen, M.; Xu, N. Chin. J. Mycol. 2015, 10, 134. [肖 琴,陈 敏, 徐 楠. 中国真菌学杂志, 2015, 10, 134.]doi: 10.3969/j.issn.1673-3827.2015.03.003
(126) Gong, D. J.; Gao, G. B.; Zhang, M. X.; Sun, T. L. Prog. Chem.2016, Z2, 296. [龚德君, 高冠斌, 张明曦, 孙涛垒. 化学进展,2016, Z2, 296.] doi: 10.7536/PC150931
(127) Gao, G. B.; Gong, D. J.; Zhang, M. X.; Sun, T. L. Acta Chim. Sin.2016, 74, 363. [高冠斌, 龚德君, 张明曦, 孙涛垒. 化学学报,2016, 74, 363.] doi: 10.6023/A16010038
Gold Nanorods——from Controlled Synthesis and Modification to Nano-Biological and Biomedical Applications
HU Xue-Jiao GAO Guan-Bin* ZHANG Ming-Xi*
(State Key Laboratory of Advanced Technology for Materials Synthesis and Processing,Wuhan University of Technology, Wuhan 430070, P. R. China)
Gold nanorods (AuNRs) have been the focus of considerable attention in the nano-biotechnology and biomedicine fields because of their unique optical activities, adjustable aspect ratios, ease of surface modification, and good biocompatibility. AuNRs offer specific tunable surface plasmon resonance (SPR) effects (including TSPR and LSPR), which can tune their fluorescence-emission between the visible and near-infrared (NIR) zones. Controlled synthesis and surface modification determine the physical and chemical properties of AuNRs, which ultimately determine their biocompatibility and biomedical applicability. In this review, the four main types of controlled synthesis (template, electrochemical synthesis, photochemical synthesis, and seeded growth methods), controlled surface modification methods, as well as the nano-biological and biomedical applications of AuNRs, are summarized. The controlled surface modification methods of AuNRs and their application to molecular probes, bio-sensing, bio-imaging, gene carriers, pharmaceutical carriers,and cancer photothermal therapy are discussed in detail. Finally, we outline our personal perspectives on the main issue affecting AuNRs in biological applications. That is, chiral molecular and smart polymers can be introduced onto the surfaces of AuNRs to improve the specific recognition of tumor cells and to increase fluorescence quantum yields, thus providing a new direction for the development of AuNRs.
Gold nanorods; Controlled synthesis; Controlled modification; Nano-biological applications; Biomedical applications
January 3, 2017; Revised: March 13, 2017; Published online: April 11, 2017.
O648
10.1126/science.283.5408.1676
[Review]
10.3866/PKU.WHXB201704112 www.whxb.pku.edu.cn
*Corresponding authors. GAO Guan-Bin, Email: gbgao@whut.edu.cn; Tel: +86-15827567674. ZHANG Ming-Xi, Email: mxzhang@whut.edu.cn;Tel: +86-13476111239.
The project was supported by the National Natural Science Foundation of China (51533007, 51521001, 21404083).
国家自然科学基金(51533007, 51521001, 21404083)资助项目
© Editorial office of Acta Physico-Chimica Sinica
胡雪娇,1993年生。2015毕业于沈阳化工大学高分子材料与工程专业,获学士学位。2015年至今就读于武汉理工大学材料工程专业。主要研究方向为金纳米材料的制备与应用。
高冠斌,1987年生。2016年毕业于武汉理工大学材料物理与化学专业,获博士学位。同年留校担任材料复合新技术国家重点实验室助理研究员。主要研究方向为智能纳米材料、生物界面材料等。张明曦,1982年生。2010年毕业于武汉大学分析化学专业,获博士学位。2010年起在武汉理工大学工作,2013年晋升副研究员。主要研究方向为纳米生物技术、仿生复合材料、生物医用材料等。
