LC3Ⅱ及P62在小胃间质瘤中的表达及意义
2017-11-01牛小平何池义刘少锋
牛小平,何池义,刘少锋,张 伟,韩 真
皖南医学院第一附属医院 弋矶山医院 1.消化内科; 2.病理科,安徽 芜湖 241001
LC3Ⅱ及P62在小胃间质瘤中的表达及意义
牛小平1,何池义1,刘少锋1,张 伟2,韩 真1
皖南医学院第一附属医院 弋矶山医院 1.消化内科; 2.病理科,安徽 芜湖 241001
目的通过检测小胃间质瘤和正常胃间质组织中自噬相关基因LC3Ⅱ和P62的表达情况,探讨LC3Ⅱ和P62在胃间质瘤发生、发展中的作用。方法采用免疫组织化学染色法,检测LC3Ⅱ和P62在21例小胃间质瘤组织、16例正常胃间质组织中的表达情况。 试验组:选取2013年1月-2014年5月在皖南医学院弋矶山医院内镜切除的21例小胃间质瘤病例,中位年龄52岁。对照组:选取同期16例因“消化性溃疡”在皖南医学院戈矶山医院行胃大部切除术的病例,术后病理证实胃组织正常者,中位年龄47岁。采用免疫组织化学法(非生物素二步法)分别检测LC3Ⅱ和P62在小胃间质瘤和正常胃间质组织中的表达,免疫组化结果采用半定量综合分析法。结果正常胃间质组织和小胃间质瘤组织中LC3Ⅱ、P62的阳性率均为100%。与正常胃间质组织相比,小胃间质瘤组织LC3Ⅱ表达明显增强,P62表达减弱,差异有统计学意义(P=0.000)。结论小胃间质瘤自噬活性增加,可能与肿瘤发生、发展有关。
自噬;LC3Ⅱ;P62;小胃间质瘤
细胞自噬(autophagy)是一种依赖溶酶体的降解途径,它与细胞生长、分化及死亡有着非常重要的关系。研究发现,在肿瘤发生、发展过程中,自噬活性的改变是一把双刃剑,一方面,自噬能够使肿瘤细胞逃避放疗、化疗所致的损伤,从而耐受应激条件而获得生存;另一方面,自噬可以减轻各种应激条件下的正常组织细胞的损伤(如慢性炎症、慢性细胞死亡及基因组损伤)而减少肿瘤的发生[1]。胃肠间质瘤(gastrointestinal stromal tumors,GIST)是一组独立起源于胃肠道的间叶性肿瘤,与平滑肌肿瘤和神经鞘瘤不同,其基本瘤细胞是一种未定的具有多潜能的梭形或上皮间叶样细胞。GIST占胃肠道恶性肿瘤的1%~3%,多发于中老年患者,40岁以下患者少见,男女发病率无明显差异,胃是GIST最常见发病部位(占全部GIST的50%~70%)。小胃肠间质瘤是指瘤体≤2 cm的间质瘤,目前将其分级定为极地危险度范畴,小胃间质瘤是间质瘤发展的早期阶段[2]。本研究将通过检测小胃间质瘤和正常胃间质组织中自噬相关基因LC3Ⅱ和P62的表达情况,探讨细胞自噬与胃间质瘤的关系,将有助于阐明胃间质瘤的发生、发展及预后等一系列问题,并为胃间质瘤的预防、诊治提供新的思路。
1 材料与方法
1.1标本来源收集2013年1月-2014年5月在弋矶山医院消化科内镜中心采用内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)切除的21例小胃间质瘤病例,所有病例术前均未进行任何化学和放射治疗,术后均经病理诊断证实,且免疫组化CD117均为阳性。
1.2主要试剂DAB显色试剂盒(ZL1-9032)、辣根酶标记链亲和素(ZB-2404)、生物素化山羊抗兔IgG(H+L)(ZB-2010),LC3Ⅱ(货号PM036)及P62(PM045)均购自日本MBL公司。
1.3免疫组化分析所有标本均用100 g/L中性福尔马林固定,常规脱水,石蜡包埋并切片,片厚4.0 μm。免疫组织化学染色采用SP法,染色步骤按说明书进行。一抗稀释度为1∶100,用PBS代替一抗作阴性对照,以已知阳性切片作为阳性对照。将胞浆为棕黄色~黄色判定为阳性,细胞核为蓝色判定为阴性。在100倍光镜下观察免疫组化全片,选择5个阳性物质丰富的视野,采用Image-ProPlus Version 6.0分析软件在200倍光镜下测定阳性物质的积分光密度(integrated optical density,IOD)值,分析LC3Ⅱ及P62蛋白在小胃间质瘤组及正常对照组中的表达及意义。
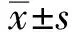
2 结果
参照Joensuu等[3]对GIST危险度分级评分,21例小胃间质瘤均为极地危险度。免疫组化结果示,LC3Ⅱ及P62在小胃间质瘤组织及正常胃间质组织均有不同程度的表达,即表达率均为100%。且LC3Ⅱ及P62均定位于细胞质中,而在细胞核中无表达。Image-ProPlus测定阳性物质的IOD定量分析发现,与正常胃间质组织相比,小胃间质瘤组织中,LC3Ⅱ表达增强,P62表达减弱,差异有统计学意义(P<0.05,见表1、图1),表明胃间质瘤自噬功能增强。

表1 LC3Ⅱ、P62蛋白在小胃间质瘤及正常胃间质组织中的表达水平
注:与正常对照组LC3Ⅱ表达比较,t=13.151,*P<0.05;与正常对照组P62表达比较,t=22.248,*P<0.05。

图1小胃间质瘤内镜下表现及LC3Ⅱ、P62免疫组化结果A:胃体底交界小胃间质瘤;B:小胃间质瘤超声内镜,起源于黏膜肌层;C:LC3Ⅱ蛋白在小胃间质瘤的表达;D:LC3Ⅱ蛋白在正常胃间质组织的表达;E:P62蛋白在小胃间质瘤的表达;F:P62蛋白在正常胃间质组织的表达(C~F均为SP法,200×)
Fig1EndoscopicfindingsofsmallgastricstromaltumorsandimmunohistochemicalfindingsofLC3ⅡandP62A: small stromal tumor of the fundus of stomach; B: endoscopic ultrasonography of small gastric stromal tumors originated from the muscularis mucosae; C: the expression of LC3Ⅱ protein in small gastric stromal tumors; D: the expression of LC3Ⅱ protein in normal gastric stromal tissues; E: the expression of P62 protein in small gastric stromal tumors; F: the expression of P62 protein in normal gastric stromal tissues
3 讨论
自噬又称为Ⅱ型程序性细胞死亡(type Ⅱ programed cell death),是以胞质内出现双层膜结构包裹长寿命蛋白和细胞器的自噬体为特征的细胞“自我消化”的一系列生化过程。研究[4]发现,自噬与肿瘤的发生和发展具有非常重要的关系,并且为肿瘤治疗提供了新思路及靶点,已经成为目前国际肿瘤研究领域的热点。自噬现象贯穿于真核细胞正常生长增殖的病理生理全部过程,对细胞的作用具有双重性,在肿瘤发生发展的不同阶段,或者细胞周围环境发生变化及治疗干预措施的不同时期,自噬发挥着不同的作用[5]。一般认为,在肿瘤尚未完全形成之前,尤其是在不典型增生时期,自噬抑制肿瘤的形成,此时阻碍自噬将导致癌前病变的发展,进而形成早癌[6]。自噬在肿瘤进展中的作用随疾病病程而不断发生动态变化,在肿瘤生长过程中,尤其是肿瘤早期阶段,当肿瘤内还未形成足够的血管为其扩增提供营养时,肿瘤细胞可以通过自噬来克服营养缺乏和低氧的环境得以生存。此外,对肝癌、胃癌等研究发现,当化疗、放疗后,肿瘤细胞会产生大量的破损细胞器、损坏的蛋白质等有害成分,自噬可以清除化学及电离辐射时受损的大分子或细胞器(如线粒体),保护肿瘤细胞免受电离辐射的作用,从而逃避凋亡存活下来,因此认为自噬可以作为这些肿瘤治疗的一个新靶点[7-8]。
LC3是迄今为止发现的唯一一个定位于自噬泡内膜、参与多种信号传导调节的蛋白,后被证明为细胞自噬发生与否的一个良好的标志物。LC3前体Pro LC3形成后,首先加工成胞浆可溶性形式的LC3Ⅰ,并暴露出其羧基末端的甘氨酸残基,随后与自噬泡膜表面的PE结合,被修饰成LC3Ⅱ。当细胞自噬过程进行到自噬泡即将形成闭合结构时,只有膜结合形式的LC3Ⅱ定位于自噬泡膜上,且LC3Ⅱ始终位于胞内自噬体的膜上,其含量的多少与自噬泡数量的多少呈正比。因此,LC3Ⅱ含量的多少与自噬泡数量的多少呈正比。所以,LC3Ⅱ是研究自噬很好的标记物[9]。同时,P62作为LC3的配体,是细胞内信号传导的一个整合性蛋白,在决定细胞凋亡和存活中起到重要的作用,同时也是一个抑制癌症生成的重要蛋白质。P62是否被降解也可以作为细胞自噬发生与否的一个良好标志物[10]。国外有研究[11]表明,进展期胃间质瘤自噬功能增强,进而导致了间质瘤细胞对伊马替尼的耐药。但对间质瘤发展初期尤其是小间质瘤自噬功能的研究,国内外尚未见相关报道。本研究通过对ESD法切除的21例小胃间质瘤免疫组化染色发现,与正常胃间质组织相比,小胃间质瘤组织LC3Ⅱ表达明显增强,P62表达减弱,表明小间质瘤细胞自噬活性增强,能及时清除瘤细胞生长所产生的废物,这可能与间质瘤不像胃癌组织那样容易发生坏死有关。由于小间质瘤是间质瘤发展的早期阶段,肿瘤内还没有形成足够的血管为其扩增提供营养,间质瘤细胞可以通过增强自噬功能来克服营养缺乏和低氧的环境得以生存。
GIST是一种潜在恶性的肿瘤,目前对于原发、较大的GIST,外科手术是其主要的治疗方法,而对于<2 cm的GIST,尤其是小胃间质瘤,主要采取内镜ESD。但对于术后复发转移或不可切除的GIST,则主要依赖于伊马替尼的治疗。但伊马替尼价格昂贵,且易产生耐药[12-13],因而,研究间质瘤早期阶段发生、发展机理,探索新的治疗方案势在必行。本研究发现,小胃间质瘤组织细胞自噬功能与正常胃间质组织相比,明显增强,如何将细胞自噬作为靶点,开辟新的治疗方案,将是未来间质瘤治疗的研究热点之一。
[1] Sui X, Chen R, Wang Z, et al. Autophagy and chemotherapy resistance: a promising therapeutic target for cancer treatment [J]. Cell Death Dis, 2013, 4: e838.
[2] CSCO胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识(2013年版)[J]. 临床肿瘤学杂志, 2013, 18(11): 1025-1032.
[3] Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor [J]. Hum Pathol, 2008, 39(10): 1411-1419.
[4] Wang J, Xu Y, Zou Y, et al. Overexpression of cannabinoid receptor 1 promotes renal cell carcinoma progression [J]. Tumour Biol, 2016. [Epub ahead of print]
[5] Choi KS. Autophagy and cancer [J]. Exp Mol Med, 2012, 44(2): 109-120.
[6] Giatromanolaki A, Koukourakis MI, Koutsopoulos AV, et al. Autophagy and hypoxia in colonic adenomas related to aggressive features [J]. Colorectal Dis, 2013, 15(5): e223-e230.
[7] Liu D, Gao M, Zhao S. Autophagy as a novel strategy for treatment of gastric cancer: a hypothesis [J]. Med Sci Monit, 2013, 19: 794-796.
[8] Cui J, Gong Z, Shen HM. The role of autophagy in liver cancer: molecular mechanisms and potential therapeutic targets [J]. Biochim Biophys Acta, 2013, 1836(1): 15-26.
[9] Ni HM, Bockus A, Wozniak AL, et al. Dissecting the dynamic turnover of GFP-LC3 in the autolysosome [J]. Autophagy, 2011, 7(2): 188-204.
[10] Lee HS, Daniels BH, Salas E, et al. Clinical utility of LC3 and p62 immunohistochemistry in diagnosis of drug-induced autophagic vacuolar myopathies: a case-control study [J]. PLoS One, 2012, 7(4): e36221.
[11] Romeo S, Debiec-Rychter M, Van Glabbeke M, et al. Cell cycle/apoptosis molecule expression correlates with imatinib response in patients with advanced gastrointestinal stromal tumors [J]. Clin Cancer Res, 2009, 15(12): 4191-4198.
[12] Gupta A, Roy S, Lazar AJ, et al. Autophagy inhibition and antimalarials promote cell death in gastrointestinal stromal tumor (GIST) [J]. Proc Natl Acad Sci U S A, 2010, 107(32): 14333-14338.
[13] Hsueh YS, Yen CC, Shih NY, et al. Autophagy is involved in endogenous and NVP-AUY922-induced KIT degradation in gastrointestinal stromal tumors [J]. Autophagy, 2013, 9(2): 220-233.
(责任编辑:马 军)
ExpressionsandclinicalsignificancesofLC3ⅡandP62insmallgastricstromaltumors
NIU Xiaoping1, HE Chiyi1, LIU Shaofeng1, ZHANG Wei2, HAN Zhen1
1.Department of Gastroenterology; 2.Department of Pathology, Yijishan Hospital, the First Affiliated Hospital of Wannan Medical College, Wuhu 241001, China
ObjectiveTo detect the expressions of autophagy-related gene LC3Ⅱ and P62 in patients with small gastric stromal tumors and healthy controls, and explore the roles of LC3Ⅱ and P62 in the occurrence and development of gastric stromal tumors.MethodsImmunohistochemistry was used to detect expressions of LC3Ⅱ and P62 among 21 cases of small gastric stromal tumor tissues and 16 cases of normal gastric tissues. Experimental groups: 21 cases of small stromal tumor were resected by endoscopy in Yijishan Hospital from Jan. 2013 to May. 2014. The median age of the patients was 52 years. Control group: 16 cases of peptic ulcer patients, who underwent gastrectomy in Yijishan Hospital were selected during the same period, the cases were postoperative pathologically confirmed normal gastric tissue. The median age was 47 years old. Expressions of P62 and LC3Ⅱ were detected by immunohistochemistry method (non-biotin two-step), semi-quantitative method of comprehensive analysis was used to quantify the results of immunohistochemistry.ResultsThe expressions of LC3Ⅱand P62 were positive both in normal gastric tissues and small gastric stromal tumor tissues. The expression of LC3Ⅱ was increased and the expression of P62 was significantly decreased in small gastric stromal tumor tissues compared with normal gastric tissues (P=0.000).ConclusionAutophagic activity in small gastric stromal tumors is significantly increased, which may be associated with occurrence and development of tumors.
Autophagy; LC3Ⅱ; P62; Small gastric stromal tumor
R735.2
A
1006-5709(2017)10-1138-03
2017-03-25
牛小平,副主任医师,博士,研究方向:消化系统疾病的诊断及治疗。E-mail:niuxiaoping@aliyun.com
何池义,硕士,主任医师,研究方向:消化病学及消化内镜学。E-mail:chiyihe@126.com
10.3969/j.issn.1006-5709.2017.10.018
