芒果苷脂质体的制备及其在Lewis肺癌移植瘤中的抗肿瘤作用及临床意义
2017-11-01李霞吴小程周人杰
李霞 吴小程 周人杰
·论著·
芒果苷脂质体的制备及其在Lewis肺癌移植瘤中的抗肿瘤作用及临床意义
李霞 吴小程 周人杰
目的探讨水溶性芒果苷脂质体对Lewis肺癌的治疗作用。方法采用薄膜法制备芒果苷脂质体,并对其形态粒径进行表征。MTT法测定其对Lewis肺癌细胞的抗增殖作用;流式细胞术测定其对Lewis肺癌细胞凋亡作用的影响;建立小鼠Lewis肺癌移植瘤模型,检测芒果苷脂质体体内抗肿瘤效果并采用。TUNEL法原位测定其对凋亡的影响。结果芒果苷脂质体为均匀的球状或近球状,平均粒径为(207.2±2)nm。MTT实验结果显示,芒果苷脂质体对Lewis肺癌细胞抑制作用显著高于游离芒果苷(P<0.05),与Lewis肺癌细胞作用12 h后芒果苷IC50为(45.2±5.1)μg/ml,芒果苷脂质体IC50为(32.7±4.6)μg/ml。作用24 h后,芒果苷IC50为(22.0±3.9)μg/ml,芒果苷脂质体IC50为14.8±2.7 μg/ml。而芒果苷脂质体在体内动物实验中同样表现出抗肿瘤活力,结果显示通过小鼠尾静脉给药后,可显著抑制Lewis移植瘤在小鼠体内的生长并且与对照组相比可延长生存期超过3 d。同时,流式细胞术分析Lewis细胞凋亡实验及TUNEL 法原位检测肿瘤组织细胞凋亡结果均显示芒果苷脂质体可以诱导Lewis肺癌细胞凋亡。结论芒果苷脂质体可用于静脉注射改善芒果苷水溶性问题,同时提高其抗肿瘤效应。
芒果苷; 脂质体; Lewis肺癌; 细胞增殖; 细胞凋亡
肺癌是最常见的恶性肿瘤之一,其在全球的发病率和死亡率均呈上升态势,尤其在我国等发展中国家,其上升尤其明显[1-2]。全国肿瘤登记中心 2014年发布的数据显示,2010年,我国新发肺癌病例 60.59万,其中男性41.63万例,女性18.96万例,居恶性肿瘤首位(男性首位,女性第2位),占恶性肿瘤新发病例的 19.59%(男性 23.03%,女性14.75%)[3]。目前,外科手术是肺癌治疗的首选方式,但是,许多患者在确诊为肺癌时已确诊为肺癌晚期,错失了手术机会。而化疗成为该类患者的首选治疗方案。同时,即使是成功实施手术的患者,化疗仍然对其具有重要意义。然而化疗药物存在选择性差、不良反应大,患者顺应性低,且容易产生多药耐药性等缺点。因此,研发更安全,不良反应低,特别是天然植物来源的新型化疗药物成为目前研发的热点。
芒果苷是一类从漆树科植物芒果Mangifera sylvaticaRoxb、百合科植物知母Anemarrhena asphodeloidesBunge 中分离得到的一种多酚羟基二苯并吡喃酮类化合物[4]。具有多种药理作用,如抗炎、抗氧化、抗菌、抗病毒等[5-6],同时,其对肿瘤的治疗作用也日益引起人们的重视。目前已有报道芒果苷对前列腺癌[7], 结肠癌[8-10], 白血病均表现出一定治疗作用[11],而其对肺癌的治疗作用逐步受到人们的重视。已有报道芒果对肺癌有良好的治疗效果[12-13]。但是芒果苷水溶性极差,仅为0.111 mg/ml[14],严重限制了其临床使用。而脂质体是一种新型药物载体,它具有改善药物溶解性,延长药物半衰期,提高药物靶向性,降低药物毒副作用及提高难溶性药物生物利用度等优点,目前被广泛应用为难溶性天然小分子药物载体[15]。移植瘤模型是指将人源细胞(组织)移植到小鼠体内,并以此为模型进行疾病发生机制和药物筛选的研究。目前肿瘤化疗所应用的大多数药物,都经动物移植性肿瘤试验而被发现,因此它是筛选抗肿瘤新药中最常用的模型。因此,为解决芒果苷的溶解性问题,提高其体内生物利用度,本研究将芒果苷制备成脂质体,并采用Lewis 肺癌移植瘤模型小鼠,旨在评价芒果苷脂质体在动物体内的抗肿瘤疗效以预测其临床效果,为其未来应用于临床提供理论支持。
材料与方法
一、实验动物
选择雄性C57BL/6小鼠32只,约8周龄,体重18~20 g(购于四川大学华西医学中心实验动物中心,合格证号:川实动管第9号)。每日自由饮水摄食。
二、细胞系及细胞培养
小鼠Lewis 肺癌细胞株溶于含10%小牛血清的DMEM 培养液在 37 ℃、5%二氧化碳孵箱中培养,细胞半贴壁生长,每2 d换培养液1 次,3~ 4 d 传代1次。
三、试剂与主要设备
芒果苷(mangiferin,美国Sigma公司);达尔伯克改良伊格尔培养液(DMEM,美国Gibieo BRL公司);胎牛血清(天津索莱宝生物工程有限公司);四甲基偶氮唑蓝(MTT,南京凯基生物科技发展有限公司);二甲基亚砜(DMSO,美国Sigma 公司);0.25% 胰蛋白酶(以色列Biological Industries 公司);TUNEL试剂盒(瑞士罗氏生物制剂公司);旋转蒸发仪;探头超声仪;马尔文粒径电位分析仪;离心机;CO2培养箱;超净工作台;倒置显微镜;酶标仪;流式细胞仪;分光光度计;荧光显微镜;超纯水设备。
四、实验方法
1. 薄膜法制备芒果苷脂质体: 采用薄膜法制备芒果苷脂质体。称取处方量的芒果苷、卵磷脂、胆固醇及聚乙二醇置于茄型瓶中,加入三氯甲烷并超声5 min,待其完全溶解后旋转蒸发除去有机溶剂,形成类脂薄膜。加入10 ml 磷酸盐缓冲溶液(PBS)(pH 6.5)洗脱膜材并水化15 min,将得到的混悬液放入冰水浴探头超声20 min,过0.22μm 滤膜后4 ℃保存,即得芒果苷脂质体。
2. 脂质体粒径测定及形态学研究: 取 100 μl 芒果苷脂质体,以去离子水稀释1 ml,马尔文粒度仪测定其粒径分布。另取少量芒果苷脂质体,用磷酸盐缓冲液稀释后,滴于载玻片上,用1%磷钨酸进行负染,再滴至覆有支持膜的铜网上,自然挥干,使粒子在铜网上浓缩沉积,用透射电子显微镜进行观察并拍摄照片。
3. MTT法测定Lewis 肺癌细胞增殖作用的影响: 消化收集对数增值期Lewis 肺癌细胞细胞悬液接种于96孔培养板中,每孔100 μl,培养24 h之后,加入用不同浓度的芒果苷脂质体或游离芒果苷至终浓度分别为7.25、12.5、25、50、100 μg/ml,对照组加入等量的空白脂质体(每组设置3个复孔,实验重复3次)。培养12或24 h。结束培养前4 h,加入MTT 20 μl/孔,37 ℃继续培养4 h。吸去上清液,每孔加入150 μl DMSO,37 ℃下轻微震摇10 min,使充分溶解。在酶标仪上,设定570 nm波长下检测每孔细胞的光密度值( OD570值),按下列公式计算抑制率:抑制率(%)=(1-加药组OD值/对照组OD值)×100%。
4. 流式细胞术分析凋亡和细胞周期: 取对数生长期的Lewis 肺癌细胞接种于6孔板内,待24 h细胞贴壁后,加入芒果苷脂质体或游离芒果苷至终浓度25 μg/ml,同时设对照组,处理细胞24 h后,收集细胞,以离心半径8 cm,1 800 r/min离心3 min,弃上清,PBS清洗2次,用0.2 ml PBS将细胞沉淀混匀,70%冷乙醇固定24 h,1 ml碘化丙啶(PI)染液(含50 mg/L PI,10%, Triton X-100和10 mg/L RNaseA),4 ℃避光染色30 min,用ESP型流式细胞仪(美国Coulter公司)检测凋亡率与细胞周期。
5. Lewis 肺癌荷瘤肿瘤模型建立及分组: 取对数生长期Lewis肺癌细胞,用0.25% 胰酶溶液消化,用不含血清的培养液吹打细胞制成细胞悬液,于小鼠右后肢靠背部皮下进行接种,每只C57BL/6小鼠接种1×106个细胞。待小鼠肿瘤直径约为5 mm×5 mm时(记为第0天) ,将荷瘤小鼠随机分为2组,每组8只,分别为模型对照组及芒果苷脂质体组。芒果苷脂质体组尾静脉注射给药,给药剂量按芒果苷10 mg/kg计算,每天一次,治疗7 d。另取8只C57BL/6小鼠作为正常对照组。治疗期间每3 d测量肿瘤的长短径,计算肿瘤的体积(V),V=a×b2×0.52 (单位: mm3,a长径,b短径),绘制肿瘤生长曲线及小鼠生存期。
6. TUNEL 法原位检测肿瘤组织细胞凋亡: 肿瘤组织用4%多聚甲醛溶液固定后,蜡块包埋,切片。采用TUNEL试剂盒原位检测肿瘤组织细胞凋亡情况。
五、统计学方法
结 果
一、脂质体粒径测定及形态学研究
芒果苷脂质体粒径为207.2±2 nm,且由透射电镜照片可见,芒果苷脂质体为粒径较均匀的球状或近球状小囊泡,脂质体粒度分布较窄,脂质体为球状或近球状,分散性较好。电镜下未见药物接近和脂质体聚集现象,见图1。

图1 芒果苷脂质体粒径测定及形态学研究;注:A:芒果苷脂质体透射电镜照片 (×30 000);B:芒果苷脂质体粒径测定结果
二、芒果苷脂质体对Lewis肺癌细胞生长的抑制作用
芒果苷脂质体对Lewis肺癌细胞抑制作用显著高于游离芒果苷(P<0.05),且与浓度和时间呈正相关性。作用12 h时,芒果苷IC50为(45.2±5.1)μg/ml,芒果苷脂质体IC50为(32.7±4.6)μg/ml。作用24 h时,芒果苷IC50为(22.0±3.9)μg/ml,芒果苷脂质体IC50为(14.8±2.7)μg/ml,见图2。
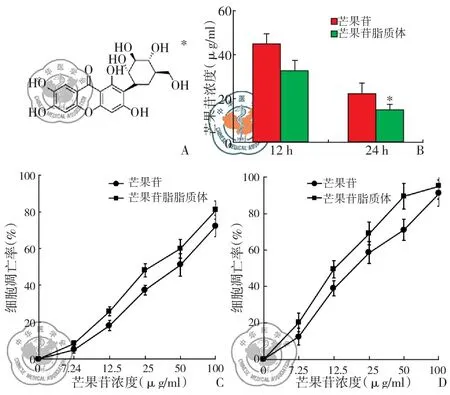
图2 芒果苷脂质体对Lewis肺癌细胞生长的抑制作用;注:A:芒果苷结构式;B:芒果苷脂质体及芒果苷在12或24 h时IC50;C:12 h时芒果苷及芒果苷脂质体对Lewis肺癌细胞抑制率;D:24 h时芒果苷及芒果苷脂质体对Lewis肺癌细胞抑制率(*P<0.05)
三、芒果苷脂质体对Lewis肺癌细胞周期的影响
芒果苷脂质体sub-G1期的细胞分布百分率〔(17.8±2.0)%〕与对照组〔(5.2±1.2)%〕相比增加(P<0.05),芒果苷脂质体sub-G1期细胞分布百分率为〔(6.9±2.0)%〕,显著高于对照组(P<0.05),但低于芒果苷脂质体组(P<0.05),见图3。该结果说明芒果苷可诱导Lewis肺癌细胞凋亡,而芒果苷脂质体可增强其效果。

图3 芒果苷脂质体对Lewis肺癌细胞周期的影响;注:A:不同细胞周期细胞百分比;B:流式细胞仪检测不同组Lewis肺癌细胞细胞周期情况
四、芒果苷脂质体对Lewis 肺癌荷瘤肿瘤模型中肿瘤生长的抑制作用
与模型对照组相比,芒果苷脂质体治疗抑制了Lewis 肺癌荷瘤肿瘤模型小鼠肿瘤的生长(P<0.05),与模型对照组相比生存期起码延长3 d,见图4。
五、芒果苷脂质体对Lewis 肺癌荷瘤肿瘤模型中肿瘤凋亡情况影响
与模型对照组相比,芒果苷脂质体治疗在荷瘤小鼠体内有效增加了肿瘤组织细胞凋亡,见图5。
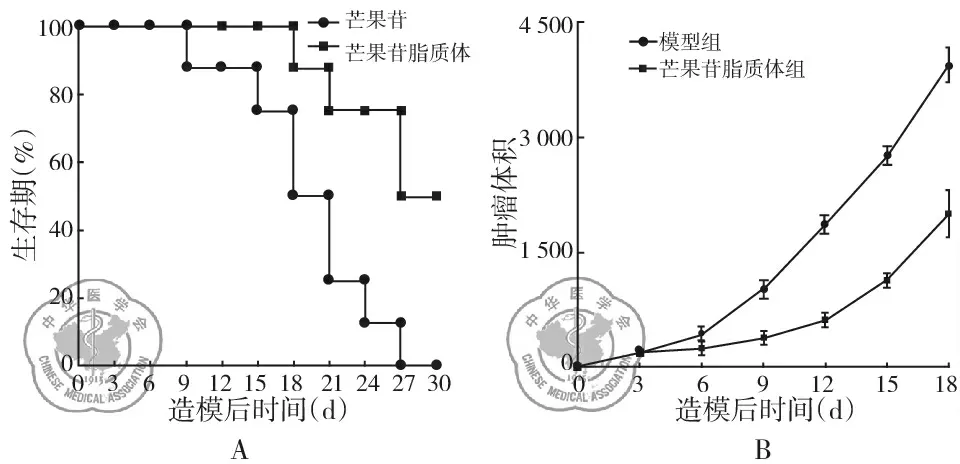
图4 芒果苷脂质体对Lewis 肺癌体内抑制情况;注:A:生存期;B:治疗后肿瘤体积变化
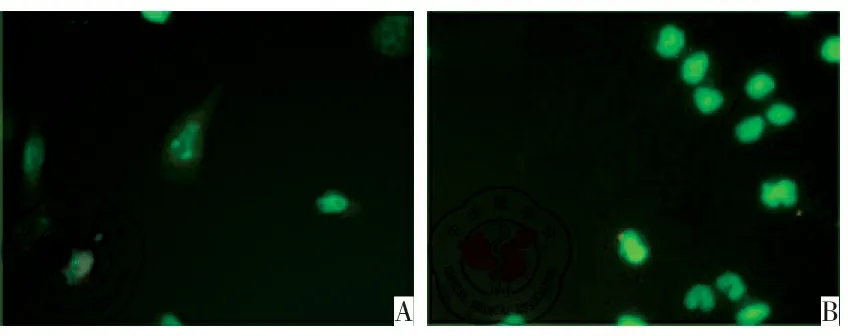
图5 芒果苷脂质体原位诱导凋亡情况;注:A:模型组;B:芒果苷脂质体组
讨 论
肺癌目前有多种治疗方法,如手术、化疗、放疗及生物免疫治疗等[16]。其中化疗是肺癌的主要治疗手段,但由于治疗费用高、化疗耐药以及药物的特殊不良反应,如胃肠道不良反应、骨髓抑制、肝脏毒性、脱发等因素,对患者造成许多不良的影响[17-18]。因此,深入研究肺癌机制,寻求安全有效且不良反应小的化疗药物越来越受到人们的关注。目前,“从植物中开发抗肿瘤药物”已成为国内外抗肿瘤新药开发的研究热点之一。
芒果苷作为一种天然的植物成分,可从漆树科芒果树和扁桃树的叶、果实、树皮及龙胆科植物东北龙胆、川西獐芽菜、水龙骨科植物光石韦等中提取[19]。近年研究显示芒果苷具有多方面的生理活性和药理作用,其抗肿瘤作用日益受到人们关注[20]。目前研究显示,吸烟是引起肺癌的最为主要的危险因素之一,对全球80% 男性肺癌患者及至少50%女性肺癌患者产生直接影响[21]。吸烟在体内引起氧化应激,该过程在肺癌的病理过程中扮演着极为重要的角色[22]。而具有抗氧化结构的天然产物可以有效的拮抗该过程,从而避免肺癌的发生。研究显示饮食中富含抗氧化结构的多酚类化合物可以有效预防肺癌的发生[23]。芒果苷具有多元酚结构,其体内抗氧化效果已被广泛报道。因此,研究者认为芒果苷可用于肺癌的防治并已得到部分证实。同时,做为植物提取物芒果苷安全性高,未见报道有明显毒副反应。因此芒果苷作为一种天然植物来源的抗肿瘤药物具有很大的优势。但是由于芒果苷水溶性极差,大多数研究采用了灌胃或腹腔注射的方式来进行体内研究,药物生物利用度较低且限制了芒果苷真正应用于临床。本研究中我们首次使用薄膜法制备芒果苷脂质体,实验结果证明芒果苷脂质体水溶性良好,粒度分布均匀,使得芒果苷可以通过静脉注射给药的方式来进行体内研究,同时为芒果苷做为药物应用于临床提供了一种新的方式。
本研究表征了芒果苷脂质体的形态和粒度,体外抗肿瘤作用,MTT及流式细胞术结果均表明芒果苷制备成脂质体后可有效提高芒果苷体外的抗肿瘤效果。通过我们建立的Lewis荷瘤小鼠模型,采用静脉注射给药方式治疗后发现芒果苷脂质体与普通芒果苷相比具有较强的抗肿瘤作用,显著抑制了Lewis移植瘤的生长,这与体外的实验结果相符。我们采用TUNEL法原位测定荷瘤小鼠瘤体细胞凋亡情况,结果也显示芒果苷脂质体在体内可有效诱导肿瘤细胞凋亡。因此,本研究为芒果苷做为新型植物来源的抗肿瘤药物切实应用于临床,提供了一种新的可能性。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及其原因[J/CD]. 中华肺部疾病杂志(电子版), 2011, 4(1): 1-6.
2 支修益, 石远凯, 于金明. 中国原发性肺癌诊疗规范(2015 年版)[J]. 中华肿瘤杂志, 2015, 37(1): 67-92.
3 姚晓军, 刘伦旭. 肺癌的流行病学及治疗现状[J]. 现代肿瘤医学, 2014, 22(8): 1982-1986.
4 Xu X, Chen Y, Song J, et al. Mangiferin suppresses endoplasmic reticulum stress in perivascular adipose tissue and prevents insulin resistance in the endothelium[J]. Eur J Nutr, 2017, doi: 10.1007/s00394-017-1441-z.
5 Dar A, Faizi S, Naqvi S, et al. Analgesic and antioxidant activity of mangiferin and its derivatives: The structure activity relationship[J]. Biol Pharm Bull, 2005, 28(4): 596-600.
6 Guha S, Ghosal S, Chattopadhyay U. Antitumor, immunomodulatory and anti-HIV effect of mangiferin, a naturally occurring glucosylxanthone[J].Chemotherapy, 1996, 42(6): 443-451.
7 Duang XY, Wang Q, Zhou XD, et al. Mangiferin: A possible strategy for periodontal disease to therapy[J]. Med Hypotheses, 2011, 76(4): 486-488.
8 García-Rivera D, Delgado R, Bougarne N, et al. Gallic acid indanone and mangiferin xanthone are strong determinants of immunosuppressive anti-tumour effects of Mangifera indica L[J] . Cancer Lett, 2011, 305(1): 21-31.
9 Noratto GD, Bertoldi MC, Krenek K, et al. Talcott SU: Anticarcinogenic effects of polyphenolics from mango (Mangifera indica) varieties[J]. J Agric Food Chem, 2010, 58(7): 4104-4112.
10 Chieli E, Romiti N, Rodeiro I, et al. In vitro effects of Mangifera indica and polyphenols derived on ABCB1/P-glycoprotein activity[J]. Food Chem Toxicol, 2009, 47(11): 2703-2710.
11 Cheng P, Peng ZG, Yang J, et al. The effect of mangiferin on telomerase activity and apoptosis in leukemic K562 cells[J]. Zhong Yao Cai, 2007, 30(3): 306-309.
12 吕建珍, 于洋, 邓源, 等. 芒果苷对肺癌A549细胞增殖与凋亡的影响[J]. 四川大学学报(自然科学版), 2013, 50(3): 611-614.
13 Peramaiyan R, Ganapathy E, Dhanapal S. Protective role of mangiferin against Benzo(a)pyrene induced lung carcinogenesis in experimental animals[J]. Biol Pharm Bull, 2008, 31(6): 1053-1058.
14 JoséRobertor DS, JoseéIvanx DC, Mariateresas T, et al. Chitosancoated pectin beads: Characterization and in vitro release of mangiferin[J]. Food Hydrocolloids, 2009, 23(8): 2278-2286.
15 Dicheva BM, Ten hagen TL, Li L, et al. Cationic thermosensitive liposomes: a novel dual targeted heattriggered drug delivery approach for endothelial and tumor cells[J]. Nano Lett, 2013, 13(6): 2324-2331.
16 Lin J, Gill A, Zahm SH, et al. Metformin use and survival after non-small cell lung cancer: A cohort study in the U.S. military health system[J]. Int J Cancer, 2017, 141(2): 254-263.
17 方楚玲, 郭琳琅. miRNA对肺癌化疗耐药调控研究进展[J]. 中华肿瘤防治杂志, 2014, 21(1): 72-76.
18 张永军, 张爱琴, 包文龙, 等. 榄香烯抑制p21基因表达逆转肺癌化疗耐药的实验研究[J]. 中华中医药学刊, 2015, 51(12): 59-61.
19 Zhu L, Wang Z, Zhai X, Sui Z, et al. Simultaneous quantitative determination of 13 active components in the traditional Chinese medicinal preparation Suanzaoren oral liquid by HPLC coupled with diode array detection and evaporative light scattering detection[J]. J Sep Sci, 2017, 40(11): 2320-2325.
20 Gold-Smith F, Fernandez A, Bishop K. Mangiferin and Cancer: Mechanisms of Action[J]. Nutrients, 2016, 8(7): E396.
21 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
22 Witschi H, Uyeminami D, Moran D, et al. Chemoprevention of tobacco-smoke lung carcinogenesis in mice after cessation of smoke exposure[J]. Carcinogenesis, 2000, 21(5): 977-982.
23 Niedzwiecki A, Roomi MW, Kalinovsky T, et al. Anticancer efficacy of polyphenols and their combinations[J]. Nutrients, 2016, 8(9): E552.
PreparationofmangiferinliposomeanditsantitumoreffectontransplantedLewislungcarcinomaanditsclinicalsignificance
LiXia,WuXiaocheng,ZhouRenjie.
EmergencyDepartment,XinqiaoHosptial,ThirdMilitaryMedicalUniversity,Chongqing400037,China
ZhouRenjie,Email:zhou_rj@aliyun.com
ObjectiveTo prepare water soluble mangiferin liposome and observe its effect on inhibiting the growth of transplanting Lewis lung carcinoma.MethodMangiferin liposome was prepared by film dispersion methodo. The shape, particles size of the liposome was characterized. Anti-proliferation and apoptosis effects induced by mangiferin liposome on the Lewis lung carcinoma cells were determined by MTT method and flow cytometric analysis in vitro. The model of mice carried Lewis lung carcinoma was established. The effect of mangiferin liposome on anti-tumor and apoptosis in vivo was investigated.ResultThe result of electromicrography showed that the liposomes consisted of small spherical or similar to spherical. The average diameter of mangiferin liposome was 207.2±2 nm. Meanwhile, the results of MTT indicated that Mangiferin liposome could more effective inhibit the proliferation of Lewis lung carcinoma than free Mangiferin (P<0.05). The IC50of Mangiferin liposome is 32.7±4.6 μg/ml on 12 h after Mangiferin treatment and the IC50of free Mangiferin is 45.2±5.1 μg/ml on the same time point. 24 hours later, the IC50of Mangiferin liposome is14.8±2.7 μg/ml. In contrast, the IC50of free Mangiferin is 22.0±3.9 μg/ml. The results in vivo also exhibited the anti-tumor effect of Mangiferin liposmes. Mangiferin liposmes could suppressed tumor growth efficiently and prolong the survival time more than 3days as control group. Furthermore, both flow cytometry of Lewis cell and TUNEL assay indiacated that mangiferin liposomes could induce apoptosis of Lewis lung carcinoma cells both in vitro and in vivo in our studies.ConclusionLiposome delivery system could effectively improve water solubility of mangiferin, and promote the anti-tumor effect.
Mangiferin; Liposome; Lewis lung carcinoma; Proliferation; Apoptosis
10.3877/cma.j.issn.1674-6902.2017.05.006
国家自然科学基金资助项目(30972964)
400037 重庆,第三军医大学新桥医院急诊科
周人杰, Email: zhou_rj@aliyun.com
R563
A
2017-04-25)
(本文编辑:王亚南)
李霞,吴小程,周人杰. 芒果苷脂质体的制备及其在Lewis 肺癌移植瘤中的抗肿瘤作用及临床意义[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(5): 534-538.
