鸡源肠炎沙门氏菌快速检测方法的建立及其分离株的耐药性分析
2017-10-23范忠军许保疆翟崇凯王欢莉
范忠军,许保疆,翟崇凯,郁 川,王欢莉
(1.盐城师范学院 海洋与生物工程学院,江苏 盐城 224002; 2.河南省农业科学院,河南 郑州 450002; 3.河南科技大学 动物疫病与公共卫生重点实验室,河南 洛阳 471003)
鸡源肠炎沙门氏菌快速检测方法的建立及其分离株的耐药性分析
范忠军1,许保疆2,翟崇凯3,郁 川3,王欢莉1
(1.盐城师范学院 海洋与生物工程学院,江苏 盐城 224002; 2.河南省农业科学院,河南 郑州 450002; 3.河南科技大学 动物疫病与公共卫生重点实验室,河南 洛阳 471003)
为探讨鸡源肠炎沙门氏菌的耐药机制,参照GenBank中肠炎沙门氏菌特异性序列sdfⅠ 设计引物,优化反应条件,建立鸡源肠炎沙门氏菌的PCR检测方法,用建立的检测方法对临床样品分离株进行检测,并应用K-B纸片扩散法和PCR方法检测分离株对22种药物的敏感性和耐药基因的分布情况。结果显示,建立的检测方法可有效扩增出203 bp的目的基因,DNA最低检出量为100 pg/μL,菌液最低检出浓度为4×103cfu/mL,PCR方法检测结果与传统检测方法的符合率为100%;药敏试验结果表明,56株鸡源肠炎沙门氏菌分离株对22种抗生素表现出不同程度的耐药性,其中对青霉素(98.21%)和红霉素(96.43%)的耐药性最高;耐药基因检测发现,tetA、aph(3′)-Ⅱa、blaCMY-2、cat1和sul1的检出率较高,均大于50%。可见,建立的PCR方法可有效检测鸡源肠炎沙门氏菌,鸡源肠炎沙门氏菌分离株耐药性严重,耐药基因广泛存在于耐药菌株中。
鸡; 肠炎沙门氏菌; 检测; 药敏试验; 耐药基因
沙门氏菌是一种重要的人兽共患病病原菌,在自然界分布广泛,血清分型多,有2 500多种血清型,其中肠炎沙门氏菌和鼠伤寒沙门氏菌有较为重要的公共卫生学意义[1-2]。肠炎沙门氏菌有较强的体外生存能力,其主要宿主是家禽,不仅可以感染家禽发生胃肠炎,也可通过污染肉蛋产品引起食物中毒[3-6]。近年来,肠炎沙门氏菌渐渐超越鼠伤寒沙门氏菌成为流行的优势血清型菌株[2]。随着养殖规模的大型化和集约化以及抗生素药物的滥用,肠炎沙门氏菌耐药性日趋严重,动物的感染率和发病率也逐渐上升,严重影响养殖业的经济效益和人类健康[7-9]。
传统凝集试验检测鸡源肠炎沙门氏菌费时费力,敏感性和特异性均不高。此外,鸡源肠炎沙门氏菌常与鸡白痢、鼠伤寒沙门氏菌发生交叉反应,而且感染鸡源肠炎沙门氏菌的症状和病变与感染鸡白痢沙门氏菌极为相似,在生产中常常把鸡源肠炎沙门氏菌感染误诊为鸡白痢[10-14]。因此,建立鸡源肠炎沙门氏菌快速、特异性检测方法具有重要的公共卫生意义[15-16]。本研究根据Agron等[17]筛选出的肠炎沙门氏菌种特异sdfⅠ 序列设计引物,建立检测鸡源肠炎沙门氏菌的PCR方法,同时对临床鸡源肠炎沙门氏菌分离株进行药物敏感性试验,并对5类常见抗生素的相关耐药基因进行PCR扩增,旨在为确定鸡源肠炎沙门氏菌耐药基因的分布及其耐药机制的研究提供依据。
1 材料和方法
1.1供试菌株
鸡白痢沙门氏菌标准株C79-13、猪霍乱沙门氏菌标准株C78-1、鼠伤寒沙门氏菌标准株SL1344及大肠杆菌ATCC 25922购自中国兽医药品监察所;鸡源肠炎沙门氏菌、鸡源鼠伤寒沙门氏菌、鸡白痢沙门氏菌、鸡源大肠杆菌、金黄色葡萄球菌、巴氏杆菌以及采自豫西地区的75份鸡血清样品均由河南科技大学动物疫病与公共卫生重点实验室保存。
1.2主要试剂
TaqDNA 聚合酶、dNTPs、10×PCR Buffer、DNA Marker 购自TaKaRa公司;22种抗生素药敏纸片、微量生化管、麦康凯培养基、SS 培养基等购自杭州天和微生物试剂有限公司;胰蛋白胨、酵母提取物购自英国OXOID 公司;沙门氏菌诊断血清购自宁波天润生物药业有限公司;细菌基因组提取试剂盒购自天根生化科技有限公司。
1.3细菌基因组DNA的提取与测定
按照试剂盒说明书分别提取鸡源肠炎沙门氏菌、鸡白痢沙门氏菌、猪霍乱沙门氏菌、鼠伤寒沙门氏菌、鸡源大肠杆菌、金黄色葡萄球菌、巴氏杆菌标准株或分离株的基因组DNA,测定并计算基因组DNA的浓度和纯度,于-20 ℃保存。
1.4检测种特异基因序列sdfⅠ的PCR方法的建立
1.4.1 引物的设计合成 根据肠炎沙门氏菌特异基因序列sdfⅠ (登录号:AF370707.1),应用软件Primer Premier 5.0 设计引物,上游引物P1:5′-AGAGGCGGTTTGATGTGGTTGGT-3′;下游引物P2:5′-GAAGGTGGTGGCTGGCGAATGGT-3′;预期扩增长度为203 bp。引物由北京鼎国昌盛生物技术有限责任公司合成。
1.4.2 扩增体系及程序 通过对退火温度、引物浓度等条件的优化,最终确定反应体系为:10×PCR Buffer 2.5 μL,Mg2+1.5 μL,dNTPs 1 μL,TaqDNA 聚合酶(5 U/μL) 0.3 μL,DNA 模板1 μL,上、下游引物(25 μmol/L)各1 μL,加灭菌超纯水补至25 μL。反应条件为:95 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸40 s,共30个循环;最后72 ℃延伸10 min。PCR 产物进行1.0%琼脂糖凝胶电泳,将阳性条带切胶回收,送上海生工生物工程技术服务有限公司测序。
1.5PCR特异性和敏感性检测
1.5.1 PCR特异性检测 分别提取鸡源肠炎沙门氏菌、鸡白痢沙门氏菌、猪霍乱沙门氏菌、鼠伤寒沙门氏菌、鸡源大肠杆菌、金黄色葡萄球菌、巴氏杆菌标准株及分离株的基因组DNA,按上述扩增体系及程序进行PCR,以超纯水为阴性对照,测定建立的PCR检测方法的特异性。
1.5.2 检测菌液敏感性试验 用灭菌超纯水将鸡源肠炎沙门氏菌菌液10倍梯度分别稀释至4×106、4×105、4×104、4×103、4×102、4×101、4×100cfu/mL,以超纯水为阴性对照,取1 μL作为模板进行PCR 扩增。
1.5.3 检测DNA敏感性检测 提取鸡源肠炎沙门氏菌基因组DNA,用灭菌超纯水分别将DNA模板稀释至100 ng/μL、50 ng/μL、10 ng/μL、1 ng/μL、500 pg/μL、100 pg/μL、50 pg/μL、10 pg/μL,取1 μL作为模板进行PCR 扩增并电泳检测。
1.6临床样品的检测
对采自豫西地区的75份临床样品进行鸡源肠炎沙门氏菌的分离鉴定[18],同时对分离菌株用上述建立的PCR方法进行检测。
1.7鸡源肠炎沙门氏菌分离株药敏试验
用K-B纸片扩散法测定鸡源肠炎沙门氏菌分离株对抗生素的敏感性,以大肠杆菌ATCC 25922为药敏质控菌株。用游标卡尺测量抑菌环的直径,抑菌环的边缘以肉眼见不到细菌明显生长为限,然后根据抑菌环直径大小判断细菌的药物敏感性。
1.8耐药基因的PCR扩增
根据GenBank中登录的相关抗生素耐药基因序列,参照文献[19-21],设计14对引物(表1),分别用于扩增四环素类的5种耐药基因、氨基糖苷类的2种耐药基因、β-内酰胺类3种耐药基因、氯霉素类1种耐药基因和磺胺类3种耐药基因。PCR反应体系:10×PCR Buffer 2.5 μL,Mg2+1.5 μL,dNTPs 1 μL,TaqDNA 聚合酶(5 U/μL) 0.3 μL,DNA 模板1 μL,上、下游引物各1 μL,灭菌超纯水补至25 μL。反应条件:95 ℃预变性5 min;95 ℃变性30 s,退火温度(表1)退火 30 s,72 ℃延伸45 s,30个循环;最后72 ℃延伸10 min。

表1 耐药基因PCR扩增的引物序列
1.9临床样品耐药基因的序列分析
将扩增产物送上海生工生物工程技术服务有限公司进行测序,并将测序结果与GenBank中的相应耐药基因序列进行同源性比较分析。
2 结果与分析
2.1鸡源肠炎沙门氏菌sdfⅠ序列的PCR特异性检测结果
鸡源肠炎沙门氏菌能够扩增出约200 bp大小的特异性条带,而其他血清型的沙门氏菌、大肠杆菌、巴氏杆菌、金黄色葡萄球菌以及阴性对照均无条带出现(图1)。将阳性条带切胶回收后进行测序,结果经BLAST比对发现,扩增条带的序列(203 bp)与目的基因序列的同源性为100%。表明本研究建立的PCR检测方法可以对肠炎沙门氏菌进行扩增,且有较强特异性。

M.DNA Marker; 1.阴性对照; 2.鸡源肠炎沙门氏菌; 3.猪霍乱沙门氏菌; 4.鸡白痢沙门氏菌; 5.鼠伤寒沙门氏菌; 6.鸡源大肠杆菌; 7.巴氏杆菌; 8.金黄色葡萄球菌图1 PCR的特异性试验结果
2.2鸡源肠炎沙门氏菌sdfⅠ序列的PCR敏感性检测结果
分别以10倍梯度稀释的鸡源肠炎沙门氏菌菌液和不同质量浓度基因组DNA为模板进行PCR扩增。结果显示,鸡源肠炎沙门氏菌菌液最低检出浓度为4×103cfu/mL(图2),基因组DNA最低检出量为100 pg/μL(图3)。
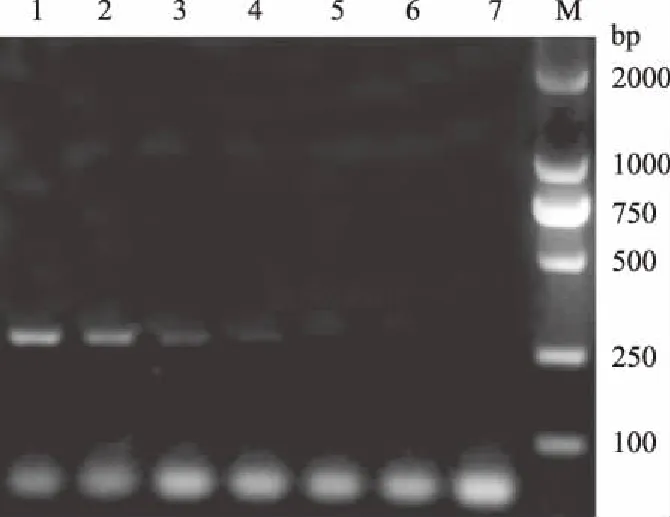
M.DNA Marker; 1—7.菌液浓度分别为4×106、 4×105、4×104、4×103、4×102、4×101、4×100 cfu/mL 图2 PCR的菌液敏感性试验结果

M.DNA Marker; 1—8.模板含量分别为100 ng/μL、50 ng/μL、 10 ng/μL、1 ng/μL、500 pg/μL、100 pg/μL、50 pg/μL、10 pg/μL图3 PCR的DNA敏感性试验结果
2.3鸡源肠炎沙门氏菌临床样品的检测结果
用建立的PCR方法对75份临床样品进行检测,其中 56株肠炎沙门氏菌分离株sdfⅠ 基因的PCR鉴定结果为阳性,非肠炎沙门氏菌的PCR鉴定结果均为阴性,特别是与肠炎沙门氏菌极易混淆的鸡白痢沙门氏菌和鸡伤寒沙门氏菌的PCR鉴定结果也均为阴性。可见,本研究建立的鸡源肠炎沙门氏菌特异性PCR检测方法的检测结果与传统方法一致。
2.4鸡源肠炎沙门氏菌分离株药敏试验结果
由表2可知,56株鸡源肠炎沙门氏菌分离株对22种抗生素表现出不同程度的耐药性,其中对青霉素(98.21%)和红霉素(96.43%)的耐药性最高,对阿奇霉素(67.86%)、氨苄西林(57.14%)、复方新诺明(53.57%)、磺胺甲恶唑(50.00%)的耐药性其次,对亚胺培南和多黏菌素B有着较高的敏感性。同时肠炎沙门氏菌对同一类药物中不同药物的耐药性也存在较大的差异。在头孢类药物中,耐药率依次为头孢噻肟(37.50%)、头孢唑啉(17.86%)、头孢曲松(14.29%)。在喹诺酮类药物中,耐药率依次为环丙沙星(21.43%)、诺氟沙星(16.07%)、氧氟沙星(12.5%)和萘啶酸(8.93%)。
此外,根据每株肠炎沙门氏菌分离株的抗生素敏感性发现,鸡源肠炎沙门氏菌分离株多重耐药性十分严重,大部分菌株以多重耐药为主,最多的耐18种抗生素;4~8重耐药菌株最多,有44株,占78.57%;10~14重耐药菌株有7株(12.5%);16重和18重耐药菌株各有1株(1.79%)。
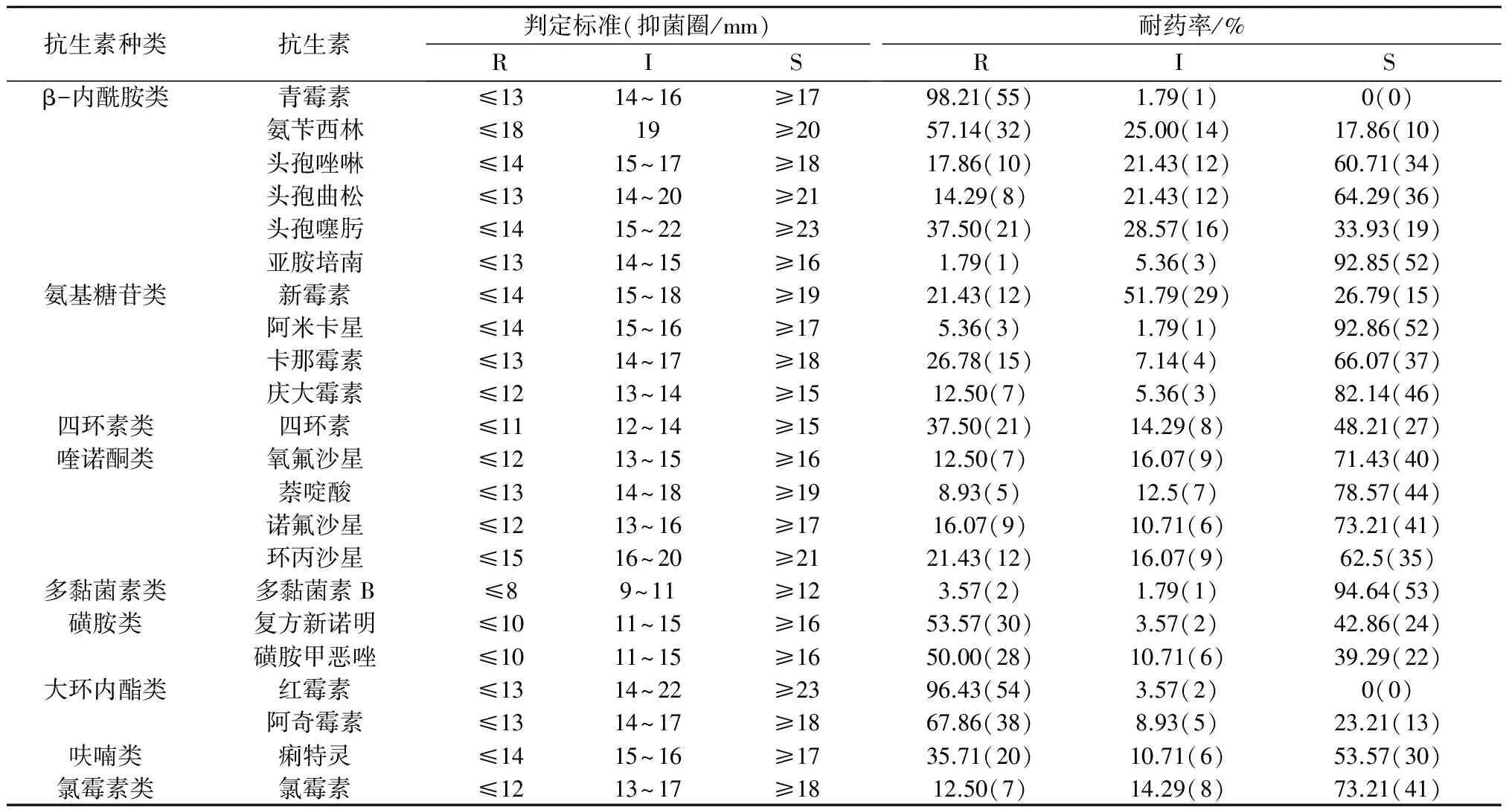
表2 56株鸡源肠炎沙门氏菌分离株对22种抗生素的敏感性试验结果
注:括号内数字表示对应判定标准下检测出的菌株数。R表示细菌对某种抗菌药耐药;I表示细菌对抗菌药中度敏感;S表示细菌对抗菌药敏感。
2.5鸡源肠炎沙门氏菌分离株耐药基因的检测结果
由表3可知,四环素类耐药菌株tetA(54.84%)、tetX(41.94%)耐药基因的检出率较高,tetC耐药基因检出率为6.45%,未检测出tetM耐药基因;氨基糖苷类耐药菌株中aph(3′)-Ⅱa耐药基因的检出率(52.94%)高于aadA1基因(35.29%);β-内酰胺类耐药基因的检出率最高,其中blaCMY-2基因的检出率(63.63%)明显高于blaTEM-1基因(29.09%);氯霉素类耐药菌株中cat1基因的检出率为71.42%;磺胺类耐药菌株中耐药基因sul1、sul2、sul3的检出率分别为53.33%、36.67%、23.33%,其中,耐药基因sul1和sul2在4个菌株中同时存在。测序结果表明,各分离株耐药基因序列与参照株序列具有高度的同源性。耐药基因tetA、aph(3′)-Ⅱa、blaCMY-2、cat1和sul1的检出率均大于50%。
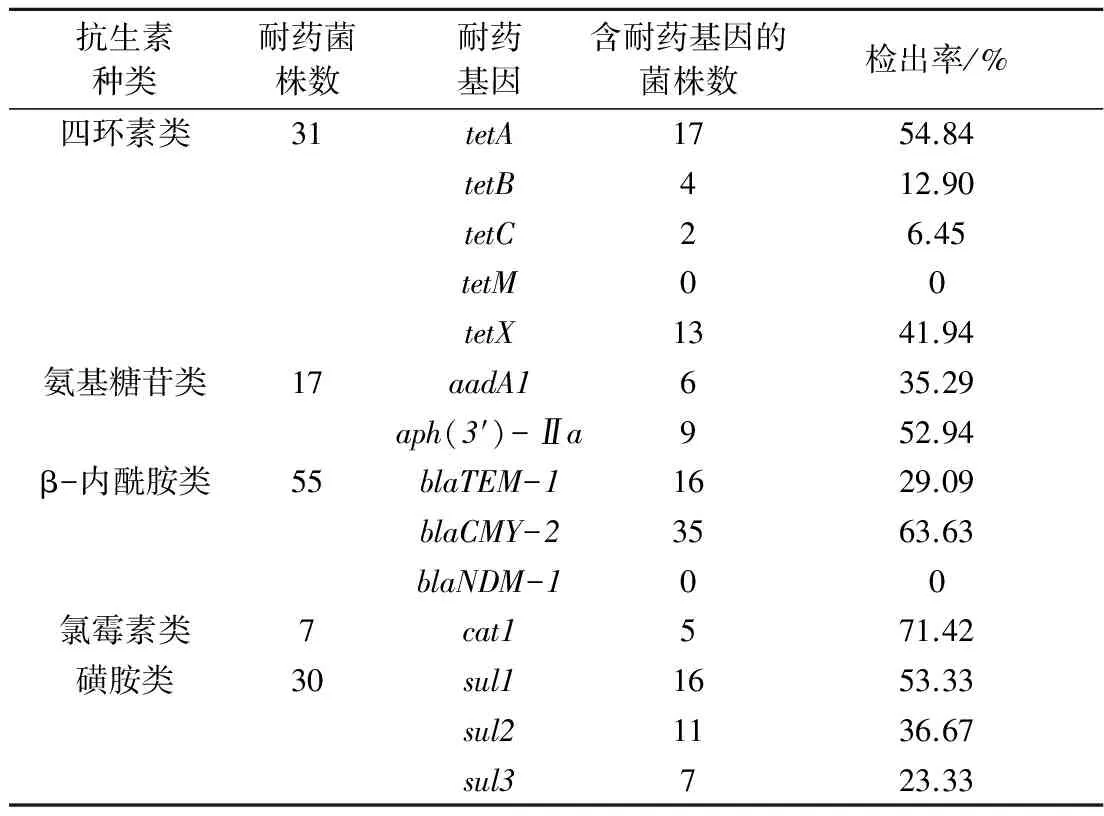
表3 含耐药基因的菌株数与耐药菌株数的关系
3 结论与讨论
影响食品安全的沙门氏菌主要血清型是肠炎沙门氏菌和鼠伤寒沙门氏菌,其中肠炎沙门氏菌是目前流行的优势血清型。鸡源肠炎沙门氏菌传统血清学检测方法费时费力,敏感性和特异性均不高,常与鸡白痢、鼠伤寒沙门氏菌发生交叉反应,导致检测时出现假阳性结果。为了能够客观、准确、快速地鉴定肠炎沙门氏菌,许多学者对肠炎沙门氏菌不同基因进行PCR扩增和检测,寻找肠炎沙门氏菌的特异性基因,但这些基因均不能特异地检测肠炎沙门氏菌[4]。直到Agron等[17]通过抑制消减杂交法(subtractive hybridization)筛选出肠炎沙门氏菌的种特异序列sdfⅠ ,才为建立肠炎沙门氏菌的PCR检测方法提供了科学依据。本试验根据肠炎沙门氏菌sdfⅠ 序列设计引物,建立鸡源肠炎沙门氏菌的PCR 检测方法。试验结果表明,建立的PCR 检测方法具有较高的可靠性、特异性和敏感性,能有效避免假阳性结果的出现而提高检测准确率。同时,该PCR方法可大大缩短检测时间,可用于临床上鸡源肠炎沙门氏菌的快速检测及分子流行病学调查。
对56株鸡源肠炎沙门氏菌临床分离株进行药敏试验发现,分离株对青霉素、红霉素、氨苄西林、阿奇霉素、磺胺甲恶唑、复方新诺明6种抗生素有很高的耐药性,对亚胺培南和多黏菌素B有一定的敏感性。由于临床上对某些抗生素的禁用和控制,分离菌株对氯霉素(73.21%)、痢特灵(53.57%)和萘啶酸(78.57%)的敏感率较高,说明加强兽药的管理对于减少耐药性具有一定意义。本研究还发现,鸡源肠炎沙门氏菌分离株的多重耐药现象也十分严重,大部分菌株以4重以上耐药为主,4~8重耐药菌株最多,有的菌株可耐18种抗生素。因此,临床上一定要合理使用抗生素,严格控制抗生素使用类型和周期,减轻对细菌的选择性压力,降低细菌耐药发生概率。
检测细菌耐药基因的PCR方法比药敏试验快速、可靠,而且能监测到细菌的隐性耐药性。本研究对56株肠炎沙门氏菌分离株进行了四环素类、氨基糖苷类、β-内酰胺类、氯霉素类和磺胺类5大类药物常见耐药基因进行检测,结果表明,大部分分离株的耐药表型与耐药基因的分布相符合,少部分耐药基因与耐药表型的分布不一致。有部分菌株的耐药表型中未能检测到相应的耐药基因如tetM和blaNDM-1,其耐药机制有待进一步研究。也有少数菌株能够检测到耐药基因,但却未表现出相应的耐药表型,这可能是因为该耐药基因处于沉默状态或者受到其他因素的抑制。另外,部分同类耐药表型的菌株含有2种及以上相关的耐药基因,这可能与细菌耐药基因的水平转移有关[22]。
综上,本研究建立的肠炎沙门氏菌PCR检测方法可用于临床上鸡源肠炎沙门氏菌的快速检测,同时可对分离的56株鸡源肠炎沙门氏菌进行耐药性分析,这对鸡源肠炎沙门氏菌的流行病学调查以及预防控制均具有重要的临床意义。
[1] 杨林,娄亚坤,宿春虎,等.多重PCR方法快速鉴别肠炎、鼠伤寒、鸡白痢及鸡伤寒沙门氏菌[J].畜牧兽医学报,2014,45(2):268-273.
[2] 陆广富.肠炎沙门氏菌的分离鉴定与特异性检测方法的建立[D].扬州:扬州大学,2010.
[3] 索标,李玺,王娜,等.滤纸覆盖法采样检测食品加工台面上食源性致病菌的研究[J].河南农业大学学报,2016,50(6):811-817.
[4] Hardy J.Salmonella:A continuing problem[J].Postgrad Med J,2004,80:541-545.
[5] 邓树轩,程安春,汪铭书,等.肠炎沙门氏菌种特异性PCR及对感染鸭快速检测[J].中国兽医学报,2009,29(2):153-157.
[6] 汪敏.肠炎沙门氏菌实验性感染雏鸡的研究[D].重庆:西南大学,2009.
[7] 岳秀英,汪开毓.四川省2009—2014年鸡源沙门氏菌耐药性变迁的调查[J].中国兽医科学,2015,45(5):544-550.
[8] 王学君,卢春洪,王源,等.猪源沙门氏菌携带Ⅰ类整合子向人源细菌体外转移的研究[J].天津农业科学,2015,21(10):16-18.
[9] 舒刚,马驰,黄春,等.4种中药复方对大肠杆菌、沙门氏菌R质粒的消除作用[J].河南农业科学,2013,42(11):149-153.
[10] 张艳红,吴延功,杜元钊,等.沙门氏菌快速检测方法研究进展[J].动物医学进展,2001(2):39-41,48.
[11] 叶朗光,黎松庆,邓树轩,等.肠炎沙门氏菌感染及其检测方法研究进展[J].畜牧与饲料科学,2009(1):103-104.
[12] 徐芳,降磊,牛晋国.垂直传播引起的鸡沙门氏菌病的诊断与防治[J].山西农业科学,2013,41(3):267-269.
[13] 薛俊龙,田林君,张国权,等.山西省鸡沙门氏菌病流行病学调查分析[J].山西农业科学,2010,38(9):58-62.
[14] 温海燕. 鸡白痢沙门氏菌的分离鉴定及耐药性分析[J].河南农业科学,2014,43(8):130-132.
[15] 方平,杨永莉,杨宝,等. Real-time PCR方法检测肉品中的沙门氏菌[J].山西农业科学,2010,38(8):71-76.
[16] 洪艳,贺凡,王晓闻. LAMP检测沙门氏菌方法的建立[J].山西农业科学,2014,42(4):340-342.
[17] Agron P G,Walker R L,Kinde H,etal.Identification by subtractive hybridization of sequences specific forSalmonellaentericaserovar enteritidis[J].Appllied and Environmental Microbiology,2001,67(11):4984-4991.
[18] 中华人民共和国卫生部.实验动物沙门菌检测方法:GB/T 14926.1—2001[S].北京:中国标准出版社,2002.
[19] Ng L K,Martin I,Alfa M,etal.Multiplex PCR for the detection of tetracycline resistant genes[J].Mol Cell Probes,2001,15(4):209-215.
[20] 刘维红.猪源致病性沙门氏菌耐药基因PCR和基因芯片检测技术研究[D].成都:四川大学,2005.
[21] 余聪.厦门沙门氏菌耐药基因和PFGE分型的研究[D].福州:福建农林大学,2008.
[22] 王丹,刘芳萍,李昌文,等.鸡源多重耐药沙门氏菌转座子与耐药基因的研究[J].中国家禽,2012,34(18):9-12.
Establishment of Rapid Detection Method ofSalmonellaenteritidisand Drug Resistance Analysis of Isolates from Chickens
FAN Zhongjun1,XU Baojiang2,ZHAI Chongkai3,YU Chuan3,WANG Huanli1
(1.School of Marine and Biological Engineering,Yancheng Teachers University,Yancheng 224002,China; 2.Henan Academy of Agricultural Sciences,Zhengzhou 450002,China; 3.The Key Lab of Animal Disease and Public Security,Henan University of Science and Technology,Luoyang 471003,China)
To further investigate the mechanism of antibiotic resistance ofSalmonellaenteritidis(S.enteritidis),the specific primers were designed,based onsdfⅠ ofS.enteritidisfrom the GenBank.A PCR method forS.enteritidisdetection was developed after optimizing reaction conditions,and used for detection of clinicalS.enteritidisisolated from chickens.The isolates were evaluated for antimicrobial sensitivity by K-B disc diffusion method against 22 antimicrobial drugs and the resistance genes of the isolates were detected by PCR.Electrophoresis showed that 203 bp fragment was detected,and the PCR assay could detect 100 pg/μL of DNA sensitivity,and 4×103cfu/mL of the bacteria sensitivity,respectively.Compared with the traditional serological assay,the coincidence rate of the PCR for the isolates were 100%.The results of drug sensitive test showed that 56 isolates were resistance to the 22 antimicrobial agents in some degree,and penicillin(98.21%) and erythromycin(96.43%) were the highest.Test of resistance genes exhibited that the detectable rate of genetetA,aph(3′)-Ⅱa,blaCMY-2,cat1 andsul1 was higher(more than 50%).In conclusion,the developed PCR assay was more specific,sensitive and rapid for the detection ofS.enteritidis,and was able to be used for the rapid identification ofS.enteritidisand epidemiological investigation.The resistance analysis results showed that the problem of resistance was serious,and resistance genes were widely existed in the resistant strains.
chicken;Salmonellaenteritidis; detection; drug sensitive test; resistance gene
S855.1
A
1004-3268(2017)10-0137-06
2017-05-16
盐城市农业科技指导性计划项目(YKN2013014);盐城师范学院博士科研基金项目(12YSYJB0116)
范忠军(1978-),江苏盐城人,讲师,博士,主要从事禽类疾病预防与控制研究。E-mail:fzj811@126.com
