生物钟的秘密——2017年诺贝尔生理学或医学奖简介
2017-10-20李禹正王晓民
李禹正 张 婷 王晓民,3*
(1.首都医科大学长学制临床医学专业, 北京 100069;2.首都医科大学基础医学院神经生物学系, 北京 100069;3 北京脑重大疾病研究院, 北京 100069)
·诺贝尔奖·
生物钟的秘密——2017年诺贝尔生理学或医学奖简介
李禹正1张 婷2王晓民2,3*
(1.首都医科大学长学制临床医学专业, 北京 100069;2.首都医科大学基础医学院神经生物学系, 北京 100069;3 北京脑重大疾病研究院, 北京 100069)
北京时间2017年10月2日,瑞典卡罗琳斯卡医学院在斯德哥尔摩宣布,将2017年诺贝尔生理学或医学奖授予美国科学家Jeffrey C. Hall,Michael Rosbash以及Michael W. Young,以表彰他们在“生物节律的分子机制”方面的发现。
2017诺贝尔生理学或医学奖;生物钟;昼夜节律
地球上的所有生命都需要适应地球的自转。所有的生命体,包括人类,都有一个体内的“时钟”,使我们能够适应昼夜变换,调节生命活动。但这个生物钟到底是如何工作的?Jeffrey C. Hall、Michael Rosbash和 Michael W. Young三人对生物钟的分子机制进行了研究。他们的研究成果揭示了植物、动物以及人类如何保持自身的生物节律,适应环境变化。
1971年,Seymour Benzer和Ronald Konopka在果蝇体内发现了一种与生物钟调节相关的基因——period。十年后,Jeffrey C. Hall、Michael Rosbash和 Michael W. Young成功克隆出period基因。但在当时,period调节生物钟的具体机制仍是一个谜题。经过3位诺贝尔奖得主的不懈努力,随着与period相互作用的其他基因的发现,科学家们提出了转录翻译负反馈回路(transcription-translation feedback loop, TTFL)的概念,即period以及另一个生物钟基因-timeless的转录会被它们自身翻译出的蛋白-PER和TIM所抑制。该机制和随后发现的一些更加复杂的分子机制共同调节着生物钟的生理功能。
我们体内的生物钟在一天之中的不同时段对我们的生理功能进行着精准的调节,例如行为、激素水平、睡眠情况、体温以及新陈代谢等。当我们所处的外部环境与我们体内的生物钟不匹配时,我们的身体就会马上反应出不适,比如乘飞机穿越数个时区所导致的“时差”。此外,有迹象表明,当我们的生活方式与生物钟开始出现偏差时,我们患上各种疾病的风险也会随之增加。Jeffrey C. Hall、Michael Rosbash和 Michael W. Young三位科学家的发现阐释了生物节律的重要生理机制,为人类健康及疾病研究提供了重要的依据。
1 获奖者简介
1.1JeffreyC.Hall
Jeffrey C. Hall(图1),1945年3月3日生于美国纽约布鲁克林,遗传学家。 1971 年获得西雅图华盛顿大学遗传学博士学位,1974年成为Brandeis大学教员。1984年他和Michael Rosbash的研究小组克隆了果蝇的period基因,这个基因能够调节果蝇的生物钟。他们还揭示出该基因所编码的mRNA和蛋白质含量随昼夜节律而变化。Hall于2001年入选人文与科学院院士,2003年入选美国国家科学院院士并获美国遗传学会勋章。因为在period基因研究方面的杰出贡献,他于 2009年获格鲁伯神经科学奖,2011年获路易莎·格罗斯·霍维茨奖,2012年获盖尔德纳国际奖,2013年获得邵逸夫生命科学及医学奖。

图1 Jeffrey C. Hall
1.2MichaelRosbash
Michael Rosbash(图2),1944年3月7日生于美国密苏里州堪萨斯,遗传学家。Rosbash是Brandeis大学教授和Howard Hughes医学研究所的研究员。1984年他和Jeffrey C. Hall的研究小组克隆了果蝇的period基因,1990年提出了生物钟的转录翻译负反馈回路的概念。他们在果蝇体内发现了period基因、cycle基因和clock基因等。2003 年入选美国国家科学院院士。2013年获得邵逸夫生命科学及医学奖。

图2 Michael Rosbash
1.3MichaelW.Young
Michael W. Young(图3),1949年生于美国佛罗里达州迈阿密,遗传学家、美国国家科学院院士。1975年获得Texas大学Austin分校博士学位,1978年起任Rockefeller大学教员,后成为该校副校长。2013 年获得邵逸夫生命科学及医学奖。1984年他的团队克隆出果蝇的period基因。Young之后的研究还揭示了更多生物钟相关基因以及它们的作用机制。

图3 Michael W. Young
2 主要科学贡献[1]
虽不能草率地说是全部生物,但的确大多数的生物都可以预测并适应日常环境的变化。早在18世纪,法国天文学家 Jean-Jacques d’Ortous de Mairan以含羞草属植物为研究对象,发现不管阳光是否存在,叶子都会维持它们正常的昼夜节律(图4)。这个实验也被认为是生物具有内源生物节律的最早证据。
随后,陆续有其他研究人员发现,不仅植物有这种“内部时钟”,其他动物包括人类都存在这一现象,而这个“时钟”其实有助于我们为日常活动做好准备。这种规律性的适应就被称为“昼夜节律”(circadian rhythm),源自拉丁文词汇“circa”(意为“环绕”)以及dies(意为“一天”)。生物钟的背后又有着怎样的生物机制呢?对其分子机制的研究吸引着一代又一代优秀的科学家。

图4 含羞草的生物钟现象
含羞草叶子会在太阳光下张开,夜晚则会闭合。Jean-Jacques d’Ortous de Mairan通过实验证实,在持续黑暗条件下,含羞草叶片的开合现象依然保持着与昼夜周期同样的节律性。这表明含羞草属植物有一个自主的“钟表”可以保持一定的生物节律。
1)period基因的发现与克隆
20世纪70年代,Seymour Benzer博士和他的学生Ronald Konopka证明了某种未知的基因突变扰乱了果蝇的昼夜节律,他们命名这个基因为period[2],他们利用经典的化学致突变作用诱导基因突变,进而观察果蝇的表型,试图找出昼夜节律发生改变的突变种。经过不懈努力,他们分离出3种品系的果蝇:无节律型、短节律型(19 h)和长节律型(28 h)。他们进一步的基因图谱研究和杂交试验使他们确定了这3个突变种均为同一基因的不同突变,后来该基因被命名为period基因。20世纪80年代,Rockefeller大学的Young和Brandeis大学的Hall与Rosbash同时在进行着果蝇period基因的克隆。1984年Young和Rosbash两个团队几乎同时拿到period基因附近的基因组DNA[3-4]。该段基因可产生4.5kb和0.9kb两种长度的mRNA。他们随后发现4.5kb mRNA水平具有昼夜变化,其对应基因为period基因[5-6]。克隆出基因固然是巨大的成功,但这仅仅意味着研究生物节律这项工作才刚刚开始。正如同我们早已完成人类基因组测序,而实现从基因水平来研究疑难杂症的发病机制并彻底攻克他们,仍有很长的一段路要走。基因只是工具,真正核心的部分是分子机制,仍有待阐明。
2)period基因负反馈调节环路的发现
一些研究者相继提出几个模型都未能完美地解释period基因调节生物钟的分子机制。在成功合成PER蛋白的抗体后,研究者们终于逐渐揭开了PER蛋白作用机制的神秘面纱。1988年,Rosbash小组发现period基因编码的蛋白质PER在夜间积累,白天则被降解。即PER蛋白的水平在24 h周期内循环震荡,而这一循环周期恰恰与昼夜节律同步[7]。1990年,Rosbash小组的博士后Paul Hardin通过检测果蝇脑内的mRNA发现period基因的mRNA也呈现昼夜变化[8]。有趣的是,periodmRNA水平的峰值出现的时间要比PER蛋白水平的峰值出现时间早几个小时[8]。Period的无意义突变使periodmRNA水平的震荡无法产生,而PER蛋白可以挽救周期性mRNA水平[8]。他们随即提出了一个简单模型解释这一现象:period基因转录、翻译产生PER蛋白质的过程存在着负反馈调节,即PER表达过程中产生的mRNA和蛋白质会影响PER基因自身的转录过程,这样就可以形成一个连续的循环周期。换句话说,PER 蛋白进入细胞核结合到period基因上与之发挥相互作用进而抑制period基因的进一步转录表达,即PER 蛋白可以抑制基因合成自己,这样就可以形成一个持续循环。这个模型以一种简单并且在生物体中普遍存在的机制近乎完美地解释了PER蛋白的昼夜波动。但只有在PER蛋白有能力从细胞质进入细胞核这一大前提的存在下,PER才能抑制period基因。Hall和Rosbash的研究能够证明PER蛋白在夜间会在细胞核中积累,但未能成功解释其进入细胞核的分子机制。
1994 年,Michael W. Young发现了第2个昼夜节律基因:timeless[9]。timeless可以编码 TIM蛋白,同样为正常节律所需。Young通过实验完美地解释了PER进入细胞核的分子机制[10],他发现 TIM蛋白含量同样具有昼夜波动性,TIM会结合到 PER 上,该复合物可以进入细胞核,从而抑制period基因的活性。这些发现使我们进一步证实了period负反馈调节环路的存在及其在生物钟对机体作用过程中所扮演的重要角色。随着clock基因和cycle基因的发现,period和timeless基因的激活机制得到了解释[11]。这两个基因产生的蛋白质CLK和CYC相互结合作为转录因子共同作用于period和timeless基因,激活基因表达PER和TIM蛋白。随后有研究表明,TIM和PER蛋白可以抑制CLK的活性。至此,period基因表达的负反馈调节环路得到了圆满的阐释(图5A)。
这3位诺贝尔奖得主的研究阐述了生物钟的基本理论基础。在随后的几年里,其他一些分子也被发现,进一步解释了生物钟的机制和稳定性。Young发现的另外一个生物钟基因——doubletime[12],它编码的DBT 蛋白是一种蛋白激酶,可以通过调节PER蛋白的降解进而延迟 PER蛋白的积累,解释了为什么PER蛋白的震荡的周期会稳定在 24 h左右。20世纪90年代末,Hall实验室发现chryptochrome(cry) 基因通过对光的调节参与果蝇生物钟的控制[13-15]。光可以激活该基因的产物CRY蛋白并通过促进CRY蛋白与TIM蛋白的结合调节TIM蛋白在蛋白酶体中的降解过程。在日照充足的白天,TIM被降解,导致PER易发生由DBT介导的磷酸化进而也发生降解(图5B)。
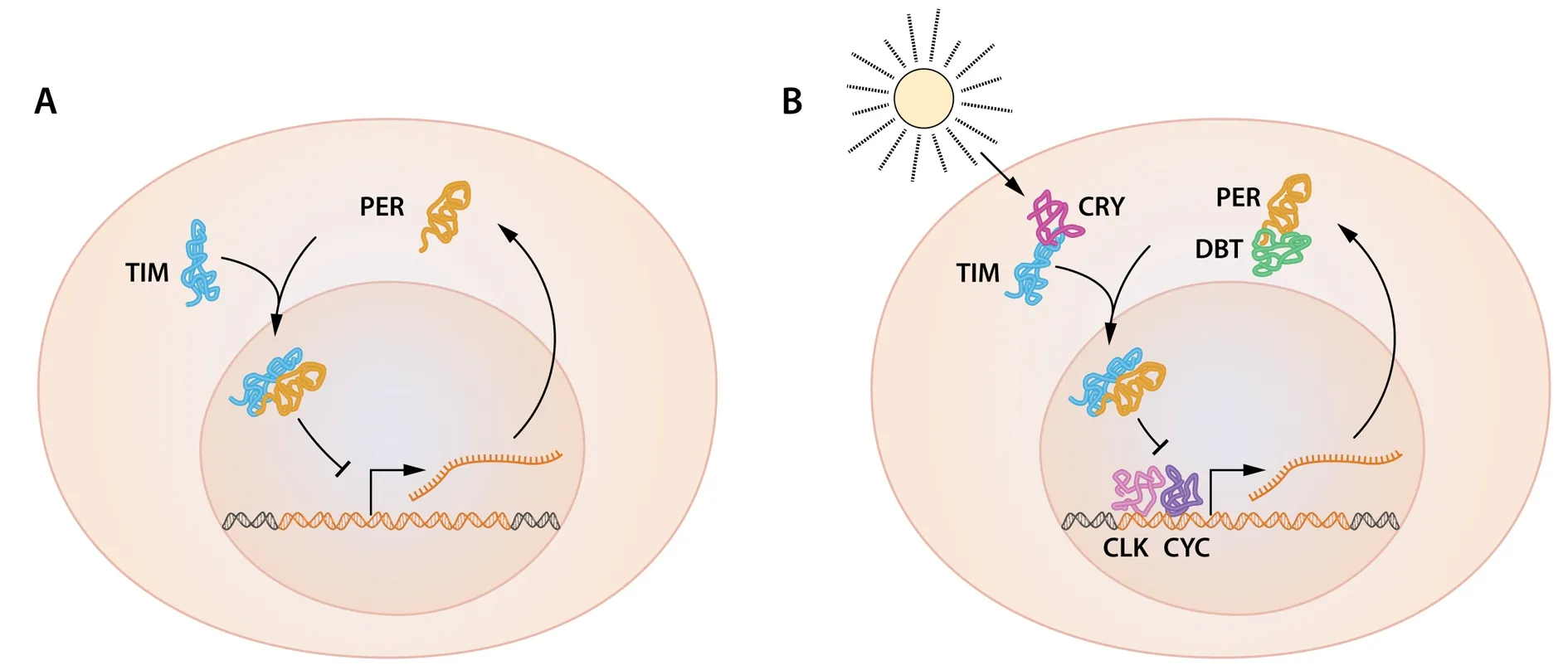
图5 period基因负反馈调节环路[1]
A:period基因表达的mRNA和PER蛋白含量都会发生震荡。PER蛋白在细胞核内通过负反馈调节环路抑制period基因的表达。B:许多生物钟蛋白都可以调节period基因的表达。由timeless基因编码的TIM蛋白含量也存在一个震荡周期并且会与period基因发挥作用,TIM蛋白与PER蛋白结合相互作用对PER蛋白能否进入细胞核通过负反馈环路调节period基因的表达至关重要。由doubletime基因编码的DBT蛋白是一种可以磷酸化PER蛋白的蛋白激酶,PER蛋白的磷酸化可导致其降解失活。由DBT蛋白调节的PER蛋白的降解最终导致了period表达的mRNA和PER蛋白聚集的时间差。由clock基因编码的CLK和由cycle基因编码的CYK是两个可以激活period表达的转录因子。
3)科学意义
生物钟涉及人体生理活动的方方面面。我们已知的所有多细胞生物,包括人类,都使用一个相似的机制来调节生理节律,例如,生物钟可以调节睡眠模式、进食行为、激素释放、血压和体温等(图6)。生物钟能调节我们大部分的基因,并最终使我们的生理活动得以适应一天中的不同时段。不仅如此,生物钟基因在外周组织中也发挥重要作用。动物模型中敲除生物钟基因会导致如皮质醇和胰岛素等释放异常[16];生物钟基因通过影响糖异生、胰岛素敏感性以及全身血糖水平来调节机体代谢[17];生物钟异常导致睡眠障碍会引起抑郁、认知和记忆障碍等神经系统疾病[18];如果内源性生物钟异常导致生活方式与生物钟长期错位会增加癌症、神经退变性疾病、代谢性疾病以及炎性反应的发病风险[19]。人们正在努力寻找调节生物钟的手段以改善人类健康。

图6 生物钟参与人体生理节律方方面面的调节[1]
生物钟可以调节睡眠模式、进食行为、激素释放、血压和体温。我们体内大部分基因的表达都由生物钟进行调控。
动植物的变化只是生物钟的外在表现,而其核心则是复杂的分子机制。我们可以很容易地通过钟表得知时间,但想要了解其内部构造,时针分针的运动机制却是需要一番研究。对生物钟的分子机制研究就好比研究钟表复杂的机芯。就目前来看,对生物昼夜节律的研究仍有很长的路要走。
[1] Scientific Background :Discoveries of Molecular Mechanisms Controlling the Circadian Rhythm[EB/OL] .(2017-10-02)[2017-10-11]https://www.nobelprize.org/nobel_prizes/medicine/laureates/2017/advanced.html
[2] Smith R F, Konopka R J. Effects of dosage alterations at the per locus on the period of the circadian clock of Drosophila[J]. Mol Gen Genet, 1982, 185(1): 30-36.
[3] Zehring W A, Wheeler D A, Reddy P, et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster[J]. Cell, 1984, 39(2): 369-376.
[4] Bargiello T A, Jackson F R, Young M W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila[J]. Nature, 1984, 312(5996): 752-754.
[5] Bargiello T A, Young M W. Molecular Genetics of a Biological Clock in Drosophila[J]. Proc Natl Acad Sci U S A, 1984, 81(7): 2142-2146.
[6] Lorenz L J, Hall J C, Rosbash M. Expression of a Drosophila mRNA is under circadian clock control during pupation[J]. Development, 1989, 107(4): 869-880.
[7] Siwicki K K, Eastman C, Petersen G, et al. Antibodies to the period gene product of drosophila reveal diverse tissue distribution and rhythmic changes in the visual system[J]. Neuron, 1988, 1(2): 141-150.
[8] Hardin P E, Hall J C, Rosbash M. Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels[J]. Nature, 1990, 343(6258): 536.
[9] Saez L, Young M W, Baylies M K, et al. Per—no link to gap junctions[J]. Nature, 1992, 360(6404): 542.
[10] Vosshall L B, Price J L, Sehgal A, et al. Block in nuclear localization of period protein by a second clock mutation, timeless[J]. Science, 1994, 263(5153): 1606-1609.
[11] Vitaterna M H, King D P, Chang A M, et al. Mutagenesis and mapping of a mouse gene, Clock, essential for circadian behavior[J]. Science, 1994, 264(5159): 719.
[12] Price J L, Blau J, Rothenfluh A, et al. double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation[J]. Cell, 1998, 94(1): 83.
[13] Plautz J D, Straume M, Stanewsky R,et al. Quantitative analysis of Drosophila period gene transcription in living animals[J]. J Biol Rhythms, 1997,12(3):204-217.
[14] Stanewsky R, Jamison C F, Plautz J D, et al. Multiple circadian-regulated elements contribute to cycling period gene expression in Drosophila[J]. EMBO J, 1997, 16(16): 5006.
[15] Brandes C, Plautz J D, Stanewsky R, et al. Novel features of drosophila period Transcription revealed by real-time luciferase reporting[J]. Neuron, 1996, 16(4): 687-692.
[16] Son G H, Chung S, Choe H K, et al. Adrenal peripheral clock controls the autonomous circadian rhythm of glucocorticoid by causing rhythmic steroid production[J]. Proc Natl Acad Sci U S A, 2008, 105(52): 20970.
[17] Panda S. Circadian physiology of metabolism[J]. Science, 2016, 354(6315): 1008.
[18] Gerstner J R, Yin J C. Circadian rhythms and memory formation[J]. Na Rev Neurosci, 2010, 11(8): 577-588.
[19] Patke A, Murphy P J, Onat O E, et al. Mutation of the human circadian clock gene CRY1 in familial delayed sleep phase disorder[J]. Cell, 2017, 169(2): 203.
Discoveriesofmolecularmechanismscontrollingthecircadianrhythm—the2017NobelPrizeinPhysiologyorMedicine
Li Yuzheng1, Zhang Ting2, Wang Xiaomin2,3*
(1.ClinicalMedicalSciences,CapitalMedicalUniversity,Beijing100069,China;2.DepartmentofNeurobiology,BasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China;3BeijingInstituteforBrainDisorders,Beijing100069,China)
In October 2, 2017, the Nobel Assembly at Karolinska Institute has decided to award the 2017 Nobel Prize in Physiology or Medicine jointly to Jeffrey C. Hall, Michael Rosbash and Michael W. Young for their discoveries of molecular mechanisms controlling the circadian rhythm.
the 2017 Nobel Prize in Physiology or Medicine;biological clock;circadian rhythm
*Corresponding authors, E-mail:xmwang@ccmu.edu.cn
时间: 2017-10-14 16∶19
http://kns.cnki.net/kcms/detail/11.3662.R.20171014.1619.038.html
10.3969/j.issn.1006-7795.2017.05.026]
2017-10-11)
编辑 陈瑞芳
