两种DNA分子同时检测的逻辑门及半加器的构建
2017-10-18晋晓勇蒙丽君许凯歌
晋晓勇, 张 笛, 蒙丽君, 许凯歌, 雷 杰, 彭 娟
(宁夏大学化学化工学院,省部共建煤炭高效利用与绿色化工国家重点实验室,宁夏银川 750021)
1959年,美国物理学家Feynman首次提出了分子计算的思想,预示着信息处理将从芯片时代向分子时代发展[1]。1994年,Adleman首次通过试验证明了计算过程可在DNA水平进行[2],随后的几十年里许多关于分子逻辑门方面的研究工作不断被报道出来[3 - 4]。分子逻辑门的输入对象是在分子或超分子水平上实施的两个或两个以上的复杂操作,输出信号为相应操作所得到的逻辑信号,使这个信号适用于“1”和“0”二进制布尔逻辑运算,从而实现数字运算[5]。计算机的构建以逻辑运算为基础,要建立和发展DNA计算机,DNA分子逻辑门技术是一个不可逾越的必经之路[6]。
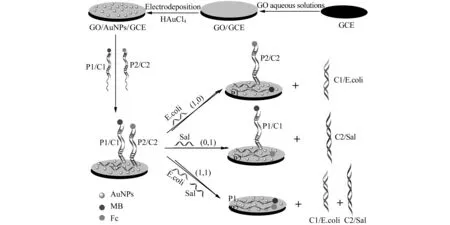
图1 双标记探针DNA生物传感的组装用于“半加器”的构建原理图Fig.1 Schematic illustration of the dual-signaling DNA biosensor for the "half adder" construction
氧化石墨烯(GO)是在表面修饰有羟基、羧基、环氧官能团的石墨烯[7 - 8],由于它的亲水性和良好的分散性而被广泛应用于传感器中。Willner课题组[9]利用GO作为有效基底材料,实现对DNAs的放大检测并应用于逻辑门操作。本实验介绍了应用电化学检测技术对大肠杆菌(E.coli)DNA和沙门氏菌(Sal)DNA的同时智能检测,原理如图1所示。在玻碳电极表面修饰GO,然后电沉积金纳米粒子(AuNPs),基于碱基互补配对原则和GO对DNA单链有强的吸附作用实现对两个目标物的同时检测。将实验结果应用于布尔逻辑运算,以两种DNA序列作为输入,其存在时定义为“1”,反之为“0”。检测各种状态的电化学信号,设置恰当的阈值,构建“AND”型和“XOR”型DNA分子逻辑门,在此基础上提出了一种新型的具有逻辑运算功能的半加器(Half adder)模型。
1 实验部分
1.1 仪器与试剂
CHI760E电化学工作站(上海辰华仪器有限公司);Exceed-E-UV超纯水仪(成都唐氏康宁科技公司);JSM7500F场发射扫描电镜(日本,电子公司)。
HAuCl4·3H2O(Au≥48%)、Tris-HCl(超纯,阿拉丁生化科技股份有限公司);K3[Fe(CN)6]、K4[Fe(CN)6](天津大茂试剂厂),所有试剂除特殊说明外均为分析纯。寡核苷酸序列购于生工生物工程(上海)股份有限公司,具体序列见表1。溶解在10 mmol·L-1磷酸盐缓冲溶液(PBS)(pH=7.4,含有100 mmol·L-1NaCl)中,配成10 μmol·L-1的DNA溶液,充分摇匀后于4 ℃下储存备用。实验用水为超纯水(18.2 MΩ·cm)。
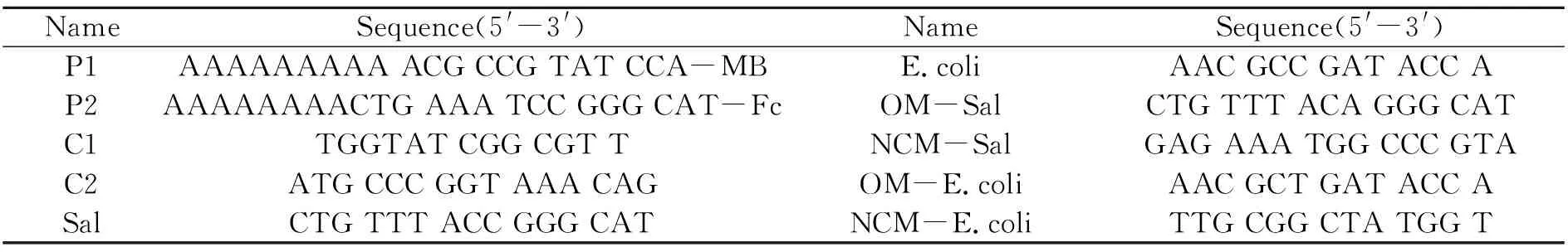
表1 实验所用寡核苷酸序列Table 1 Sequence of oligonucleotides used in this study
1.2 电极处理与修饰
将玻碳电极(GCE,直径2.0 mm)用0.3 μm和0.05 μm的Al2O3粉末在麂皮上连续抛光至光滑镜面,超纯水冲洗,在HNO3(1+1)、无水乙醇和超纯水中分别超声3 min,吹干、备用。
GO按照文献方法[10]制备。使用前将0.10 mg的GO在1.00 mL超纯水中超声分散20 min,制得0.10 mg·mL-1的浅黑色GO悬浮液,移取5.0 μL的GO悬浮液滴在处理干净的GCE表面,红外灯烤干,得到GO修饰的GCE,记作GO/GCE。将GO/GCE放入6.0 mmol·L-1HAuCl4(含0.10 mol·L-1KCl)溶液中,在-0.2 V的电位下用恒电位法电沉积2 min,取出用超纯水冲洗,吹干,得到GO/AuNPs/GCE。吸取1 μmol·L-1的P1/C1、P2/C2 DNA混合液,退火处理后,滴在GO/AuNPs/GCE表面,避光保存2 h,用20 mmol·L-1pH=7.4的Tris-HCl缓冲液冲洗电极表面,除去未吸附的DNA分子,制得DNA生物传感器。
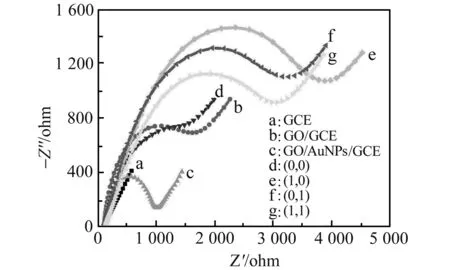
图2 不同电极在电化学阻抗谱在10 mmol·L-1 PBS(含有 0.10 mol·L-1 KCl,5.0 mmol·L-1[Fe(CN)6]3-/4-)Fig.2 Nyquist diagrams of the different electrodes in 10 mmol·L-1 PBS (containing 0.10 mol·L-1 KCl,5.0 mmol·L-1[Fe(CN)6]3-/4-)(a) Bare GCE:(b) GO/GCE;(c) GO/AuNPs/GCE;(d)(0,0) input;(e)(1,0) input;(f)(0,1) input;(g)(1,1) input.
1.3 电化学检测
电化学实验均采用三电极系统:修饰GCE为工作电极,铂电极(直径2 mm)为对电极,饱和甘汞电极(SCE)为参比电极。采用循环伏安法(CV)、方波伏安法(SWV)在10 mmol·L-1Tris-HCl缓冲液(pH=7.4,含有140 mmol·L-1NaCl、5 mmol·L-1MgCl2)中进行检测。在-0.6~0.4 V电位窗口下进行CV扫描,扫描速度0.1 V·s-1。在-0.6~0.4 V电位窗口下进行SWV扫描,脉冲电位为0.04 V,脉冲幅度为0.025 V,频率10 Hz。电化学阻抗(EIS)测量在pH=7.4的10 mmol·L-1PBS(含有0.10 mol·L-1KCl溶液、5.0 mmol·L-1K3[Fe(CN)6]溶液、5.0 mmol·L-1K4[Fe(CN)6]溶液)中进行,电位为0.187 V,振幅为0.05 V,频率范围为1 Hz~100 kHz。
2 结果与分析
2.1 不同修饰电极的表征
图2是传感器在不同组装阶段和不同逻辑输入状态下的交流阻抗图。曲线a为裸GCE,阻抗很小,电子传递效率很高;曲线b为GO/GCE,阻抗增大,因为GO修饰导致电子传递效率降低;曲线c为GCE/GO/AuNPs,阻抗明显小于GO/GCE的阻抗,由于AuNPs的引入,大大提高了电子传递效率,以上结果说明电极的成功组装;曲线d为(0,0)输入,P1/C1,P2/C2形成部分互补的双链“站立”在电极表面,由于电极表面的负电荷密度增加,降低了[Fe(CN)6]3-/4-与电极表面的电子传递效率,导致阻抗增大;曲线e和f分别为(1,0)输入和(0,1)输入状态,E.coli DNA与C1,Sal DNA与C2分别完全互补杂交形成双链从电极表面解离,使游离的P1、P2单链分别吸附在电极表面,由于DNA单链自由伸展且带有负电荷,与带负电的[Fe(CN)6]3-/4-静电排斥,导致电子传递受阻,故阻抗相比(0,0)输入有所增加;曲线g为(1,1)输入,同时加入E.coli DNA和Sal DNA时,由于杂交反应的发生使得游离的P1和P2单链都被吸附在电极表面,进一步阻碍电极表面的电子传递,阻抗增加。
图3所示为不同修饰电极的扫描电镜(SEM)图:(A)为裸GCE,由图可知GCE表面光滑,表明电极处理干净;(B)为GO/GCE,可以观察到GO典型的褶皱结构;(C)为/GO/AuNPs/GCE,可以观察到在GO褶皱表面存在纳米金,粒径约为100 nm;(D)为固定标记探针后的电极,可以观察到DNA分子的存在使AuNPs发生团簇。

图3 不同电极的扫描电镜(SEM)图Fig.3 SEM images of different electrodes(A) Bare GCE;(B) GO/GCE;(C) GO/AuNPs/GCE;(D) GO/AuNPs/GCE with probes immobilized.
2.2 实验条件的优化
考察了修饰电极以及目标物杂交时间对电化学信号的影响。图4(A)为不同修饰电极的电化学响应情况,曲线a为GO/GCE;曲线b为GO/AuNPs/GCE,探针修饰2 h,(1,1)输入情况下,目标物杂交时间相同,曲线b的信号明显强于曲线a,说明AuNPs的存在增大了电极的比表面积使得结合探针的量增加,且自身良好的电子传递功能有助于增强MB和Fc在体系中的电化学信号。因此选择GO/AuNPs/GCE修饰电极。图4(B)为目标物杂交时间的优化,在生物传感器上滴加10 μL 1.0 μmol·L-1的E.coli DNA和Sal DNA混合液,每隔1 h测定一次,Fc的信号先缓慢增大,3 h时几乎达到平稳,但4 h后又急剧下降;MB的信号也是先增大,4 h时几乎达到平稳,之后无明显变化(插图所示),因此选择杂交时间为4 h。
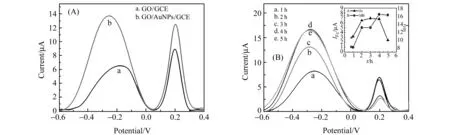
图4 实验条件的优化Fig.4 Optimization of detection conditions(A) Choice of different modified electrodes,(a) GO/GCE and (b) GO/AuNPs/GCE;(B) Effect of target hybridization time on the response of biosensor.
2.3 不同输入状态的循环伏安法和方波伏安法的检测
在最优条件下对不同输入状态进行CV和SWV的表征,结果如图5所示。(0,0)输入时,P1/C1,P2/C2分别形成部分杂交的双链“站立”在电极表面,Fc和MB距离电极表面较远,电子传递较慢,检测到很弱的Fc和MB的信号(曲线a);(1,0)输入时,E.coli DNA与C1形成DNA双链从电极表面解离,置换出的P1单链吸附在电极表面,MB与电极表面的距离减小,MB的信号增强,Fc信号基本保持不变;(0,1)输入时,C2与Sal DNA形成双链而从电极表面解离,置换出的P2单链完全吸附在电极表面,Fc与电极表面的距离减小,Fc的信号增强,MB信号基本保持不变;(1,1)输入时,E.coli DNA与C1,Sal DNA与C2完全互补都形成双链从GO表面解离,置换出游离的P1和P2单链吸附在电极表面,MB和Fc与电极表面的距离接近,因此MB和Fc的信号都会增大(曲线d)。
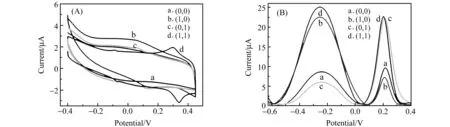
图5 逻辑门不同输入状态的循环伏安(CV)曲线(A)和方波伏安(SWV)曲线(B) Fig.5 CV curves(A) and SWV curves (B) of the logic gates under different inputs state (a)(0,0) input;(b)(1,0) input;(c)(0,1) input;(d)(1,1) input.
2.4 “AND”型和“XOR”型分子逻辑门的构建
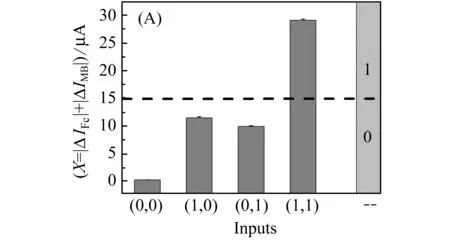
以E.coli DNA和Sal DNA作为输入,以Σ|ΔI|(Σ|ΔI|=|ΔIFc|+|ΔIMB|,ΔI=I-I0,I为加入目标物后的电流信号,I0为加入目标物前的电流信号)作为输出,设定15 μA为阈值,当X>15 μA时,输出为1;当X<15 μA时,输出为0,构建“AND”型DNA分子逻辑门。真值表如图6(B)所示。
(B)
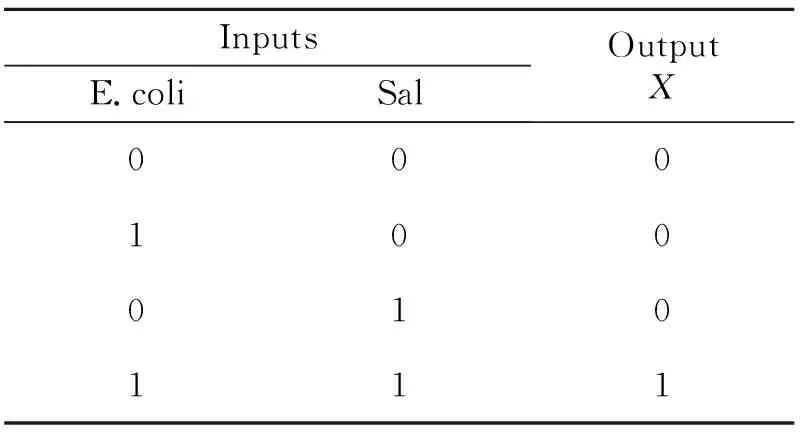
InputsE.coliSalOutputX000100010111
图6“AND”逻辑门的构建结果。(A)SWN检测Σ[Δ]的柱状图;(B)逻辑门的真值表
Fig.6Theresultof"AND"logicgate.(A)ThebardiagramsΣ|ΔI|detectionbySWV,
thedottedlineindicatesthethreshold(15μA);(B)Thetruth
Tableof"AND"logicgate
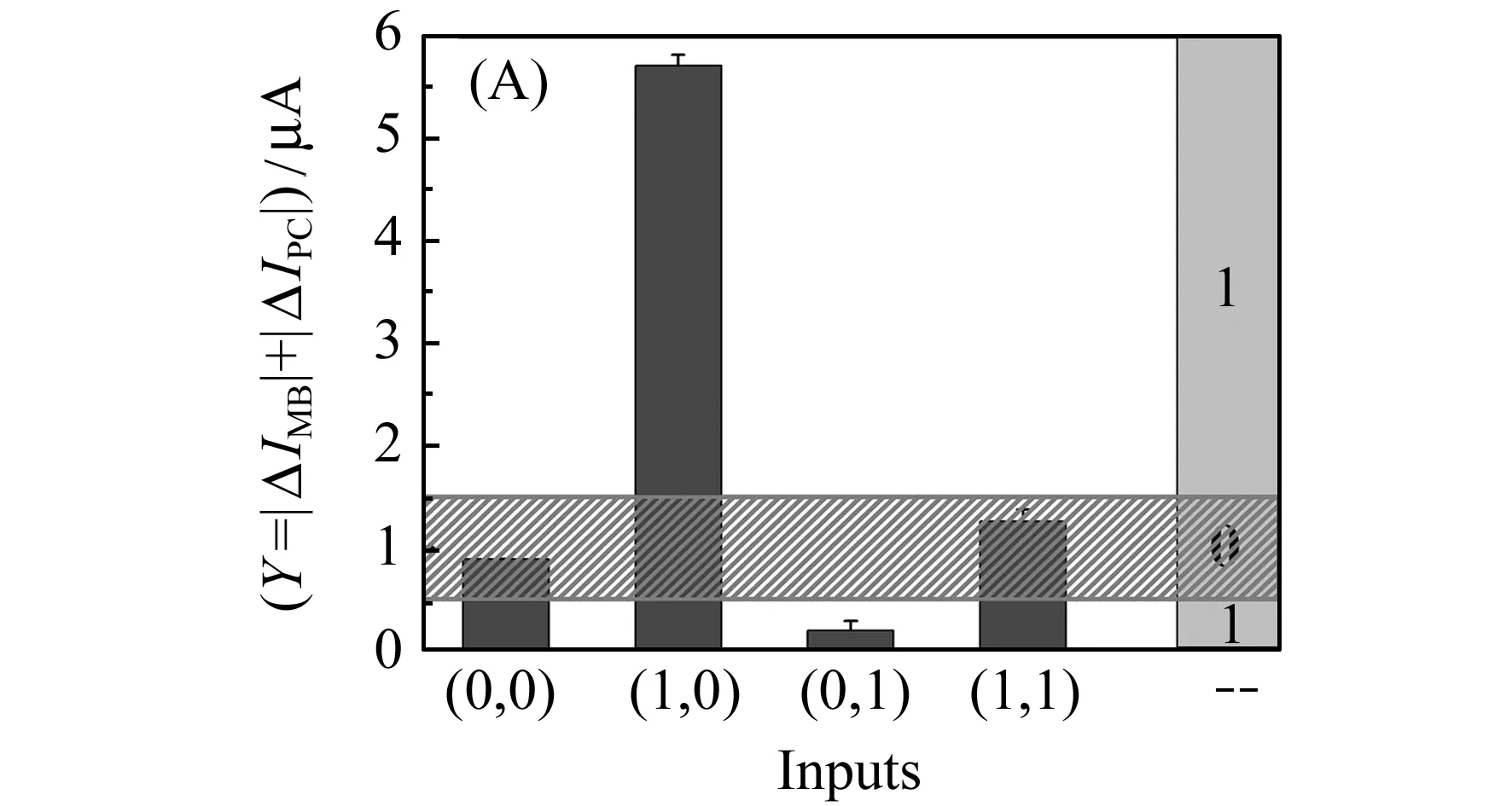
以E.coli DNA和Sal DNA作为输入,以“Y=|ΔIMB/ΔIFc|”作为输出,设定阈区间为0.5~1.5,而当Y>1.5或Y<0.5时,输出为1;当Y∈(0.5,1.5)时,输出为0,构建“XOR”型DNA分子逻辑门。真值表如图7(B)所示。
(B)
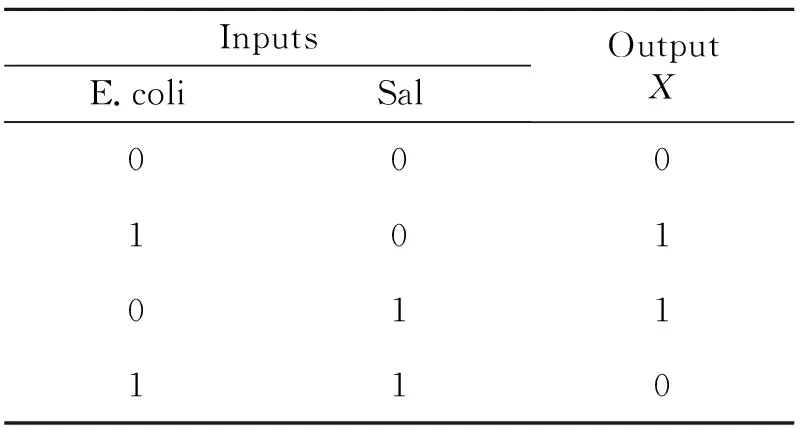
InputsE.coliSalOutputX000101011110
图7“XOR”型逻辑门的构建结果。(A)SWN检测|ΔIMB/ΔIFC|柱状图;(B)“XOR”逻辑门的真值表
Fig.7Theresultof"XOR"logicgate.(A)Thebardiagrams|ΔIMB/ΔIFc|detectionbySWV,
thedottedlineindicatesthethresholdrange(0.5-1.5);(B)Thetruth
Tableof"XOR"logicgate
2.5 半加器的构建
将所构建的“AND”逻辑门和“XOR”逻辑门整合起来构建成具有逻辑功能的半加器(Half adder)。半加器分析两种分子信号并根据以下的规则输出两种不同的分子信号:(1)没有输入信号时,系统没有变化,也没有输出;(2)当有一个输入分子信号时,只激活和位输出(sum bit output);(3)当有两种输入信号时,只激活进位输出(carry bit output)。和位输出的功能是由“XOR”逻辑门执行,而进位输出是由“AND”逻辑门执行。半加器只考虑两个一位二进制数的相加,而不考虑来自低位进位数的运算电路。真值表见表2。

表2 半加器的真值表Table 2 The truthTable for half adder
2.6 DNA生物传感器的检测范围及检出限
在最优的实验条件下,分别对两种目标DNA进行测定,结果如图8所示,E.coli DNA和Sal DNA的浓度均在1.0×10-13~1.0×10-8mol·L-1范围内,目标物浓度的对数和Σ|ΔI|(Fc和MB信号变化之和)呈良好的线性关系,其线性方程分别为:Σ|ΔI|=32.03+2.17logcE.coli(c:mol·L-1,R=0.9931),Σ|ΔI|=34.14+2.49logcSal(c:mol·L-1,R=0.9967),检出限(S/N=3)分别为 3.2×10-14mol·L-1和1.7×10-14mol·L-1。

图8 (a)不同浓度的E.coli DNA的方波伏安(SWV)图;(B)不同浓度的Sal DNA的方波伏安(SWV)图 Fig.8 (a) SWV responses with different concentration of E.coli DNA;(B) SWV responses with different concentration of Sal DNA From a to f:the concentration was 1.0×10-13,1.0×10-12,1.0×10-11,1.0×10-10,1.0×10-9 and 1.0×10-8 mol·L-1.
2.7 传感器选择性、稳定性及重现性的考察
为考察该生物传感器的选择性,分别检测了加入目标序列(Target)、一个碱基错配(OM)、完全错配(NCM)的DNA序列的响应。当加入错配碱基序列时,信号明显比加入目标序列时的信号弱很多,这是由于错配的DNA无法与相应的互补序列发生特异性杂交,不仅无法打开P1/C1,P2/C2链,而且还占据了GO表面更多的位点,结果表明该传感器具有较好的选择性。
按照1.2所述制备生物传感器,两目标物同时检测,且将此电极储存在4 ℃的冰箱中一周后,再用SWV法检测,其响应信号没有发生很大变化,表明该DNA传感器稳定性良好。采用同样的修饰方法制备了三支相同的生物传感器,在同样的实验条件下,SWV方法检测(1,1)输入状态的电化学响应,计算的相对标准偏差(RSD)为3.8%,表明该DNA传感器重现性良好。
3 结论
本研究采用滴涂法和电沉积法制备了氧化石墨烯/金纳米粒子复合膜修饰玻碳电极作为工作电极,Fc和MB作为电化学指示剂,以E.coli DNA和Sal DNA作为目标分子,构建了标记型DNA生物传感器,实现对E.coli DNA和Sal DNA的同时智能分析,检测范围均在1.0×10-13~1.0×10-8mol·L-1,检出限(S/N=3)分别为3.2×10-14mol·L-1和1.7×10-14mol·L-1。研究结果表明此电化学传感器具有稳定性好、易制备、成本低和重现性好等优点,所建立的分析方法具有高的灵敏度和较宽的线性范围。根据实验结果,以E.coli DNA和Sal DNA作为输入,探针信号变化之和Σ|ΔI|作为输出构建了“AND”型DNA分子逻辑门,以探针信号变化之比|ΔIMB/ΔIFc|作为输出构建了“XOR”型DNA分子逻辑门,提出了一种新型的半加器模型,可实现两个二进制数字相加运算。
