组学技术在茶学研究中的应用研究进展
2017-10-16,,,,,,*
, ,,,, ,*
(1.云南农业大学龙润普洱茶学院,云南昆明 650201;2.中华全国供销合作总社杭州茶叶研究院,浙江杭州 310016;3.浙江省茶资源跨界应用技术重点实验室,浙江杭州 310016)
组学技术在茶学研究中的应用研究进展
苏小琴1,2,3,马燕1,杨秀芳2,3,孔俊豪2,3,左小博2,3,赵明1,*
(1.云南农业大学龙润普洱茶学院,云南昆明650201;2.中华全国供销合作总社杭州茶叶研究院,浙江杭州310016;3.浙江省茶资源跨界应用技术重点实验室,浙江杭州310016)
基因组学、转录组学、蛋白组学和代谢组学等组学技术具有高通量、高灵敏度和系统性的特点,已成为生命科学研究中的强有力工具,也为茶学研究提供了新的方法。研究者应用组学技术开展了茶树栽培育种、种质资源特性、茶叶生理生化、茶叶加工及贮藏等多方面研究,获得了重要进展,本文综述了组学技术在茶学研究中的应用情况。
基因组学,蛋白质组学,代谢组学,转录组学,茶学
Abstract:Omics technologies including genomics,transcriptomics,proteomics,metabolomics and etc.,have characteristics with high-throughput,high sensitivity and systematic. They provided powerful tools in life science research. Omics technologies have been broadly applied in tea science,and provided novel theoretical basis and approaches to study on tea cultivation and breeding,tea germplasm resources of tea plant,physiology and biochemistry of tea plant and tea processing of tea plant. In this work,the progress of researches by omics technology in tea science was reviewed.
Keywords:genomics;proteomics;metabolomics;transcriptomics;tea science
组学(Omics)定义为“组的”组成、结构、功能以及各组分之间相互作用和联系的一门学科[1],主要包括基因组学(Genomics)、转录组学(Transcriptomics)、蛋白质组学(Protemics)和代谢组学(Metabolomics)。组学技术(Omics technology)是整合基因组学、转录组学、蛋白质组学和转录组学的研究思路和方法,动态地揭示系统结构、功能相互作用和运行规律的技术[1]。目前,以高通量测序、色谱质谱和核磁共振技术为基础的组学技术,具有高通量、高灵敏度和整体性的特征,为复杂样品分析提供了新途径,在医药、食品、农业、环境等领域得到了广泛应用[2-3]。
茶树(Camelliasinensis(L.)O. Kuntze)是指山茶科(Theaceae)、山茶属(Camellia)的多年生常绿植物[4]。茶树的嫩茎、叶加工而成的饮料已成为世界上除水之外消费最多的饮料[5]。茶饮料具有独特风味品质,以及抗衰老、抑菌、降血脂、减肥等功效[6]。近年,研究者应用基因组学、转录组学、蛋白质组学和代谢组学等技术,以茶树或茶制品为材料,开展了广泛研究,为茶树栽培和育种、茶树种质资源特性、茶树生理生化、茶叶加工及贮藏、茶叶品质等方面提供了新的知识。本文对组学技术在茶学领域应用的研究现状进行了综述,并对今后基于多组学联用的茶学组学研究进行了展望。
1 基因组学在茶学研究中的应用
基因组学(Genomics)指在生物体全基因组的基础上研究所有基因的结构、组成与功能[7]。近日,中国科学院昆明植物研究所联合华南农业大学、云南农业大学等多个机构完成了茶树基因组的测序。茶树基因组测序的完成,将极大地促进茶叶生物化学、茶树次生代谢、茶树育种等方面的研究,推动茶叶科学的发展。
宏(元)基因组学(Metagenomics)也称为微生物环境基因组学(Microbial environmental genomics)或生态基因组学(Ecological genomics),其定义为以环境样品中微生物群体基因组为对象,研究微生物的种群结构、功能活性、多样性、相互协作关系及其与环境间关系的研究方法[8]。近年,多位研究者应用宏基因组学技术开展了普洱茶、茯砖茶和六堡茶后发酵过程中微生物组成与变化研究。Lyu等[9]应用454焦磷酸测序(454 Pyrosequencing Analysis)技术发现细菌是普洱茶发酵中主要菌群,主要包括放线菌(Actinobacteria)、变形杆菌(Proteobacteria)和厚壁菌门(Firmicutes),分别占30.08%、24.47%和20.23%。陈庆金[10]和徐书泽等[11]应用Miseq技术研究发现六堡茶中优势真菌均为曲霉属(Aspergillus)和散囊菌属(Eurotium)。Fu等[12]发现茯砖和青砖优势细菌为Firmicutes,六堡茶优势细菌为Actinobacteria,而普洱茶中Firmicutes和Actinobacteria所占比例对等。Zhang等[13]发现随着发酵进行普洱生茶和熟茶的真菌多样性下降,细菌多样性上升;而不同年份的普洱生茶的微生物组成存在差异性。笔者课题组应用454 Pyrosequencing技术研究实验室模拟发酵普洱茶过程微生物多样性,发现原料与发酵初期的优势细菌是变形菌门(Proteobacteria),随后Firmicutes上升为优势菌,发酵后期Actinobacteria与Firmicutes共同成为细菌优势菌;原料的优势真菌为no_rank_Fungi,发酵过程曲霉属真菌一直处于优势,发酵中期根毛霉属(Rhizomucor)繁殖,后期降低[14]。随后,应用Miseq技术研究普洱茶工业发酵样品,发现原料与发酵初期的优势细菌是肠杆菌(Enterobacteriaceae),发酵后期优势细菌是芽孢杆菌(Bacillaceae);原料与发酵初期的优势真菌是曲霉(Aspergillus),发酵中期蓝状菌(Rasamsonia)和嗜热丝孢菌(Thermomyces)与曲霉属共同成为优势真菌,但出堆样品的优势真菌为曲霉,进一步阐明普洱茶发酵过程微生物群落组成与动态变化[15]。另外,研究者应用PCR变性梯度凝胶电泳(Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoresis,PCR-DGGE)[16-19]、16S rRNA基因克隆文库(Clonal Library)[20]等免培养技术,研究了普洱茶发酵过程微生物多样性与动态变化。
综上,以高通量测序为核心的宏基因组学技术从完整的微生物群落水平探明了普洱茶、茯砖茶和六堡茶等发酵过程微生物的组成与动态变化规律,完善了其发酵理论,为进一步研究微生物在发酵工艺中的功能奠定基础。今后应增加样本量,重点分析各地区典型厂家,不同贮藏时间及具有独特风味的样品,研究分析其微生物群落结构与动态变化规律,探究风味品质与微生物的具体关系,改进发酵工艺,稳定产品风味质量。
2 转录组学在茶学研究中的应用
转录组学(Transcriptomics)是以信使RNA(mRNA)、核糖体RNA(rRNA)、转运RNA(tRNA)及非编码RNA(ncRNA)为研究对象,从整体角度研究其种类、结构、功能及转录调控规律的学科[21]。转录组学能够为基因表达调控和蛋白质功能研究提供大量信息,已在医学、生物学、微生物学和药学等领域广泛应用[22-23]。转录组学作为研究功能基因组学的强有力工具,在茶树抗性机理、特殊茶树品种资源以及茶树次级代谢产物生物合成调控机制等方面得到了应用,并取得了重要成果。
2.1 茶树抗性机理研究中的应用
茶树生长受低温、干旱、病虫害等环境条件的制约。基于此,研究者应用高通量转录组测序技术,开展了茶树抗性机理方面研究,为发掘茶树抗性基因,培育抗性较强的茶树良种,提高茶叶品质奠定了科学基础。
在抗虫机理方面,王丹等[24]应用RNA-Seq技术揭示茉莉酸(JasmonicAcid,JA)、乙烯(Ethylene,ET)和油菜素内酯类(Brassinolides,BRs)合成提高了茶树对茶尺蠖的抗性,并挖掘出9条具茶尺蠖特性的核苷酸结合位点-亮氨酸重复(NBS-LRR)类抗性序列CsNBSs,其中CsNBS1和CsNBS2基因在强弱抗品种间表达存在差异。上官明珠[25]应用Illumina Solexa技术研究发现miR159、miR319和miR396作用的靶基因具有调控防御反应、赤霉素等激素合成与代谢等相关功能,可能参与茶树抵御害虫的防御。
在抗冷胁迫方面,Wang等[26]应用RNA-seq技术获得了信号转导基因、冷响应基因、解毒酶基因、质膜稳定化基因等,提示碳代谢和钙离子信号转导等在茶树冷胁迫过程中具有重要作用。Zhang等[27]应用Illumina Solexa技术获得了茶树响应冷害的microRNAs。另外,曹红利等[28]应用cDNA末端快速扩增(Rapid amplification of cDNA ends,RACE)技术研究发现茶树碱性亮氨酸拉链蛋白(basic region/leucine zipper protein,bZIP)转录因子在茶树抗冷耐盐逆性中发挥作用。王郁[29]研究发现CsICE1和CsCBF1转录因子能够调控茶树低温胁迫,并证明茶树中存在ICE1-CBF冷应答途径。
在抗旱胁迫方面,刘声传[30]应用RNA-seq技术揭示了干旱胁迫与复水下茶树激素代谢和信号转导以及可溶性糖和脯氨酸代谢的机理,及其在茶树耐旱中的重要作用。赵姗姗[31]应用Solexa技术获得了176条miRNA序列信息,且推断出19个miRNA可能与铁观音茶树干旱胁迫存在相关性。Mohanpuria等[32]获得了6个茶树miRNAs,其中有1个miRNA可调控耐旱功能蛋白和MYB耐旱相关转录因子表达。
2.2 特殊茶树品种资源研究中的应用
我国茶树种质资源极其丰富,尤其包括一些珍稀的茶树品种,例如高茶多酚品系、高氨基酸白化品系和高花青素紫化品系,其叶色变化和特异性成分的机理成为研究的热点和难点。陈林波、李建等[33-34]应用RNA-seq技术对高花青素“紫娟”品种进行转录组测序分析,发现碳水化合物代谢、花青素和油菜素类脂合成途径的基因显著上调,可促进花青素的合成和运输。李娜娜[35]应用Illumina Solexa技术初步明确了“小雪芽”和“黄金芽”白化阶段阻碍色素合成、类囊体膜结构形成的分子机理。李春芳[36]研究发现“白叶1号”不同叶色时期,表达上调的基因主要参与光合作用、类胡萝素的生物合成、氮代谢、磷酸戊糖途径和硫代谢,表达下调的基因主要参与花青素的生物合成。吴全金[37]应用RNA-seq技术从“白鸡冠”中获得25个转录因子家族,注释最多的为MYB转录因子、AP2结构域、同源异型盒、锋指蛋白、bZIP家族和bHLH家族。Wang[38]等应用RNA-seq技术阐明了“中黄2号”芽叶黄化变异的机理。
2.3 茶树次级代谢产物生物合成调控中的应用
Shi等[39]应用RNA-Seq技术获得了13个参与茶氨酸、类黄酮等茶特征成分代谢的茶树Unigenes。Wu等[40]应用454 GS FLX技术鉴定了可能参与茶树类黄酮合成的6个MYB和2个bHLH转录因子。王弘雪、赵磊应用RACE技术研究克隆得到了参与茶树中多酚类物质代谢调控的转录因子MYB、bHLH和WD40[41-42]。
总之,基于茶树基因组数据未公布的现状,以高通量测序为基础的转录组学技术在茶学领域发挥了极其重要的作用,为培育优良且独具功能成分特色的创新茶树品种奠定了良好的理论和研究基础。通过对转录组的差异分析,从转录组水平深入解析茶树抗性机理,特异性茶树品种典型特征产生机理。今后,应加快茶树基因组学研究的步伐,完善基础数据和基因组信息,为进一步深度挖掘转录组信息提供基础;同时应集合生物信息学等前沿技术为测序获得海量数据分析提供强有力工具;另外,应进一步推动转录组数据的验证,确保转录组测序结果的可靠性和准确性。
3 蛋白质组学在茶学研究中的应用
蛋白质组(Proteome)是由Wilkins和Williams等人[43]于1994年提出,定义为“基因组所表达的全部蛋白质的总和”。蛋白质组学(Proteomics)是一门大规模、高通量、系统化的研究所有蛋白质组成、功能及其蛋白之间的相互作用的学科[44]。目前,以二维凝胶电泳(two-dimensionalgel electrophoresis,2-DE)和质谱(Mass Spectrometry,MS)技术为核心的鸟枪(shotgun)蛋白质组学技术,被视为最经典、最广泛应用的蛋白质组分析方法[45]。近年,研究者对茶叶蛋白样品的制备,应用2-DE、质谱技术(UPLC-Q-TOF、MALDI-TOF/TOF MS、LTQ-ESI-MS/MS、TOF-TOFTM、LC-MS/MS)、同位素标记相对和绝对定量技术(Isobaric tags for relative and absolute quantittation,iTRAQ)开展了茶蛋白组学研究,在茶树抗寒、抗旱等抗性机理、次级代谢产物合成及调控规律、白化茶白化机理、茶叶降脂、减肥和抗癌功能机理以及普洱茶发酵等等方面获得了新的知识,促进了茶学研究的发展。
3.1 茶树抗逆性研究中的应用
郭春芳等[46]应用TOF-TOFTM技术分析茶树在聚乙二醇胁迫下叶片蛋白质组差异,鉴定出14个蛋白质点,代表了10种差异蛋白,5个为1,5-二磷酸核酮糖羧化酶/加氧酶大亚基,9个为 PEG胁迫响应蛋白,主要参与叶绿体组成、糖代谢、能量代谢、蛋白质代谢、信号转导等生命活动过程。庄重光[47]研究发现水分胁迫下茶树中的核酮糖1,5二磷酸羧化酶、3磷酸甘油醛脱氮酶表达量降低而光诱导蛋白(ELIP)表达量显著提高。Qi等[48]应用LC-MS/MS研究发现活性氧对茶树种子干燥胁迫具有调节作用。Zhou等[49]应用MALDI-TOF-MS技术研究发现脱落酸在茶树干旱胁迫中发挥作用,鉴定了72个蛋白点,其中16个上调,2个下调,上调蛋白对糖酵解和光合系统有重要作用,21个响应干旱胁迫的蛋白大多参与碳氮代谢,核酸代谢、防御、活性氧的控制相关。Hu等[50]应用MALDI-TOF-MS技术研究发现茶树冻害组和正常组之间存在29个上调蛋白和17个下调蛋白,主要包括热休克蛋白70、参与碳代谢的酶等。
3.2 种质资源研究中的应用
李勤等[51]通过对安吉白茶返白前期、白化期、完全复绿期间3个时期蛋白质组的研究,检测到每个时期样品的蛋白质点1000个,表达丰度变化在1.5倍以上的差异蛋白点有60个,对其中26个差异表达蛋白进行鉴定,主要参与物质及能量代谢、光合作用、蛋白质及RNA加工有关的抗性蛋白和未知功能的蛋白质。
3.3 化学品质调控中的应用
张立明等[52]分析茶树不同儿茶素含量愈伤组织的蛋白差异性,检测到14个差异蛋白主要包括谷胱甘肽、咖啡酸-O-转甲基酶、S-腺苷甲硫氨酸合成酶、果胶甲酯酶等,分别参与了类黄酮的合成、转运及其调控,参与了乙烯合成、糖酵解和信号转导等生理作用。Li等[53]首次应用iTRAQ技术分析茶树芽和嫩叶的蛋白质组差异性,鉴定了116个上调蛋白和117个下调蛋白,主要参与碳代谢、核酸和蛋白代谢、光合作用等相关的生物过程。林金科[54]通过外源无公害诱导物诱导使茶树表没食子儿茶素没食子酸酯(EGCG)含量提高20.15%~25%,出现和消失的特异蛋白分别为14种和8种,表达上调和下调相差10倍的特异蛋白分别为11种和6种,这些蛋白在提高茶树EGCG含量过程中具有重要作用。另外,笔者课题组应用LC-MS/MS宏蛋白组学技术研究普洱茶模拟发酵样品微生物酶的组成与来源,共鉴定335个蛋白,具有28种生物过程和35种分子功能,同时发现与儿茶素氧化有关的过氧化氢酶、过氧化物酶,以及与茶叶软化等有关的酶[14]。随后在普洱茶工业发酵样品研究中,共检测到27~379个细菌蛋白和189~1893个真菌蛋白[15]。
3.4 功能机理研究中的应用
刘仲华[55]应用LC-MS/MS技术研究发现茯砖茶对肝脏损伤及脂质代谢紊乱具有修复作用,并指出甘油激酶(GK)、细胞色素C氧化酶2(COX2)、脂肪酸乙酰辅酶A羧化酶(ACACB)、脂肪酸合酶(FAS)等蛋白可能是茯砖茶改善高脂血症作用于肝脏的药物靶标。吴朝比[56]通过比较高血脂模型和饲喂茯砖茶的高脂模型大鼠肝脏差异表达蛋白,推测茯砖茶具有降脂作用。宋爽[57]等研究发现普洱茶对肝脏尿蛋白具有调节代谢作用。Lu等[58]应用LC-MS/MS技术研究绿茶提取物对肺癌A549 细胞的影响,发现有14个蛋白含量发生变化,且一些上调蛋白对细胞迁移具有重要作用。
综上,以2-DE和MS为基础的蛋白质组学技术在茶学领域研究发挥了重要的作用,为培育高抗旱、耐寒茶树新品种,生产高氨基酸、高生物活性优质茶产品,探索茶风味品质形成机理提供新思路。但基于高通量质谱技术所获得的大量复杂数据的生物信息学分析成为亟需解决的问题,且由于茶树的特异性其基因组数据和蛋白质组学数据库不完善,使蛋白的鉴定和功能分析受到制约;另外,已有关于蛋白质组学在茶学方面的应用仅局限于蛋白定性分析阶段,茶学定量蛋白质组学的研究鲜有报道。今后,首先应集合生物信息学的技术手段,开发具有针对性、高效性的蛋白组数据分析新型软件,减轻海量数据分析的工作难度,从而推进蛋白组学技术在茶学的深入研究;其次,基于蛋白定性基础研究,推进茶学蛋白的相对定量和绝对定量应用,从而提供更加科学、准确的蛋白信息,为解决茶学科学问题提供强有力技术支撑。
4 代谢组学在茶学研究中的应用
基于代谢组(Metabolome)的概念,Nicholson[59]和Fiehn[60]于上世纪90年代提出代谢组学(Metablomics/metabonomics),即以整体系统的方法对细胞、组织和机体产生的低分子量(<1 kDa)代谢产物进行定性定量研究,揭示各代谢网络之间的关联性。以质谱(MS)和核磁共振(NMR)为核心的代谢组学技术具有高灵敏度、高精确度、高通量的特征,作为一种整体性的技术策略和研究方式,对茶树生长发育特性研究、茶叶品种改良、品质控制、功效成分探索以及在储藏过程中的化学成分变化规律研究起到了极大推动作用。
4.1 茶树生长发育中的应用
茶树不同生长发育阶段及后期栽培管理方式与其理化成分的代谢方式息息相关,进而影响茶叶的品质。Jiang[61]等应用UPLC-3Q-MS-MS发现茶树不同发育阶段芽、叶和根系中酚类物质积累不同,嫩叶中含量更高。杨亦扬等[62]应用1H-NMR发现茶树代谢组昼夜差异较大,主要为茶氨酸、葡萄糖和蔗糖、表儿茶素(Epicatechin,EC)、没食子儿茶素(Gallocatechin,GC)和氨基酸组分。王凯[63]应用GC-MS研究发现不同氮素形态下茶叶的非挥发性物质差异较大,全氮和铵态氮更有利于茶叶中有机酸和糖类的积累。郝亚利等[64]应用GC-MS研究发现不同光质处理对儿茶素、咖啡碱、糖类、氨基酸和挥发性物质效应存在显著差异,从而影响茶鲜叶品质。Lee等[65]应用UPLC-Q-TOF-MS分析发现遮阴处理能够增加茶氨酸、咖啡碱、苯基丙氨酸等10种化学成分的含量,降低儿茶素、EC等4种成分的含量;并应用1H-NMR技术研究发现绿茶叶片越嫩茶氨酸、咖啡碱、没食子酸含量越高,而儿茶素、葡萄糖和蔗糖含量减少[66]。另外,李春芳[36]通过分析“安吉白茶”白化期和绿期的代谢谱,得到65个差异显著的代谢产物,主要参与碳固定、苯丙烷生物合成和类黄酮生物合成途径;与绿期相比,白化期的糖、糖衍生物和表儿茶素含量显著降低,而氨基酸含量显著升高,有助于进一步理解茶树白化代谢调控机制。
4.2 茶叶加工工艺中的应用
加工是茶叶品质形成的关键环节。宁井铭等[67]应用GC-MS技术发现祁门红茶加工中儿茶素类一直降解,茶黄素呈先增后减趋势,儿茶素与茶黄素代谢在萎凋和揉捻阶段呈显著性负相关。王秀梅[68]应用GC-MS和LC-MS法研究发现祁红不同加工的水相和有机相含量及物质种类差异较大,亮氨酸和咖啡碱含量一直很高,生物碱基本不变,在干燥中略有下降,其它氨基酸随加工工序变化。
4.3 茶叶质量品质评价中的应用
目前,茶叶品质的评判仍以感官审评为主,而代谢组学技术为茶叶高效率、高精度的品质判别提供了一种科学手段。吕海鹏[69]等应用GC-MS研究发现不同等级普洱茶香气成分存在显著差异,其中醇类香气可作为区分普洱茶等级的重要指标。Lucksanaporn等[70]应用1H-NMR研究表明糖、奎宁酸、咖啡因、茶氨酸、EGCG和ECG是评价日本绿茶等级的重要标记化合物。Pongsuwan等[71]应用UPLC-TOF-MS研究发现EGCG和ECG是日本煎茶高等级的标志物。刘晓莎[72]应用NMR技术发现相对于清香型铁观音,浓香型的茶汤中EC、蔗糖等物质的相对含量较高,而茶氨酸、异亮氨酸、奎尼酸、EGC、ECG、EGCG等物质的相对含量较低。Lee等[73]研究发现发酵茶中EC、EGC、ECG、EGCG、奎尼酸、咖啡因和蔗糖等物质的含量下降,没食子酸和葡萄糖含量升高。另外,陈红霞[74]应用LC-MS技术在普洱茶发酵中鉴定了49种显著差异性代谢物,其中茶氨酸、槲皮素、EGCG、EC的含量下降,黄嘌呤和次黄嘌呤上升。叶茂[75]应用UPLC-Q-TOF-MS分析发现普洱生茶和熟茶化学成分随着存放时间的延长而变化,且存在差异性。Ku等[76]发现随着储藏年份增加普洱生茶中EGCG、EGC、ECG、奎宁酸、绿原酸和木麻黄素含量下降,没食子酸含量上升;而不同贮藏年限的熟茶无显著差异。
4.4 茶叶产地、季节和茶类判别中的应用
我国茶叶种类繁多,同一品种不同产地的茶、不同类型的茶,以及不同加工生产季节的茶、其品质存在差异性。研究者应用MS和NMR结合多元统计的代谢组学分析手段,发现不同类型、不同生产季节以及同一种类不同产地的茶(相邻地区除外)代谢组均存在显著差异性(详见表1)。基于此,代谢组学可作为茶叶溯源判别的强有力工具,为茶叶溯源准确判别奠定基础。
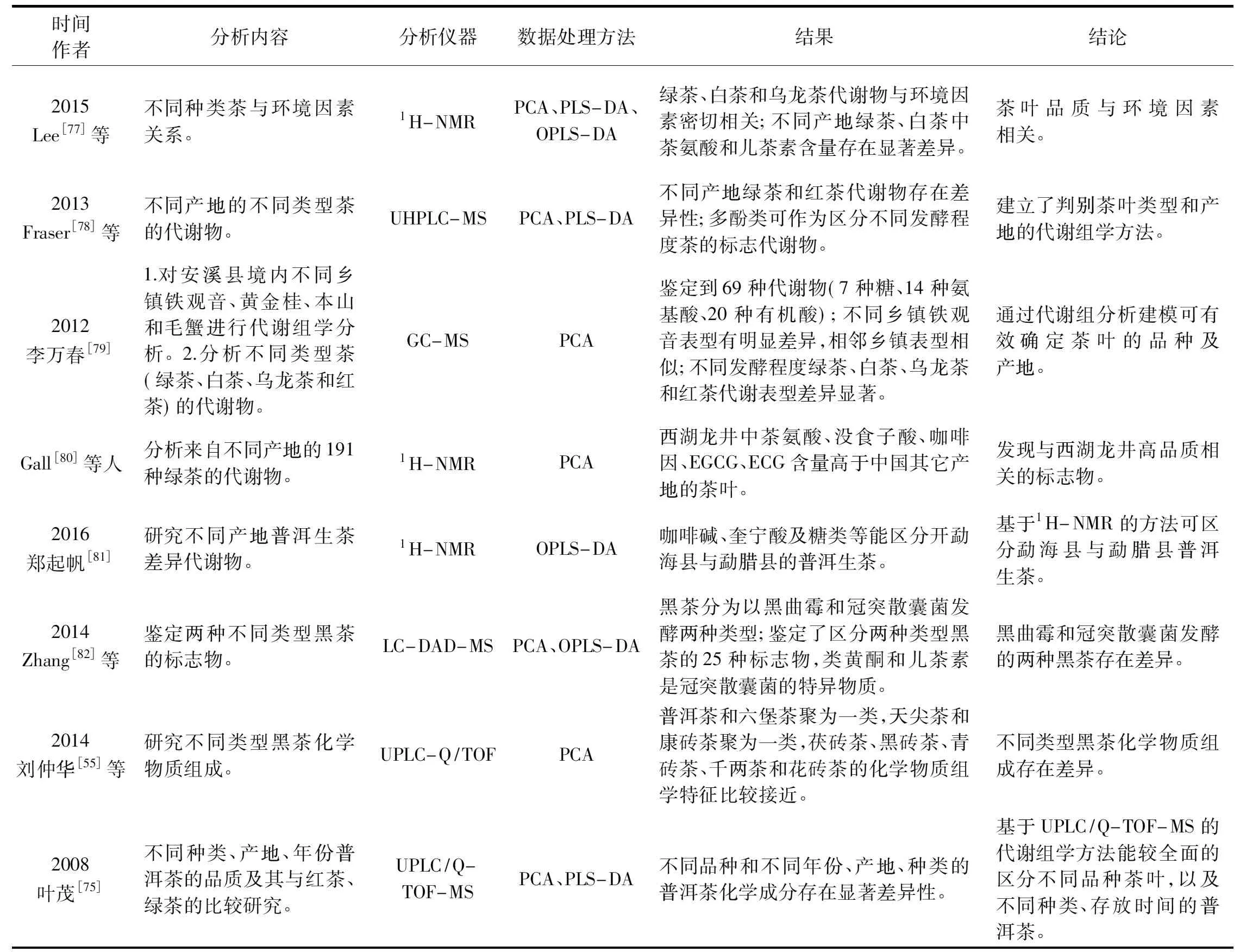
表1 茶叶溯源评判的代谢组学研究Table 1 Researchs of application of metabonomics techniques in tea origin traceability
注:主成分分析(Principal component analysis,PCA)、偏最小二乘判别分析(partial least square discrimination analysis,PLS-DA)、正交偏最小二乘判别分析(orthogonal projections to the latent structures discriminant analysis,OPLS-DA)。
综上,多位研究者应用以NMR和MS 技术为基础的代谢组学研究策略开展了茶产品品种、类型、产地、来源与生产季节鉴别、品质与质量评估和内含成分变化规律等多方面研究。这对于揭示茶叶主要品质特征的形成,探讨不同风味品质特征成分之间的相互转化关系,研究加工工艺和储藏条件对茶叶品质的变化规律,阐明茶叶品质的形成机理具有重要的理论意义,且茶树品种的改良效率和茶叶品质调控也具有实际应用价值。然而,目前代谢组学在茶学领域的应用仅仅局限于茶叶内含成分变化,对于产生这些差异性变化机理、内含成分组之间转化途径、以及内含成分组变化与茶叶品质和具体风味变化的关联等方面尚缺乏深入研究。今后,应致力于将代谢组学的数据与基因组学、转录组学和蛋白质组学的数据进行整合,构建代谢网络和通路,获得代谢物动态变化规律,并阐明其变化机理。应致力于研究代谢物差异与茶叶感官品质的关系建立,建立代谢物与经典茶叶评价的模型。
5 总结
近年,以基因组学、转录组学、蛋白质组学和代谢组学为基础的组学技术在茶学领域多方面开展了研究,已成为茶学研究的强有力工具(详见图1)。高通量测序技术的发展,极大推动了茶树全基因组测序工作进程,为完善茶树基因组数据库,深度挖掘功能基因信息奠定了基石。基于海量数据的转录组学提拱了大量转录水平的信息和思路,在筛选功能基因和代谢通路上发挥了不可替代作用。以LC-MS为基础的蛋白质组学技术为解释茶树生命现象及品质形成机理提供了技术支撑。以NMR和MS为基础的代谢组学技术在茶树品种、产品、产地、来源与生产季节鉴别、品质与质量评估和内含成分变化规律研究中发挥了极大作用。综上,组学技术在茶树生理生化、茶叶加工、种质资源特性等方面都得到了广泛应用,已有的研究结果极大丰富了茶学知识,为生产优质茶产品,培育我国特有茶树资源提供了科学数据,推动了茶学学科的发展。

图1 组学技术在茶学研究中应用情况Fig.1 Summy of application of omics technology in tea science
另外,组学技术作为一门前沿科学技术,其在茶学研究中的应用存在着很多的不足和亟待突破的难题,概括起来主要包括:我国茶树品种多样,茶制品类型各异,其品质形成机理、特点及产品功能等相关基础数据缺乏,品质与组学数据之间缺乏有效联系;茶树基因功能验证体系的缺乏限制了组学技术发现的基因、蛋白的功能研究;高通量技术可以获得海量数据,有效信息的抽提与分析需要生物信息学、统计学与生物学基础,这些知识与技术对于茶学研究者比较困难;单一的组学技术仅能在某一层面反映生物信息情况,目前尚未有综合基因组学、转录组学、蛋白质组学和代谢组学等组学方法来研究茶学的报道。组学技术与经典茶学如何结合,如何深度挖掘茶学信息等。针对这些问题,首先应加强茶树基因组学的研究,从源头上丰富茶树的基因组信息。其次,有针对性的建立不同层面研究的数据库,加大茶学研究的深度和广度。同时,在组学时代,应集合基因组学、转录组学、蛋白质组学以及代谢组学的研究策略,采用多组学综合分析研究茶学生理生化特征、茶风味品质形成机理。
总之,多组学综合分析必将成为解决茶树生命现象和茶叶品质形成机理的强有力工具,为揭示茶树抗逆、抗病的机制,品种选育和种质资源鉴定发挥重要作用,更全面更深入地认识茶、为创新茶加工工艺提供理论支撑,推动茶学学科发展的进程。
[1]Sánchez B,Ruiz L,Gueimonde M,et al. Omics for the study of probiotic microorganisms[J]. Food Research International,2013,54(1):1061-1071.
[2]Van Aggelen G,Ankley G T,Baldwin W S,et al. Integrating omic technologies into aquatic ecological risk assessment and environmental monitoring:hurdles,achievements,and future outlook[J]. Environ Health Perspect,2010,118(1):1-5.
[3]Zhang X,Wei D,Yap Y,et al. Mass spectrometry-based “omics” technologies in cancer diagnostics[J]. Mass Spectrometry Reviews,2007,26(3):403-431.
[4]Chen L,Zhou Z,Yang Y. Genetic improvement and breeding of tea plant(Camelliasinensis)in China:from individual selection to hybridization and molecular breeding[J]. Euphytica,2007,154(1-2):239-248.
[5]Ho C T,Lin J K,Shahidi F. Tea and tea products:chemistry and health-promoting properties[M]. Boca Raton:CRC,2008.
[6]宛晓春. 茶叶生物化学[M]. 北京:中国农业出版社,2006.
[7]李伟,印莉萍. 基因组学相关概念及其研究进展[J]. 生物学通报,2000,35(11):1-3.
[8]贺纪正,张丽梅,沈菊培,等. 宏基因组学的研究现状和发展趋势[J]. 环境科学学报,2008,28(2):209-218.
[9]Lyu C,Chen C,Ge F,et al. A preliminary metagenomic study of puer tea during pile fermentation[J]. Journal of the Science of Food & Agriculture,2013,93(13):3165-3174.
[10]陈庆金,黄丽,滕建文,等. 基于Miseq测序分析六堡茶陈化初期真菌多样性[J]. 食品科技,2015,40(8):67-71.
[11]徐书泽. 六堡茶中真菌的多样性分析[D]. 南宁:广西大学,2014.
[12]Fu J,Lv H,Chen F. Diversity and variation of bacterial community revealed by MiSeq sequencing in chinese dark teas[J].Plos One,2016,11(9):e0162719.
[13]Zhang Y,Skaar I,Sulyok M,et al. The microbiome and metabolites in fermented pu-erh tea as revealed by high-throughput sequencing and quantitative multiplex metabolite analysis[J]. Plos One,2016,11(6):e157847.
[14]Zhao M,Zhang D,Su X,et al. An integrated metagenomics/metaproteomics investigation of the microbial communities and enzymes in solid-state fermentation of pu-erh tea[J]. Scientific Reports,2015,5:10117.
[15]苏小琴.普洱茶发酵过程微生物群落与蛋白的多组学研究[D]. 昆明:云南农业大学,2016.
[16]Abe M,Takaoka N,Idemoto Y,et al. Characteristic fungi observed in the fermentation process for Puer tea[J]. International Journal of Food Microbiology,2008,124(2):199-203.
[17]杨晓苹,罗剑飞,刘昕,等. 普洱茶固态发酵过程中微生物群落结构及变化[J]. 食品科学,2013,34(19):142-147.
[18]刘石泉,胡治远,赵运林. 用DGGE法初步解析茯砖茶渥堆发酵过程中真菌群落的结构[J]. 湖南农业大学学报(自然科学版),2014,40(5):494-500.
[19]Xu A,Wang Y,Wen J,et al. Fungal community associated with fermentation and storage of Fuzhuan brick-tea[J]. International Journal of Food Microbiology,2011,146(1):14-22.
[20]赵明. 普洱熟茶后发酵过程细菌多样性的16S rRNA基因文库研究[A].第十五届中国科协年会第20分会场:科技创新与茶产业发展论坛论文集[C]. 中国贵州贵阳,2013:8.
[21]Wang Z,Gerstein M,Snyder M. RNA-Seq:a revolutionary tool for transcriptomics[J]. Nature Reviews Genetics,2009,10(1):57.
[22]Trapnell C,Williams BA,Pertea G,et al. Transcript assembly and quantification by RNA-Seq reveals unannotated transcripts and isoform switching during cell differentiation[J]. Nature Biotechnology,2010,28(5):511-515.
[23]付畅,黄宇. 转录组学平台技术及其在植物抗逆分子生物学中的应用[J]. 生物技术通报,2011(6):40-46.
[24]王丹. 基于转录组比较探究茶树对茶尺蠖抗性分子机制[D]. 杭州:中国农业科学院,2015.
[25]上官明珠. 茶树miRNA的分离鉴定及其与茶尺蠖取食诱导的差异表达特征研究[D]. 合肥:安徽农业大学,2013.
[26]Wang X C,Zhao Q Y,Ma C L,et al. Global transcriptome profiles ofCamelliasinensisduring cold acclimation[J]. BMC Genomics,2013,14:415.
[27]Zhang Y,Zhu X,Chen X,et al. Identification and characterization of cold-responsive microRNAs in tea plant(Camelliasinensis)and their targets using high-throughput sequencing and degradome analysis[J]. BMC Plant Biol,2014,14:271.
[28]曹红利,岳川,周艳华,等. 茶树bZIP转录因子基因CsbZIP1的克隆与表达定位[J]. 作物学报,2014,40(9):1702-1709.
[29]王郁. 茶树低温应答相关转录因子CsICE1和CsCBF1的研究[D]. 合肥:安徽农业大学,2011.
[30]刘声传. 茶树对干旱胁迫和复水响应的生理、分子机理[D]. 杭州:中国农业科学院茶叶研究所,2015.
[31]赵姗姗. MicroRNA对铁观音茶树干旱胁迫响应机制研究[D]. 福州:福建农林大学,2015.
[32]Mohanpuria P,Yadav S K. Characterization of novel small RNAs from tea(Camelliasinensis,L.)[J]. Molecular Biology Reports,2012,39(4):3977-3986.
[33]陈林波,夏丽飞,周萌,等. 基于RNA-Seq技术的“紫娟”茶树转录组分析[J]. 分子植物育种,2015,13(10):2250-2255.
[34]李健. ‘紫娟’茶树紫叶花青素积累机理的转录组分析[D]. 福州:福建农林大学,2016.
[35]李娜娜. 新梢白化茶树生理生化特征及白化分子机理研究[D].杭州:浙江大学,2015.
[36]李春芳. 茶树类黄酮等次生代谢产物的合成及基因的表达分析[D]. 杭州:中国农业科学院,2016.
[37]吴全金. ‘白鸡冠’茶树响应光调控的基因差异及理化特征分析[D]. 福州:福建农林大学,2015.
[38]Wang L,Yue C,Cao H,et al. Biochemical and transcriptome analyses of a novel chlorophyll-deficient chlorina tea plant cultivar[J]. Bmc Plant Biology,2014,14:352.
[39]Shi C,Yang H,Wei C,et al. Deep sequencing of theCamelliasinensistranscriptome revealed candidate genes for major metabolic pathways of tea-specific compounds[J]. BMC Genomics,2011,12(1):131.
[40]Wu H,Chen D,Li J,et al. De novo characterization of leaf transcriptome using 454 sequencing and development of EST-SSR markers in tea(Camelliasinensis)[J]. Plant Molecular Biology Reporter,2013,31(3):524-538.
[41]王弘雪. 与茶树类黄酮合成相关的MYB转录因子的克隆及表达研究[D]. 合肥:安徽农业大学,2012.
[42]赵磊. 茶树类黄酮合成转录因子筛选及ANR基因功能验证[D]. 合肥:安徽农业大学,2013.
[43]Kahn P. From genome to proteome:Looking at a cell’s proteins[J]. Science,1995,270(5235):369-370.
[44]尹稳,伏旭,李平. 蛋白质组学的应用研究进展[J]. 生物技术通报,2014(1):32-38.
[45]Zhang X,Fang A,Riley C P,et al. Multi-dimensional liquid chromatography in proteomics—A review[J]. Analytica Chimica Acta,2010,664(2):101-113.
[46]郭春芳,孙云,赖呈纯,等. 聚乙二醇胁迫下茶树叶片的蛋白质组分析[J]. 茶叶科学,2009,29(2):79-88.
[47]庄重光. 不同水分处理下铁观音茶树的生理机制及其差异蛋白质组学研究[D]. 福州:福建农林大学,2008.
[48]Chen Q,Yang L,Ahmad P,et al. Proteomic profiling and redox status alteration of recalcitrant tea(Camelliasinensis)seed in response to desiccation[J]. Planta,2011,233(3):583-592.
[49]Zhou L,Xu H,Mischke S,et al. Exogenous abscisic acid significantly affects proteome in tea plant(Camelliasinensis)exposed to drought stress[J]. Horticulture Research,2014,1:14029.
[50]Hu Yongguang L Y L J. Comparative proteomics analysis of tea leaves exposed to subzero temperature:Molecular mechanism of freeze injury[J]. International Journal of Agricultural & Biological Engineering,2013,6(4):27-34.
[51]李勤. 安吉白茶新梢生育期间蛋白质组学及茶氨酸体外生物合成的研究[D]. 长沙:湖南农业大学,2011.
[52]张立明,王云生,高丽萍,等. 茶树不同儿茶素含量愈伤组织的蛋白差异分析[J]. 中国农业科学,2010(19):4053-4062.
[53]Li Q,Li J,Liu S,et al. A comparative proteomic analysis of the buds and the young expanding leaves of the tea plant(CamelliasinensisL.)[J]. International Journal of Molecular Sciences,2015,16(6):14007-14038.
[54]林金科. 茶树高EGCG的种质资源及外源诱导研究[D]. 福州:福建农林大学,2003.
[55]刘仲华. 黑茶化学物质组学与降脂减肥作用机理研究[D]. 北京:清华大学,2014.
[56]吴朝比. 黑茶降血脂功效评价及其对模型大鼠蛋白质差异表达的影响[D]. 长沙:湖南农业大学,2012.
[57]宋爽,严亮,王宣军,等. 双向电泳分析普洱茶对小鼠肝脏MUP-1蛋白表达的影响[J]. 西南农业学报,2014,27(1):428-432.
[58]Lu Q Y,Yang Y A,Jin Y S,et al. Effects of green tea extract on lung cancer A549 cells:proteomic identification of proteins associated with cell migration[J]. Proteomics,2009,9(3):757-767.
[59]Sumner L W,Mendes P,Dixon R A. Plant metabolomics:large-scale phytochemistry in the functional genomics era[J]. Phytochemistry,2003,62(6):817-836.
[60]Fiehn O. Metabolomics - the link between genotypes and phenotypes[J]. Plant Molecular Biology,2002,48(1):155-171.
[61]Jiang X,Liu Y,Li W,et al. Tissue-specific,development-dependent phenolic compounds accumulation profile and gene expression pattern in tea plant(Camelliasinensis)[J]. Plos One,2013,8(4):e62315-e62315.
[62]杨亦扬,马立锋,黎星辉,等. 氮素水平对茶树新梢叶片代谢谱及其昼夜变化的影响[J]. 茶叶科学,2013,33(6):491-499.
[63]王凯. 基于稳定性同位素~(15)N示踪和代谢谱分析技术的茶叶氮代谢研究[D]. 合肥:安徽农业大学,2012.
[64]郝亚利. 基于代谢谱分析的不同光质处理对茶鲜叶品质形成的影响研究[D]. 合肥:安徽农业大学,2010.
[65]Lee L,Choi J H,Son N,et al. Metabolomic analysis of the effect of shade treatment on the nutritional and sensory qualities of green tea[J]. Journal of Agricultural and Food Chemistry,2013,61(2):332-338.
[66]Lee J,Lee B,Hwang J,et al. Metabolic dependence of green tea on plucking positions revisited:A metabolomic study[J]. Journal of Agricultural and Food Chemistry,2011,59(19):10579-10585.
[67]宁井铭,方骏婷,朱小元,等. 基于代谢谱分析的祁门红茶加工过程中儿茶素及芳香类物质变化[J]. 食品工业科技,2016(9):127-133,138.
[68]王秀梅. 祁门红茶加工过程中代谢谱分析及其品质形成机理研究[D]. 合肥:安徽农业大学,2012.
[69]吕海鹏,林智,张悦,等. 不同等级普洱茶的化学成分及抗氧化活性比较[J]. 茶叶科学,2013(4):386-395.
[70]Tarachiwin L,Ute K,Kobayashi A,et al. 1H NMR based metabolic profiling in the evaluation of japanese green tea quality[J]. Journal of Agricultural and Food Chemistry,2007,55(23):9330-9336.
[71]Pongsuwan W,Bamba T,Harada K,et al. High-throughput technique for comprehensive analysis of japanese green tea quality assessment using ultra-performance liquid chromatography with time-of-flight mass spectrometry(UPLC/TOF MS)[J]. Journal of Agricultural and Food Chemistry,2008,56(22):10705-10708.
[72]刘晓莎,董继扬,孟维君,等. 铁观音茶水浸出物组成模式及溶出规律的核磁共振波谱分析[J]. 茶叶学报,2015(4):198-205.
[73]Lee J,Lee B,Chung J,et al.1H NMR-based metabolomic characterization during green tea(Camelliasinensis)fermentation[J]. Food Research International,2011,44(2):597-604.
[74]陈红霞. 普洱茶发酵过程的代谢组学研究[D]. 北京:北京化工大学,2013.
[75]叶茂. 应用代谢组学策略研究普洱茶及其对人体代谢的影响[D]. 上海:上海交通大学,2008.
[76]Ku K M,Kim J,Park H,et al. Application of metabolomics in the analysis of manufacturing type of pu-erh tea and composition changes with different postfermentation year[J]. Journal of Agricultural and Food Chemistry,2010,58(1):345-352.
[77]Lee J,Lee B,Chung J,et al. Metabolomic unveiling of a diverse range of green tea(Camelliasinensis)metabolites dependent on geography[J]. Food Chemistry,2015,174:452-459.
[78]Fraser K,Lane G A,Otter D E,et al. Analysis of metabolic markers of tea origin by UHPLC and high resolution mass spectrometry[J]. Food Research International,2013,53(2):827-835.
[79]李万春. 气质联用在不同茶叶品质鉴定中的应用[D]. 南京:南京理工大学,2012.
[80]Le Gall G,Colquhoun I J,Defernez M. Metabolite profiling using1H NMR spectroscopy for quality assessment of green tea,Camelliasinensis(L.)[J]. Journal of Agricultural and Food Chemistry,2004,52(4):692-700.
[81]郑起帆,佘玉奇,肖雪蓉,等. 基于1H-NMR的2个产地普洱生茶差异代谢物的研究[J]. 广东药学院学报,2016(2):187-191.
[82]Zhang L,Deng W,Wan X. Advantage of LC-MS metabolomics to identify marker compounds in two types of Chinese dark tea after different post-fermentation processes[J]. Food Science and Biotechnology,2014,23(2):355-360.
Progressofresearchesinteasciencebyomicstechnologies
SUXiao-qin1,2,3,MAYan1,YANGXiu-fang2,3,KONGJun-hao2,3,ZUOXiao-bo2,3,ZHAOMing1,*
(1.College of Longrun Pu-erh tea,Yunnan Agricultural University,Kunming 650201,China;2.Hangzhou Tea Research Institute,All China Federation of Supply and Marketing Cooperatives,Hangzhou 310016,China;3.Zhejiang Key Laboratory of Transboundary Applied Technology for Tea Resource,Hangzhou 310016,China)
TS272
A
1002-0306(2017)18-0333-08
2017-02-13
苏小琴(1990-),女,硕士,研究实习员,主要从事茶叶生物化学和蛋白质组学方面的研究,E-mail:cecynasu@163.com。
*通讯作者:赵明(1979-),男,博士,教授,主要从事茶学多组学方面的研究,E-mail:zhaoming02292002@aliyun.com。
国家自然科学基金项目(31160174);“十三五”国家重点研发计划项目(2016YFD400805-3)。
10.13386/j.issn1002-0306.2017.18.063
