贝那普利和氨氯地平对自发性高血压大鼠酪酪肽表达的影响
2017-10-13刘志军颜春鲁刘峰林张秋菊徐厚谦胡继宏窦荣海温鑫洋
金 华 刘志军 颜春鲁 刘峰林 陈 丽 张秋菊 徐厚谦 胡继宏 窦荣海 温鑫洋
(甘肃中医药大学,甘肃 兰州 730000)
贝那普利和氨氯地平对自发性高血压大鼠酪酪肽表达的影响
金 华 刘志军 颜春鲁 刘峰林 陈 丽 张秋菊 徐厚谦 胡继宏 窦荣海 温鑫洋
(甘肃中医药大学,甘肃 兰州 730000)
目的探讨贝那普利和氨氯地平对自发性高血压大鼠(SHR)酪酪肽(PYY)表达的影响。方法14周龄雄性SHR 45只随机分为模型组(n=15)、贝那普利组(盐酸贝那普利灌服0.90 mg·kg-1·d-1,n=15)、氨氯地平组(苯磺酸氨氯地平灌服0.45 mg·kg-1·d-1,n=15),以同源雄性WKY大鼠作为正常对照(n=15),模型组及WKY 组每日灌服同体积的蒸馏水,干预8 w后,应用酶联免疫法检测血清中PYY的含量,采用免疫组化法和RT-PCR法分别检测结肠中PYY及其mRNA的表达。结果干预8 w后,模型组血清中PYY及其mRNA表达量显著升高(P<0.05),与模型组比较,各给药组血清中PYY及其mRNA表达无显著性差异(P>0.05);与WKY组比较,模型组结肠组织中PYY及其mRNA表达显著升高(P<0.05),与模型组比较,贝那普利组与氨氯地平组结肠组织中PYY及其mRNA表达降低(P<0.05),与贝那普利组比较,氨氯地平组结肠组织中PYY及其mRNA表达显著降低(P<0.05)。结论SHR大鼠结肠组织中PYY调节失衡,贝那普利、氨氯地平的降压作用很可能还通过调节PYY的表达而达到降压目的。
自发性高血压大鼠;酪酪肽;贝那普利;氨氯地平
酪酪肽(PYY)是由36个氨基酸组成的小分子多肽,主要分布在肠道远端的内分泌L-细胞,是一种重要的胃肠激素类脑肠肽。PYY3-36是PYY的主要存在形式,PYY可自由通过血脑屏障与下丘脑弓状核Y2受体结合〔1〕。然而,有关PYY这一高相关胃肠激素在高血压发病过程中的变化及ACEI、CCB等药物对其的影响尚无实验研究。本实验拟分析自发性高血压大鼠(SHR)PYY的表达。
1 材料与方法
1.1动物 14周龄SPF级雄性SHR 45只,体重(350±20)g;同源雄性 WKY大鼠15只,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。饲养于甘肃中医药大学SPF级动物实验室(恒温22℃±2℃,恒湿55%±5%,人工光照明暗各12 h)。
1.2实验分组及干预 45只SHR常规饲养7 d后,随机分为模型组、贝那普利组、氨氯地平组各15只;同时以WKY大鼠15只作为正常对照组。以蒸馏水为溶剂配制贝那普利和氨氯地平混悬液,贝那普利组灌服贝那普利0.90 mg·kg-1·d-1;氨氯地平组灌服氨氯地平0.45 mg·kg-1·d-1。模型组及正常对照组每日灌服同体积的蒸馏水。共干预8 w。实验过程中由于灌胃不当等原因导致个别动物死亡。
1.3药物、试剂和仪器 盐酸贝那普利(洛汀新,10 mg,北京诺华制药有限公司,批号:X1936),苯磺酸氨氯地平(络活喜,5 mg,辉瑞制药有限公司,批号:1205120)。PYY酶联免疫吸附(ELISA)试剂盒(上海源叶生物科技有限公司,批号20130402B)。PYY一抗,批号为:ab15879,Lot:147843-1;Goat anti-Rabbit IgG(H+L),ab6702;上述均购置于美国abcam公司。免疫组化染色试剂盒购置于武汉博士德生物工程有限公司。RNA提取试剂盒(QIAGEN公司,批号74104),反转录试剂盒(Roche公司)、荧光染料(Roche公司)、PCR引物(金唯智生物科技有限公司设计合成)、全自动酶标分析仪(Bio-Rad公司,型号iMark)、荧光PCR仪(Bio-Rad公司,型号CFX96)、凝胶扫描成像系统(Bio-Rad公司)、电子天平(上海精密科学仪器有限公司,型号FA2004N)、医用低速离心机(金坛市恒丰仪器厂,型号LX-820)等。
1.4取血 末次给药24 h后,并禁食 10 h(过夜),次日测量所有大鼠的体质量,随后腹腔注射10%的水合氯醛(1.5 ml/100 g体质量) 麻醉大鼠,腹主动脉采血5 ml,4℃ 3 500 r/min(半径7 cm)离心15 min,分离血清,-20℃保存,待测。
1.5血清中PYY含量的检测 用ELISA检测血清中PYY的含量,严格按照试剂盒说明书步骤进行操作。批内变异系数为8.5%,批间变异系数为13.5%。
1.6免疫组化法测定结肠中PYY的表达 取部分结肠组织,作适当的修整后放入4%多聚甲醛中固定。①石蜡切片:40℃过夜,60℃烤片1 h;②常规脱蜡至水;③抗原修复:枸橼酸缓冲液(pH6.0)恒温水浴至95℃~98℃,放入玻片,维持60 min;室温放置自然冷却,磷酸盐缓冲液(PBS)冲洗5 min×3次;④滴加内源性过氧化物酶封闭液,避光室温孵育10 min;PBS冲洗5 min×3次;⑤封闭:滴加正常山羊血清,37℃孵育15 min,甩干不洗;⑥滴加稀释5-HT抗体,然后4℃过夜。用PBS替代一抗作为阴性对照,约12~16 h;次日取出,室温放置10 min,PBS洗5 min×3次;⑦滴加二抗工作液,37℃孵育30 min;PBS洗5 min×3次;⑧滴加HRP标记的链霉亲和素,37℃孵育15 min;PBS洗5 min×3次;⑨DAB显色:DAB按试剂说明书配置,镜下观察,至目的组织出现阳性颗粒而周围组织无非特异显色时,蒸馏水终止;⑩苏木素复染细胞核1~2 min,1%盐酸乙醇分化数秒,镜下控制,自来水返蓝10 min;脱水、透明、封片。
1.7RT-RCR法测定结肠中PYY mRNA表达 ①总RNA的提取:取30 mg组织提取总RNA,液氮速冻后碾磨组织,加入600 μl RLT裂解液裂解组织,将所得溶液于离心机4℃、12 000 r/min(半径7 cm)离心3 min;加入70%乙醇600 μl后,立即转移700 μl溶液(包括沉淀)至柱子上,离心15 s,完全滤过溶液;分别加入700 μl Buffer RW1、500 μl Buffer RPE,按上述条件离心,弃滤液,加入500 μl Buffer RPE离心2 min,弃滤液;将柱子移入至新的2 ml试管中,离心1 min干燥滤膜,将柱子移入之新的1.5 ml试管中加入30~50 μl无酶水,离心1 min得到RNA;同时取2 μl RNA样品稀释50倍后测定样品在260 nm和280 nm的吸收值,OD260/280 在1.8~2.0视为提取的总RNA质量纯度较好。② 逆转录获得第一链cDNA:使用罗氏反转录试剂盒(No 0489686-6001),严格按照说明书进行反转录总mRNA,合成第一链cDNA文库,反应产物在-20℃冰箱中保存备用。反应条件:25℃、10 min,55℃、30 min,85℃、5 min,4℃保存。引物设计与合成:β-actin:正义:3′AGGGAAATCGTGCGTGAC5′,反义:3′CGCTCATTGCCGATAGTG5′;PYY:正义:3′CTGCGCCACTACCTCAAVVT5′,反义:3′TCTCGCTGTCGTCTGTGAAGA5′。③cDNA的PCR扩增:使用FastStart Universal SYBR Green MASTER(ROX),实验步骤参照其说明书,采用总体积50 μl反应体系,反应条件:95℃、5 min,95℃、10 s,55℃、20 s,75℃、30 s。实验重复3次。采用2-△△CT法做相对定量分析。
1.8统计学方法 采用SPSS17.0软件进行方差分析、SNK-q检验。
2 结 果
2.1血清中PYY含量的变化 与正常对照组(0.74±0.03)比较,模型组PYY血清浓度(0.80±0.07)显著升高(P<0.05);与模型组比较,贝那普利组(0.82±0.05)和氨氯地平组(0.79±0.08)无显著差异(P>0.05)。
2.2PYY在结肠中的表达 PYY在各组大鼠的结肠中均有表达。与正常对照组(81.15±0.35)比较,模型组PYY的表达(94.89±0.83)明显升高(P<0.05);与模型组比较,贝那普利组和氨氯地平组(97.13±0.30,82.38±0.87)明显降低(P<0.05);与贝那普利组比较,氨氯地平组明显降低(P<0.05)。镜下观察显示,PYY在黏膜下腺体上皮细胞的胞质中表达较弱,而在黏膜层底部表达增强,正常对照组PYY在黏膜层底部表达较弱,模型组PYY在黏膜层底部表达增强,贝那普利组和氨氯地平组PYY在黏膜层底部表达减弱,而氨氯地平组的表达减弱更显著,见图1。
2.3PYY mRNA在结肠中的表达 与正常对照组(0.27±0.07)比较,模型组PYY mRNA在结肠中的表达(1.00±0.32)明显升高(P<0.05);与模型组比较,贝那普利组和氨氯地平组(0.92±0.09,0.31±0.09)表达明显降低(P<0.05);与贝那普利组比较,氨氯地平组表达降低(P<0.05)。
2.4PYY 在结肠中的蛋白表达 PYY蛋白在WKY组结肠组织中处于低表达状态。与正常对照组(0.68±0.02)比较,模型组结肠组织中PYY蛋白表达(1.04±0.05)升高(P<0.05);与模型组比较,贝那普利组和氨氯地平组(0.89±0.03,0.76±0.04)蛋白表达降低(均P<0.05);与贝那普利组比较,氨氯地平组蛋白表达降低(均P<0.05)。见图2。
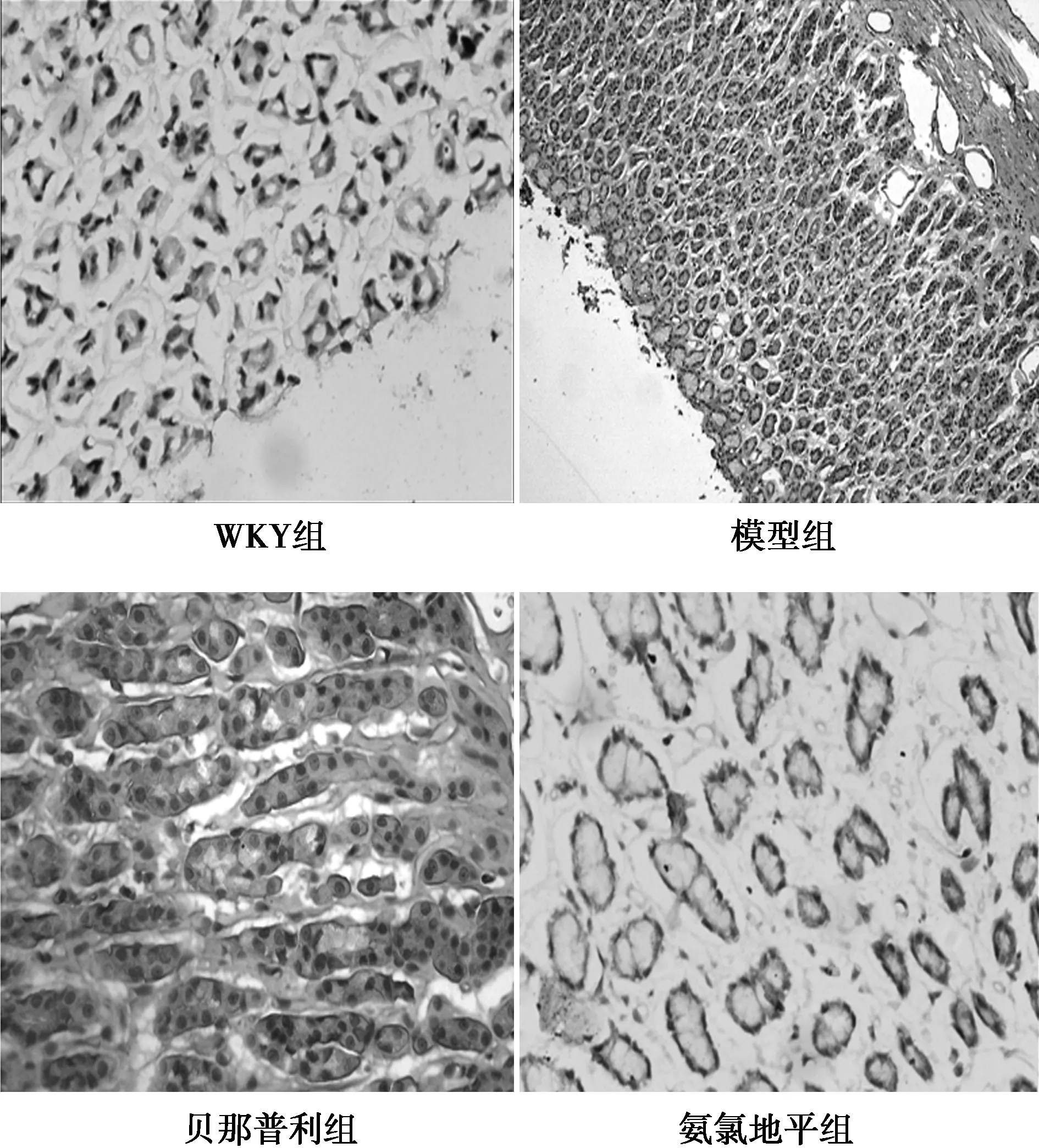
图1 各组大鼠结肠中PYY表达(免疫组化染色,×400)

图2 各组大鼠结肠中PYY蛋白表达的影响
3 讨 论
研究表明,胃肠激素是消化系统和心血管的一类重要调节因子,胃肠激素调节异常可能是高血压发病的重要因素〔2〕。胃肠激素通过“迷走传入神经-孤束核”将信号传导至下丘脑弓状核,进而参与食物摄入和能量平衡的调节〔3,4〕。PYY是含有 36 个氨基酸的直链多肽类物质,是一种重要的胃肠激素。PYY主要有PYY1-36和PYY3-36两种类型,而PYY3-36是血液循环中的主要存在形式〔5〕。PYY作为一种调节肽,通过位于靶细胞的PYY受体向组织细胞内传递信息〔6〕。研究发现〔7〕,迷走神经、脑干介导的通路通过PYY3-36 而发挥调节作用,Y2 受体就位于迷走传入神经的终端,如果腹部切断迷走神经或者横断丘脑-后脑将会抑制 PYY 的减食欲作用,下丘脑将不会被激活。而由十二指肠注入食物时,在营养素抵达PYY生成的主要部位—肠道远端之前,血浆PYY水平就已升高,提示PYY的释放可通过神经反射—迷走神经反射引起〔8〕。PYY参与营养、摄食、能量平衡的调节〔9〕,是一个调节摄食的饱感信号〔10〕。本实验通过ELISA检测血清中PYY的含量,结果显示,与WKY组比较,模型组大鼠血清中PYY含量表达升高,SHR大鼠血清中PYY表达含量升高,这可能与血压升高相关。
贝那普利和氨氯地平均具有良好的降压作用,而且在降压的同时能有成效逆转血管重构〔11,12〕。但关于二者对“胃肠激素-酪酪肽”表达的影响,目前尚未见相关研究文献。本实验结果提示,氨氯地平可使SHR结肠中PYY mRNA的表达降低,进而达到降压的目的。从而推测,SHR大鼠结肠组织中PYY调节失衡,氨氯地平的降压作用很有可能是通过调节“胃肠激素-酪酪肽”的的表达,最终降低血压。
高血压的发生是多因素影响的结果,而遗传易感性和环境因素可能通过胃肠激素影响血压调控。“胃肠激素-酪酪肽”的研究从一个全新的角度对高血压的发病机制进行探索,而胃肠激素可能是影响血压调控的重要因素之一。研究胃肠激素与高血压的相关性,可能是对高血压发病机制中的神经、体液调节的一项重要补充,但氨氯地平和贝那普利通过调节胃肠激素降低血压的具体作用机制及途径还有待更深入地研究。
1Keire DA,Mannon P,Kobayashi M,etal.Primary structure of PYY,〔Pro(34)〕PYY,and PYY-(3-36) confer different conformations and receptor selectivity〔J〕.Am J Physiol Gastrointest Liver Physiol,2000;279(1):G126-31.
2Kasacka I,Piotrowska Z,Janiuk I.Influence of renovascular hypertension on the distribution of vasoactive peptide in the stomach and heat of rats〔J〕.Exp Biol Med(Maywood),2015;240(11):1402-7.
3Simpson KA,Martin NM,Bloom SR.Hypothalamic regulation of food intake and clinical therapeutic applications〔J〕.Arq Bras Endocrinol Metabol,2009;53(2):120-8.
4Sainsbury A,Zhang L.Role of the arcuate nucleus of the hypothalamus in regulation of body weight during energy deficit〔J〕.Mol Cell Endocrinol,2010;316(2):109-19.
5Mentlein R,Dahms P,Grandt D,etal.Proteolytic processing of neuropeptide Y and peptide YY by dipeptidyl peptidase IV〔J〕.Regul Pept,1993;49(2):133-44.
6潘淑波,刘 欣.胃肠激素酪酪肽的特性及其与疾病关系的研究进展〔J〕.陕西医学杂志,2009;38(10):1382-3.
7Koda S,Date Y,Murakami N,etal.The role of the vagal nerve inperipheral PYY3-36-induced feeding reduction in rats〔J〕.Endocrinology,2005;146(5):2369-75.
8Fu-cheng X,Anini Y,Charoit J,etal.Mechanisms of Peptide YY release induced by intradudenal meal in rats:neural regulation by Proximal gut〔J〕.Pflugers Areh,1997;433(5):571-9.
9Cani PD,Delzenne NM.The role of the gut microbiota in energy metabolism and metabolic disease〔J〕.Curr Pharm Des,2009;15(13):1546-58.
10Camilleri M.Peripheral mechanisms in the control of appetite and related experimental therapies in obesity〔J〕.Regul Pept,2009;156(1-3):24-7.
11万新红,罗玉梅,姜德谦,等.miRNA-195、贝那普利与自发性高血压大鼠主动脉重构〔J〕.中国动脉硬化杂志,2014;22(3):227-32.
12Shang W,Han P,Yang CB,etal.Synergism of irbesartan and amlodipine on hemodynamic amelioration and organ protection in spontaneously hypertensive rats〔J〕.Acta Pharmacol Sin,2011;32(9):1109-15.
〔2016-12-11修回〕
(编辑 李相军)
R544
A
1005-9202(2017)19-4717-03;
10.3969/j.issn.1005-9202.2017.19.012
国家自然科学基金资助项目(81160477);甘肃省自然科学研究基金计划( 1107RJZA220);甘肃省高等学校基本科研业务费资助项目(2010-5)
金 华(1970-),男,教授,主任医师,博士,主要从事心脑血管疾病及其危险因素的临床与实验研究。
