表面活性剂Tween 80对植物修复土壤芘污染的影响
2017-10-12潘声旺何茂萍陈珂铭
潘声旺, 何茂萍, 陈珂铭,2, 刘 琴,3
(1.成都大学 建筑与土木工程学院, 四川 成都 610106;2.西南石油大学 化学化工学院, 四川 成都 610500;3.四川农业大学 建筑与土木工程学院, 四川 成都 611830)
表面活性剂Tween 80对植物修复土壤芘污染的影响
潘声旺1, 何茂萍1, 陈珂铭1,2, 刘 琴1,3
(1.成都大学 建筑与土木工程学院, 四川 成都 610106;2.西南石油大学 化学化工学院, 四川 成都 610500;3.四川农业大学 建筑与土木工程学院, 四川 成都 611830)
为了评估表面活性剂对植物修复持久性有机污染物(POPs)的强化作用,研究了Tween 80对高羊茅修复土壤芘污染的影响效应,探讨了Tween 80对植物修复的强化机理.结果表明,实验浓度(20.24~321.42 mg/kg)范围内,Tween 80的存在促进了土壤中芘的去除,在70 d表面活性剂强化植物修复(SEPR)实验间,种植高羊茅的土壤中芘的去除率为66.52%(53.99%~80.18%),无植物土壤中芘的去除率为14.32%(11.28%~20.23%);添加4%Tween 80时,种植植物的土壤中的芘去除率为75.73%(60.96%~86.39%),无植物土壤中仅为18.43%(14.24%~25.79%).所有的芘去除途径中,植物—微生物相互作用的贡献最为显著,无论有(45.67%)、无(51.56%)Tween 80存在,都是污染物芘去除的主要手段.可见,表面活性剂Tween 80的存在强化了高羊茅对芘污染土壤的修复效果,SEPR技术是改善植物修复POPs修复效果的有效途径.
植物修复;表面活性剂;SEPR;芘;Tween 80;土壤
0 引 言
植物修复过程中,根系分泌物介导下的根际效应在改善根际生态属性、缓解环境胁迫及促进持久性有机污染物(persistent organic pollutants,POPs)快速消解等方面具有重要作用[1].一方面,根系活动所释放的某些胞外酶能够直接参与部分有机污染物的降解过程;另一方面,根系分泌物中的某些可溶性糖、低分子量有机酸以及氨基酸等物质,可为根际微生物的生长提供充足的碳源、氮源,改善其营养结构,激发其生长活性[2],进而促进根际环境中POPs等的迁移转化或生物降解.因土壤中多环芳烃(PAHs)、有机氯农药(OCPs)、多氯联苯(PCB)等污染物大多具有很强的疏水性,性质稳定、水溶性差,极易吸附在土壤中,生物可利用性低,严重制约了植物修复POPs的效率,影响了该技术的推广与应用[3].如何有效改善土壤中POPs的生物可利用性,提高修复效率,一直是环境领域急需解决的问题.
表面活性剂强化植物修复技术(surfactant-enhanced phytoremediation,SEPR)是基于表面活性剂对难降解有机物的增溶作用,使吸附在土壤介质上的有机物被降解吸附后进入水相,同时改善难降解有机物的生物可利用性,进而改善植物修复效率的一种有效手段[4].目前,国内外在该领域的研究主要集中在增溶机理及增溶动力学、增溶效果定量表达和影响因素等方面.而在具体场地应用过程中,如何调控SEPR的强化过程,实现增溶效果的最大化对提高修复效率至关重要.据此,本研究在评估表面活性剂Tween 80对植物修复芘污染土壤强化作用的基础上,探讨表面活性剂对植物修复POPs污染物强化修复过程及其机理,拟为SEPR技术在修复场地的实际应用提供一定参考.
1 材料和方法
1.1 材 料
1.1.1 化学制品.
实验选取芘作为POPs污染物的代表物,购自德国Fluka公司,纯度>98.5%,分子量为202.26 g/mol,logKow(Kow,辛醇—水分配系数)为4.88.
1.1.2 表面活性剂.
以聚氧乙烯山梨醇酐单油酸酯(polyoxyethylene sorbitan monooleate,Tween 80)为非离子表面活性剂的代表物,购自Tokyo Kasei Kogyo Co.,Ltd.,纯度≥98%,分子量为1 310 g/mol,亲水亲油平衡值(HLB)为15,临界胶束浓度(CMC)为15.72 mg/L.本研究选择4%(体积比),因为它对疏水性有机化合物显示出良好的溶解性,并且在先前的研究中表现出去除效率最佳.
1.1.3 污染土壤.
中性紫色土(Typic Purpli-Udic Cambosols),采自成都市郊旱地表层(5~15 cm),无污染史,检出限下无芘检出[5].该土壤理化属性在文献[6]中已有详细报道.土壤风干过2 mm筛后,加入芘的丙酮溶液;待丙酮挥发后,用未污染土壤不断稀释、搅拌,过2 mm筛、混匀,结合农田土壤PAHs背景值,制得5个污染水平.在田间持水量(water holding capacity,WHC)为50%、室温20 ℃状态下平衡7 d后,测得土样中芘的初始浓度分别为:C0(无芘污染)、C1(20.24±0.94 mg/kg)、C2(39.58±1.51 mg/kg)、C3(79.86±2.37 mg/kg)、C4(160.64±3.05 mg/kg)和C5(321.42±4.93 mg/kg).将处理后的土样(2 kg)装入20 cm×15 cm的塑料盆钵中,在45% WHC室内平衡7 d.
1.1.4 植 物.
以高羊茅为实验植物,其种子经10% H2O2溶液消毒10 min、蒸馏水冲洗干净、烧杯中浸泡吸胀24 h后,将高羊茅种子发芽并生长在潮湿珍珠岩中.待出苗7 d后,选择大小均匀的幼苗移植到指定的温室盆钵中.
1.2 实验方法
实验分为2组.
1)第1组.设计了4个处理、5次重复,具体为:处理1(CK1),未移栽高羊茅幼苗、且添加0.1% NaN3(抑菌剂,抑制微生物活性[7])的污染土壤;处理2(CK2),既未移栽高羊茅幼苗又未添加NaN3的污染土壤;处理3(TR3),既移栽高羊茅幼苗又添加0.1% NaN3的污染土壤;处理4(TR4),移栽高羊茅幼苗但未添加NaN3的污染土壤.同时,移植5 d后间苗,每盆保存8株.在20 ℃、50% WHC(称重补水法)、80%的相对湿度(RH)下恒温培养20 d,光照强度为3 000 lx.
2)第2组.除了添加4% Tween 80外,所有处理和培养条件与第1组实验相同.根据钵中土壤重量,将300 mL 4%(vol/vol)的Tween 80加入盆钵土壤中,45% WHC下平衡4 d后,移入温室备用.
此外,SEPR实验70 d后,分别对供试植物与土样破坏性取样,具体步骤为:分离幼苗茎叶与根系组织后,蒸馏水洗涤并用滤纸干燥、称重,检测植物组织中芘积累量;充分混匀根内土壤后,四分法取样并分析芘残留量.
1.3 分析方法
1.3.1 PAHs检测.
PAHs的检测参照文献[8]的相关方法,并略作改进:取2.0 g土样于离心管内,加入2.0 g无水硫酸钠,混匀;加入10 mL二氯甲烷,40 ℃下超声萃取1 h;4 000 r/min下离心.取3 mL上清液过Fisher Pasteur玻璃管硅胶柱,1∶1二氯甲烷和正己烷洗脱,40 ℃下浓缩至干,用甲醇定容到2 mL,过0.22 μm孔径滤膜后HPLC(Waters 600)分析.检测条件为:DAD检测器,Φ4.6×250 mm C18反相色谱柱,甲醇加水(83∶17)为流动相,检测波长λ为235 nm.在此条件下,芘的检测限为44.62 pg/L,土样与植物组织中芘的加标回收率分别为93.52%(n=10,RSD<6.37%)和93.23%(n=9,RSD<5.49%).
1.3.2 数据分析.
实验数据处理采用Microsoft Excel 2003,不同处理间的差异显著性借助SPSS 11.5软件的LSD法分析.其中,土壤中芘的去除率(D)计算公式为,
D=(C0-Ct)×100%/C0
式中,C0为土壤中芘的初始浓度,Ct为实验结束时土壤中芘的残留浓度.
在SEPR过程中,给定因子i对芘去除的贡献率(Ti)计算公式为,
Ti=Di×100%/W·C0
式中,Di是给定因子i在SEPR过程中对芘的去除量,W为钵中土壤质量,C0为芘的初始浓度.很显然,D值在理论上应等于所有因子i的贡献率Ti之和[7-8].
2 结果与讨论
2.1 植物生物量
实验期间,高羊茅的生物量及其根冠比的变化差异如图1所示.图1中,不同小写字母表示相同胁迫条件下差异显著,PT代表添加4% Tween 80,AT代表没有添加Tween 80.
图1显示,实验浓度(20.24~321.42 mg/kg)范围内,芘污染对高羊茅的生长并没有产生明显的抑制作用.在70 d的SEPR过程中,高羊茅的总生物量、根冠比与未污染的参比组(C0∶1.43 g、0.284)间没有明显差异(n=30,p>0.05).虽然重污染(C5)条件下高羊茅的生物量略有下降,但与其他污染水平(C0~C4)间差异不显著明显(n=30,p>0.05),此表明高羊茅对芘胁迫具有较强的适应性,适宜于作为修复芘污染的备选植物.在添加4% Tween 80(PT)后,高羊茅的地下、地上生物量分别比未污染的参比组(C0)高出27.23%和16.61%,但与相同污染水平下未添加Tween 80(AT)的土样间差异不显着(n=30,p>0.05).所有污染水平(C0~C5)土样中,植物的根冠比均明显大于未添加Tween 80(AT)的污染土样(n=30,p<0.05),此表明表面活性剂(Tween 80)的存在促进了高羊茅根系的生长.
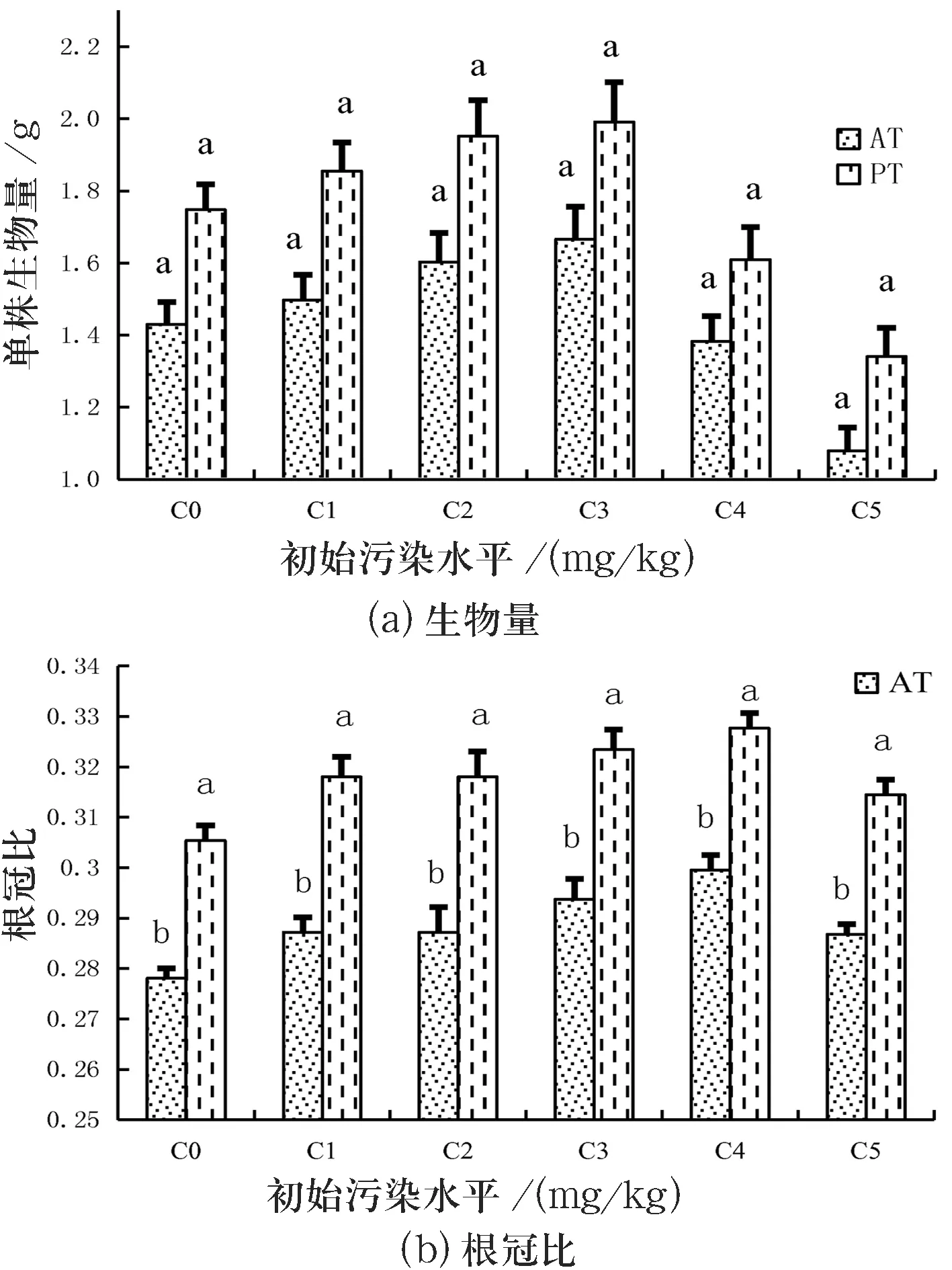
图1 Tween 80对芘污染土壤中高羊茅生物量、根冠比的影响
2.2 PAHs去除率
不同处理条件下,土壤中芘的去除率如图2所示.图2中,CK,PT和AT分别代表未种植植物的污染土样、添加及未添加Tween 80且种植高羊茅的污染土样.
图2显示,在4% Tween 80(PT)存在下,土壤中芘的去除率(D)总是高于相同污染水平下的其他处理(CK、AT),呈现PT>AT>CK趋势.SEPR实验期间,种植高羊茅的土壤(PT)中芘的去除率为75.73%(60.96%~86.39%),无植物土壤为18.43%(14.24%~25.79%);相同处理条件下未添加表面活性剂的土壤(AT)中芘的去除率为66.52%(53.99%~80.18%),而既未种植高羊茅又未添加表面活性剂的对照组(CK)中芘的去除率仅为14.32%(11.28%~20.23%),差异明显(n=30,p<0.05).此表明添加Tween 80能显著促进污染土壤中芘的去除,借助SEPR技术强化芘污染土壤的修复效果理论上可行.
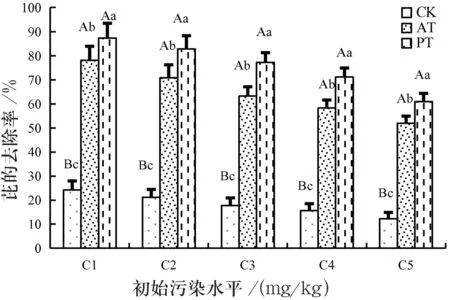
图2不同处理条件下土壤中芘的去除率
本研究在进一步分析不同污染水平下表面活性剂对高羊茅修复芘污染土壤的影响差异(见图3)时发现,实验浓度(20.24~321.42 mg/kg)范围内,中等污染水平(C3)的芘污染土壤中添加4% Tween 80对植物修复的强化效率(14.02%)最高,且远高于表面活性剂的平均强化去除率(11.42%);低(C1)或高(C5)污染水平的土壤中芘的强化去除率相对较低,分别为9.21%和8.96%.其原因可能与土壤颗粒对PAHs的吸附特性有关,即在低污染水平(C1~C2)下,土壤颗粒对PAHs的吸附主要借助表面吸附作用为主导的线性分配过程而吸附于土壤无机矿物质、无定形有机质(软碳)中,快速可逆,其吸附容量随污染水平的升高而递增[9];较高污染水平(C4~C5)下,用于表面吸附的吸附点位趋于饱和,部分PAHs借助孔隙填充作用为主导的非线性分配过程进入土壤凝聚态有机质(硬碳)中,其吸附行为表现为线性分配和非线性孔隙填充的共同作用[10],吸附容量增速渐缓;相对于污染水平的持续递增,PAHs去除率逐渐降低,进而呈现“先升后降"趋势.
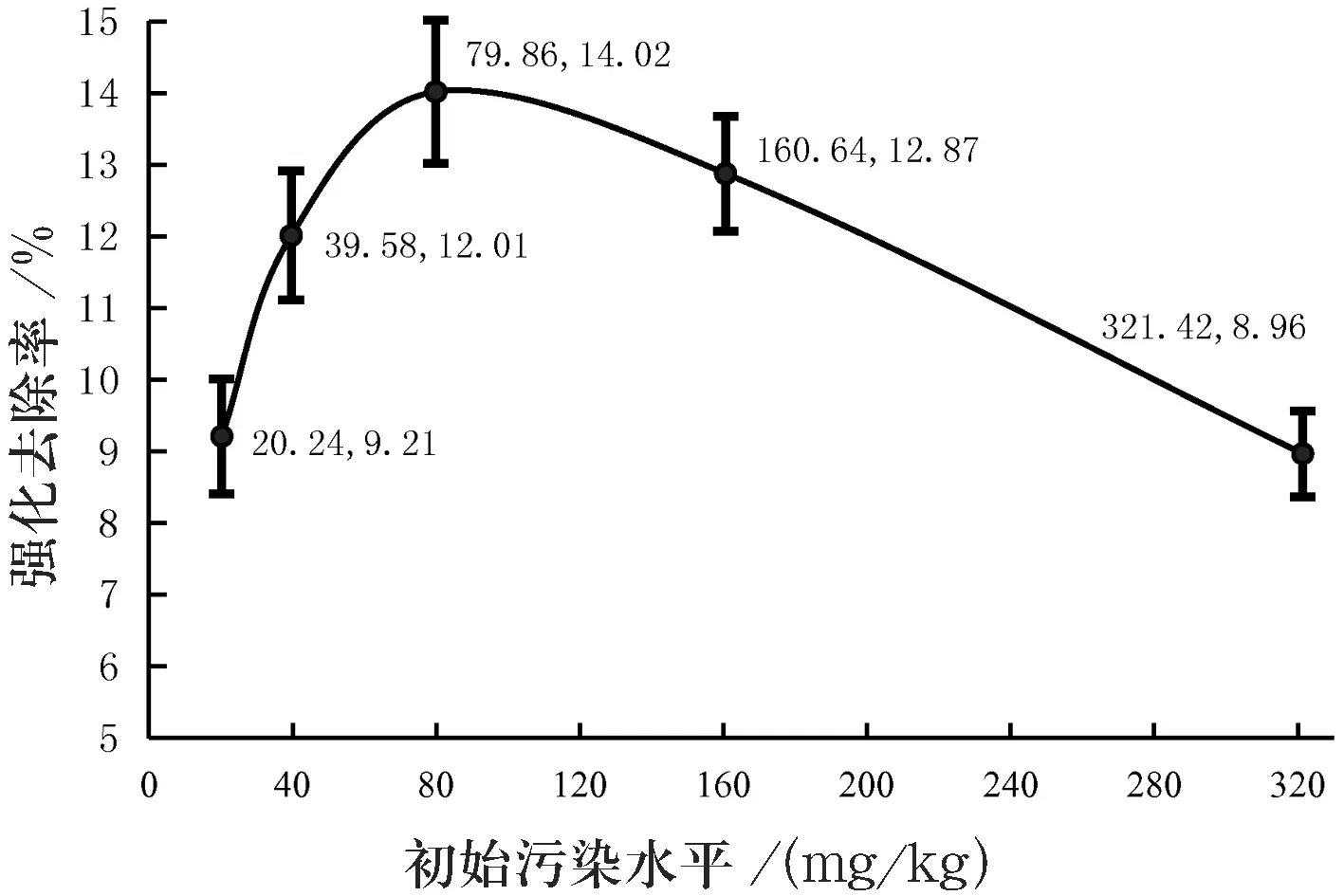
图3 Tween 80对不同污染水平下植物修复芘污染土壤的强化效果
2.3 植物组织对PAHs的富集作用
植物组织对PAHs的富集作用实验结果如图4所示.图4中,RCFs-PT、RCFs-AT分别代表添加或未添加Tween 80时芘在高羊茅根系的生物富集系数.
图4显示,实验期间,芘在植物组织中的积累浓度与所在土壤的芘污染水平呈正相关;相同污染水平下,添加4%Tween 80的污染土壤(PT)中植物组织所富集的芘含量总低于没有添加表面活性剂时(AT)的富集量.70 d SEPR实验中,随着芘污染水平的递增,污染土壤(AT)中高羊茅根系、茎叶中芘含量分别从14.17、2.08 mg/kg增加到72.26、13.79 mg/kg;添加4%Tween 80的土壤(PT)中,它们分别从9.69、1.32 mg/kg增加到58.59、10.36 mg/kg,递增趋势明显.
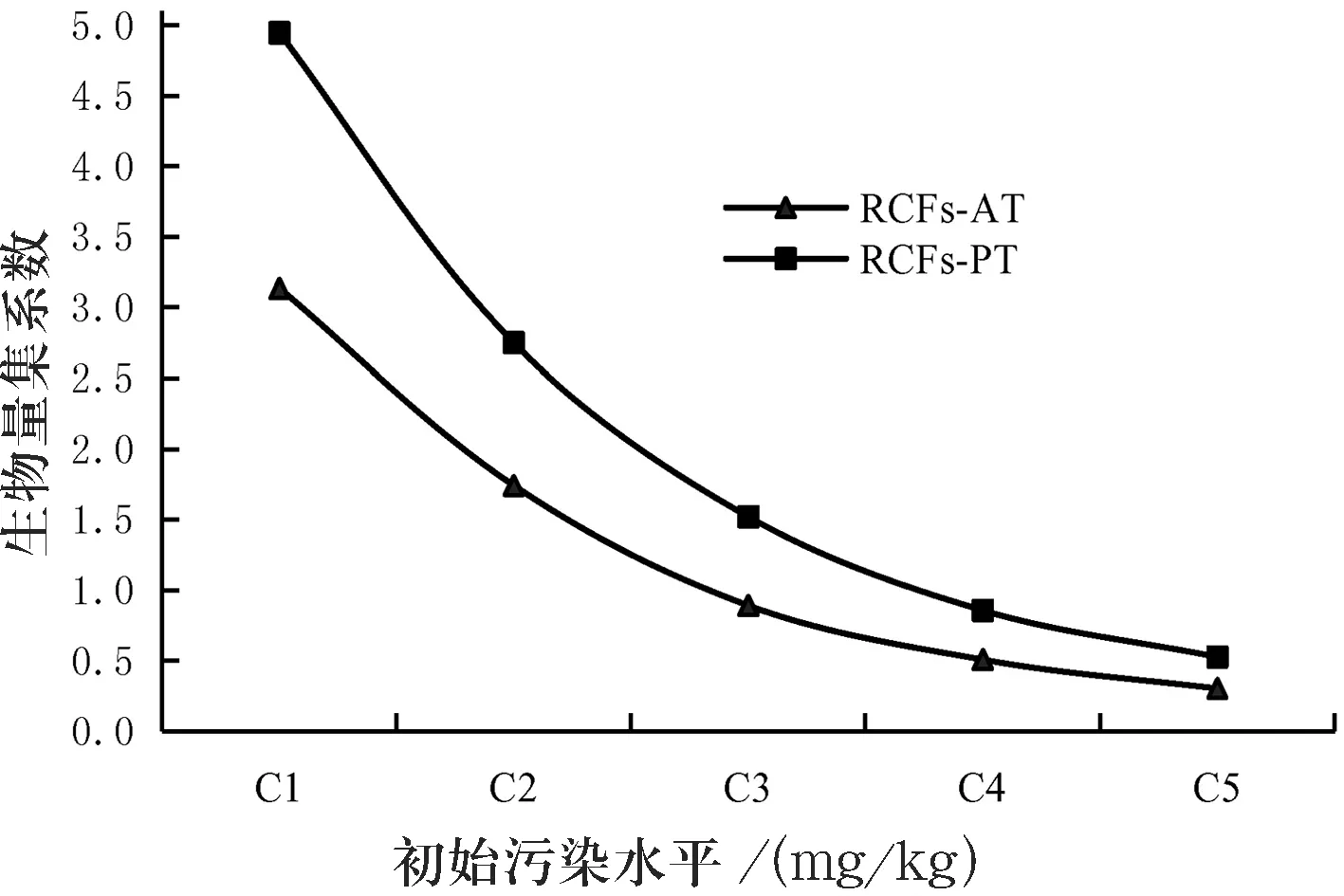
图4植物组织对芘的富集作用
基于芘在土壤中残留浓度、植物组织中积累浓度,可推算芘在植物组织中根系富集系数、茎叶浓缩系数(root or shoot concentration factors,RCFs or SCFs),即一定时间内根际土壤中的芘浓度与植物组织所富集的芘浓度之比[7].总体上看,随着初始污染水平递增,芘在植物组织中的积累浓度逐渐增大,而生物富集系数RCFs(SCFs)、却逐渐减小;相同污染水平下,添加4%Tween 80时植物组织对芘的富集量普遍低于未添加时,其生物富集系数RCFs(SCFs)却高于未添加Tween 80时(见图4).如T1~T5水平下,无Tween 80时RCFs(SCFs)为1.52(0.30~3.14)、0.41(0.19~1.39),有Tween 80时分别上升至2.32(0.53~4.95)、0.76(0.27~2.81).此表明,在植物—土壤系统中,表面活性剂的存在能改善PAHs等疏水性污染物的输导能力、减少在植物组织的积累,可在一定程度上降低PAHs等污染物在植物组织中的生物集聚风险.
2.4 PAHs污染物的去除途径
土壤中芘的去除主要源于各种非生物因素的共同作用,如渗滤、吸附、光解与挥发等,以及生物因素,如植物代谢、富集、微生物降解及植物—微生物交互作用等[8].如果用Ta、Td、Tc、Tm、Tpm代表非生物损失、植物代谢、富集、微生物降解、植物—微生物交互作用在芘去除过程中的贡献率,用D1、D2、D3、D4代表未添加Tween 80时CK1、CK2、TR3及TR4处理中芘的表观去除率,在不考虑因子间交互作用的情况下,土壤中芘的去除可以表示为,
D1=Ta
(1)
D2=Ta+Tm
(2)
D3=Ta+Tc+Td
(3)
D4=Ta+Tc+Td+Tm+Tpm
(4)
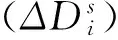
(5)
(6)
(7)
(8)
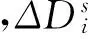
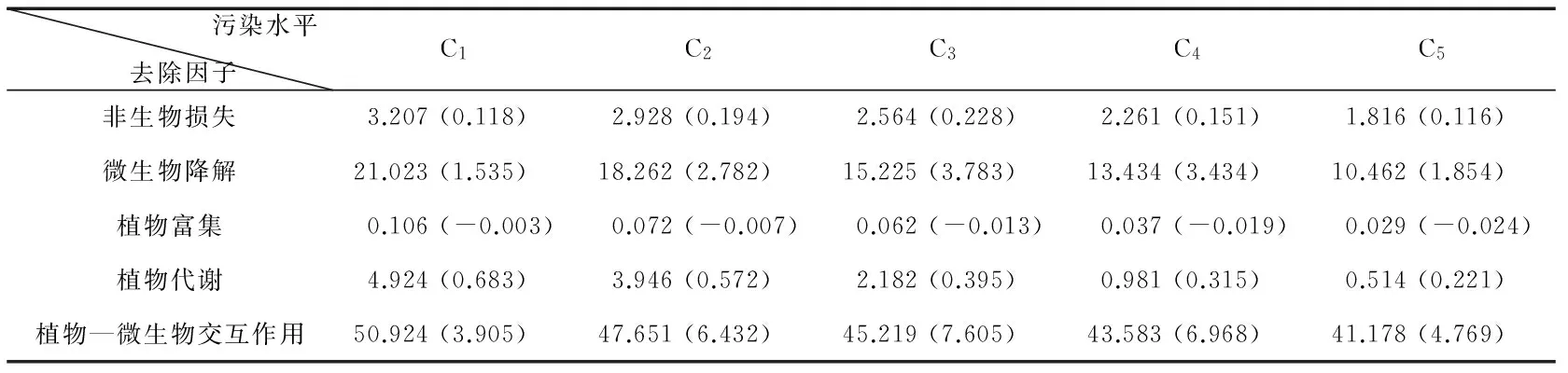
表1 各种生物、非生物因子在SEPR修复芘过程中的贡献率(单位:%)
注:括号中数据表示添加4% Tween 80后给定因子i在SEPR修复芘过程中贡献率的增加值.
表1数据显示,实验期间,盆钵渗滤液中没检测出芘,渗滤损失量甚微;CK1中芘的去除率为1.82%~3.21%(平均值M=2.56%),说明非生物性损失不是芘去除的主要途径.植物积累、植物代谢对芘去除的贡献率分别为0.03%~0.11‰(M=0.06%)、0.51%~4.92%(M=2.51%),二者也不是芘去除的主要途径.相比之下,微生物降解与植物—微生物交互作用对植物修复芘污染的贡献较大,其贡献率分别为10.46%~21.02%(M=15.88%)、45.67%(41.18%~50.92%),说明二者是植物修复芘污染的主要途径.
同时,70 d SEPR过程中,Tween 80对各种芘去除因子的强化作用也不一样.总体上看,Tween 80对植物—微生物交互作用与微生物降解的强化程度(5.94%、2.68%)明显超过非生物损失、植物代谢(0.16%、0.44%);植物积累对芘去除的贡献率较未添加Tween 80时降低了0.01%,这与相同污染水平下添加Tween 80后植物组织富集的芘浓度总低于未添加Tween 80时的富集浓度相一致.
3 讨 论
根际环境中,根系分泌物和根际微生物间的相互作用是一个复杂的生态过程,根系通过分泌各种次生性代谢物质和土壤微生物自身的趋化感应影响根际微生物的生长代谢及环境分布,对根际微生物的群落结构与功能产生选择塑造作用.同时,根际微生物群落结构变化又对根系分泌物释放、土壤物质循环、能量流动及信息传递产生影响,进而影响根际的环境属性与生态性能,呈现独特的根际效应,并在有机污染物的原位修复过程中发挥着决定性作用[11-12].本研究表明,实验浓度(20.24~321.42 mg/kg)范围内,高羊茅的存在显著的促进了根际土壤中芘的去除,70 d模拟修复实验中,植物—土壤系统中芘的去除率高达66.52%(53.99%~80.18%),而未种植高羊茅的对照组仅为14.32%(11.28%~20.23%).可见,植物的存在明显促进了土壤中芘的去除.
目前,表面活性剂增效修复技术(SEPR)是强化修复土壤和地下水有机污染的有效原位修复技术之一,现已有较多的实际应用案例.SEAR的修复机理主要基于:一是利用表面活性剂的增溶与增流作用,提高有机物的水相溶解度,同时降低界面张力,提高有机物的迁移能力;二是改善难降解有机物的生物可利用性[13].本研究在添加4%Tween 80后,植物—土壤系统中芘的去除率为75.73%(60.96%~86.39%),而未种植高羊茅的对照组为18.43%(14.24%~25.79%),分别比未添加表明活性剂时高出9.21%(7.73%~12.91%)、4.12%(3.45%~5.99%),说明使用表面活性剂能够有效地增强植物修复效率.
值得注意的是,添加Tween 80后,芘污染土壤中生长的高羊茅所积累的污染物总量总低于未添加表面活性剂时的积累量,70 d SEPR模拟修复实验中,在植物的茎叶、根系内所富集的芘的浓度总是略低相同污染浓度下未添加表面活性剂时的植物组织.此表明,添加表面活性剂能在一定程度上减少植物组织对有机污染物的积累,缓解了潜在的生态风险[14].
4 结 论
在实验浓度(20.24~321.42 mg/kg)范围内,表面活性剂能有效地强化植物修复芘污染.70 d SEPR实验中,加入4%Tween 80时,植物—土壤系统中芘的去除率为75.73%(60.96%~86.39%)、未种植高羊茅的对照组为18.43%(14.24%~25.79%),分别比未添加表明活性剂时高出9.21%(7.73%~12.91%)、4.12%(3.45%~5.99%),说明SEPR技术是一种强化污染地区有机污染物去除的可行方法.PAHs去除过程中,微生物降解、植物—微生物交互作用至关重要,其贡献率分别为10.46%~21.02%(M=15.88%)、45.67%(41.18%~50.92%),说明二者是表面活性剂强化植物修复芘污染的主要途径.
[1]Khan S,Afzal M,Iqbal S,et al.Plant-bacteriapartnershipsfortheremediationofhydrocarboncontaminatedsoils[J].Chemosphere,2013,90(4):1317-1332.
[2]Abhilash P C,Powell J R,Singh H B,et al.Plant-microbeinteractions:novelapplicationsforexploitationinmultipurposeremediationtechnologies[J].Trends Biotechnol,2012,30(8):416-420.
[3]Chen B L,Johnson E J,Chefetz B,et al.Sorptionofpolarandnonpolararomaticorganiccontaminantsbyplantcuticularmaterials:roleofpolarityandaccessibility[J].Environ Sci Technol,2005,39(16):6138-6146.
[4]Lee D H,Robert D C,Kim D J,et al.Effectofsoiltextureonsurfactant-basedremediationofhydrophobicorganic-contaminatedsoil[J].Environ Int,2002,27(8):681-688.
[5]潘声旺,袁馨,刘灿,等.苯并[α]芘对不同修复潜力羊茅属植物的根系分泌物中几种低分子量有机物的影响[J].植物生态学报,2016,40(6):604-614.
[6]潘声旺,刘灿,黄方玉.根系分泌物对土壤中有机氯农药降解的强化效应及其作用机制[J].成都大学学报(自然科学版),2016,35(2):196-200.
[7]Wei S Q,Pan S W.Phytoremediationforsoilscontaminatedbyphenanthreneandpyrenewithmultipleplantspecies[J].J Soils Sed,2012,10(5):886-894.
[8]Pan S W,He M P,Lei Z H,et al.InfluenceofinoculatingearthwormsonremovalofpyreneinsoilsgrowingFestucaarundinacea[J].Environ Toxicol Chem,2016,98(5-6):601-610.
[9]Huang W,Weber W J.Adistributedreactivitymodelforsorptionbysoilsandsediments.10:relationshipsbetweensorption,hysteresisandthechemicalcharacteristicsoforganicdomains[J].Environ Sci Technol,1997,31(9):2562-2569.
[10]Wang X,Sato T,Xing B.Sorptionanddisplacementofpyreneinsoilsandsediments[J].Environ Sci Technol,2005,39(22):8712-8718.
[11]Sumia K,Muhammad A,Samina I,et al.Plant-bacteriapartnershipsfortheremediationofhydrocarboncontaminatedsoils[J].Chemosphere,2013,90(4):1317-1332.
[12]Gao Y Z,Ling W T,Zhu L Z,et al.Surfactant-enhancedphytoremediationofsoilscontaminatedwithhydrophobicorganiccontaminants:potentialandassessment[J].Pedosphere,2013,17(4):409-418.
[13]白静,赵勇胜,陈子方,等.利用Tween 80溶液冲洗修复萘污染地下水模拟实验[J].吉林大学学报(地球科学版),2013,43(2):552-557.
[14]Tejeda-Agredano M C,Gallego S,Vila J,et al.InfluenceofthesunflowerrhizosphereonthebiodegradationofPAHsinsoil[J].Soil Biol Biochem,2013,57(3):2065-2076.
Abstract:In order to evaluate the reinforcement effects of surfactants on phytoremediation with persistent organic pollutants(POPs),the paper studies the efficacy of Tween 80 on the soil photoremediation with Festucaarundinacea and discusses the strengthening mechanisms of Tween 80 on the soil photoremediation.Results show that the presence of Tween 80 enhances the dissipation of pyrene at initial contents ranging from 20.24 to 321.42 mg/kg.During the 70 d SEPR-experiments,about 66.52%(53.99%~80.18%) of pyrene is removed from soil with Festucaarundinacea,and only 14.32%(11.28%~20.23%) degradation of pyrene occurs in soil without Festucaarundinacea.With the presence of 4% Tween 80,the dissipation ratios of pyrene in soil with Festucaarundinacea,increase up to 75.73%(60.96%~86.39%) while the dissipation ratios of pyrene in soil without Festucaarundinacea are as low as 18.43%(14.24%~25.79%).Among all possible methods,plant-microbial interactions plays the most important role in the dissipation of pyrene,either with the presence(45.67%) or the absence(51.56%) of Tween 80,which are all the primary means for removing contaminants pyrene.It’s clear to see that the existence of surfactant Tween 80 reinforces the remediation effects of Festucaarundinaceaon soil polluted by pyrene and SEPR technology could serve as the most effective way to improve the remediation effects of Phytoremediation with persistent organic pollutants(POPs).
Keywords:phytoremediation;surfactants;SEPR;pyrene;Tween 80;soil
InfluenceofTween80onPyrenePollutioninSoilPhytoremediation
PANShengwang1,HEMaoping1,CHENKeming1,2,LIUQin1,3
(1.School of Architecture and Civil Engineering, Chengdu University, Chengdu 610106,China;2.School of Chemistry&Chemical Engineering, Southwest Petroleum University, Chengdu 610500, China;3.School of Architecture and Civil Engineering, Sichuan Agricultural University, Chengdu 611830, China)
X131.3;X53
A
1004-5422(2017)03-0319-06
2017-06-28.
四川省教育厅自然科学基金(17ZA0091)、 成都市科技惠民计划(2015-HM01-00368-SF)资助项目.
潘声旺(1973 — ), 男, 博士, 副教授, 从事环境生态与生态修复技术研究.
