分子荧光差异加标法快速测定蛋黄中VB2的含量
2017-10-11高向阳郭楠楠岳希举
高向阳,张 娜,郭楠楠,岳希举,魏 龙
分子荧光差异加标法快速测定蛋黄中VB2的含量
高向阳,张 娜,郭楠楠,岳希举,魏 龙
(郑州科技学院食品科学与工程系,河南 郑州 450064)
为建立一种快速、简便定量测定生物样品中VB2的新型分析方法,以鸡蛋黄为样品,用分子荧光差异加标法测定。结果表明:鸡蛋黄样品中VB2的含量为402 μg/100 g,相对标准偏差不大于1.5%(n=6);加标回收率为92.0%~104%;检出限为5.76×10-3μg/mL,定量限为1.92×10-2μg/mL。该法在实验条件完全相同的情况下测定,扣除了背景干扰,不需绘制工作曲线和过柱去杂质,快速、准确、简便、实用,是适合VB2测定的新型分析技术。
分子荧光;差异加标法;鸡蛋黄;VB2
鸡蛋黄含有丰富的ω-3不饱和脂肪酸、蛋白质、钙、磷、铁等矿物质[1-2]和VB2,ω-3不饱和脂肪酸可减少脑血栓的形成,有提高人体自身免疫的作用[3-4]。VB2又称核黄素,紫外线照射下可光解为光黄素[5-6],是动物和人体维持正常机体功能的营养物质,因不会在人体蓄积,需及时通过蛋黄、牛奶、黄豆、酵母等膳食进行补充。人体缺乏核黄素时,代谢容易发生障碍[7],所以,蛋黄是人类良好的主要辅助食品。
目前,VB2的测定方法有核磁共振法[8-9]、高效液相色谱法[10-14]、化学发光法[15-18]、电化学法[19-20]、离子色谱法[21]、质谱法[22-24]、超临界流体色谱[25]、共振光散射法[26]、分光光度法[27]等。这些方法大多数仪器昂贵、成本较高,需要配制5~7 个标准系列溶液用标准曲线法进行定量,耗费时间且存在作图误差;由于标准溶液与样品试液本底背景常存在较大差异,若试液本底对测定信号产生无法排除的干扰,测定准确度会降低;标准曲线绘制时的温度、湿度、大气压、仪器等测定条件与样品试液测定时常有极大不同,当用之前绘制的标准曲线测定当前的样品结果时,试液与标准溶液无法实现同步同条件实时测定,不可避免会引入一定误差。因此,标准曲线常需要重新绘制或者校正,过程繁琐,给工作带来不便;如果不能及时扣除不同样品的不同本底,所有样品使用同一个标准工作曲线,样品间的测定结果缺乏可比性。
分子荧光法灵敏度高,是一种痕量分析技术,但用于测定生物样品中VB2时,有基体共存蛋白质等背景的干扰[28-30],因此,减少荧光污染、扣除环境因素和试液背景的干扰对准确、快速测定VB2具有重要意义。分子荧光差异加标法测定VB2鲜见文献报道,鸡蛋黄基体成分复杂,定量分析时,无论是采用传统的标准曲线法还是比较法,均易受到共存蛋白质的干扰和各种荧光污染的影响,带来一定的测定误差。分子荧光差异加标法是在完全相同的试液背景条件下加入不同量的标准溶液后测定被测物质,能有效的扣除背景,消除基体荧光和可能光解等副反应的干扰。该法操作简便,快速准确,成本较低,且无需绘制工作曲线和过柱除杂,工作效率得到极大提高,适用于基体较为复杂的蛋黄等生物样品中VB2含量的测定,具有一定的推广应用价值。
1 材料与方法
1.1 材料与试剂
鲜鸡蛋,2016年11月购于郑州市好又多超市,及时处理 和测定。
VB2标准品(CAS编号83-88-5,纯度≥99%) 上海金穗生物科技有限公司;木瓜蛋白酶(食品级) 南宁庞博生物工程有限公司;低亚硫酸钠(分析纯) 天津市致远化学试剂有限公司。
1.2 仪器与设备
YXQ-SG 41-280A高压蒸汽灭菌锅 开封大河机电厂;970CRT荧光分光光度计、PXSJ-216离子计 上海仪电科学仪器股份有限公司;SYZ-135型石英亚沸高纯水蒸馏器 金坛市杰瑞尔电器有限公司;BS-224S型电子天平 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 溶液配制
10 g/L木瓜蛋白酶用2.5 mol/L乙酸钠溶液配制,现用现配;20 g/100 mL低亚硫酸钠溶液现用现配,保存于冰水浴中,4 h内有效。25 μg/mL VB2标准储备液配制:准确称取于真空干燥器中干燥24 h的VB2标准品50.0 mg,置于2 L容量瓶中,加入2.4 mL冰乙酸和1.5 mL水,溶解后定容,移至棕色试剂瓶中,加少许甲苯于表面,4 ℃冰箱中保存。1 μg/mL VB2标准使用液配制:吸取25 μg/mL VB2标准储备液2.00 mL,置于50 mL棕色容量瓶中,用水稀释至刻度,避光保存于4 ℃冰箱。所用水为二次石英亚沸重蒸高纯水。
1.3.2 样品预处理
随机取鲜鸡蛋50 枚,用水清洗后,置于锅中加热煮沸10 min,冷却后剥除蛋壳和蛋白,将蛋黄置于洁净磁盘中用玻璃棒捣碎后,于60 ℃烘箱中烘干至恒质量。用瓷研钵研碎后充分混匀,此为熟鸡蛋黄样品,保存于磨口瓶中,置于4 ℃冰箱中保存、备用。
1.3.3 VB2含量测定
称取20 g(精确至0.000 1 g)熟鸡蛋黄于250 mL锥形瓶中,加0.1 mol/L盐酸70 mL,混匀,用瓷坩埚扣盖瓶口,于10.3×104Pa压力锅水解30 min,冷却后用1 moL/L氢氧化钠溶液调pH值至 5.5,加3 mL 10 g/L木瓜蛋白酶溶液,39 ℃保温酶解16 h,干滤纸过滤除杂后用pH 5.5的二次亚沸水定容至100 mL。取4 份10.00 mL过滤液分置于25 mL刻度比色管中,于第1份和第2份提取液中分别加1 μg/mL VB2标准溶液1.00 mL和2.00 mL;第4份加入低亚硫酸钠0.50 mL,将VB2还原为无荧光物质作为背景空白,第3份不加标准溶液和低亚硫酸钠,为原过滤定容试液。各管加水至15 mL后,加0.50 mL冰乙酸,加30 g/L高锰酸钾溶液0.50 mL,混匀,放置2 min,氧化去杂质,滴加3.0 g/100 mL的双氧水溶液至褪色,振摇使多余氧气逸出后,加水定容至25 mL,在完全相同条件下进行3 次平行测定,检验无可疑值后取平均值,按式(1)计算样品中VB2的含量。
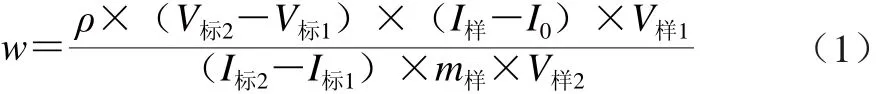
式中:w为样品中VB2含量/(μg/g);ρ为标准溶液质量浓度/(μg/mL);V标1、V标2分别为第1份、第2份过滤液中加入的标准溶液的体积/mL;I标1、I标2分别为第1份、第2份加标过滤液的相对荧光强度;I样、I0分别为第3份、第4份过滤液的相对荧光强度;m样为取样质量/g;V样1、V样2分别为样品过滤液定容总体积和测定时所用体积/mL。
2 结果与分析
2.1 波长的选择
根据文献[28]选择最大激发波长和最大发射波长分别为440 nm和525 nm。
2.2 盐酸体积的确定
称取20.0 g(精确至0.000 1 g)鸡蛋黄5 份分置于250 mL锥形瓶中,分别加入0.1 mol/L盐酸50、60、70、80、90 mL,搅拌均匀后,按1.3.3节方法水解、酶解、过滤、氧化去杂质,定容至25 mL,平行测定3 次,取平均值,结果见图1。
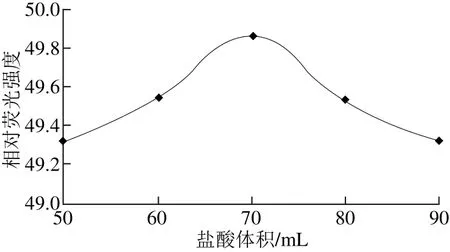
图1 盐酸体积对鸡蛋黄样品相对荧光强度的影响Fig. 1 Effect of hydrochloric acid volume on relative fl uorescence intensity
由图1可知,加入0.1 mol/L盐酸70 mL进行水解,鸡蛋黄样品相对荧光强度达到最大,为49.87。
2.3 酶解pH值的选择
称取20.0 g(精确至0.000 1 g)鸡蛋黄于250 mL锥形瓶中,加入0.1 mol/L盐酸70 mL,按照1.3.3节方法进行水解,水解液冷却后,滴加1 moL/L氢氧化钠溶液,分别调pH值为4.500、5.500、6.500、7.500、8.500。然后按照1.3.3节方法进行酶解和测定,平行测定3 次,取平均值,结果见图2。
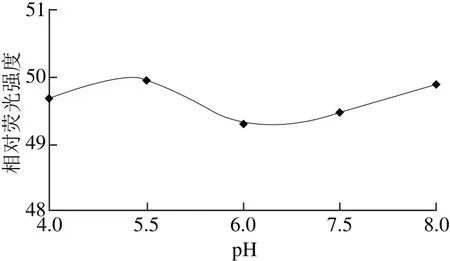
图2 pH值对鸡蛋黄样品相对荧光强度的影响Fig. 2 Effect of pH on relative fl uorescence intensity
由图2可知,酶解液pH 5.500时,测得的相对荧光强度最大,为49.97。实验选择pH 5.500为最佳酶解条件控制酸度。
2.4 低亚硫酸钠溶液加入的体积
称取20.0 g(精确至0.000 1 g)鸡蛋黄于250 mL锥形瓶中,按1.3节操作定容至100 mL后,分别置于6 个25 mL的比色管中加10.00 mL鸡蛋黄过滤液,按1.3.3节方法氧化去除杂质,分别加入0.10、0.20、0.30、0.40、0.50 mL和0.60 mL 20 g/100 mL低亚硫酸钠溶液,定容至25 mL,混匀后,平行测定3 次,取平均值,测定结果如图3所示。

图3 低亚硫酸钠体积对鸡蛋黄样品相对荧光强度的影响Fig. 3 Effect of Na2S2O4 volume on relative fl uorescence intensity
由图3可知,10.00 mL鸡蛋黄过滤液加入0.50 mL低亚硫酸钠较为合适。
2.5 VB2标准溶液体积的确定
称取20.0 g(精确至0.000 1 g)鸡蛋黄于250 mL锥形瓶中,按1.3.3节水解、酶解、过滤、定容后,分别置于8个25 mL试管中各加10.00 mL过滤液,在3、4、5、6、7、8号管中分别加入1.00、2.00、3.00、4.00、5.00 mL和6.00 mL 1 μg/mL VB2标准使用液,1号和2号管不加标准溶液,以下按照1.3.3节方法操作,定容至25 mL混匀,各管平行测定3 次,取平均值,代入公式计算鸡蛋黄VB2含量然后和GB/T 5009.85—2016《食品中核黄素的测定》[28]测定结果对照,如表1所示。
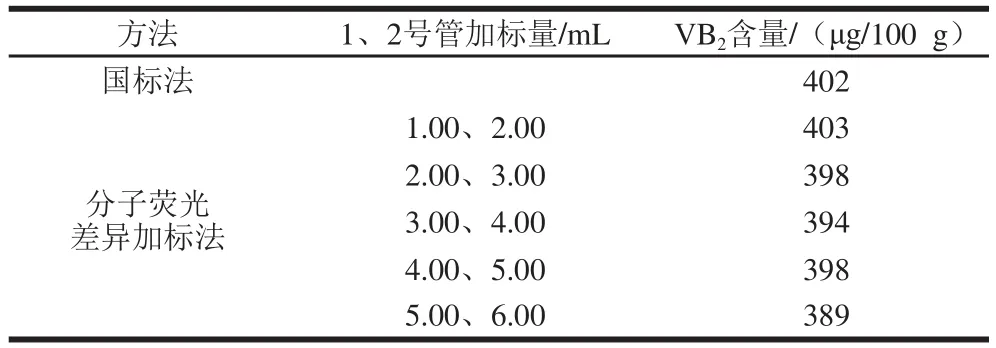
表1 鸡蛋黄中VB2含量Table 1 Selection of optimal standard solution volumes added to analyte samples
由表1可知,加标1.00、2.00 mL测得含量和国标法结果最接近,因此,本实验选择1 μg/mL VB2标准使用液添加量1.00、2.00 mL为最佳差异加标体积。
2.6 加标回收率
称取20.0 g(精确至0.000 1 g)鸡蛋黄,按照1.3.3节方法操作,用1 μg/mL VB2进行加标回收率实验,各加标质量浓度分别进行3 次平行测定,由表2可知,样品的加标回收率为92.0%~104%。

表2 加标回收率Table 2 Analyte recoveries from spiked yolk
2.7 检出限和定量限
取0.1 μg/mL VB2标准溶液进行11 次平行测定,计算出标准偏差,按3 倍标准偏差得VB2检出限为5.76×10-3μg/mL,按10 倍标准偏差计算的定量限为1.92×10-2μg/mL。
2.8 测定结果对照
按1.3.3节方法和国标法[28]第一法对照分析,各进行6 次平行测定,检验无可疑值后,取平均值,结果如表3所示。
由表3可知,平行测定的相对标准偏差不大于1.5%;2 种方法按文献[31]进行F检验和t检验,结果表明:置信度为95%时,分子荧光差异加标法和国标法的精密度、平均值皆不存在显著性差异。

表3 分子荧光加标法和国标法测定鸡蛋黄中VB2结果Table 3 Comparison of VB2contents in yolk determined by the developed method and the fi rst method described in the national standard
3 结 论
利用差异加标新技术在最佳条件下测定鸡蛋黄样品中VB2含量为402 μg/100 g,相对标准偏差为1.0%(n=6),加标回收率为92.0%~104%,检出限为5.76×10-3μg/mL,定量限为1.92×10-2μg/mL。该法与国标法对照测定,样品测定结果经过F检验和t检验表明:2 种方法间的精密度和平均值均不存在显著性差异。该方法只需用2个加标质量浓度不同的试液,在条件完全相同下测定同体积试液的发光信号,即可按公式快速获得测定结果,无需绘制工作曲线和过柱去杂质。差异加标法扣除了样品试液中背景发光值以及质量浓度差异所可能带来的干扰,克服了标准曲线法的诸多缺点,实现了待测试液与标准溶液的同步实时测定,提高了测定准确度和工作效率,简便、快速,是适合蛋黄等较为复杂生物样品中VB2测定的新型分析技术,该技术不但适用于分子荧光分析,也适用于分子磷光、化学发光、生物发光和原子荧光、原子发射光谱等其他定量分析发光体系,有较强的创新性、实用性和推广应用价值。
[1] 张晓维. 卵黄高磷蛋白的分离纯化、结构表征及功能特性研究[D].武汉∶ 华中农业大学, 2014∶ 3-14; 71.
[2] 李艳, 杨涛, 汪龙. 蛋黄不饱和脂肪酸的生理功能的研究进展[J]. 食品工业科技, 2014, 35(16)∶ 367-370; 376. DOI∶10.13386/j.issn.1002-0306.2014.16.072.
[3] 黄燕, 何劲, 雷邦星. 不同烹饪方法对乌鸡蛋黄营养成分损失的影响[J]. 保鲜与加工, 2016, 16(5)∶ 64-66; 73. DOI∶10.3969/j.issn.1009-6221.2016.05.014.
[4] SIEGEL G, ERMILOV E. Qmega-3 fatty acids∶benefits for cardiocerebro-vascular diseases[J]. Atherosclerosis, 2012, 225(2)∶ 291-295.
[5] 宋吉英. 荧光分光光度法测定枸杞中核黄素含量[J]. 化学世界,2012, 53(12)∶ 720-722.
[6] 王妙云, 叶蔚云, 蒋翠萍. 光黄素荧光法测定食物中的核黄素[J].中国卫生检验杂志, 2005, 15(3)∶ 333-338.
[7] 马琦, 李坤, 张素芳. 核黄素在电化学还原石墨烯/Nafion修饰电极上的电化学行为及分析检测[J]. 分析科学学报, 2016, 32(5)∶ 705-708. DOI∶10.13526/j.issn.1006-6144.2016.05.023.
[8] 胡敏芳, 江明, 邱慧, 等. 维生素B2的NMR含量测定[J]. 分析测试学报, 2013, 32(12)∶ 1511-1514. DOI∶10.3969/j.issn.1004-4957.2013.12.020.
[9] 郭强胜, 刘明珂, 禹珊. 定量核磁共振法同时测定复合维生素B1、B2、烟酰胺和泛酸钙[J]. 波谱学杂志, 2016, 33(3)∶ 442-450.DOI∶10.11938/cjmr.2016309.
[10] 夏冰, 蔡大川, 郑家概, 等. 高效液相色谱法测定保健食品中维生素B2的含量[J]. 山东化工, 2016, 45(13)∶ 79-81. DOI∶10.19319/j.cnki.issn.1008-021x.2016.13.026.
[11] MATTIVI F, MONETTI A, VRHOVSEK U, et al. Highperformance liquid chromatographic determination of the ribofl avin concentration in white wines for predicting their resistance to light[J]. Journal of Chromatography A, 2000, 888∶ 121-127.
[12] 黎超, 马跃龙, 党敏娜. 高效液相色谱法同时测定鸡精中四种黄色色素[J]. 中国调味品, 2016, 41(4)∶ 126-129. DOI∶10.3969/j.issn.1000-9973.2016.04.028.
[13] MÁRQUEZ-SILLERO I, CÁRDENAS S, VALCARCEL M.Determination of water-soluble vitamins in infant milk and dietry supplement using a liquid chromatography on-line coupled to a cornacharged aerosol detector[J]. Journal of Chromatography A, 2013,1313∶ 253-258. DOI∶10.1016/j.chroma.2013.05.015.
[14] 高超, 王雪, 杨栋磊, 等. 反相高效液相色谱-激光诱导荧光法检测饮料中的维生素B2[J]. 化学试剂, 2014, 36(8)∶ 725-728. DOI∶10.13822/j.cnki.2014.08.013.
[15] QI H L, CAO Z Z, HOU L N. Electrogenerated chemiluminesence method for the determination of ribofl avin at ionic liquid modifi ed gold electrode[J]. Spectrochim Acta Part A Molecular and Biomolecular Spectroscopy, 2011, 78(11)∶ 211-215.
[16] 李起云, 李红. Luminol-Cu(Ⅱ)体系流动注射化学发光法测定维生素B2[J]. 光谱实验室, 2011, 28(4)∶ 1986-1988.
[17] 林珍, 朱连杰, 王菲菲, 等. 亚硫酸氢钠-过氧化氢超微弱化学发光体系用于核黄素检测[J]. 分析测试学报, 2015, 34(5)∶ 595-599.DOI∶10.3969/j.issn.1004-4957.2015.05.016.
[18] LI H, DU J X. Sensitive chemiluminescence determination of three thiol compounds based on Cu (Ⅱ)-catalyzing luminol reaction in the absence of an oxidant[J]. Analytical Letters, 2009, 42(13)∶ 2131-2140 .
[19] 沈峥, 习霞, 明亮. 线性扫描伏安法测定维生素B2[J]. 中国教育技术装备, 2010(30)∶ 89-92. DOI∶10.3969/j.issn.1671-489X.2010.30.089.
[20] 赵常志, 张茹惠, 李明艳. 核黄素的光电化学性质及其应用[J]. 辽宁师范大学学报(自然科学版), 2015, 38(2)∶ 208-213. DOI∶10.11679/lsxblk2015020208.
[21] 曹盛林, 陈郁, QAMAR Subhani, 等. 离子色谱柱后光化学衍生荧光检测法 测定保健品中的核黄素[J]. 浙江大学学报(理学版), 2013,40(3)∶ 304-307; 343. DOI∶10.3785/j.issn.1008-9497.2013.03.013.
[22] 莫彩娜, 杨曦, 黄智成. 高效液相色谱-串联质谱法同时测定配合饲料中维生素B1和维生素B2[J]. 理化检验: 化学分册, 2015, 51(9)∶1316-1319. DOI∶10.11973/.Ihjy-hx201509026.
[23] LEPORATI A, CATELLANI D, SUMANM, et al. Application of a liquid charommatography tandem mass spectrometry method to the analysis of water-soluble vitamins in Italian pasta[J]. Analytical Chimica Acta, 2005, 531(1)∶ 87-95.
[24] PHILLIPS M M. Liquid chromatography with isotope dilution mass spetrometry for determination of water-soluble vitamins in food[J].Analytical and Bioanalytical Chemistry, 2015, 407∶ 2965-2974.DOI∶10.1007/s00216-014-8354-y.
[25] 竹弘, 量初燕, 陈新雷. 超临界流体色谱同时测定药片中的核黄素[J].广东化工, 2013, 40(12)∶ 187-188.
[26] 李松青, 徐英杰, 马欢欢. 共振光散射法测定药片中的核黄素[J].湘潭大学自然科学学报, 2011, 33(3)∶ 86-88. DOI∶10.13715/j.cnki.nsjxu.2011.03.008.
[27] ABERASTURI F J, JIMENEZ A I, ARIAS J J, et al. Simultaneous spectrophotometric determination of folic acid, pyridoxine, ribofl avin and thiamine by partial least-squares regression[J]. Analytical Letters,2002, 35(10)∶ 1677-1691.
[28] 卫生部, 国家标准化管理委员会. 食品中核黄素的测定∶ GB/T 5009.85—2016[S]. 北京∶ 中国标准出版社, 2016∶ 4-7.
[29] ZANDOMENEGHI M, CARBONARO L, ZANDOMENEGHI G.Biochemical fl uorometric method for the determination of ribofl avin in milk[J]. Agricultural Food Chemistry, 2007, 55∶ 5990-5994.
[30] GARCÍ A L, BLÁZQUEZ S, ANDRÉS M P S, et al. Determination of thiamine, ribofl avin and pyridoxine in pharmaceuticals by synchronous fl uorescence spectrometry in organized media[J]. Analytica Chimica Acta, 2001, 434(2)∶ 193-199.
[31] 高向阳. 现代食品分析化学[M]. 北京∶ 科学出版社, 2012∶ 32-34.
Rapid Determination of Vitamin B2in Egg Yolks by Molecular Fluorescence Differential Standard Addition Method
GAO Xiangyang, ZHANG Na, GUO Nannan, YUE Xiju, WEI Long
(Department of Food Science and Engineering, Zhengzhou University of Science and Technology, Zhengzhou 450064, China)
This study aimed to establish a new rapid and simple method for the quantitative determination of riboflavin in biological samples, namely molecular fl uorescence differential standard addition method. The results showed that the ribofl avin content in yolks determined by the method was 402 μg/100 g with relative standard deviation (RSD) of less than or equal to 1.5% (n = 6). The recoveries of the analyte from spiked samples ranged between 92.0% and 104%. The limit of detection (LOD) of the method was 5.76 × 10-3μg/mL and the limit of quantitation (LOQ) was 1.92 × 10-2μg/mL. This method was tested under the same conditions without background interference and without the need to prepare a working curve and to remove impurities by column chromatography. It was rapid, accurate, simple, practical and suitable for the determination of vitamin B2in egg yolks.
molecular fl uorescence; differential standard addition method; egg yolks; vitamin B2
O657.3
A
1002-6630(2017)20-0318-04
高向阳, 张娜, 郭楠楠, 等. 分子荧光差异加标法快速测定蛋黄中VB2的含量[J]. 食品科学, 2017, 38(20)∶ 318-321.DOI∶10.7506/spkx1002-6630-201720047. http∶//www.spkx.net.cn
GAO Xiangyang, ZHANG Na, GUO Nannan, et al. Rapid determination of vitamin B2in egg yolks by molecular fluorescence differential standard addition method[J]. Food Science, 2017, 38(20)∶ 318-321. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720047. http∶//www.spkx.net.cn
2017-01-13
郑州市科技局新兴产业研究与开发基金资助项目(153PXXCY186)
高向阳(1949—),男,教授,学士,研究方向为食品安全快速分析与检验。E-mail:ndgaoxy@163.com
DOI∶10.7506/spkx1002-6630-201720047
