慢性乙型肝炎患者NK细胞功能与干扰素疗效相关性研究
2017-09-28屈晓晶路遥曹卫华张英冉崇平齐天林胡蕾苹郝红晓张璐李明慧谢尧
屈晓晶 路遥 曹卫华 张英 冉崇平 齐天林 胡蕾苹 郝红晓 张璐 李明慧 谢尧
100015 北京,首都医科大学附属北京地坛医院肝病中心肝病二科
·病毒病诊断与治疗·
慢性乙型肝炎患者NK细胞功能与干扰素疗效相关性研究
屈晓晶 路遥 曹卫华 张英 冉崇平 齐天林 胡蕾苹 郝红晓 张璐 李明慧 谢尧
100015 北京,首都医科大学附属北京地坛医院肝病中心肝病二科
目的探讨慢性乙型肝炎(Chronic hepatitis B, CHB)患者外周血NK细胞频数及功能分子与干扰素α(Interferon-alpha, IFNα)疗效的相关性。方法采集乙型肝炎病毒(Hepatitis B virus, HBV)慢性感染免疫清除(Immune clearance, IC)期经聚乙二醇干扰素α-2a(Peg-IFNα-2a)治疗患者在基线及治疗12和24周静脉全血,采用流式细胞仪检测外周血CD3-CD56+NK细胞、CD56brightNK细胞和CD56dimNK细胞频数及NK细胞表面受体IFNAR2和NKp46的表达。血浆HBV DNA、HBsAg、HBeAg含量及肝功能由北京地坛医院检验科提供。结果本实验共入组41例IC期经Peg-IFNα-2a治疗患者,包括21例应答不佳 (Poor response, PG)患者和20例应答(Good response, GR)患者,结果显示:与基线比较,GR组CD3-CD56+NK细胞频数在治疗24周升高(11.74, 5.69%~18.15% vs 13.7, 9.36%~20.18%,P>0.05),在PR组同样升高(8.94, 6.26%~14.15% vs 12.5, 7.64%~16.55%,P>0.05)。GR组CD56brightNK细胞频数在治疗24周显著升高(9.49, 6.2%~12.48% vs 12.98, 7.75%~20.93%,P>0.05),在PR组也同样显著升高(11.45, 8.27%~19.13% vs 17.52, 12.3%~22.42%,P=0.0239)。GR组NK细胞NKp46表达水平在治疗24周显著升高(90.55, 83.8~94.78 vs 93.8, 92.28~96.4,P=0.0263),而PR组却未升高(95, 90.6~96.15 vs 94.3, 92.1~95.6,P>0.05)。GR组NK细胞NKp46high表达水平在治疗24周显著升高(12.4, 8.58~19.08 vs 39.3, 23.15-49.3,P=0.0011),其升高幅度显著高于PR组(14.2, 9.78~17.65 vs 27.58, 19.13~36.56,P=0.006)。结论慢性乙型肝炎患者经 Peg-IFN-α-2a治疗后外周血CD3-CD56+NK细胞和CD56brightNK细胞频数升高,对Peg-IFN-α-2a治疗应答患者NK细胞上NKp46表达上调,而且Peg-IFN-α-2a治疗使NKp46high表达显著上调,尤其在应答患者。
Fundprogram: Bejing Municipal Administration of Hospitals Clinical and Technical Innovation Project (XMLX201706)
乙型肝炎病毒(Hepatitis B virus, HBV)感染是引发慢性肝炎、肝硬化及肝癌的重要原因之一[1-2]。在急性HBV感染中,适应性免疫的病毒特异性CD8+T细胞在清除病毒过程中起非常重要作用,但在慢性HBV感染,病毒特异性CD8+T细胞反应微弱并呈现功能性耗竭,这可能是HBV长期存在的原因[3]。固有免疫重要组成的NK细胞对病毒特异性CD8+T细胞的耗竭起重要作用[4]。对NK细胞的研究有助于了解HBV与人体免疫的相关作用。
急性HBV感染研究显示CD3-CD56+NK细胞早期被快速激活并发挥抗病毒作用,而且能及时触发适应性免疫反应[5]。然而在慢性HBV感染NK细胞似乎受到抑制,研究发现慢性HBV感染患者NK细胞上抑制性受体NKG2A表达上调,而且调节性CD4+CD25+T细胞分泌的抑制性细胞因子IL-10增加[6],虽然外周血NK细胞的数量不变,细胞毒活性保持,但其分泌细胞因子如干扰素γ(Interferon-gamma, IFNγ)和肿瘤坏死因子α(Tumor necrosis factor-alpha,TNFα)等的能力受损[7]。干扰素α(Interferon-alpha, IFNα)不仅具有直接抗病毒、调节免疫作用,而且还有抗肿瘤等作用,目前被广泛应于慢性乙型肝炎患者的治疗[8]。研究显示,在CHB患者治疗过程中IFNα对NK细胞及树突状细胞(Dendritic cell,DCs)等多种免疫细胞有调节作用[9]。因此,研究慢性乙型肝炎(Chronic hepatitis B, CHB)患者经IFNα治疗过程中NK细胞与IFNα的相互作用有助于了解IFNα的具体作用机制,而且有助于免疫治疗新策略的研发。
1 材料与方法
1.1研究对象本实验入选了2014年9月至2016年1月到首都医科大学附属北京市地坛医院就诊的慢性HBV感染免疫清除(Immune clearance, IC)期接受聚乙二醇干扰素α-2a(Peg-IFNα-2a)治疗患者。为了探讨NK细胞与Peg-IFNα-2a疗效的相关性,我们以Peg-IFN-α-2a治疗24周时HBsAg下降程度为依据分组,HBsAg下降<1 log的为应答不佳(Poor response, PG)组,HBsAg下降≥1 log的应答(Good response,GR)组,受试者特征如表1。本研究经过首都医科大学附属北京市地坛医院伦理委员会通过,所有患者签署知情书。
1.2细胞表面染色为了检测CD3-CD56+NK细胞,在100 μl静脉全血中加入3 μl PerCP Mouse anti-Human CD3,3 μl APC Mouse anti-Human CD56,5uL PE anti-Human CD335(NKp46),5 μl FITC Anti-Human IFNAR2 Antibody,避光孵育15~20 min,染色后的细胞用FACS Lysing Solution裂解,磷酸盐缓冲液(PBS)洗涤,流式细胞仪检测和FlowJo7.6分析。
1.3QuantiBRITEPE 微球定量功能分子 QuantiBRITE微球表面标记的荧光素与NK细胞表面结合的抗体上的荧光素相同,均为PE标记,使其有匹配的荧光光谱。每个BD QuantiBRITE PE管里有一个冻干的颗粒,颗粒由4种已知的标有不同PE分子数量的微球混合而成,用流式细胞仪测定时制作标准曲线。把细胞表面CD分子的PE荧光强度值转换为每个细胞表面CD分子的绝对值。
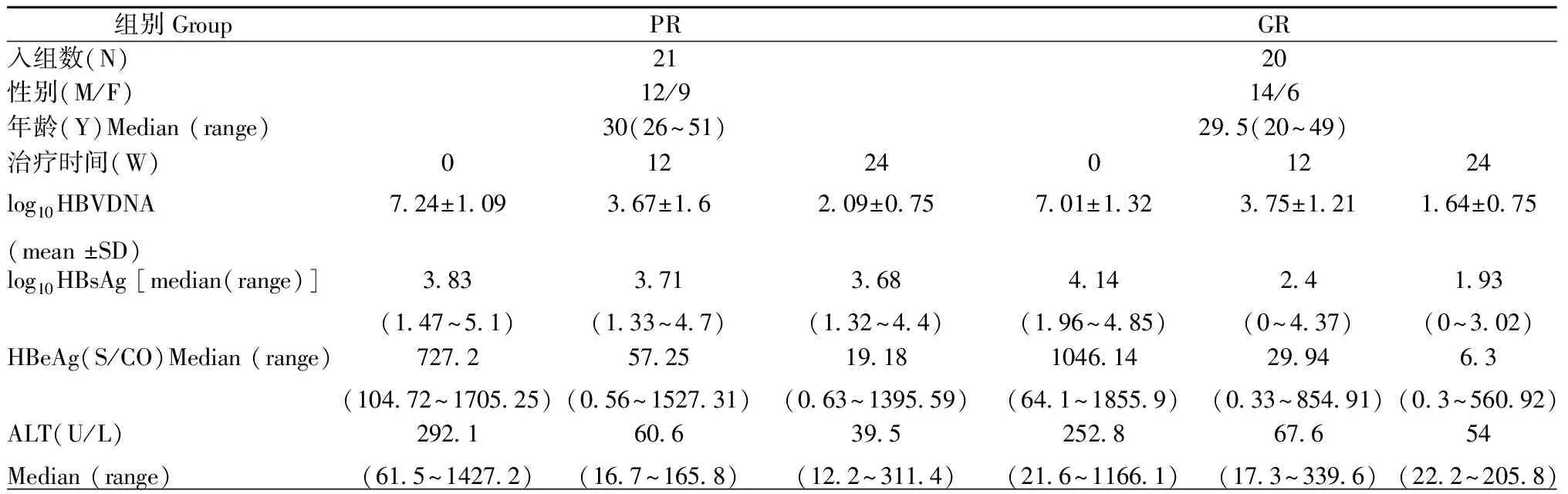
表1 PR组和GR组受试者特征
注:SD,标准差;ALT,丙氨酸氨基转移酶
Notes: SD, standard deviation; ALT, alanine aminotransferase
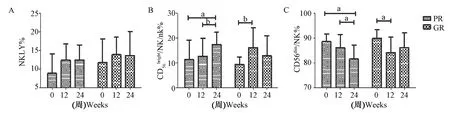
图1 IC期患者经Peg-IFNα-2a治疗PR组和GR组NK细胞及其亚群频数的变化aP<0.05,bP<0.01, cP<0.001,P<0.05表示差别有统计学意义Fig.1 The change of the frequency of NK cells and their subgroups in PR and GR groups from patients in IC phase treated with Peg-IFNα-2aaP<0.05, bP<0.01, cP<0.001, P<0.05 was considered to be statistically significan
1.4统计学方法所有数据以中位数(median)及四分位数(Q1,Q3)表示,应用GraphPad Prism 5软件进行统计分析。不同组间多重比较采用Kruskal-Wallis H分析完成,组间两两比较采用Mann-Whitney非参数 U检验方法,连续变量的前后比较采用wilcoxon秩和检验。aP<0.05,bP<0.01,cP<0.001,P<0.05表示差别有统计学意义。
2 结果
2.1Peg-IFNα-2a治疗使外周血CD3-CD56+NK和CD56brightNK细胞频数升高与基线比较,GR组CD3-CD56+NK细胞频数在治疗24周升高(11.74, 5.69~18.15% vs 13.7, 9.36%~20.18%,P>0.05),在PR组同样升高(8.94, 6.26%~14.15% vs 12.5, 7.64%~16.55%,P>0.05)(图1 A)。GR组CD56brightNK细胞频数在治疗24周显著升高(9.49, 6.2%~12.48% vs 12.98, 7.75%~20.93%,P>0.05),在PR组同样显著升高(11.45, 8.27%~19.13% vs 17.52, 12.3%~22.42%,P=0.0239)(图1B)。GR组CD56dimNK细胞频数在治疗24周降低(90.03, 86.95%~93.46% vs 86.3, 77.95%~92.13%,P>0.05),在PR组也降低(88.6, 80%~91.63% vs 81.6, 77.14%~87.25%,P=0.0123)(图1C)。
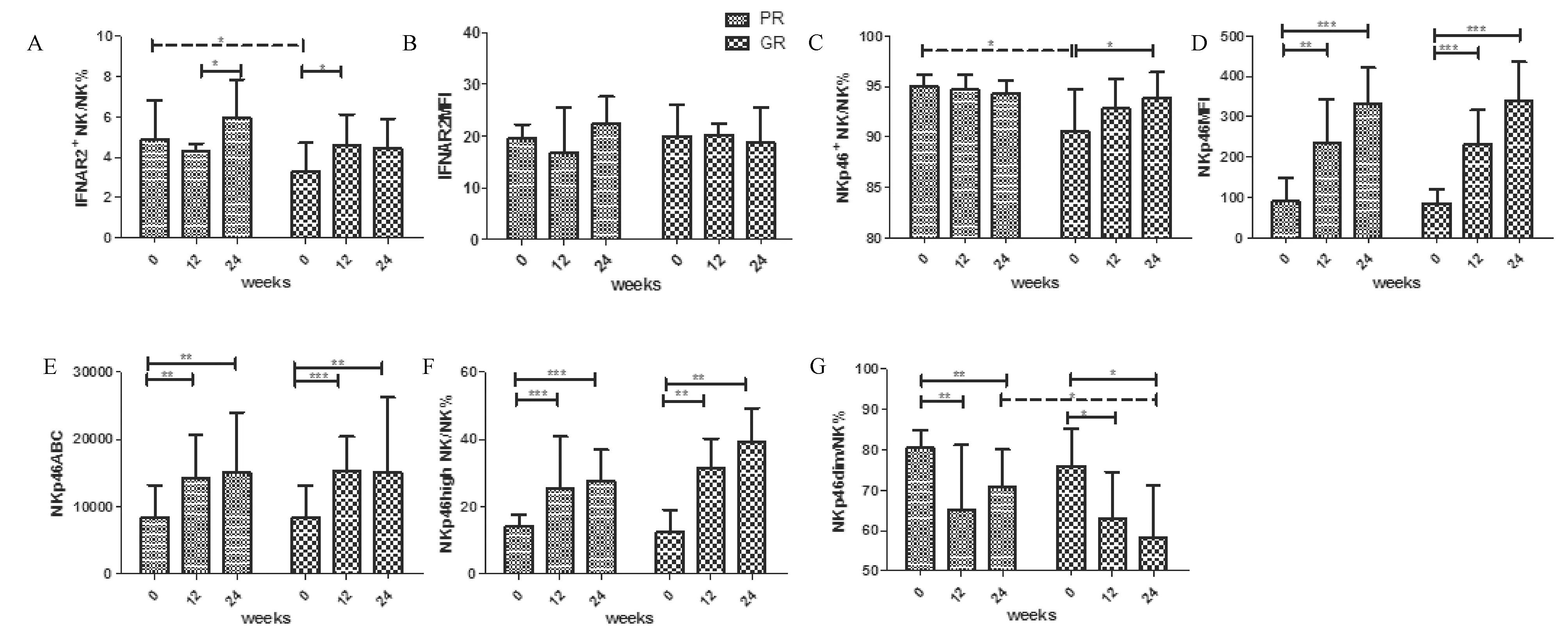
图2 IC期患者经Peg-IFNα-2a治疗PR组和GR组NK细胞表面受体IFNAR2和NKp46的变化FMI,平均荧光强度;ABC,抗体结合量;*P<0.05,**P<0.01, ***P<0.001,P<0.05表示差别有统计学意义Fig.2 The change of the expression of IFNAR2 and NKp46 on NK cells in PR and GR groups from patients in IC phase treated with Peg-IFNα-2a. FMI, mean fluorescent intensity, ABC, antibody binding capacity*P<0.05, **P<0.01, ***P<0.001, P<0.05 was considered to be statistically significant.
2.2NKp46在GR组表达上调与基线比较,GR组NK细胞IFNAR2表达水平在治疗24周升高(3.3, 2.3~4.7 vs 4.46, 2.7-5.92,P>0.05),其升高幅度与PR组差异无统计学意义(4.86, 3.53~6.81 vs 5.94, 2.77~7.85,P>0.05)(图2 A)。GR组NK细胞NKp46表达水平在治疗24周显著升高(90.55, 83.8~94.78 vs 93.8, 92.28~96.4,P=0.0263),而PR组却未升高(95, 90.6~96.15 vs 94.3, 92.1~95.6,P>0.05)(图2 C)。GR组NK细胞NKp46ABC在治疗24周显著升高(8405.67, 6762.03~13090.4 vs 14974.3, 8489.77~26243,P=0.0016),其升高幅度与PR组差异无统计学意义(8496.88, 6786.24~13202.1 vs 14952.1, 8253.18~23975.1,P=0.0074)(图2 E)。
2.3经Peg-IFNα-2a治疗,NKp46high表达显著上调,尤其在GR组与基线比较,GR组NK细胞NKp46high表达水平在治疗24周显著升高(12.4, 8.58~19.08 vs 39.3, 23.15~49.3,P=0.0011),其升高幅度显著高于PR组(14.2, 9.78~17.65 vs 27.58, 19.13~36.56,P=0.006)(图2 F)。GR组NK细胞NKp46dim表达水平在治疗24周显著降低(76, 59.33~85.13, vs 58.2, 41.05~71.2,P=0.016),其降低幅度显著高于PR组(80.4, 74.2~84.95 vs 70.7, 59.6-80.07,P=0.0091)(图2 G)。
2.4NK细胞功能与Peg-IFN-α-2a疗效相关性分析为了探讨CD3-CD56+NK细胞与Peg-IFNα-2a疗效是否具有相关性,我们把所有IC期经Peg-IFNα-2a治疗患者的血浆HBsAg和HBV DNA的下降程度分别作自变量,CD3-CD56+NK细胞、CD56brightNK细胞和CD56dimNK细胞频数及IFNAR2MFI、 NKp46MFI、NKp46ABC以及NK细胞上IFNAR2、NKp46、NKp46high和NKp46dim表达水平的变化作因变量进行Spearman等级相关检验,结果未显示其有相关性(数据未呈现)。
3 讨论
IFNα可以通过不同的机制发挥直接抗病毒的作用,比如阻止包含RNA的核心颗粒形成,加速核心颗粒衰减和降解前基因组RNA(Pregenomic RNA)[10-11],也有报道显示IFNα可直接促使共价闭合环状DNA(Covalently closed circular DNA, cccDNA)降解[12]。而且部分患者经过IFNα治疗停药后可获得长期抑制病毒复制的免疫,这些研究支持IFNα的直接抗病毒活性在控制HBV感染方面的重要性,然而关于IFNα在调节免疫反应尤其是调节固有免疫方面作用机制的研究结果不尽相同。
Bruder等[9]研究发现Peg-IFNα-2a可以使CD56brightNK细胞显著扩增,而且促进CD56dimNK细胞的激活并加强其功能,CD56brightNK的绝对分子计数与HBsAg滴度呈负相关。我们前期研究发现慢性HBV感染免疫清除期患者外周血CD3-CD56+NK频数降低[13],这可能是肝炎发生时NK细胞功能耗竭所致,随后经过Peg-IFNα-2a治疗无论应答组还是应答不佳组CD3-CD56+NK细胞频数均升高,且这种升高伴随着ALT的降低,间接提示NK细胞与肝脏损伤相关,随着炎症减轻NK细胞数量也在恢复。正如Zheng等研究所得,在HBV感染炎症发生时外周血NK细胞数量降低,激活的NK细胞富集在肝脏组织,且CD69+NK细胞与ALT成正相关[14],遗憾的是我们并没有得出ALT与CD3-CD56+NK细胞、CD56brightNK细胞和CD56dimNK细胞频数及IFNAR2MFI、NKp46MFI和NKp46ABC以及NK细胞上IFNAR2、NKp46、NKp46high和NKp46dim的表达具有相关性。
我们的研究发现经过Peg-IFNα-2a治疗的免疫清除期患者CD56brightNK细胞的频数升高,而且有报道显示在丙型肝炎和丁型肝炎患者IFNα同样可以使CD56brightNK细胞频数升高[15、16]。Bruder等[9]发现经Peg-IFNα-2a治疗的慢乙肝患者CD56brightNK细胞绝对数与HBsAg滴度呈负相关,但我们并没有发现CD56brightNK细胞频数与HBsAg含量相关。有报道显示恩替卡韦(entecavir, ETV)抗病毒治疗虽然可以增加CD56brightNK细胞的激活,但更主要的会增强CD56dimNK细胞分泌IFN-γ的能力[17]。我们发现应答组CD56brightNK细胞频数在前12周扩增显著,我们猜测Peg-IFNα-2a治疗扩增CD56brightNK细胞发挥抗病毒作用主要发生在治疗前期。
我们的研究发现Peg-IFNα-2a治疗无论应答组还是应答不佳组NK细胞上NKp46分子量均明显增加,然而Peg-IFNα-2a应答不佳组NK细胞上NKp46表达水平较基线无明显改变,治疗应答组NK细胞NKp46表达水平却上调,提示Peg-IFNα-2a治疗促进NK细胞的激活,而且激活的NK细胞与Peg-IFNα-2a疗效相关。
HCV感染患者研究NKp46highNK细胞与抑制病毒复制和肝脏损伤密切相关,在HBV感染的研究还较少。我们发现免疫清除期患者Peg-IFNα-2a治疗NKp46high表达升高,而且在应答组显著升高。因此,我们推测激活的NKp46highNK细胞与Peg-IFNα-2a疗效密切相关。
本研究结果显示慢性乙型肝炎患者经 Peg-IFNα-2a治疗外周血CD3-CD56+NK细胞和CD56brightNK细胞频数升高,对Peg-IFNα-2a治疗应答患者NK细胞上NKp46表达上调,而且Peg-IFNα-2a治疗使NKp46high表达显著上调,尤其在应答患者。本研究初步探讨了Peg-IFNα-2a在治疗慢性乙型肝炎患者过程中NK细胞频数和功能变化的基本规律,而激活的NK细胞发挥作用的具体机制仍需进一步研究。
[1] Wu SF, Wang WJ,Gao YQ. Natural killer cells in hepatitis B virus infection[J]. Braz J Infect Dis, 2015, 19(4):417-425.doi: 10.1016/j.bjid.2015.05.006.
[2] Li MH, Zhang L, Qu XJ, et al.Kinetics of hepatitis B surface antigen level in chronic hepatitis B patients who achieved hepatitis B surface antigen loss during pegylated interferon Alpha-2a treatment [J]. Chin Med J (Engl), 2017, 130(5):559-565.doi: 10.4103/0366-6999.200554.
[3] Zhao J, Li Y, Jin L, et al. Natural killer cells are characterized by the concomitantly increased interferon-gamma and cytotoxicity in acute resolved hepatitis B patients[J]. PLoS One, 2012, 7(11): e49135.doi: 10.1371/journal.pone.0049135.
[4] Waggoner SN, Cornberg M, Selin LK, et al. Natural killer cells act as rheostats modulating antiviral T cells[J]. Nature, 2011, 481(7381): 394-398.doi: 10.1038/nature10624.
[5] Fisicaro P, Valdatta C, Boni C, et al. Early kinetics of innate and adaptive immune responses during hepatitis B virus infection[J]. Gut, 2009, 58(7): 974-982. doi: 10.1136/gut.2008.163600.
[6] Li F, Wei H, Wei H, et al. Blocking the natural killer cell inhibitory receptor NKG2A increases activity of human natural killer cells and clears hepatitis B virus infection in mice[J]. Gastroenterology, 2013, 144(2): 392-401. doi: 10.1053/j.gastro.2012.10.039.
[7] Das A, Maini MK. Innate and adaptive immune responses in hepatitis B virus infection[J]. Dig Dis, 2010, 28(1): 126-132.doi: 10.1159/000282075.
[8] Li MH, Zhang L, Qu XJ, et al. The predictive value of baseline HBsAg level and early response for HBsAg loss in patients with HBeAg-positive chronic hepatitis B during pegylated interferon Alpha-2a treatment[J]. Biomed Environ Sci, 2017, 30(3):177-184.doi: 10.3967/bes2017.025.
[9] Bruder Costa J,Dufeu-Duchesne T,Leroy V, et al. Pegylated interferon alpha-2a triggers NK-Cell functionality and specific T-Cell responses in patients with chronic HBV infection without HBsAg seroconversion[J]. PLoS One, 2016, 11(6): e0158297.doi: 10.1371/journal.pone.0158297.
[10] Xu C, Guo H, Pan XB, et al. Interferons accelerate decay of replication-competent nucleocapsids of hepatitis B virus[J]. J Virol, 2010, 84(18): 9332-9340.doi: 10.1128/JVI.00918-10.
[11] Li J, Lin S, Chen Q, et al. Inhibition of hepatitis B virus replication by MyD88 involves accelerated degradation of pregenomic RNA and nuclear retention of pre-S/S RNAs[J]. J Virol, 2010, 84(13):6387-6399.doi: 10.1128/JVI.00236-10.
[12] Lucifora J, Xia Y, Reisinger F, et al. Specific and nonhepatotoxic degradation of nuclear hepatitis B virus cccDNA[J]. Science, 2014, 343(6176):1221-1228. doi: 10.1126/science.1243462.
[13] 屈晓晶,李明慧,曹卫华,等.NK细胞在HBV感染中的作用研究[J].中华实验和临床病毒学杂志,2016,30(5):439-443.doi:10.3760/cma.j.issn.1003-9279.2016.05.006.
[14] Nattermann J. NK cells in acute hepatitis C[J]. J Hepatol, 2011, 55(2): 265-267.doi: 10.1016/j.jhep.2011.01.005.
[15] Ahlenstiel G, Edlich B, Hogdal LJ, et al. Early changes in natural killer cell function indicate virologic response to interferon therapy for hepatitis C[J]. Gastroenterology, 2011, 141(4):1231-1239.e1-2.doi: 10.1053/j.gastro.2011.06.069.
[16] Lunemann S, Malone DF, Grabowski J, et al. Effects of HDV infection and pegylated interferon a treatment on the natural killer cell compartment in chronically infected individuals[J]. Gut, 2015, 64(3):469-482.doi: 10.1136/gutjnl-2014-306767.
[17] Tan AT, Hoang LT, Chin D, et al. Reduction of HBV replication prolongs the early immunological response to IFNalpha therapy[J]. J Hepatol, 2014, 60(1): 54-61.doi: 10.1016/j.jhep.2013.08.020.
FunctionsofNKcellsinchronichepatitisBpatientstreatedwithinterferon
QuXiaojing,LuYao,CaoWeihua,ZhangYing,RanChongping,QiTianlin,HuLeiping,HaoHongxiao,ZhangLu,LiMinghui,XieYao
SecondDivisionofLiverCenter,BeijingDitanHospital,CapitalMedicalUniversityBeijing100015,China
XieYao,Email:xieyao00120184@sina.com;LiMinghui,Email:wuhm2000@sina.com
ObjectiveTo elucidate the functions of peripheral blood NK cells in chronic hepatitis B patients treated with interferon.MethodsVenous whole blood samples were obtained from patients in the immune clearance (IC) phase treated with peg-interferon-alpha-2a (Peg-IFNα-2a) at baseline (t=0), 12 weeks (t=12) and 24 weeks (t=24). The frequencyies of peripheral blood CD3-CD56+NK cells, CD56brightNK cells and CD56dimNK cells, the expression level of IFNAR2 and NKp46 on NK cells were detected by flow cytometry. The levels of serum HBV DNA, HBsAg, HBeAg and ALT were detected by Ditan Hospital clinical laboratory.ResultsForty-one patients in the IC phase treated with Peg-IFNα-2a, including 21 poor response (PR) patients and 20 good response (GR) patients, were recruited for this study. Theresult were as follows: The frequency of peripheral blood CD3-CD56+NK cells was increased at week 24 in GR compared with the baseline(11.74, 5.69%-18.15% vs 13.7, 9.36-20.18%,P>0.05), and it also was increased in PR(8.94, 6.26%-14.15% vs 12.5, 7.64-16.55%,P>0.05). The frequency of peripheral blood CD56brightNK cells was increased at week 24 in GR compared with the baseline(9.49, 6.2%-12.48% vs 12.98, 7.75%-20.93%,P>0.05), and it also was increased in PR(11.45, 8.27%-19.13% vs 17.52, 12.3%-22.42%,P=0.0239). The expression level of NKp46 on NK cells was significantly increased at week 24 in GR compared with the baseline(90.55, 83.8-94.78 vs 93.8, 92.28-96.4,P=0.0263), but it was not increased in PR(95, 90.6-96.15 vs 94.3, 92.1-95.6,P>0.05). The expression level of NKp46highon NK cells was significantly increased at week 24 in GR compared with the baseline(12.4, 8.58-19.08 vs 39.3, 23.15-49.3,P=0.0011), at that range of the increase was significantly higher than PR(14.2, 9.78-17.65 vs 27.58, 19.13-36.56,P=0.006).ConclusionsThe frequencies of peripheral blood CD3-CD56+NK cells and CD56brightNK cells were increased from patients in the IC phase treated with Peg-IFNα-2a. The expression level of NKp46 on NK cells was increased in GR patients treated with Peg-IFNα-2a. The expression level of NKp46highon NK cells was significantly increased, especially in GR patients treated with Peg-IFNα-2a.
Hepatitis B virus; NK cells; Immunopathogenesis; Interferon-alpha
肝炎病毒,乙型;自然杀伤细胞;免疫病理;干扰素α
2017-06-12)
(本文编辑:陈培莉)
屈晓晶、路遥对本文同等贡献
谢尧,Emai:xieyao00120184@sina.com;李明慧,Email:wuhm2000@sina.com
10.3760/cma.j.issn.1003-9279.2017.04.013
北京市医院管理局临床技术创新项目(XMLX201706)
QuXiaojingandLuYaoarethefirstauthorswhocontributedequallytothearticle
