不同叶位和离体失水时间对烤烟叶片保水能力的影响
2017-09-27张小全许志文阚洪赢张林张鋆鋆郭传滨杨立均夏宗良
张小全,许志文,阚洪赢,张林,张鋆鋆,郭传滨,杨立均,夏宗良
1 河南农业大学烟草学院 郑州 450002;
2 河南省烟草公司驻马店市公司 驻马店 463000;
3 河南农业大学生命科学学院 郑州 450002
农艺与调制
不同叶位和离体失水时间对烤烟叶片保水能力的影响
张小全1,许志文1,阚洪赢1,张林1,张鋆鋆1,郭传滨2,杨立均2,夏宗良3
1 河南农业大学烟草学院 郑州 450002;
2 河南省烟草公司驻马店市公司 驻马店 463000;
3 河南农业大学生命科学学院 郑州 450002
为阐明叶位和离体时间对烤烟叶片保水能力的影响。以2个田间抗旱性不同的烤烟品种豫烟6号和农大202的离体叶片为材料,采用离体叶片自然失水法,研究了不同叶位和离体时间对叶片失水率、抗氧化酶活性、激素和抗逆胁迫响应基因表达的影响。结果表明:5个不同叶位的失水率为离体0~24 h较高,24 h后失水速率逐渐变缓,叶位间差异不显著,农大202失水率显著高于豫烟6号;离体叶片内抗氧化酶(SOD、POD、CAT)活性、可溶性蛋白含量、脱落酸(ABA)含量均在离体24 h时达到最高值,丙二醛(MDA)含量也在24 h后增速变缓;4个胁迫响应基因(AREB、CDPK2、ERD10C、LEA5)相对表达量也在24 h达到最高,说明烤烟叶片离体24 h生理代谢反应最强,2个品种在离体24 h各指标差异最大。因此,烤烟叶片保水力与取样叶位关系不大,离体叶片失水24 h为测定烟草保水力的合适时间。
烤烟;叶片保水力;抗氧化酶活性;胁迫响应基因
烟草起源于降雨充沛的热带,整个生育期对水分的需求都很高。我国多数优质烟区位于丘陵山区,季节性干旱严重影响烟叶质量的提高和产量的稳定[1]。通过改善生产条件和应用栽培技术来缓解雨养烟区的水分胁迫问题是有限的,因此选育优质抗旱品种对稳定和发展旱地烟叶生产有着重要意义。鉴定抗旱相关性状及不同品种的抗旱机制,成为烟草抗旱育种的重要前提。抗旱性鉴定指标多种多样,有干旱条件下的生物量[2]、细胞膜透性[3]、气孔阻力[4]、抗氧化酶活性[5]、叶片保水力[6]等。叶片保水力是叶片在离体条件下具有保持原有水分的能力,其保水力的强弱与植物遗传性、细胞特性和原生质胶体性质有关,离体叶片的保水力可以反应植物原生质的耐脱水能力和叶片角质层的保水能力,在一定时间内含水量越高,表明叶片保水力越强,抗旱性也越强。Clarke等[7-10]最先研究了不同发育时期的叶片、不同离体时间的小麦叶片的保水力差异,并将叶片保水力作为小麦的抗旱性鉴定指标。叶片保水力具有测定方法简单、时间短、工作量小等优点,目前在小麦[11]、玉米[12]、油菜[13]、烟草[14]、红树[15]等抗旱性鉴定当中有大量应用。烟草叶片较大、水分含量较高,国内外大量研究在测定叶片保水力时,选用的叶位、离体时间不同,没有统一的标准[8,14]。本试验拟对不同叶位和离体时间对烤烟叶片保水能力的影响进行研究,以期探明不同叶位和离体时间烟草叶片保水力的变化规律,为应用叶片保水力作为烟草抗旱性鉴定和抗旱育种选择指标提供依据。
1 材料与方法
1.1 试验材料与处理
选用抗旱性能不同的豫烟6号和农大202为试验品种[6]。试验于2016年在河南农业大学许昌校区进行,选取2个品种整齐一致的烟苗于4月30日移栽至大田,株距55 cm,行距120 cm。每个品种种植4行,每行100株。供试土壤为轻壤土,土壤中碱解氮含量为48.8 mg.kg-1,速效磷含量为51.7 mg.kg-1,速效钾含量为103.9 mg.kg-1,pH为7.7。田间管理措施按当地优质烟叶栽培技术规程进行。
在移栽后60 d,旺长后期,现蕾前,选取2品种自下而上第1、4、7、10、13叶位的叶片各6片用于不同叶位对叶片保水力的影响研究;选取2个品种第10叶位的叶片各36片用于不同失水时间对叶片相关生理指标的影响研究。选取得各叶位的叶片均为正常生长,朝向一致的叶片。
1.2 测定指标与方法
1.2.1 叶片失水率和叶片保水力测定
采用离体叶片自然失水法测定,具体步骤如下:在早上8:00~9:00,在田间摘取叶片后,迅速装入塑料封口袋,并密封袋口,置于冰盒内迅速带回实验室。实验室保持恒温、避风、无阳光直射,将叶样从塑料袋内取出,迅速擦干叶片上沾有的水分,用电子天平称取叶样鲜重(FW0),而后悬挂于室温25±1°C,相对湿度40%的室内,每隔12 h再次称重,获得每个样品的FW12、FW24、FW36、FW48。24 h和48 h称重后,每个处理选取3片叶105℃杀青30 min,95℃烘干至恒重,称取干重获得DW24和DW48。分别在0、12、24、36、48 h节点各选取6片叶,用于生理指标、激素和基因表达分析,每项指标3次生物学重复。叶片失水率和叶片保水力采用下面公式计算:

1.2.2 生理指标测定
抗氧化酶活性测定参考Li Q的方法[16],取0.5 g叶片于预冷的研钵中,加入1 mL磷酸缓冲液在冰浴下研磨成浆,加缓冲液使最终体积为5 mL。取2 mL于12000 r/min下离心10 min,上清液即为SOD、POD、CAT粗提液,比色并计算酶活。丙二醛(MDA)含量和相对电导率参照李合生等[17]方法测定。可溶性蛋白含量测定参照考马斯亮蓝(Bradford)法测定[18]。激素含量的测定采用酶联免疫吸附分析法[19]。
1.2.3 胁迫响应基因的相对表达量分析
样品总RNA的提取按照美国Invitrogen公司TRIZOL试剂说明书操作,反转录取2 μgRNA为模版,参照立陶宛Fermentas公司的RevertAidTM First Strand cDNA Synthesis Kit产品说明书进行反转录,合成第一链cDNA。PCR扩增采用BioRad iQ5实时定量PCR仪进行。反应结束后分析荧光值变化,每项指标3次生物学重复。目的基因的相对表达量在将CT值导入Excel2010后按照公式2-△△CT计算[20],并绘制基因表达差异图。内参基因为烟草ACTIN2基因,表1为4个胁迫响应基因的PCR扩增引物信息。

表1 荧光定量PCR分析用的引物Tab.1 Primers used for quantitative real-time PCR
1.3 数据处理
试验数据的统计分析采用DPS 7.05[21]以及Excel 2010进行。
2 结果与分析
2.1 不同叶位叶片含水率和失水率比较
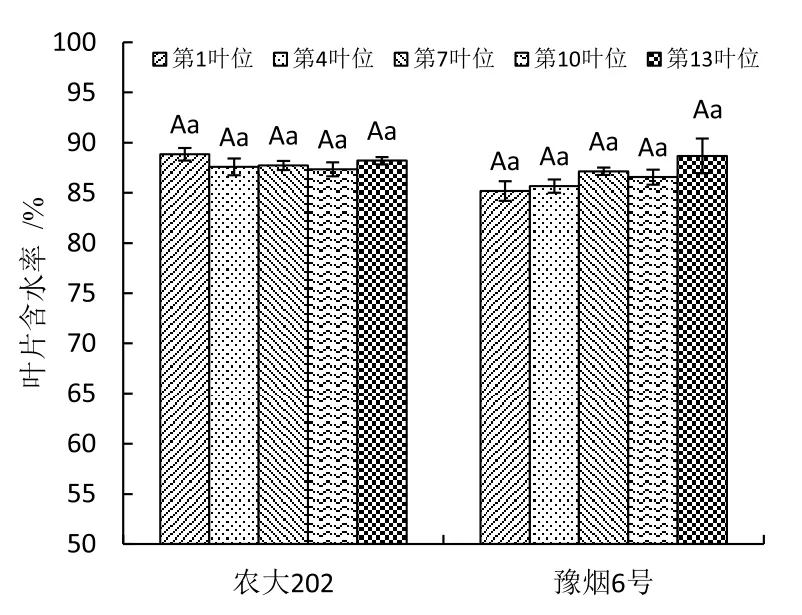
图1 不同叶位叶片含水率比较Fig.1 Comparison of leaves water content in different leaf positions
在旺长后期对豫烟6号和农大202的第1、4、7、10和13叶位离体叶片取样测定叶片含水率与叶片失水率。图1显示2个品种不同叶位叶片含水率在85%~90%之间,不同叶位之间无差异,品种间差异不显著。叶片失水曲线如图2所示,2个品种5个不同叶位的失水率为0~24 h较高,24 h后失水速率逐渐变缓,叶位间差异不明显,农大202失水率显著高于豫烟6号。
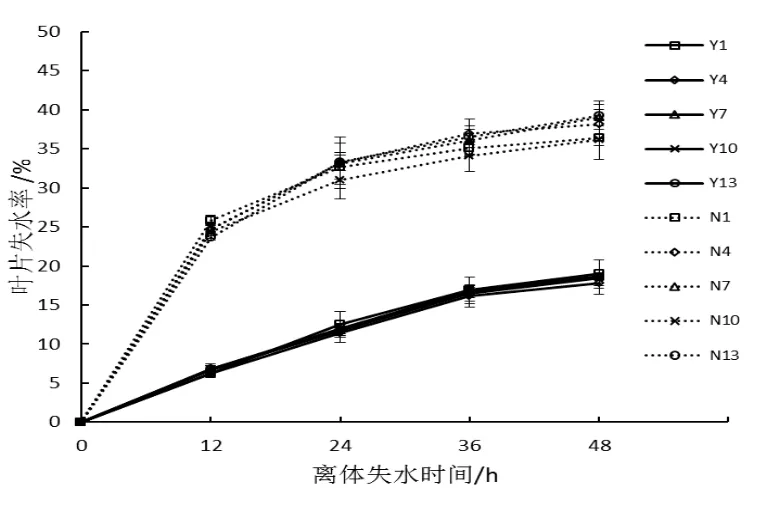
图2 不同叶位叶片失水率比较Fig.2 Comparison of leaf water loss in different leaf positions
2.2 不同离体失水时间烤烟叶片生理变化
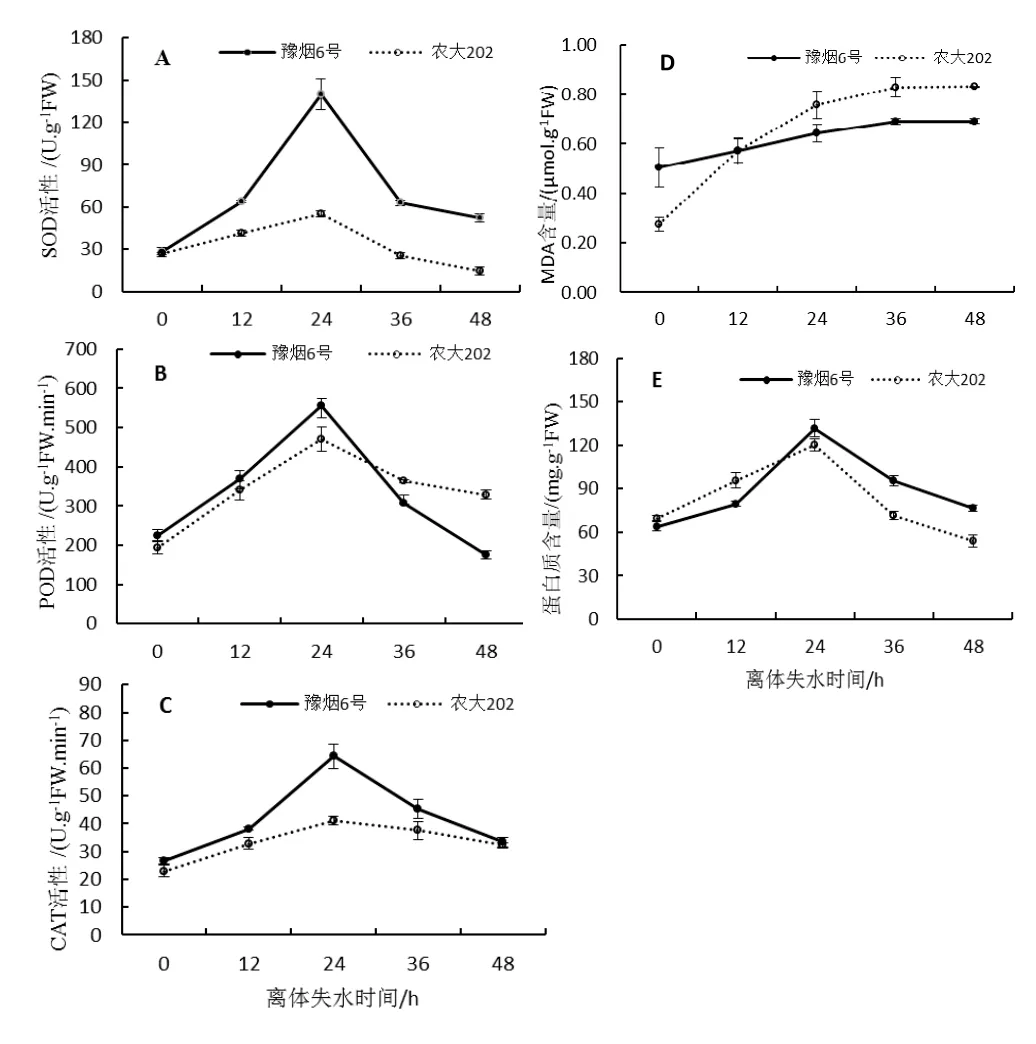
图3 不同离体失水时间烤烟叶片生理变化Fig.3 Physiological changes of flue - cured tobacco leaves under different dehydration time
对豫烟6号和农大202不同离体失水时间的第10叶位叶片分别进行了SOD、POD、CAT活性,MDA含量以及可溶性蛋白含量测定。结果表明3种抗氧化酶活性均呈现出先升后降趋势,且在24 h时达到最高值,整体上看豫烟6号抗氧化酶活性均高于农大202(图3A、B、C),说明豫烟6号能对细胞膜起到更好的保护作用。MDA作为膜脂过氧化的产物,其含量呈不断增加趋势,但24 h后增速减缓,这说明膜脂过氧化在加剧但叶片失水24 h后过氧化程度在变缓,12 h后农大202的MDA含量超过了豫烟6号,说明随失水时间农大202膜系统受伤害程度大于豫烟6号(图3D)。可溶性蛋白含量也呈先升后降趋势,失水24 h其含量达到最高值(图3E)。这些表明烤烟叶片失水24 h后其生理活性减弱,叶片生命力开始降低。
2.3 不同离体失水时间烤烟叶片激素含量变化
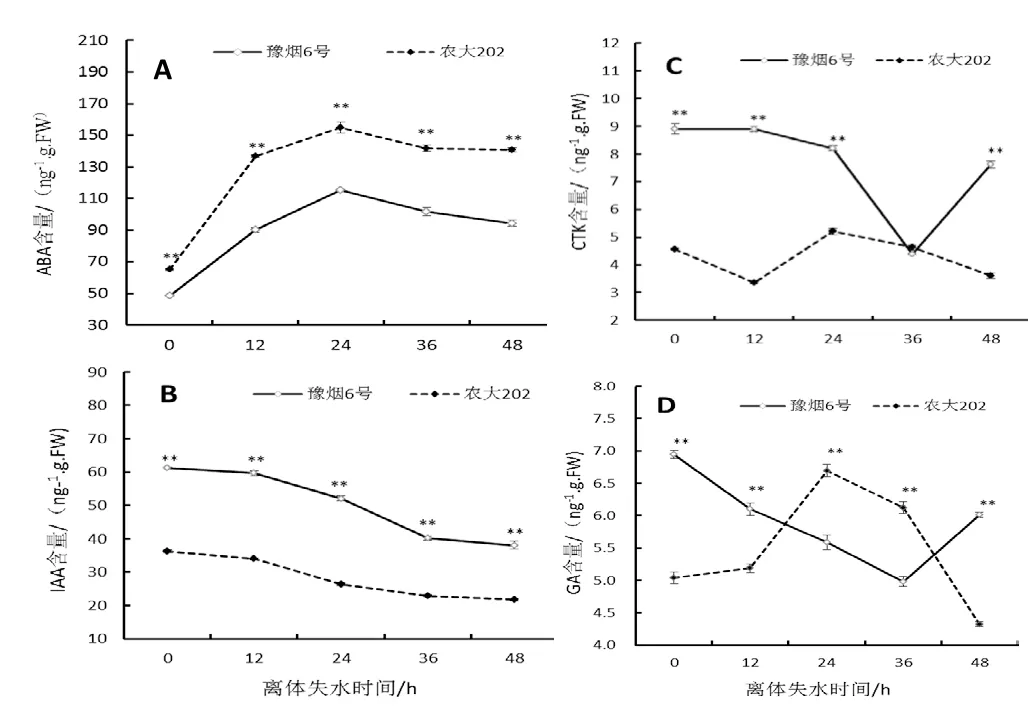
图4 不同离体失水时间叶片激素含量变化Fig.4 Changes of hormone contents in tobacco leaves at different dehydration time
激素作为植物体内重要的微量调节和信号转导物质,对植物抵御非生物胁迫具有重要作用。对2个品种不同离体失水时间的第10叶位叶片内的ABA、IAA、CTK和GA含量进行了测定,结果如图4所示,ABA含量在叶片离体后迅速升高,在24 h达到最高值,而后开始下降(图4A),并且农大202体内ABA含量显著高于豫烟6号,这可能由于农大202遭受水分胁迫时其依赖ABA信号途径的调控网络反应较为敏感。IAA含量表现出逐渐降低趋势,随时间增加其降幅减缓,并且豫烟6号叶片内IAA含量高于农大202(图4B)。CTK含量2个品种离体叶片均先下降后上升,但农大202在离体12 h前后下降后开始升高,而豫烟6号在36 h前后下降后开始升高(图4C),CTK有延缓植物衰老的效应,2个品种离体叶片CTK变化的不同可能跟其叶片衰老进程不同有关。GA有提高生长素水平,抑制侧芽休眠,衰老,加速细胞分裂,诱导α-淀粉酶的形成等作用,豫烟6号离体叶片GA从较高的水平先下降后上升,农大202离体叶片GA则从较低的含量水平先上升后下降,表现出不同的特征,表明2个品种离体叶片在失水衰老的过程中生理过程有着很大的不同。
2.4 不同离体失水时间烤烟叶片胁迫响应基因表达量变化
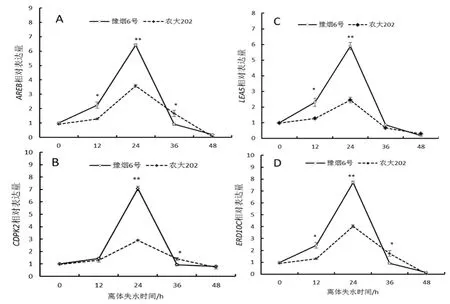
图5 胁迫响应基因相对表达量Fig.5 Stress response gene relative expression
对4个胁迫响应基因(AREB、CDPK2、ERD10C、LEA5)的荧光定量PCR结果如图5所示:随叶片离体失水时间增加,4个基因的相对表达量均表现出先升后降的趋势,并在24 h时达到最高值,表明叶片在24 h时应胁反应达到最强。在叶片离体失水12 h~24 h基因表达量迅速增加,说明叶片的应胁反应在此时间段较为剧烈,也反映了此时叶片已经受到了巨大的影响,而24 h~48 h表达量迅速下降说明了叶片因过度失水生命力开始渐失,生理活性减弱。整体上看豫烟6号胁迫响应基因的相对表达量显著高于农大202,说明豫烟6号受到水分胁迫后应胁反应强于农大202,抗逆性相对较强。
2.5 不同叶位离体叶片保水力比较

图6 不同叶位保水力比较Fig.6 The water retention capacity of excised leaves among different leaf positions
采用叶片离体失水24 h对农大202和豫烟6号进行了叶片保水力测定(图6)。2个品种不同叶位间的离体叶片保水力均无显著差异,说明离体叶片保水力与叶位无关。豫烟6号叶片保水力达到了85%以上,而农大202的叶片保水力在65%左右,差异达极显著水平。表明豫烟6号离体叶片有相对较强的保水能力。同一品种不同叶位叶片具有不同的叶龄,其含水率和离体失水速率差异不大(图1和图2),叶片保水力没有显著性差异,可能跟这些叶片均为移栽后60天同时取样,处在旺长后期,测定的第1、4、7、10、13叶位叶片均已定长,与叶片水分散失相关的角质层厚度、气孔及细胞壁发育等已经基本定型,以及取样前一段时间这些叶片的生长环境相同有关,而品种间差异显著则可能主要跟品种本身的遗传性、细胞原生质胶体性质等有关。
3 结论与讨论
本研究表明同一品种烤烟的不同叶位叶片保水力及含水率无显著差异,说明叶片保水力与叶位关系不大。在烤烟叶片失水24 h后,其抗氧化酶活性、可溶性蛋白含量、ABA含量以及胁迫响应基因相对表达量均达到最高值,而后开始下降。该结果说明离体叶片失水24 h后其生理活动由强变弱,叶片开始失去活力。这一现象可能跟植物生长发育的生物节律有关,离体条件下,烤烟叶片在自然环境中仍然要像正常生长条件下一样努力维持昼夜生长节律。因此叶片失水24 h左右为烟草离体叶片保水力的合适研究时间。
植物通过保持吸水率与自身水分损失率间的平衡来防止其组织水分含量下降[22],当叶片离体以后吸水停止,只能通过保持水分来维持组织水分平衡。在此过程中细胞的代谢会因失水而改变,耐脱水的细胞必须做到能够调节失水情况下的代谢和能修复失水代谢造成的损伤[22-25]。细胞开始脱水后,调节失水代谢的主要策略为关闭气孔和调节渗透。因此水分胁迫后叶片内ABA和可溶性蛋白含量往往会大幅上升,ABA可以诱导气孔关闭,并且是植物抵御胁迫的重要信号转导物质。因此二者遇胁迫后含量上升幅度越大意味着叶片保水能力越强,抗逆能力越强。另外,叶片失水后IAA含量出现下降,推测是由于叶片为适应水分亏缺,抑制自身生长以减少水分需求,这也是细胞调节失水代谢的手段之一。细胞失水造成的损伤主要在细胞膜系统上,表现为膜脂过氧化和膜透性增加,故失水后叶片MDA含量会呈增加态势,与此同时抗氧化酶活性会明显升高以清除膜脂过氧化产生的大量活性氧,因此保水能力较强的叶片失水后MDA含量增幅较小,抗氧化酶活性较高。综上可知,保水能力强的叶片失水后表现为可溶性蛋白含量及抗氧化酶活性相对较高,MDA含量增幅相对较低,这与本试验结果相一致。
AREB转录因子基因是ABA信号途径下游的关键调控因子,可启动下游基因的表达,而AREB基因是植物应对渗透胁迫关键基因之一[26]。CDPKs即钙离子依赖蛋白激酶基因,是植物细胞应对各种生物和非生物胁迫中承接Ca2+流变化的重要因素。研究表明CDPK2基因参与了植物对干旱的抵御反应[27]。LEA蛋白能在水分亏缺时束缚水分子并稳定蛋白质和细胞膜结构,其过表达可以提高转基因烟草对渗透胁迫的抵抗力[28]。CBF类转录因子在植物应对低温及水分胁迫中发挥着重要作用,ERD10C基因作为其下游基因,同样对植物的抗逆反应起着关键作用。而Liu等的研究也证实了烟草在受到水分胁迫时ERD10C会表现出上调表达[29],本研究表明,失水后叶片的胁迫响应基因相对表达量显著增加,且2个品种基因表达量高低与保水力趋势相一致,说明烟草的叶片保水力以及各生理指标变化是受胁迫响应基因调控的。当细胞受到水分胁迫后首先会引发渗透势的改变,继而胁迫响应基因编码大量蛋白以应对胁迫,主要包括起到抗性作用的蛋白(包括水通道蛋白、合成渗透保护物质的关键酶、起保护作用的蛋白酶以及解毒酶类)和对信号转导起关键作用的蛋白因子(主要包括与第二信使生成有关酶类以及表达调控逆酶基因的有关转录因子)。通过这些脱水胁迫诱导基因产物实现了对失水情况下代谢的调节以及失水代谢造成损伤的修复。
植物的抗旱性通常是非常复杂的数量性状,受多种因素的影响,选择不同的指标研究得到的结论也不一样。植物角质层是植物在4亿5000万年前向陆地过渡过程中进化的一项重要创新[30-31]。叶片是烤烟的主要蒸腾部位,水分经叶表面的蒸腾作用有两条途径:一是通过角质层蒸腾,另一种是通过气孔蒸腾。烤烟幼叶因角质层发育不完全,角质层蒸腾几乎占蒸腾量的40%~70%,而随着叶片成年其角质层蒸腾减少,仅占总蒸腾量的5%~10%[32]。赵阳等研究表明水分胁迫情况下抗旱能力强的农大202的一级侧根数目和二级侧根密度显著增加,说明农大202的抗旱机制可能主要在根系而不在叶片,因此其保水力相对豫烟6号较弱[33]。这也从侧面反映了植物对于耐旱有着不同的机制,即根系发达具有较强的吸水能力或者叶片细胞组织弹性较高,细胞壁以及角质层较厚,具有较强的抗脱水能力。因此可对不同抗旱烤烟品种角质层及根系再做进一步深入研究。
[1]云南省烟草科学研究所.云南烟草栽培学[M].北京:科学出版社,2005: 15-16.Institute of tobacco science of Yunnan.Yunnan tobacco cultivation[M].Beijing: Science Press, 2005: 15-16.
[2]梁太波, 王建伟, 尹启生,等.水分胁迫对烤烟氨同化关键酶活性和生物量的影响[J].中国烟草学报, 2012, 18(3): 50-54.LIANG Taibo, WANG Jianwei, YIN Qisheng, et al.Effects of water stress on ammonium assimilation and biomass of fl ue-cured tobacco[J].Acta Tabacaria Sinica, 2012, 18(3): 50-54.
[3]马新蕾, 房燕, 王玉军,等.十个烤烟品种的抗旱性鉴定[J].中国烟草学报, 2005, 11(5): 26-30.MA Xinlei, FANG Yan, WANG Yujun, et al.The evaluation of drought resistance of ten tobacco cultivars.Acta Tabacaria Sinica,2005, 11(5): 26-30.
[4]刘贞琦, 伍贤进, 刘振业.土壤水分对烟草光合生理特性影响的研究[J].中国烟草学报, 1995, 2(1): 44-49.LIU Zhenqi, WU Xianjin, LIU Zhenye.The effects of soil water content on photosynthetic characteristics of tobacco[J].Acta Tabacaria Sinica, 1995, 2(1): 44-49.
[5]裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,(05):1386-1396.PEI Bin, ZHANG Guangcan, ZHANG Shuyong, et al.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities inHippophae Rhamnoides Linn.Seeding[J].Acta Ecologica Sinica,2013,33(5):1386-1396.
[6]任庆成,陈秀华,张生杰,等.不同烤烟品种抗旱生理特征比较研究[J].西北植物学报,2009,29(10):2019-2025.REN Qingcheng, CHEN Xiuhua, ZHANG Shengjie, et al.Comparison of drought resistance characteristics of different fl uecured tobacoo varieties[J].Acta Botanica Boreali Occidentalia Sinica, 2009, 29(10): 2019-2025.
[7]Clarke J M, Mccaig T N.Excised-leaf water retention capability as an indicator of drought resistance ofTriticumgenotypes.[J].Canadian Journal of Plant Science, 1982, 62(3): 571-578.
[8]Clarke J M, Mccaig T N.Evaluation of techniques for screening for drought resistance in wheat.[J].Crop Science, 1980, 22(3): 503-506.
[9]Clarke J M, Romagosa I, Jana S, et al.Relationship of excised-leaf water loss rate and yield of durum wheat in diverse environments.[J].Canadian Journal of Plant Science, 1989, 69(4): 1075-1081.
[10]Clarke J M, Townley smith T F.Heritability and relationship to yield of excised-leaf water retention in durum wheat[J].Crop Science, 1986, 26(2): 289-292.
[11]Winter S R, Musik K B Porter.Evaluation of screening technique for breeding drought-resistant winter wheat[J].Crop Science, 1988,28: 512–516.
[12]武斌,李新海,肖木辑,等.53份玉米自交系的苗期耐旱性分析[J].中国农业科学, 2007, 40(4): 665-676.WU Bin, LI Xinhai, XIAO Muji, et al.Genetic variation in fi ftythree maize inbred lines in relation to drought tolerance at seeding stage[J].Scientia Agricultura Sinica, 2007, 40(4): 665-676.
[13]王丹丹,唐章林,荆蓉蓉,等.甘蓝型油菜遗传图谱构建及苗期耐旱相关性状的 QTL 定位[J].西南大学学报(自然科学版),2014, (7): 8-16.WANG Dandan, TANG Zhanglin, JING Rongrong.et al.Construction of a molecular genetic map of rapeseed (Brassica napus L.)and QTL mapping of its drought tolerance-related traits[J].Journal of Southwest University(Natural Science Edition),2014, (7): 8-16.
[14]Han Y, Wang W, Sun J, et al.Populus euphratica XTH overexpression enhances salinity tolerance by the development of leaf succulence in transgenic tobacco plants[J].Journal of Experimental Botany, 2013, 64(14): 4225.
[15]Lechthaler S, Robert E M R, Tonné N, et al.Rhizophoraceae mangrove saplings use hypocotyl and leaf water storage capacity to cope with soil water salinity changes[J].Frontiers in Plant Science,2016, 7: 1-13.
[16]Li Q, Yu B, Gao Y, et al.Cinnamic acid pretreatment mitigates chilling stress of cucumber leaves through altering antioxidant enzyme activity.[J].Journal of Plant Physiology, 2011, 168(9): 927-934.
[17]李合生.植物生理生化实验原理和技术[M].北京: 高等教育出版社, 2000: 280-283.LI Hesheng.Principles and techniques of plant physiological biochemical experiment[M].Beijing: Higher education press, 2000:280-283.
[18]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry, 1976, 72: 248–254.
[19]Zhao J, Li G, Yi G X, et al.Comparison between conventional indirect competitive enzyme-linked immunosorbent assay(icELISA) and simplified icELISA for small molecules[J].Analytica Chimica Acta, 2006, 571(1): 79-85.
[20]Livak K J, Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J].Methods, 2001, 25: 402-408.
[21]Tang Q Y, Zhang C X.Data Processing System (DPS) software with experimental design, statistical analysis and data mining developed for use in entomological research.Insect Science.2013,20(2) : 254-260.
[22]Verslues P E, Agarwal M, Katiyaragarwal S, et al.Methods and concepts in quantifying resistance to drought, salt and freezing,abiotic stresses that affect plant water status.[J].Plant Journal,2006, 45(4): 523-539.
[23]Leprince O, Deltour R, Thorpe P C, et al.The role of free radicals and radical processing systems in loss of desiccation tolerance in germinating maize (Zea mays L.)[J].New Phytologist, 2010,116(4): 573-580.
[24]Leprince O, Harren F J M, Buitink J, et al.Metabolic dysfunction and unabated respiration precede the loss of membrane integrity during dehydration of germinating radicles[J].Plant Physiology,2000, 122(2): 597-608.
[25]Walters C, Pammenter N W, Berjak P, et al.Desiccation damage,accelerated ageing and respiration in desiccation tolerant and sensitive seeds[J].Seed Science Research, 2001, 11(2):135-148.
[26]Fujita Y, Yoshida T, Yamaguchishinozaki K.Pivotal role of theAREB/ABF-SnRK2pathway inABRE-mediated transcription in response to osmotic stress in plants[J].Physiologia Plantarum,2013, 147(1): 15.
[27]Urao T, Katagiri T, Mizoguchi T, et al.Two genes that encodeCa-dependent protein kinases are induced by drought and highsalt stresses inArabidopsis thaliana[J].Molecular Genetics and Genomics, 1994, 244(4): 331-340.
[28]Yang L, Li W, Jiang S, et al.Group 5 LEA protein,ZmLEA5C,enhance tolerance to osmotic and low temperature stresses in transgenic tobacco and yeast[J].Plant Physiology & Biochemistry,2014, 84:22.
[29]Liu X, Liu S, Wu J, et al.Overexpression of Arachis hypogaeaNAC3in tobacco enhances dehydration and drought tolerance by increasing superoxide scavenging[J].Plant Physiology &Biochemistry, 2013, 70(1):354-359.
[30]Chen Guoxiong, Takao Komatsud, Ma Jianfeng et al.An ATP-binding cassette subfamily G full transporter is essential for the retention of leaf water in both wild barley and rice[J].Proceedings of the National Academy of Sciences, 2011, 108(30): 12354–12359.
[31]Karolina M.Jarzyniak, Micha Jasin ski.Membrane transporters and drought resistance – a complex issue[J].Frontiers in Plant Science, 2014, 5: e687.
[32]刘国顺.烟草栽培学[M].北京:中国农业出版社, 2003: 221-222.LIU Guoshun.Tobacco Cultivation[M].Beijing: China Agriculture Press, 2003: 221-222.
[33]赵阳,王树声,张亚丽,等.增加烟草一级和二级侧根是抵御干旱的生理机制[J].植物营养与肥料学报,2017,23(2): 548-555.ZHAO Yang, WANG Shusheng, ZHANG Yali, et al.Role of increasing first-and second-order lateral roots of tobacco for drought tolerance[J].Journal of Plant Nutrition and Fertilizer, 2017,32(2): 548-555.
Effects of stalk positions and natural dehydration after priming on water retention capacity of fl ue-cured tobacco leaves
ZHANG Xiaoquan1, XU Zhiwen1, KAN Hongying1, ZHANG Lin1, ZHANG Yunyun1, GUO Chuanbin2, YANG Lijun2, XIA Zongliang3*
1 College of Tobacco Sciences, Henan Agricultural University, Zhengzhou 450002, China;
2 Henan Zhumadian Municipal Tobacco Company, Zhumadian 463000, Henan, China;
3 College of Life Sciences, Henan Agricultural University, Zhengzhou 450002, China
In order to elucidate the effect of stalk positions and natural dehydration after priming on water retention capacity of fl ue-cured tobacco leaves, evaluation index of drought resistance of tobacco leaves was investigated.Effects of different stalk positions and natural dehydration after priming on leaf water loss rate, antioxidant enzyme activity, hormone and stress resistance gene expression were studied through natural dehydration method with two fl ue-cured tobacco varieties, Yuyan 6 and Nongda 202 of different drought resistance.Results showed that the water loss rate of leaves of 5 different stalk positions was higher during 0-24h, and gradually slowed down after 24h, and there was no signi fi cant difference among different stalk positions, but water loss rate of Nongda 202 was signi fi cantly higher than that of Yuyan 6.Antioxidant enzyme (SOD, POD, CAT) activity, soluble protein content, abscisic acid (ABA) content in excised leaves reached the highest value 24 hours in vitro, and Malondialdehyde (MDA) content also slowed down after 24 hours.The relative expression of four stress responsive genes (AREB, CDPK2, ERD10C, LEA5) reached the highest level after 24 hours.Physiological metabolism of excised fl ue-cured tobacco leaves was the strongest 24 hours in vitro, and the difference between the indexes of the two varieties was the greatest 24 hours in vitro.There was little relationship between water retention capacity and leaf position in excised fl ue-cured tobacco leaves, and leaf water loss 24 hours in vitro was the appropriate time to determine water retention capacity of excised tobacco leaves.
fl ue-cured tobacco;water retention capacity of leaves; antioxidant enzyme activity; stress responsive genes
张小全,许志文,阚洪赢,等.不同叶位和离体失水时间对烤烟叶片保水能力的影响[J].中国烟草学报,2017, 23(4)
河南省烟草公司驻马店市公司项目和河南省烟草公司重点项目(HYKJ201401)
张小全(1980—),博士,副教授,主要从事烟草品种改良和推广研究,Email: zxq013415@163.com
夏宗良(1973—),博士,教授,Email:xiazl08@163.com
2017-04-06;< class="emphasis_bold">网络出版日期:
日期:2017-07-18
:ZHANG Xiaoquan, XU Zhiwen, KAN Hongying, et al.Effects of stalk positions and natural dehydration after priming on water retention capacity of fl ue-cured tobacco leaves [J].Acta Tabacaria Sinica, 2017, 23(4)
*Corresponding author.Email:xiazl08@163.com
