气相色谱-质谱法检测洗涤用品中高关注物质卡拉花醛及其同分异构体
2017-09-26余建龙李春燕张子豪刘莹峰李攻科郑建国
王 晶,李 菊,余建龙,李春燕,张子豪,刘莹峰,李攻科,郑建国
(1.中山大学 化学与化学工程学院,广东 广州 510275;2.广东出入境检验检疫局,广东 广州 510623)
研究简报
气相色谱-质谱法检测洗涤用品中高关注物质卡拉花醛及其同分异构体
王 晶1,2*,李 菊2,余建龙2,李春燕2,张子豪2,刘莹峰2,李攻科1,郑建国2
(1.中山大学 化学与化学工程学院,广东 广州 510275;2.广东出入境检验检疫局,广东 广州 510623)
采用气相色谱-质谱(GC-MS)技术对洗涤用品中卡拉花醛及其同分异构体的总含量进行测定。样品以甲醇为溶剂进行超声提取,经DB-5MS(30 m×0.25 mm×0.25 μm)色谱柱分离,SCAN模式进行分析检测。通过气相色谱法确定标准溶液中卡拉花醛及其同分异构体的比例,在5~100 mg/L浓度范围内建立标准曲线。方法定量下限(S/N=10)为0.25 mg/g,加标回收率为97.4%~111.5%,相对标准偏差(RSD,n=6)为3.7%~7.2%。该方法快速简便、准确可靠,适用于洗涤用品中卡拉花醛及其同分异构体的日常分析检测。
洗涤用品;卡拉花醛;同分异构体;气相色谱-质谱
卡拉花醛是一种缩醛类香料,具有强烈的琥珀香气,能在闻香纸上留香数月,广泛应用于香水、肥皂、洗衣粉等日化产品。同时,它还具有出色的织物留香能力,广泛用于香波和织物柔顺剂等与生活息息相关的消费品中。卡拉花醛及其同分异构体具有强持久性和强生物累积性(vPvB),被欧洲化学品管理局(ECHA)于2015年6月15日列入欧盟REACH法规中第十三批高关注物质(SVHC)名单,规定卡拉花醛及其同分异构体在产品中的总含量超过0.1%时,要标明具体含量,并向ECHA通报。鉴于卡拉花醛在洗涤用品中的应用情况,因此有必要对此类产品中卡拉花醛及其同分异构体的含量进行检测。

1 实验部分
1.1 仪器与试剂
气相色谱仪7890A,配氢火焰离子化检测器(FID)(Agilent公司);气相色谱-质谱联用仪7890A(Agilent公司);AS20500A 超声波发生器(AUTO Science 公司)。
卡拉花醛购自Alligator Reagent公司和International Laboratory公司,纯度大于90%。甲醇(色谱纯)购自Tedia公司,乙腈(色谱纯)购自Fisher公司,丙酮、乙酸乙酯(分析纯)购自广州化学试剂厂。
1.2 标准工作溶液
称取卡拉花醛50 mg于50 mL容量瓶中,用甲醇定容,配制成质量浓度为1 000 mg/L的标准储备液;用甲醇将标准储备液逐级稀释,配制成质量浓度分别为5、10、20、50、100 mg/L的标准工作溶液,均置于4 ℃冰箱保存。
1.3 样品预处理
1.3.1皂类与粉类固体样品将样品粉碎至粒径小于2 mm,称取0.5 g(精确到0.1 mg)待测样品于50 mL具塞锥形瓶中,加入10 mL甲醇,超声提取30 min。将提取溶液过滤至25 mL容量瓶中,少量甲醇润洗锥形瓶后并入容量瓶中,用甲醇定容后经微孔滤膜过滤,滤液作为待测样液。
1.3.2液体类样品称取0.5 g(精确到0.1 mg)待测样品于25 mL容量瓶中,加入10 mL甲醇,超声提取30 min。用甲醇定容后经微孔滤膜过滤,滤液作为待测样液。
1.4 气相色谱条件
色谱柱:DB-5MS (30 m×0.25 mm×0.25 μm) 色谱柱;柱温:初始温度120 ℃,保持1 min;以10 ℃/min升至260 ℃,保持10 min;进样口温度:280 ℃;进样量:1 μL,分流比:不分流;载气:氦气;流速:1 mL/min;色谱-质谱接口温度:300 ℃。
1.5 质谱条件
电离源:EI;电子能量:70 eV;离子源温度:230 ℃;四极杆温度:150 ℃;溶剂延迟时间:4 min;质量扫描模式:SCAN模式。
2 结果与讨论
2.1 色谱柱的选择与卡拉花醛及其同分异构体的定量方法
本实验采用DB-5MS(30 m×0.25 mm×0.25 μm)色谱柱和INNOWAX(30 m×0.25 mm×0.25 μm)色谱柱对卡拉花醛进行分离分析。在上述色谱条件下分析得到的谱图见图1。卡拉花醛在两种色谱柱上均形成了1组多峰,质谱信息显示这组峰具有相同的定性离子(见图2),比较发现购自两家不同公司的卡拉花醛的出峰情况相同,这组峰对应的物质为卡拉花醛及其同分异构体。卡拉花醛在DB-5MS柱上能够良好分离,峰形尖锐、对称,而在INNOWAX柱上有部分峰重叠,同时由于INNOWAX柱在高温时色谱柱流失严重,基线向上偏移,噪音增大,对低浓度的卡拉花醛检测造成较大的干扰,因此选择受温度影响较小的DB-5MS柱进行分离。又考察了卡拉花醛在DB-5MS柱上分别以4 ℃/min和10 ℃/min从120 ℃升温至260 ℃的升温程序,发现两者分离情况类似,而10 ℃/min时具有合适的保留时间,因此选择10 ℃/min的升温程序。
在定量分析时,首先通过气相色谱-FID检测器对标准样品进行分析,采用面积归一化法确定标准样品中各组分之间的比例,由此确定各浓度的标准溶液中各组分的含量。然后采用气相色谱-质谱法建立标准曲线,对样品进行检测,分别计算卡拉花醛及其同分异构体的含量,最后以各组分的总和作为卡拉花醛及其同分异构体的总含量。

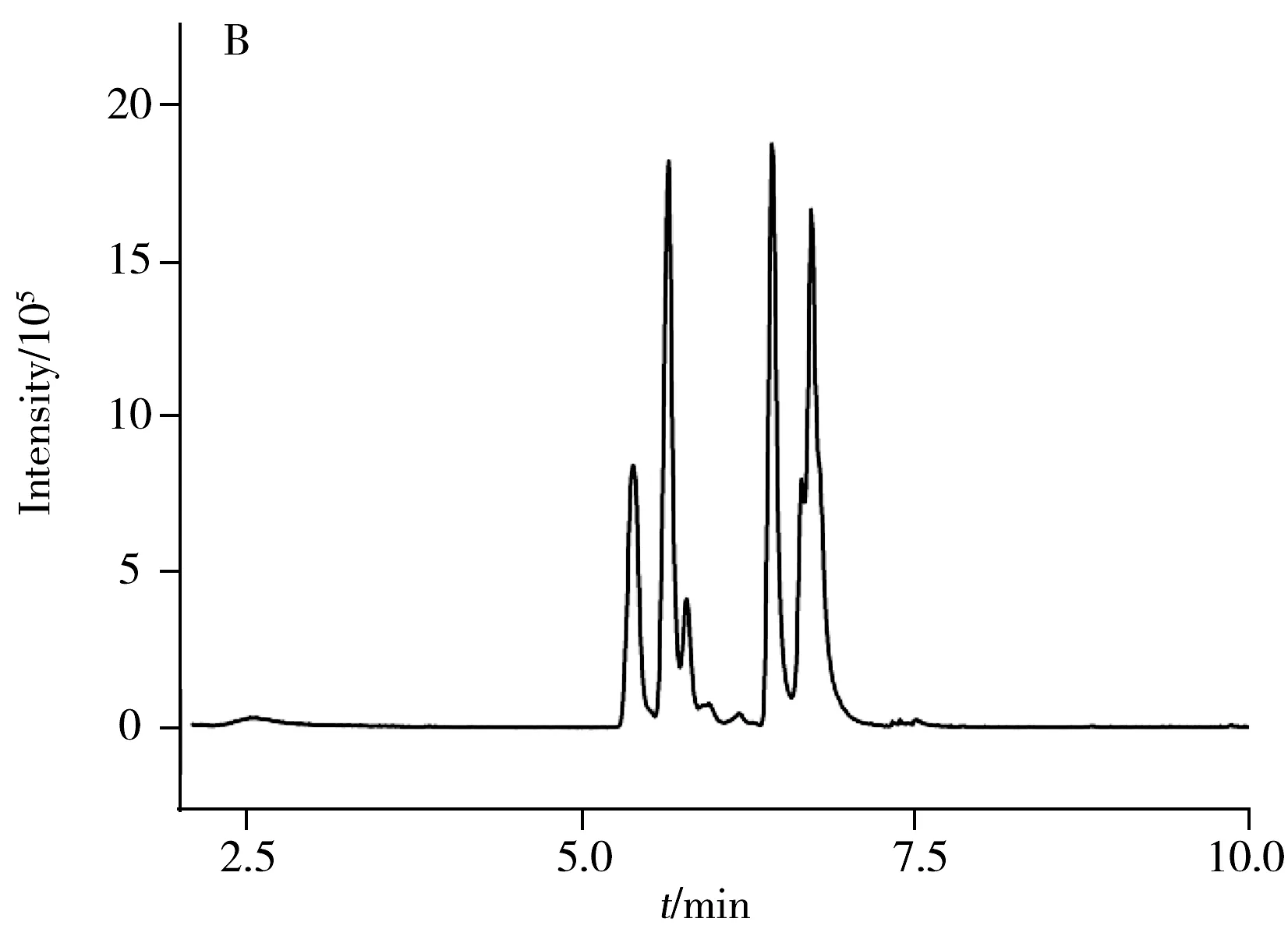
图1 卡拉花醛在DB-5MS柱(A)和INNOWAX柱(B)上的分离图Fig.1 Chromatograms of a standard solution of karanal with DB-5MS(A) and INNOWAX(B) column
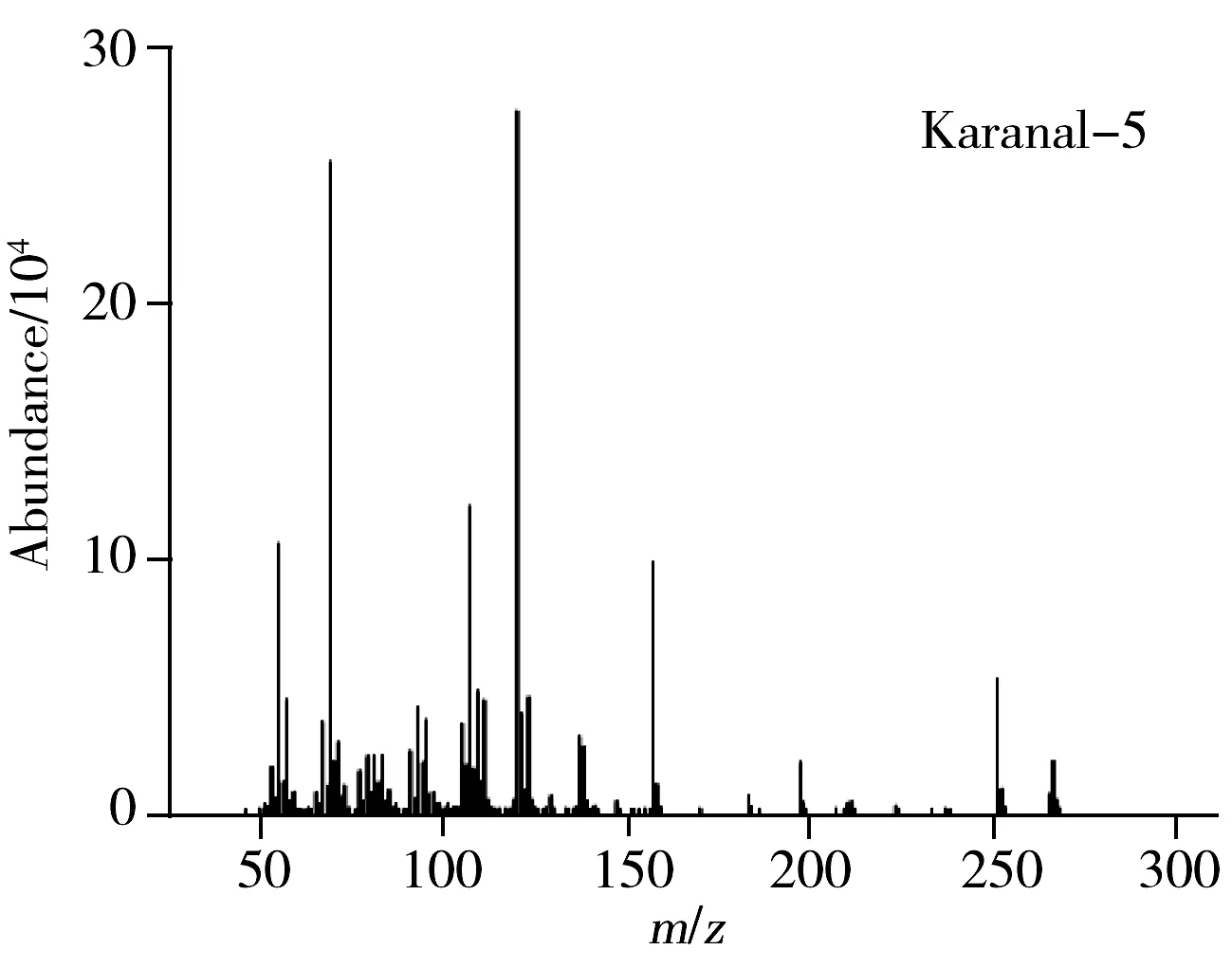
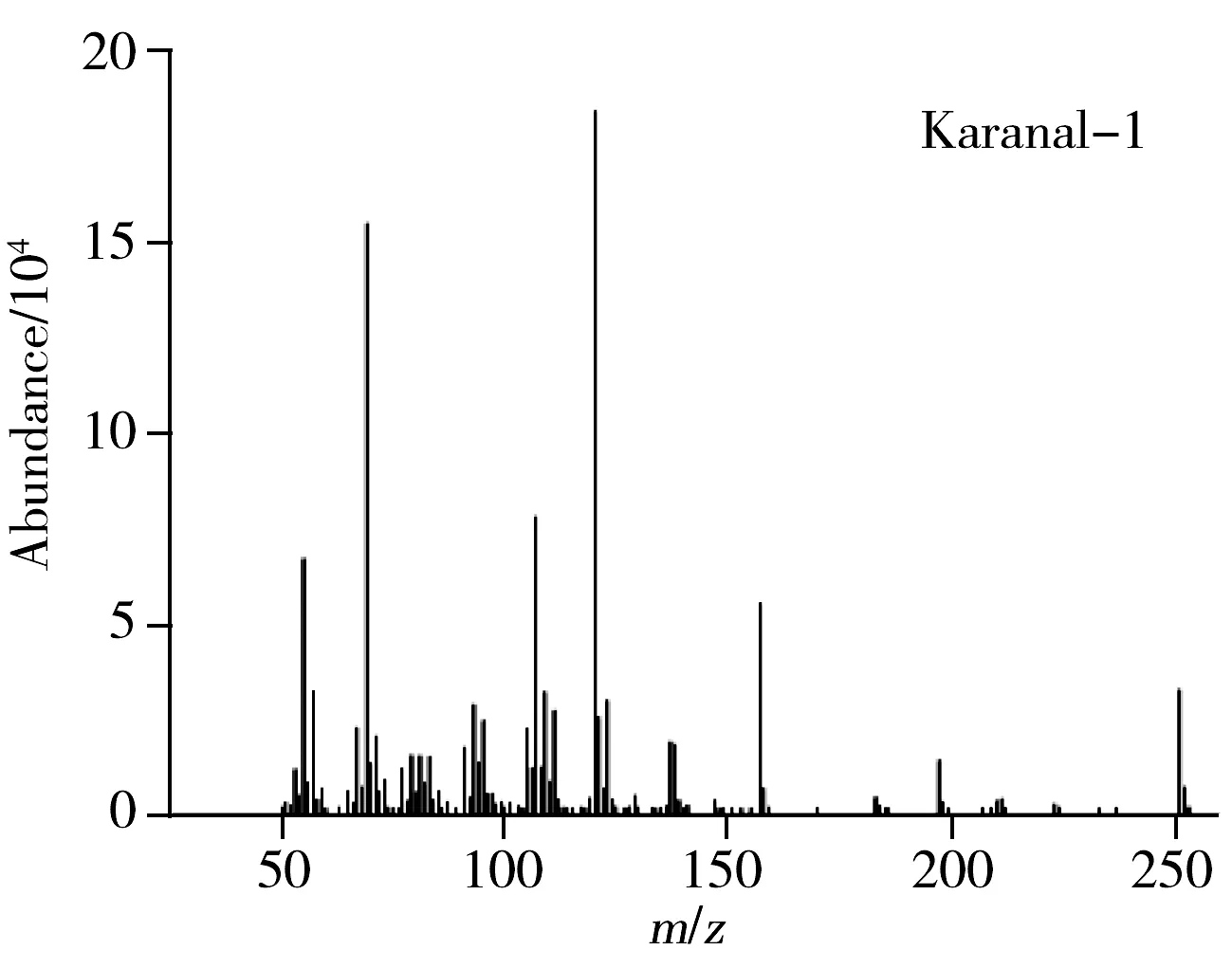

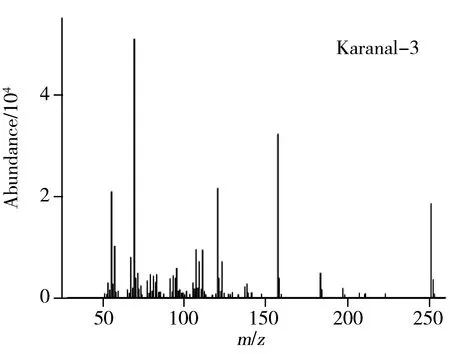
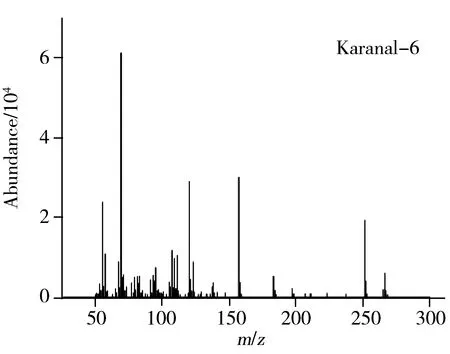
图2 卡拉花醛及其同分异构体的质谱信息Fig.2 Mass data of karanal and its isomers
2.2 提取溶剂的选择
由于卡拉花醛是极性分子,易溶于极性溶剂,因此选择极性溶剂作为提取溶剂。采用丙酮、甲醇、乙酸乙酯、乙腈等作为提取溶剂,分别对固体类和液体类样品进行加标水平为5 mg/g的回收率实验,对比了不同溶剂的萃取效率。结果表明,上述4种溶剂对固体类和液体类样品的提取效率相近,为94.7%~98.4%。最终选择提取效率最高的甲醇作为提取溶剂。
2.3 超声时间的选择
为保证充分提取,对超声提取时间(10、20、30、40 min)进行优化。结果表明,随着提取时间从10 min增至30 min,固体类和液体类样品中卡拉花醛的提取效率明显提高,但继续增加提取时间,提取效率基本达到平衡。最终选取30 min作为最佳提取时间。
2.4 线性范围、方法检出限与定量下限
经过气相色谱确定标准样品中卡拉花醛各同分异构体的比例之后,配制卡拉花醛总质量浓度为5~100 mg/L的标准工作溶液进行测试,计算每个组分的实际浓度,以各组分的质量浓度(X,mg/L)为横坐标,对应峰面积(Y)为纵坐标绘制标准曲线。结果表明,卡拉花醛总质量浓度在5~100 mg/L范围内线性关系良好,相关系数(r)为0.999 0~0.999 5。以10倍信噪比(S/N=10)作为定量下限(LOQ),用卡拉花醛及其同分异构体的总量计算定量下限为0.25 mg/g。卡拉花醛的线性方程、相关系数及定量下限见表1。
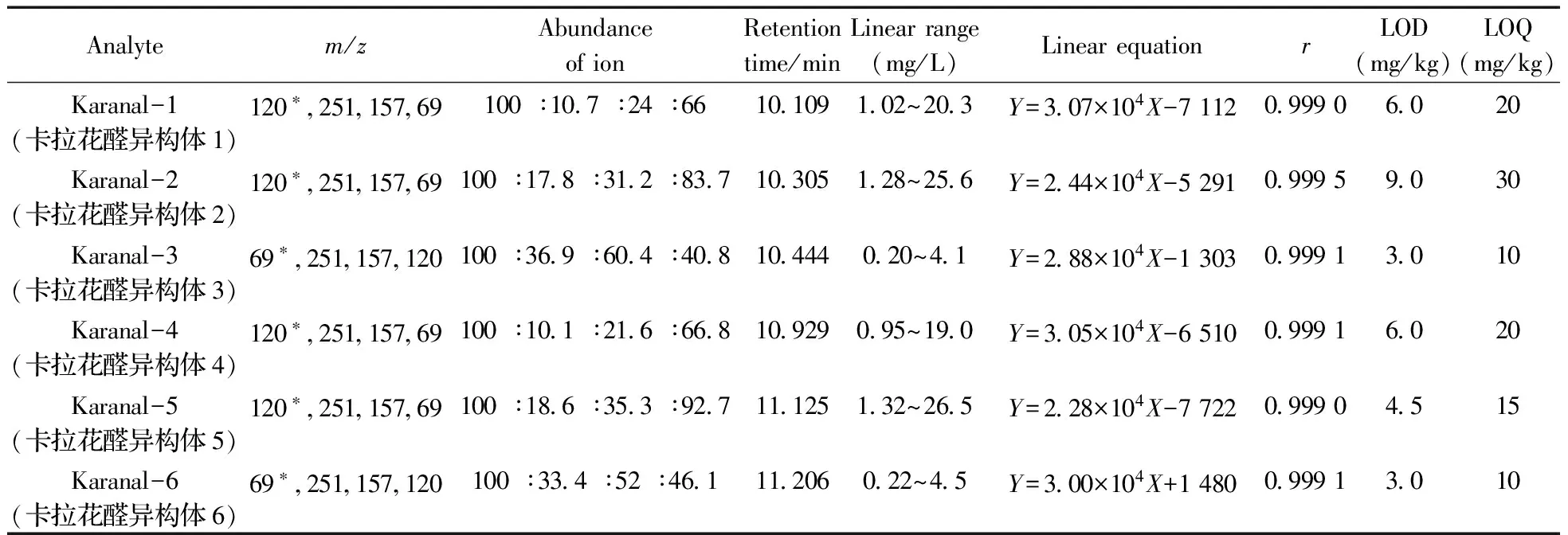
表1 卡拉花醛的离子丰度、保留时间、线性关系、相关系数及定量下限Table 1 Ion abundance,retention time,linear equation,correlation coefficients and limits of quantitation of karanal
*quantitative ion
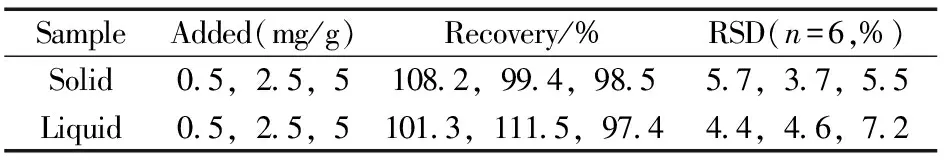
表2 卡拉花醛的回收率与相对标准偏差Table 2 Recoveries and RSDs of karanal
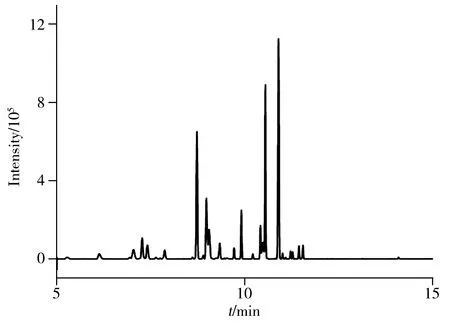
图3 某实际洗涤剂样品的GC-MS分离图Fig.3 GC-MS chromatogram of a detergent sample
2.5方法回收率、精密度及实际样品检测
选取空白洗涤剂和洗衣粉样品各1个,分别进行3个浓度水平的加标回收实验,每个加标浓度平行6次,回收率和精密度结果见表2。卡拉花醛在空白基质中的加标回收率为97.4%~111.5%,相对标准偏差(RSD,n=6)为3.7%~7.2%,表明方法具有良好的准确度和精密度。选取20个洗涤剂、洗衣粉和皂类样品进行检测,结果均未检出卡拉花醛。图3为某实际洗涤剂样品的GC-MS分离图。
3 结 论
建立了GC-MS测定洗涤用品中卡拉花醛及其同分异构体含量的方法,结合GC/FID检测器对标准样品进行分析,采用面积归一化法确定标准样品中各组分之间的比例。优化了提取条件和色谱条件,获得良好的色谱分离和合适的保留时间。该方法操作简便、精密度及准确性好,方法检出限能满足REACH法规的检测要求,可为检测洗涤用品中的卡拉花醛及其同分异构体提供准确高效的分析方法。
[1] Liu T,Wu D.Int.J.CosmeticSci.,2012,34:489-494.
[2] Li P,Guo X Y,Li H Y,Lü Q,Bai H,Zhang Q.Chin.J.Anal.Lab.(李丕,郭项雨,李海玉,吕庆,白桦,张庆.分析试验室),2014,33(12):1416-1419.
[3] Wang X J,Lin Z X,Huang T R.Chem.Reagents(王晓娟,林振兴,黄通人.化学试剂),2015,37(2):139-141,154.
[4] Roosens L,Covaci A,Neels H.Chemosphere,2007,69:1540-1547.
[5] Ye H,Lin Y H,Yang F,Liu Z C,Lu S Y,Lan J C.Chin.J.Anal.Lab.(叶洪,林永辉,杨方,刘正才,卢声宇,蓝锦昌.分析试验室),2013,32(2):64-68.
[6] Zhao T T,Li H Y,Li Z Y,Guo C H,Li X Y.Anal.Instrum. (赵田甜,李慧勇,李焯原,郭长虹,李鑫宇.分析仪器),2015,(3):1-4.
[7] Shu W C,Ding W H.J.Chromatogr.A,2005,1088:218-223.
[8] Ma H J,Ma Q,Bai H,Li J D,Meng X S,Chen Y X,Li W T.Chin.J.Anal.Lab.(马会娟,马强,白桦,李晶瑞,孟宪双,陈云霞,李文涛.分析试验室),2014,33(5):569-573.
[9] Zhang L Y.GuangdongChem.Ind.(张丽娅.广东化工),2008,35(6):124-126.
[10] Wang H J,Wang P W,Guan J C.Phys.Test.Chem.Anal.:Chem.Anal.(王惠敬,王佩维,关景才.理化检验-化学分册),2008,44(10):917-920.
[11] Yang L F.Detergent&Cosmetics(杨丽峰.日用化学品科学),2013,36(7):21-23.
[12] Wang L,Sun H X,Wu H X.Detergent&Cosmetics(王禄,孙海新,吴海霞.日用化学品科学),2013,36(12):21-23,42.
[13] Xu S H,Yuan L F,Wu B L,Lin Z X.Phys.Test.Chem.Anal.:Chem.Anal.(徐善浩,袁丽凤,邬蓓蕾,林振兴.理化检验-化学分册),2015,51(9):958-961.
[14] Li X R,Yao C Z,Yan F.TextileAuxiliaries(李晓睿,姚晨之,严方.印染助剂),2015,32(6):50-52.
[15] Guo X Y,Li H Y,Zhang Q,Lü Q,Li P,Bai H,Wang Z J,Wang W.Chem.Reagents(郭项雨,李海玉,张庆,吕庆,李丕,白桦,王志娟,王婉.化学试剂),2015,37(3):239-242.
[16] Zhao Y W,Li R,Wang H R,Yang M.Chin.J.Anal.Lab.(赵彦伟,李蕊,王海瑞,杨铭.分析试验室),2016,35(1):78-81.
[17] Mahendra S,Petzold C J,Baidoo E E,Keasling J D,Alvarez-Cohen L.Environ.Sci.Technol.,2007,41:7330-7336.
[18] Wang C,Wang X,Ji M Q,Chen W,Cai T P,Liu J.J.Chin.MassSpectrom.Soc.(王超,王星,季美琴,陈伟,蔡天培,刘娟.质谱学报),2005,26(4):254-256.
[19] Hosseiny D S S,Masoomi L,Banitaba M H,Lotfi Zadeh Zhad H R,Sadeghi O,Samiei A.Chromatographia,2012,75:371-377.
[20] Rastogi S C.Chromatographia,1990,29:441-445.
[21] Poss M,Couch T,Odufu A,McCann J,Mellon J,Melnick B,Jenke D.J.Chromatogr.Sci.,2003,41:410-417.
[22] Fuh C B,Lai M,Tsai H Y,Chang C M.J.Chromatogr.A,2005,1071:141-145.
[23] Tian Y,Chang Y W,Cao H,Cao B S,Zhou X J,Zhao Y Q,Li W.Chin.J.Anal.Lab.(田野,常宇文,曹红,曹宝森,周相娟,赵玉琪,李伟.分析试验室),2008,27:289-292.
[24] Tanabe A,Kawata K.J.AOACInt.,2008,91(2):439-444.
[25] Cui J,Yang J L,Liu X,Hong Y C,Tong L L.J.Instrum.Anal.(崔进,杨佳玲,刘祥,洪育春,佟丽丽.分析测试学报),2012,31(11):1446-1450.
[26] Lü Q,Wang Z J,Zhang Q,Li H Y,Guo X Y,Bai H.Phys.Test.Chem.Anal.:Chem.Anal.(吕庆,王志娟,张庆,李海玉,郭项雨,白桦.理化检验-化学分册),2015,51(9):1298-1301.
Determination of Karanal and Its Isomers in Detergents by Gas Chromatography-Mass Spectrometry
WANG Jing1,2*,LI Ju2,YU Jian-long2,LI Chun-yan2,ZHANG Zi-hao2,LIU Ying-feng2,LI Gong-ke1,ZHENG Jian-guo2
(1.School of Chemistry and Chemical Engineering,Sun Yat-sen University,Guangzhou 510275,China;2.Guangdong Entry-Exit Inspection and Quarantine Bureau,Guangzhou 510623,China)
A gas chromatography-mass spectrometric(GC-MS) method was developed for the determination of karanal and its isomers in detergents.Samples were extracted with methanol through ultrasonic method.The target ingredients were separated on a DB-5MS column(30 m×0.25 mm×0.25 μm) and analyzed with MS under scan mode(SCAN).Gas chromatography was used to confirm the proportion of karanal and its isomers in standard solution.The linear equations of karanal and its isomers were set up between 5 mg/L and 100 mg/L.The limits of quantitation were 0.25 mg/g.The recoveries ranged from 97.4% to 111.5%,with relative standard deviations(RSDs,n=6) of 3.7%-7.2%.This method was rapid,accurate and convenient to operate,and it was appropriate for the determination of karanal and its isomers in detergents in routine tests.
detergents;karanal;isomer;gas chromatography-mass spectrometry(GC-MS)
O657.63;O657.7
:A
:1004-4957(2017)09-1104-05
2017-03-30;
:2017-05-15
国家重点研发计划(2016YFF0203705);广东检验检疫局科技计划项目(2017GDK14);国家质监总局科技计划项目(2015IK049)
*
:王 晶,博士,研究方向:消费品检测,Tel:020-38290373,E-mail:wangj@iqtc.cn
10.3969/j.issn.1004-4957.2017.09.008
