应用iTRAQ-LC-MS/MS方法筛选大鼠DAI后脑组织差异表达蛋白质
2017-09-26张文芳
陈 庆,白 洁,张文芳
(北京市公安局法医检验鉴定中心,北京100192)
应用iTRAQ-LC-MS/MS方法筛选大鼠DAI后脑组织差异表达蛋白质
陈 庆,白 洁,张文芳
(北京市公安局法医检验鉴定中心,北京100192)
目的 应用相对和绝对定量同位素标记结合液相色谱-串联质谱法(isobaric tag for relative and absolute quantification-liquid chromatograph-mass spectrometer/mass spectrometer,iTRAQ-LC-MS/MS)筛选SD大鼠弥漫性轴索损伤(diffuse axonal injury,DAI)后脑组织差异表达的蛋白质,寻找诊断DAI的潜在生物标志物。 方法 参照Marmarou法建立DAI动物模型,分为空白对照组(n=4)、假打击组(n=4)和打击致死组(n=4),采用iTRAQ-LC-MS/MS技术对大鼠脑组织蛋白质进行检测,并对检测结果进行生物信息学分析及验证,筛选出差异表达的蛋白质。 结果 定量检测出2 016种蛋白质,生物信息学分析显示其在细胞中分布广泛、功能多样,并且参与了多种生物过程,16种蛋白质在打击致死组具有差异表达,包括1种表达上调蛋白质和15种下调蛋白质;Western印迹法验证了iTRAQ-LC-MS/MS的结果。 结论iTRAQ-LC-MS/MS的检测技术筛选出大鼠DAI后脑组织中多个差异表达的蛋白质,不仅为深入探讨DAI后轴索损伤的发病机制提供了研究方向,也为DAI的诊断提供了潜在生物标志物。
法医病理学;蛋白质组学;弥漫性轴索损伤;同位素标记;串联质谱法;色谱法,反相;大鼠
弥漫性轴索损伤(diffuse axonal injury,DAI)是指头部遭受外力作用后发生加(减)速运动所造成的弥漫性分布于脑白质、以轴索损伤为主要改变的一种原发性脑实质损伤[1],具有高植物状态生存率、高死亡率的损伤特点。由于目前DAI的具体发病机制不详,单纯依据临床症状、体征和影像学结果,漏诊率和假阳性率较高,病理诊断中DAI的特征性改变轴索收缩球(axomal retraction ball,ARB)难以早期形成[2],同时,已知的生物分子标志物存在特异性不高的缺陷[3]。因此,深入研究DAI中轴索损伤的机制,寻找诊断DAI的生物标志物,早期、准确诊断DAI是当前临床医学和法医学研究的难点和重点[3]。
相对和绝对定量同位素标记(isobaric tags for relative and absolute quantitation,iTRAQ)技术是近年来发展的一项新的体外同位素标记技术,该技术可以对1个基因组表达的全部蛋白质或1个复杂的混合体系中的所有蛋白质进行精确定量和鉴定;同时,也可以寻找多个组间差异表达的蛋白质,筛选潜在分子标志物并分析其功能。该技术已在寻找疾病潜在生物标志物、探索病理生理机制等医学领域中得到了极其广泛的应用[4,5]。本研究利用iTRAQ结合LC-MS/MS(iTRAQLC-MS/MS)的检测技术,通过对大鼠DAI后死亡组和对照组脑组织的蛋白质表达谱进行比较分析,筛选出差异表达的蛋白质,寻找诊断DAI的潜在生物标志物,为进一步研究轴索损伤的病理生理机制、临床治疗及法医学鉴定提供帮助。
1 材料与方法
1.1 实验动物
清洁级健康成年雄性SD大鼠(重庆医科大学实验动物中心提供)38只,体质量250~350 g。
1.2 主要试剂与仪器
20%硝酸银、0.2%氯化金及连苯三酚(成都市科龙化工试剂厂),胰蛋白酶(美国Promega公司),iTRAQ试剂盒(美国AB SCIEX公司),蛋白质浓度测定试剂盒(美国BIO-RAD公司);Triple TOF®5600+系统、ProteinPilot 4.0软件(美国AB SCIEX公司),Image Lab软件(美国BIO-RAD公司)。
1.3 实验方法
1.3.1 DAI模型的建立
参照Marmarou法[6]建立DAI动物模型。随机抽取30只SD大鼠,用10%水合氯醛溶液以0.35 mL/100 g腹腔注射麻醉,生效后除去头顶部毛发,碘附消毒,沿中线切开头皮、分离骨膜,将打击垫片(直径10 mm、厚3 mm)粘于颅顶的冠状缝与人字缝之间的中央部,再将大鼠俯卧位固定于致伤装置的海绵床上,然后将450 g重锤(正对打击垫片中央)提升至1.5 m高度后放松悬线,使重锤自由下落、打击大鼠头顶部的垫片,然后立即撤离海绵床,防止重锤二次打击,检查打击后SD大鼠是否有颅骨骨折,如存在则剔除该大鼠,随后取出垫片,消毒、缝合手术切口,常规进食进水。
SD大鼠在打击后即刻出现昏迷;6只SD大鼠打击后死亡,死亡率为20%,平均存活时间为(4.80± 1.48)min。24只打击存活大鼠于打击3 d后断头处死,取出脑组织,置于10%中性甲醛溶液中固定1周后,石蜡包埋,制成5.0μm厚的切片进行嗜银染色观察,验证模型建立成功与否。
1.3.2 实验分组
打击后死亡的6只大鼠按照随机抽样法抽取4只,为打击致死组;未打击的8只大鼠按照随机抽样法分为假打击组与空白对照组;假打击组4只大鼠给予1.3.1部分同样的手术和打击前准备,但不给予打击;空白对照组4只大鼠不做任何处理。
1.3.3 标本
大鼠打击死亡后立即取出脑组织,随机取3只置于无菌无酶冻存管后迅速放入液氮罐中暂时保存,用于iTRAQ-LC-MS/MS检测;取1只的脑组织置于10%中性甲醛溶液中固定1周后,石蜡包埋,制成5.0μm厚的切片进行嗜银染色观察。空白对照组和假打击组大鼠于相应操作后5 min断头处死,取出脑组织,后续操作同打击致死组。
1.3.4 嗜银染色
将切片置入37℃湿盒中,用银A(20%硝酸银)涂片2 h,后在还原剂A(连苯三酚100 mg,甲醛10 mL,80%乙醇1 200 mL)中冲洗5 min,蒸馏水冲洗3次后置入银B(20%硝酸银5 mL,40%氢氧化钠200μL,蒸馏水20 mL,氨500μL)中30 s,蒸馏水冲洗后还原剂B液(甲醛5 mL,蒸馏水95 mL)冲洗5 min,蒸馏水冲洗,用0.2%氯化金上色3 min,蒸馏水冲洗,5%硫代硫酸钠固定5 min,自来水冲洗后脱水、透明、封片。
1.3.5 脑组织蛋白质提取与标记
将冻存的各组大鼠全脑,分别放入研钵中,于冰上迅速碾磨。各组分别提取100 g脑组织匀浆用于iTRAQ-LC-MS/MS检测。向各组脑组织匀浆中加入预冷的裂解液(0.2%两性电解质,0.001%溴酚蓝,8 mol尿素,4%CHAPS,65 mmol DTT),于4℃条件下,以离心半径10 cm,12 000 r/min,离心60 min去除细胞碎片。Bradford法[4]测定各组蛋白质浓度,并提取250 mg蛋白质加入胰蛋白酶消化(50μg/mL),于37℃条件下,孵育过夜。3份上述样本中分别加入50μL异丙酚后再次离心,条件同上,分别收集管底部的酶解后样品100μL。取出iTRAQ试剂,恢复至室温,离心,将iTRAQ试剂内容物甩至管底部;在每份iTRAQ试剂中加入150μL乙醇;在3份上述样本中加入iTRAQ试剂;室温下孵育2 h,分别标记为113、114、115。
1.3.6 LC-MS/MS检测
样品经反相液相色谱柱(Gemini-NX C18;4.6 mm× 250mm)、纳米柱(Acclaim PepMap C18;75μm×150 mm,200μm×0.5 mm)分离,分离条件参照WEI等[7]的方法;质谱鉴定采用Triple TOF®5600+系统,MS扫描范围为350~1 250 m/z,一个谱图选择4个最强的母离子进行串级扫描,MS/MS扫描范围100~1 500 m/z。
1.3.7 生物信息学分析
所得质谱数据采用ProteinPilot 4.0软件检索SwissProt数据库,以质荷比(m/z)113为对照,筛选条件:置信度大于等于95%,差异倍数大于1.3或小于0.7(P<0.05),从打击致死组中筛选出与空白对照组及假打击组相比有明显差异的蛋白质。蛋白质注释和分类使用DAVID[8],其中选择基因本体论(Gene ontology,GO)的生物过程、细胞成分和分子功能注释对蛋白质进行分类。
1.3.8 Western印迹法检测各组微管相关蛋白1b(Map1b)的表达
每组取30μg蛋白质,加入5×SDS上样缓冲液煮沸10 min变性;10%聚丙烯酰胺凝胶电泳,半干式电转移至硝酸纤维素膜,5%脱脂奶粉室温封闭1 h。依次滴加兔抗大鼠Map1b一抗(1∶2 000,英国Abcam公司),4℃过夜,TBST洗膜,加入辣根过氧化物酶标记的羊抗兔IgG抗体(1∶5 000),室温孵育1 h,TBST洗膜后加入ECL试剂,暗室中曝光于X线胶片上,显影、定影。采用Image Lab软件进行图像扫描和分析,β-actin作为内参对蛋白质条带进行校正。
1.4 统计学方法
Western印迹法所得数据采用SPSS 21.0统计软件进行统计学处理。计量资料用x±s表示,组间差异采用单因素方差分析,组间多重比较采用Tukey法。检验水准α=0.05。
2 结 果
2.1 嗜银染色验证DAI动物模型成功
大鼠致伤3 d后轴索肿胀、扭曲、断裂,可见ARB形成;打击致死组轴索肿胀、扭曲、断裂,未见典型ARB形成;空白对照组与假打击组轴索走行自然、光滑,粗细基本均匀,排列紧密(图1)。说明本方法制作的DAI模型建立成功。
2.2 蛋白质谱鉴定及表达差异分析
通过iTRAQ-LC-MS/MS分析,在3组样品中定量检测到2 016种蛋白质;以空白对照组进行相对定量,共有16种蛋白质在打击致死组差异表达,包括1个表达上调蛋白和15个下调蛋白(表1)。其中,代表性差异蛋白质肌酸激酶B型(creatine kinase B-type,Ckb)的二级质谱图以及肽段的标记定量信息见图2。
2.3 蛋白质功能聚类分析
通过GO注释对蛋白质的生物过程、细胞成分和分子功能进行聚类分析,结果显示所定量检测的2 016种蛋白质在细胞中分布广泛、功能多样,并且参与了多种生物过程(图3),这提示基于iTRAQ的定量蛋白质组学技术在脑组织中的研究方法是可行的。GO分析发现,16个差异表达的蛋白质中15个表达下调的蛋白质主要参与了细胞的能量代谢、微管转运及细胞骨架的组成等过程。
2.4 Western印迹法验证iTRAQ-LC-MS/MS结果
Western印迹法结果显示,打击致死组Map1b的表达量(目的蛋白质条带与内参的灰度值之比为0.68± 0.12)较空白对照组(1.08±0.03)、假打击组(1.04± 0.10)降低。经统计学分析,打击致死组与空白对照组、假打击组之间的差异均有统计学意义(P<0.05)。
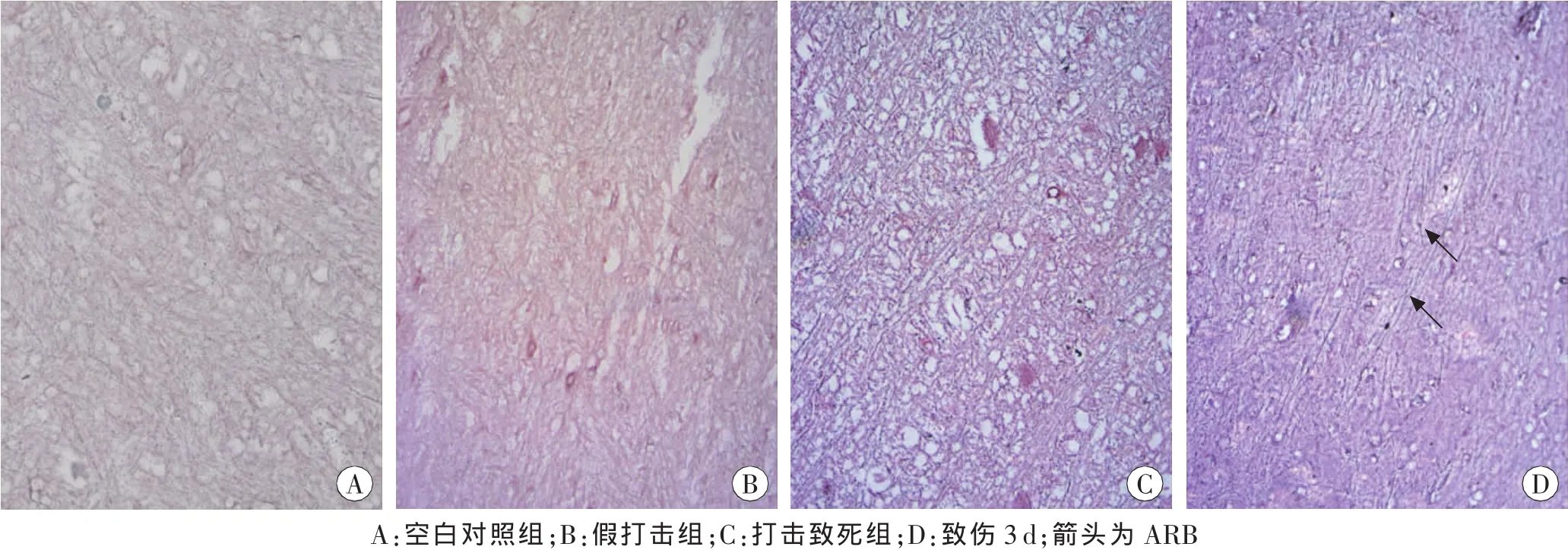
图1 各组大鼠脑组织病理切片 嗜银染色×400
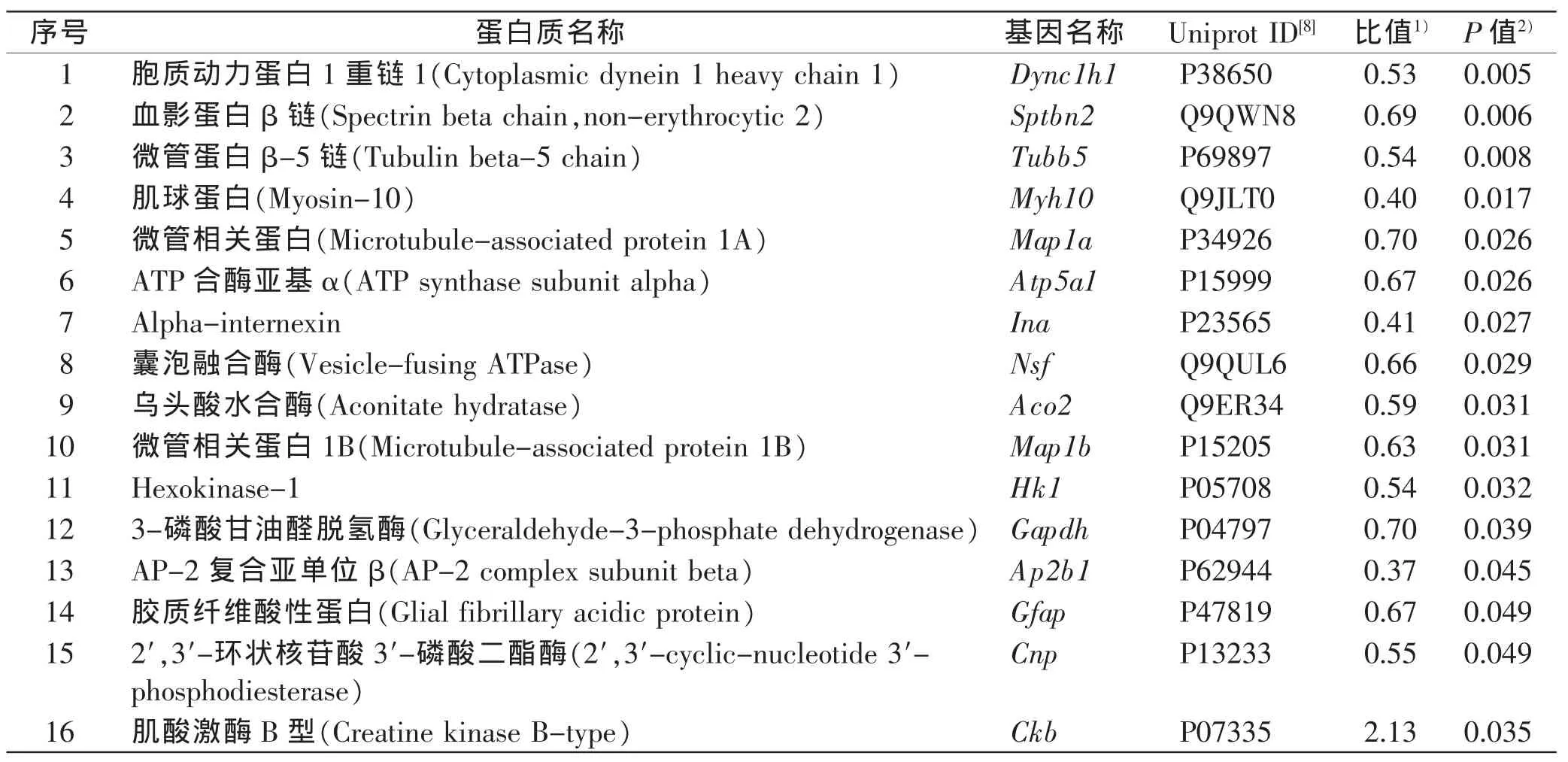
表1 打击致死组大鼠脑组织中差异表达蛋白质
图2 代表性差异蛋白质Ckb多肽质谱图
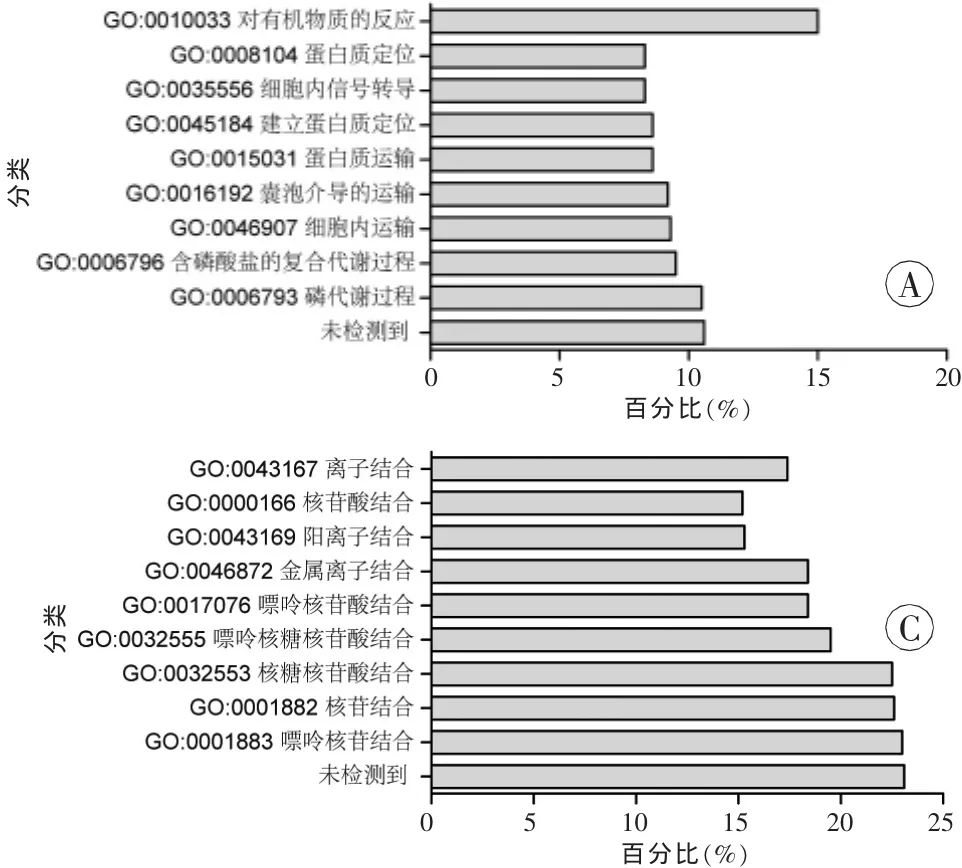
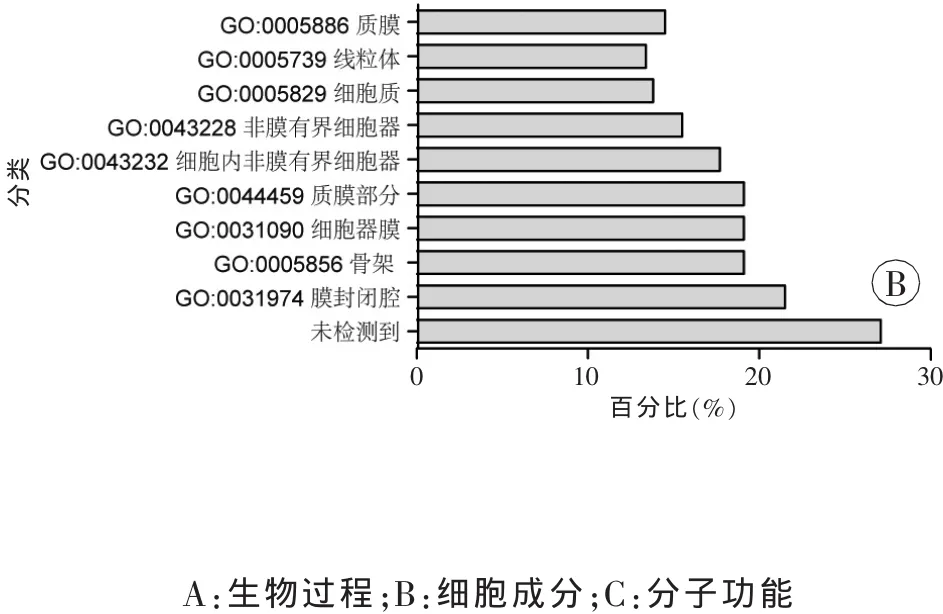
图3 iTRAQ-LC-MS/MS定量分析出的2 016种蛋白质的GO分析
3 讨 论
DAI作为一种常见的重要的创伤性脑损伤(traumatic brain injury,TBI),因其致残率、植物状态生存率和致死率高,诊断困难的特点而日益得到临床医学和法医学的重视。目前,CT和常规MRI等影像学检查对DAI的诊断能力有限(尤其是损伤早期、轻型损伤和死亡过程迅速的DAI),单纯的组织病理学方法也难以早期诊断DAI[3]。目前大多数学者认为,脑震荡实际上是一种轻型的DAI,其发生机制与DAI是一致的,只是轴索损伤程度较轻、范围较小,以轴索肿胀为主[1]。
β淀粉样前体蛋白质(β-amyloid precursor protein,β-APP)常被认为是DAI早期诊断的重要标志物[9]。β-APP是一种快速顺轴浆运输蛋白质,可在轴索损伤后快速聚集,最早可在伤后0.5 h检见,但最近研究[3]发现,在缺血缺氧性脑损伤、创伤性脑水肿、脑疝等亦可引起轴索损伤的疾病或病理改变中,β-APP也会聚集,从而难与DAI相鉴别,因此,应用β-APP诊断DAI时需谨慎以免误诊。其他生物标志物,如相对分子质量为145 000的血影蛋白裂解产物(spectrin breakdown products,SBDP)、tau、髓鞘碱性蛋白质(myelin basic protein,MBP)、髓鞘少突胶质细胞糖蛋白质(myelin oligodendrocyte glycoprotein,MOG)、2′,3′环核苷酸磷酸二酯酶3′(2′,3′-cyclic nucleotide 3′phosphodiesterase,CNPase)、微管相关蛋白质(microtubule-associated protein-2,MAP-2)等在诊断DAI时也存在类似的缺陷[10]。因此,寻找诊断DAI新的生物标志物,客观准确地早期诊断DAI成为当前临床医学和法医学所要解决的难点。
iTRAQ结合液相色谱-串联质谱技术,因其灵敏度高、分离能力强、高通量、结果可靠等优势,在定量蛋白质组学中得到了广泛的应用,已成为发现生物标志物的重要途径[11]。
本研究采用iTRAQ-LC-MS/MS的检测技术,通过对大鼠DAI后死亡组和对照组脑组织的蛋白质表达谱进行比较分析,共筛选出16个差异表达的蛋白质,其中Ckb在SD大鼠DAI后死亡组的脑组织中表达明显升高,另有15个蛋白质表达下调。在16个差异表达的蛋白质中,Aco2、Myh10及Map1b等蛋白质已有相关报道[11]表明与DAI过程中轴索的损伤相关,其结果与本研究一致,这也提示iTRAQ-LC-MS/MS检测技术在DAI后脑组织中寻找差异蛋白质是可靠的。
本研究同时发现,15个表达下调的蛋白质主要参与了细胞的能量代谢、微管转运及细胞骨架的组成等过程,其中Dync1h1、Atp5a1、Hk1、Gapdh、Ckb等蛋白质主要参与能量的代谢,Sptbn2、Map1a、Ina、Tubb5等蛋白质主要参与微管转运及细胞骨架的组成,这提示DAI后细胞能量的供应不足可能是轴索损伤、断裂的另一个重要原因。
综上所述,本研究采用iTRAQ-LC-MS/MS检测技术,筛选出DAI后脑组织中多个差异表达的蛋白质,不仅为深入探讨DAI后轴索损伤的发病机制提供了新的研究方向,为临床DAI治疗靶点的确定提供了重要参考,同时,也为DAI的诊断提供了潜在生物标志物。
[1]冯华,朱刚,林江凯.颅脑创伤基础与临床[M].北京:人民军医出版社,2011.
[2]BISHT A,GARG K,AGARWAL D,et al.Histological changes in thalamus in short term survivors following traumatic brain injury:an autopsy study[J]. Neurol India,2013,61(6):599-605.
[3]OGATA M.Early diagnosis of diffuse brain damage resulting from a blunt head injury[J].Leg Med(Tokyo),2007,9(2):105-108.
[4]DATTA A,QIAN J,CHONG R,et al.Novel pathophysiological markers are revealed by iTRAQ-based quantitative clinical proteomics approach in vascular dementia[J].J Proteomics,2014,99:54-67.
[5]WANG W S,LIU X H,LIU L X,et al.Identification of proteins implicated in the development of pancreatic cancer-associated diabetes mellitus by iTRAQ-based quantitative proteomics[J].J Proteomics,2013,84:52-60.
[6]MARMAROU A,FODA M A,VAN DEN BRINK W,et al.A new model of diffuse brain injury in rats.PartⅠ:Pathophysiology and biomechanics[J].J Neurosurg,1994,80(2):291-300.
[7]WEI D,ZENG Y,XING X,et al.The proteome differences between hepatitis B virus genotype B and genotype C induced hepatocellular carcinoma revealed by iTRAQ based quantitative proteomics[J].J Proteome Res,2016,15(2):487-498.
[8]DAVID 6.8[DB/OL].[2016-10-8].http://david.abcc. ncifcrf.gov.
[9]HORTOBAGYI T,WISE S,HUNT N,et al.Traumatic axonal damage in the brain can be detected using beta-APP immunohistochemistry within 35 min after head injury to human adults[J].Neuropathol Appl Neurobiol,2007,33(2):226-237.
[10]HAYASHI T,AGO K,NAKAMAE T,et al.Two different immunostaining patterns of beta-amyloid precursor protein(APP)may distinguish traumatic from nontraumatic axonal injury[J].Int J Legal Med,2015,129(5):1085-1090.
[11]ZHANG P,ZHU S,LI Y,et al.Quantitative proteomics analysis to identify diffuse axonal injury biomarkers in rats using iTRAQ coupled LC-MS/MS[J]. J Proteomics,2016,133:93-99.
Screening of Differential Expression Proteins in Rat Brain Tissues after DAI by iTRAQ-LC-MS/MS
CHEN Qing,BAI Jie,ZHANG Wen-fang
(Forensic Medical Examination Center of Beijing Public Security Bureau,Beijing 100192,China)
Objective To screen for the differential expression proteins in brain tissues of SD rat after diffuse axonal injury(DAI)by isobaric tag for relative and absolute quantification-liquid chromatographmass spectrometer/mass spectrometer(iTRAQ-LC-MS/MS),and to explore potential biomarkers available for the diagnosis of DAI.Methods Animal models of DAI were established with the Marmarou method as reference,and the subjects were divided into blank control group(n=4),sham strike group(n=4)and fatal strike group(n=4),respectively.The proteins in rat brain tissues were detected by iTRAQ-LC-MS/MS, and bioinformatics analysis and verification were performed on the results and screened for the differential expression proteins.Results A total of 2 016 proteins were identified and quantified.The bioinformatics analysis revealed that the proteins had wide distribution and function,and participated in different biological processes.There were 16 proteins showed differential expression in fatal strike group,including one up-regulated expression protein and 15 down-regulated expression proteins.The results of iTRAQLC-MS/MS were confirmed by Western blotting method.Conclusion Multiple differential expression proteins in rat brain tissues after DAI can be screened by iTRAQ-LC-MS/MS.This not only indicates a research direction for exploring the pathogenesis of DAI,but also provides potential biomarkers available for the diagnosis of DAI.
forensic pathology;proteomics;diffuse axonal injury;isobaric labeling;tandem mass spectrometry;chromatography,reverse-phase;rats
DF795.1
A
10.3969/j.issn.1004-5619.2017.04.003
1004-5619(2017)04-0348-05
2016-10-08)
(本文编辑:邹冬华)
陈庆(1976—),男,副主任法医师,主要从事法医病理鉴定及研究;E-mail:cq7q7q7q7@163.com
