基于丙氨酸为底物的厌氧氨氧化过程研究
2017-09-25高大文哈尔滨工业大学市政环境工程学院黑龙江哈尔滨150000
徐 敏,高大文(哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150000)
基于丙氨酸为底物的厌氧氨氧化过程研究
徐 敏,高大文*(哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150000)
通过批次实验,分别研究了丙氨酸对于厌氧氨氧化过程的短期以及长期影响.研究表明,当丙氨酸为唯一底物时,无论短期还是长期培养,厌氧氨氧化过程均受到很大影响,体系内未发生氮的去除. 在缺乏电子受体 NO2--N的情况下,体系内未发生厌氧氨氧化反应,虽然丙氨酸降解率达到了86%以上,但产生的NH4+-N在体系内积累.当向丙氨酸为底物的系统中投加NH4+-N和NO2--N时,短期(7h)培养中厌氧氨氧化活性受到的影响较小.同时,2mmol/L丙氨酸在厌氧氨氧化体系中10h即可去除78%,高浓度(10mmol/L)丙氨酸在60h达到99%的去除率;长期培养过程中,浓度为2mmol/L的丙氨酸一定程度上抑制了厌氧氨氧化活性.在厌氧氨氧化与反硝化的共同作用下, TN的去除率达到57%,丙氨酸的去除率为99%左右.
丙氨酸;厌氧氨氧化;生物脱氮
厌氧氨氧化(ANAMMOX)是指在厌氧条件下通过厌氧氨氧化菌(AAOB)的作用,以 NH4+-N为电子供体,NO2--N为电子受体,将 NH4+-N和NO2--N同时转化为 N2的过程[1-3].与传统硝化-反硝化脱氮相比,具有无需外加碳源;节约成本;避免二次污染;节省供氧动力消耗;降低温室气体排放;产泥量少等优点[4-7].因此,厌氧氨氧化技术作为一种高效低耗的新型生物脱氮技术而受到人们的重视.
厌氧氨氧化工艺多被应用于高氨氮、低碳氮比的废水当中,通常认为在有机物存在下,厌氧氨氧化菌会受到一定的影响.但不含有机物的废水十分罕见,废水在通过厌氧处理后会产生小分子有机酸等代谢产物.因此近年来许多学者对小分子有机酸对厌氧氨氧化过程的影响进行了研究.Kartal等[8]发现了可以氧化丙酸盐的厌氧氨氧化菌,并命名为 Anammoxoglobus propionicus. Huang等[9]在研究中发现,厌氧氨氧化菌 J. asiatica可以在低浓度的乙酸盐(120mg/L)和丙酸盐(200mg/L)的存在下生长.Guven等[10]的研究发现,乙醇对厌氧氨氧化菌具有抑制作用.然而氨基酸作为多种废水中的厌氧产物,目前并没有相应地研究报道.
氨基酸作为蛋白质的主要组成部分,广泛地应用于食品工业、饲料工业、医药工业等,这样含氨基酸的废水大量排放浪费了有实用价值的氨基酸.并且这种废水的排放使得水体的酸度发生变化,水体自净能力降低,水中的微生物生长受到阻碍,严重污染环境[11].目前国内外对这类废水的处理方法主要有电渗析法[12-13]、资源化法
[14-15]、生物法[16]等.其中,电渗析法是利用膜的选择透过性,以电场为推动力将氨基酸与水进行分离;资源化法则是对氨基酸进行回收利用,制备农药、饲料以及缓蚀剂等,目前国内对胱氨酸生产废水的效益型资源化研究报道的最多;生物法通过好氧活性污泥法或者厌氧生物处理法进行去除[11].
因此,本研究通过批次实验,分别考察了丙氨酸作为唯一底物以及丙氨酸为底物时向体系中投加 NH4+-N、NO2--N对于厌氧氨氧化系统的影响.为厌氧氨氧化工艺在含有氨基酸废水中的实际应用提供理论基础.
1 材料与方法
1.1 试验装置
本试验短期培养以及长期培养使用的装置均为150mL的厌氧瓶.采用丁基橡胶塞进行密封,并使用瓶盖进行加固以保证其厌氧特性.接种厌氧氨氧化菌富集培养物后的厌氧瓶放置在 35℃水浴摇床中,以140r/min的转速进行避光培养.
1.2 厌氧氨氧化菌富集培养物
Ⅰ组和Ⅱ组试验所用的厌氧氨氧化菌富集培养物取自实验室稳定运行2a以上的EGSB反应器,为提高厌氧氨氧化菌的含量,保证在投加丙氨酸之前该体系为厌氧氨氧化体系,对厌氧氨氧化富集菌培养物分别进行一个月的厌氧瓶强化培养,最终两组 NO△2-/NH△4+, NO△3-/NH△4+的比值能够分别稳定在 1.32±0.05,0.17±0.02; 1.31±0.11,0.19±0.04[17].
1.3 试验用水
短期试验中的试验用水是在 2mmol/L, 5mmol/L, 10mmol/L丙氨酸存在的情况下投加了无机营养基质(表1).
通过信息化系统,将项目建设中分散在个人手中的涉及财务、采购、招标、技术、申报、批复等资料,进行统一管理,并与项目建设同步,形成电子化档案库和目录,解决项目中资料归档问题,提高项目档案管理水平。

表1 无机营养基质配方Table 1 Formula of inorganic nutrient matrix
其中,微量元素的成分:ZnSO4·7H2O 430mg/ L、MnCl2·4H2O 990mg/L、CoCl2·6H2O 240mg/L、NaSeO4·10H2O 210mg/L、CuSO4·5H2O 250mg/L、NiCl2·6H2O 190mg/L 、 H3BO414mg/L 、NaMoO4·2H2O 220mg/L.
维生素的成分:维生素 B15mg/L、维生素B25mg/L、维生素B610mg/L、维生素B120.1mg/ L、维生素H 2mg/L、对氨基苯甲酸 5mg/L、硫辛酸 5mg/L、烟酸 5mg/L、叶酸 2mg/L、泛酸5mg/L.
1.4 试验方法
短期培养试验开始前将厌氧氨氧化富集培养物放进厌氧操作台进行12h的饥饿处理[18].使用的培养基均是利用N2曝气20min除去溶解氧后的无氧基质,并且培养基的更换均是在厌氧操作台内进行.每个条件下的试验设置3组平行,试验时间根据目标物的去除效果而定,为保证系统的密闭性,取样均采用注射器进行抽取,试验结果取其平均值.根据短期影响中的效果选择2mmol/L的丙氨酸作为研究对象,其余条件与短期培养条件一致,Ⅰ组试验以24h为一个周期,进行17个周期的长期培养;Ⅱ组试验以12h为一个周期,进行35个周期的长期培养, 19周期后取出1/3的厌氧氨氧化富集培养物,在保证其余条件不变的情况下调整进水量为之前的 2/3.并通过水中含氮化合物和丙氨酸的变化评估丙氨酸对厌氧氨氧化过程的长期影响.
1.5 检测项目与分析方法
丙氨酸采用液相色谱串联质谱法测定[19]; NH4+-N采用纳氏试剂分光光度法测定; NO2--N采用 N-(1-萘基)-乙二胺光度法测定; NO3--N采用麝香草酚分光光度法测定;pH值采用德国WTW公司pH/Oxi 340i手提式多参数测试仪测定.
2 结果与讨论
2.1 丙氨酸对厌氧氨氧化过程的影响
2.1.1 丙氨酸浓度对厌氧氨氧化过程短期的影响 图 1为丙氨酸作为唯一底物时体系中NH4+-N浓度随着反应时间的变化曲线.由图1可知, 由于体系中丙氨酸的氨化作用,使得NH4+-N的浓度随着反应时间的推移而升高, 而 NO2--N和 NO3--N在体系中始终未被检测到,在整个过程中,未发生厌氧氨氧化反应.并且从图2中可以看出,随着丙氨酸浓度的提高,丙氨酸降解所需的时间增长.丙氨酸浓度为2mmol/L时,培养30h丙氨酸去除率可以达到86%,而10mmol/L丙氨酸在80h时达到99%以上的去除率.
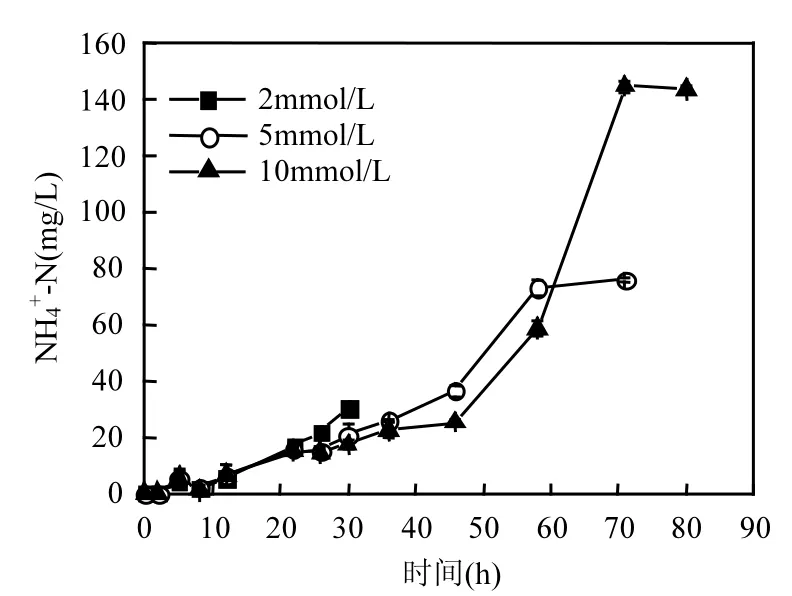
图1 丙氨酸存在下体系中NH4+-N的变化Fig.1 Changes of NH4+-N in the system of alanine
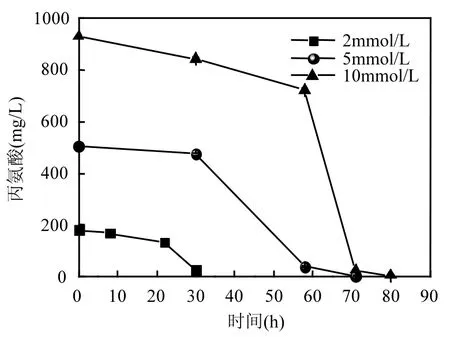
图2 丙氨酸在厌氧氨氧化体系中随反应时间的降解Fig.2 Degradation of alanine in ANAMMOX system
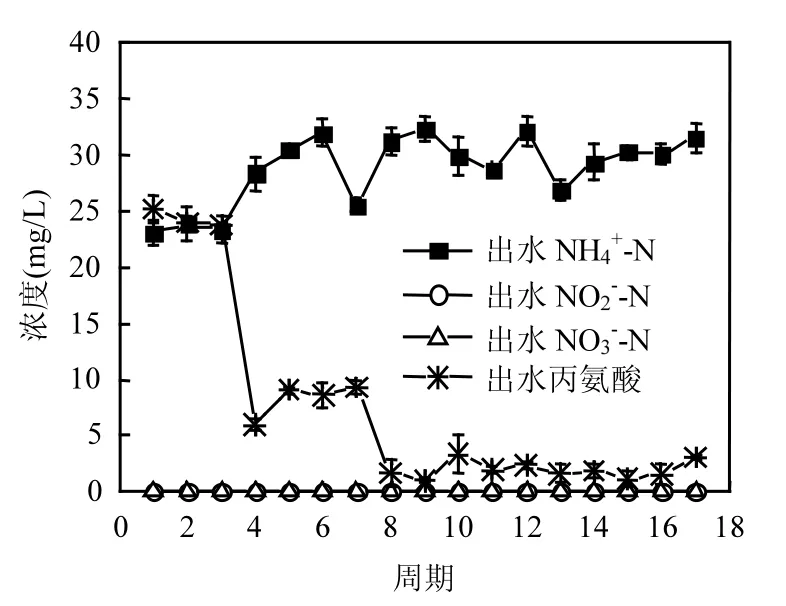
图3 丙氨酸存在下体系中出水含氮化合物的变化Fig.3 Changes of effluent nitrogen compounds in the system of alanine
2.2 丙氨酸对底物有NH4+-N、NO2--N的厌氧氨氧化过程的影响
2.2.1 丙氨酸对厌氧氨氧化富集培养物脱氮效能的短期影响 由图4可知,不同浓度的丙氨酸对于NO2--N的影响不大,在不同条件下NO2--N被利用的趋势基本相同,初始浓度为92.4mg/L的NO2--N在 8h后基本检测不出;虽然前 7h都有NO3--N的生成,但与空白对照组的变化趋势不同,含有丙氨酸的 3组试验中,NO3--N的生成量小于空白对照组NO3--N的量,并且在12h后均检测不到 NO3--N.这说明体系中存在反硝化过程利用了厌氧氨氧化过程生成的NO3--N.

图4 丙氨酸存在下体系中三氮的变化Fig.4 Changes of three nitrogen in the system of alanine
不同丙氨酸浓度条件下的 NH4+-N的出水效果在前6h表现出一样的趋势,这一结果与胡勇有[20]等的研究有一定的相似性,不同浓度的有机物在反应前期对 NH4+-N的去除效果影响较小.但随着反应时间的推移, NH4+-N在体系中积累,2mmol/L、5mmol/L、10mmol/L丙氨酸条件下的 NH4+-N出水浓度分别为 28,75, 140mg/L.通过计算可知,在以上 4个条件下氨氮的去除均在 70mg/L左右,并没有受到丙氨酸浓度的影响.这说明丙氨酸浓度在短期内并不影响厌氧氨氧化活性.这一结果与杨洋[21]等的研究结果不太相符,杨洋等通过研究有机物对厌氧氨氧化菌活性的影响试验得出,低浓度的葡萄糖对厌氧氨氧化菌活性没有影响,而高浓度的葡萄糖能够抑制厌氧氨氧化菌的活性.本试验则出现高浓度丙氨酸(178mg/L)在短期内同样对厌氧氨氧化菌的活性影响很小的结果.这可能是因为体系中反硝化菌的本底含量较少的原因.
体系中 NH4+-N发生积累的原因在于丙氨酸的降解.由图5可知,不同浓度的丙氨酸随着反应时间的推移,均发生降解.其中,丙氨酸浓度较低时去除效果较好,在反应10h后,去除率能够达到78%;但是随着丙氨酸浓度的提高,由于最初体系中异养菌本底值较低,对于丙氨酸的利用速度较慢,因此,其降解所需的时间与低浓度丙氨酸的降解时间比相对较长.5mmol/L的丙氨酸在 36h时去除率达到 97%;而丙氨酸浓度达到10mmol/L时,其在60h时能够达到99%的去除率.

图5 丙氨酸在厌氧氨氧化体系中随反应时间的降解Fig.5 Degradation of alanine in ANAMMOX system
2.2.2 丙氨酸对厌氧氨氧化富集培养物脱氮效能的长期影响 如图6所示,在长期培养的35个周期内,三氮的出水效果趋于稳定.NH4+-N的出水浓度出现2个周期的波动(由于丙氨酸的投加,厌氧氨氧化体系的环境发生改变,体系通过2个周期适应新环境)后趋于稳定,出水浓度平均为75mg/L.除去前2个波动期,NH4+-N的去除率平均为20%,NH4+-N出现大量积累,其来源于丙氨酸的降解.从图 7可知,丙氨酸的去除率保持在99%左右,降解产生大量NH4+-N.
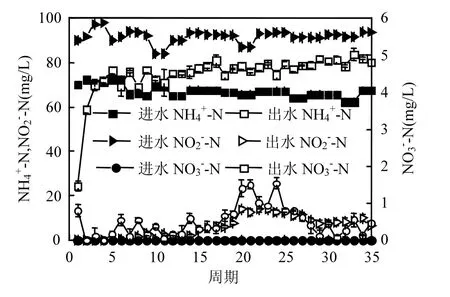
图6 丙氨酸对体系脱氮性能的影响Fig.6 Effect of alanine on nitrogen removal performance
出水NO2--N的浓度在前14个周期内都比较低,出水浓度在 3mg/L以下,去除率达到 97%,但随着体系的继续运行,在19周期后NO2--N保持较高的出水浓度,最高出水浓度可达 14mg/L,去除率降低至85%.这可能是因为在19周期后人为取出体系中部分厌氧氨氧化富集培养物进行分析,造成污泥量的减少,导致体系受到冲击,最终表现为NO2--N的出水浓度升高.同时,体系在整个运行过程中 NO3--N的含量较低,几乎检测不出. 通过计算可知 △ N O2-/△N H4+和 △ N O3-/△N H4+比值为4.06和0.02,与理论比值1.32、0.26相差很大.出现这样结果的原因可能是丙氨酸以及 NH4+-N对于厌氧氨氧化过程产生了抑制,并且一定程度上促进了反硝化过程.刘金苓等[22]研究表明,少量葡萄糖能促进体系中 NH4+-N和NO2--N的去除,但高浓度的葡萄糖则抑制了厌氧氨氧化菌的活性.浓度为2mmol/L的丙氨酸虽然在短期内没有对厌氧氨氧化菌的活性产生影响,但是这个浓度却在长期培养中抑制了厌氧氨氧化活性;当体系中NH4+-N浓度较高时,导致系统中游离氨(FA)浓度升高,也抑制了厌氧氨氧化菌的活性[23-25].Jin等[26]认为 FA 抑制浓度仅为1.7mg/L,这一定程度上解释了在本研究中NH4+-N和NO2--N均有剩余的情况下厌氧氨氧化效果没有增强的原因.
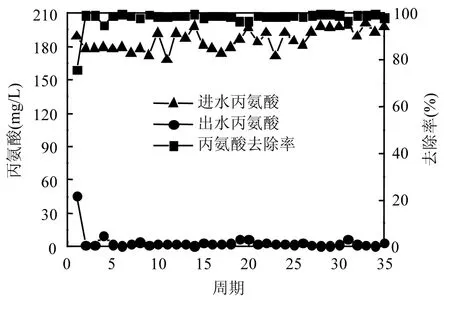
图7 厌氧氨氧化体系中丙氨酸的降解Fig.7 Degradation of alanine in ANAMMOX system
3 结论
3.1 当厌氧氨氧化体系中仅含有丙氨酸一种底物时,无论短期还是长期培养,均未发生厌氧氨氧化反应,丙氨酸的氨化作用正常进行, 生成的NH4+-N未被去除,积累在体系内.并且丙氨酸的去除效果较好,去除率均高于86%.
3.2 在以丙氨酸为底物的厌氧氨氧化体系中投加NH4+-N和NO2--N后,厌氧氨氧化活性在短期内较好,不同浓度丙氨酸条件下的脱氮效果与空白对照组均类似.并且丙氨酸的去除率也很高.但是随着长期培养,厌氧氨氧化活性受到抑制,但是出水效果比较稳定,丙氨酸去除率达到99%以上,在一定程度上与反硝化过程保持着稳定的脱氮平衡. TN的去除率平均能达到57%.
[1]Vande Caaaf A A, De Bruijn P, Robertson L A, et al. Autotrophic growth of aerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor [J]. Microbiology, 1996,142(8):2187-2196.
[2]Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobicammonium oxidizing microorganisms [J]. Appl. Microbiol. Biotechnol., 1998,50(5):589-596.
[3]曹天昊,王淑莹,苗 蕾,等.不同基质浓度下SBR进水方式对厌氧氨氧化的影响 [J]. 中国环境科学, 2015,35(8):2334-2341.
[4]王 全,张克峰,王洪波,等.厌氧氨氧化技术研究进展 [J]. 山东建筑大学学报, 2011,26(1):80-83.
[5]蒋 彬,吕锡武.生物脱氮除磷机理及技术研究 [J]. 安全与环境工程, 2005,12(3):74-77.
[6]高大文,侯国凤,陶 彧,等.厌氧氨氧化菌代谢有机物研究 [J].哈尔滨工业大学学报, 2012,44(2):89-93.
[7]于英翠,高大文,陶 彧,等.利用序批式生物膜反应器启动厌氧氨氧化研究 [J]. 中国环境科学, 2012,32(5):843-849.
[8]Kartal B, Rattray J, van Niftrik L A, et al. Candidatus "Anammoxoglobus propionicus" a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria[J]. Systematic and Applied Microbiology, 2007,30(1):39-49.
[9]Huang X L, Gao D W, Tao Y, et al. C2/C3 fatty acid stress on anammox consortia dominated by Candidatus Jettenia asiatica [J]. Chemical Engineering Journal, 2014,253:402-407.
[10]Guven D, Dapena A, Kartal B, et al. Propionate oxidation by and methanol inhibition of anaerobic ammonium-oxidizing bacteria [J]. Applied and Environmental Microbiology, 2005,71(2):1066-1071.
[11]李良红,陈 武,梅 平.氨基酸废水处理技术的研究进展 [J].氨基酸和生物资源, 2006,28(2):63-66.
[12]雷智平.双极膜电渗析技术处理氨基酸废水的研究 [D]. 太原:太原理工大学, 2003.
[13]贾晓波.膜生物反应器处理氨基酸生产废液的研究 [D]. 天津:天津大学, 2007.
[14]陆林华.利用胱氨酸废水制备工业酸洗缓蚀剂 [J]. 化工环保, 2002,22(4):241-242.
[15]张开诚.利用胱氨酸废液生产复合氨基酸营养粉作饲料添加剂[J]. 饲料研究, 2000,(7):30-31.
[16]叶 伟.厌氧生物法处理氨基酸发酵废水的实验研究 [J]. .工业水处理, 2004,24(1):11-13.
[17]丛 岩,黄晓丽,王小龙,等.厌氧氨氧化颗粒污泥的快速形成[J]. 化工学报, 2014,65(2):664-671.
[18]魏启航,王小龙,李龙伟,等.盐度对厌氧氨氧化脱氮效能的影响[J]. 工业水处理, 2016,36(4):25-29.
[19]郑 重,孙 琦,石永伟,等.高效液相色谱-串联质谱法直接定量分析植物酵素中多种氨基酸成分 [J]. 色谱, 2015,33(3): 309-313.
[20]胡勇有,梁辉强,朱静平,等.有机碳源环境下的厌氧氨氧化批式实验 [J]. 华南理工大学学报:自然科学版, 2007,35(6):710-715.
[21]杨 洋,左剑恶,沈 平,等.温度、pH值和有机物对厌氧氨氧化污泥活性的影响 [J]. 环境科学, 2006,27(4):691-695.
[22]刘金苓,钟玉鸣,谢志儒,等.厌氧氨氧化微生物在有机碳源条件下的代谢特性 [J]. 环境科学学报, 2009,29(10):2041-2047.
[23]魏思佳,于德爽,李 津,等.厌氧氨氧化与反硝化耦合脱氮除碳研究Ⅰ:COD/NH4+-N对耦合反应的影响 [J]. 中国环境科学, 2016,36(3):759-767.
[24]Schalk J, Oustad H, Kuenen J G, et al. The anaerobic oxidation of hydrazine: a novel reaction in microbial nitrogen metabolism [J]. FEMS Microbiology Letters, 1998,158(1):61-67.
[25]Fern Ndez I, Dosta J, Fajardo C, et al. Short-and long-term effects of ammonium and nitrite on the Anammox process [J]. Journal of Environmental Management, 2012,95:S170-S174.
[26]Jin R C, Yang G F, Yu J J, et al. The inhibition of the Anammox process: a review [J]. Chemical Engineering Journal, 2012,197: 67-79.
Study on ANAMMOX process with alanine as substrate.
XU Min, GAO Da-wen*(School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150000, China). China Environmental Science, 2017,37(9):3379~3384
The short-term and long-term effects of alanine on ANAMMOX process were investigated by batch experiments. The ANAMMOX process was greatly affected both in short-term and long-term culture when alanine was the sole substrate, and there was no nitrogen removal in the system. Without electron acceptor NO2--N, ANAMMOX process could not occur in the system, although the alanine removal could reach more than 86%, NH4+-N was accumulated in the system. When NH4+-N and NO2--N were added to the system with alanine as a substrate, the activity of ANAMMOX bacteria was not affected so much in the short term (7h), and 2mmol/L and 10mmol/L alanine reached 78% and 99% removal efficiencies in 10 and 60h, respectively. During the long term experiments, the activity of ANAMMOX bacteria could be inhibited by alanine with a concentration of 2mmol/L. Combined with ANAMMOX and denitrification processes, the removal efficiency of TN reached 57%, and the removal efficiency of alanine was about 99%.
alanine;ANAMMOX;biological nitrogen removal
X703.1
A
1000-6923(2017)09-3379-06
2017-03-11
黑龙江省自然科学基金重点项目(ZD201412)
* 责任作者, 教授, gaodw@hit.edu.cn
徐 敏(1993-),女,新疆塔城人,哈尔滨工业大学硕士研究生,主要从事厌氧氨氧化研究.
