柠檬苦素高效降解菌的分离筛选与鉴定
2017-09-22董晨张锦华白宝清徐蔓
董晨,张锦华,白宝清,徐蔓
(山西大学 生命科学学院,山西 太原,030006)
柠檬苦素高效降解菌的分离筛选与鉴定
董晨,张锦华*,白宝清,徐蔓
(山西大学 生命科学学院,山西 太原,030006)
筛选出在酸性环境下高效降解柠檬苦素的菌株,扩展了生物法消除柑橘果汁中的苦味物质的应用领域。从新鲜醋醅中粗筛并分离出以柠檬苦素为唯一碳源的8株菌,其相应的柠檬苦素降解率均达70%以上,其中6、7、8号菌的柠檬苦素降解率较高,分别为95.14%、98.21%和94.31%。比较3株高效降解菌的胞外蛋白、胞内蛋白和菌液的柠檬苦素降解能力,3株菌中具有降解柠檬苦素的活性蛋白酶主要分布在细胞外,属于胞外蛋白酶,胞内蛋白对柠檬苦素几乎无降解作用,其中6号菌株胞外酶的柠檬苦素降解活性最强,柠檬苦素降解率为45.57%。形态学观察及分子生物学鉴定6、7、8号菌均属于拉乌尔菌属(Raoultellasp.)。菌株6具有高效降解柠檬苦素能力,能够成为今后降解柠檬苦素微生物源的优势菌种。
柠檬苦素;降解;筛选;鉴定;酶系定位
柑橘汁生产过程中所出现的苦味问题一直备受关注[1]。柑橘类果汁中主要有柚皮苷和柠檬苦素2类产生苦味的物质[2],其中柠檬苦素是一类三萜系化合物[3],它导致很多柑橘类果汁在后期的加工中产生强烈的“后苦味”[4],并且其苦味阈值低,在水溶液中为1.0 mg/L,在果汁中约为3.4 mg/L,大约为柚皮苷的20倍[5],是柑橘果汁中最主要的苦味物质,极大影响了人们饮用果汁时的口感。
目前,脱除柠檬苦素等苦味物质的方法主要有物理法和生物法。物理脱苦法主要包括吸附脱苦、膜分离脱苦、超临界CO2脱苦、屏蔽法脱苦和添加苦味抑制剂脱苦等;生物脱苦法主要包括自然生物转化脱苦、酶法脱苦、固定化细胞脱苦和基因工程脱苦等[6]。其中酶法脱苦具有专一性强、效果好、对风味和营养成分无破坏、成本低等优点[7],是目前研究的主要趋势。文献报道中相关的脱苦酶主要有柠酸A-环内酯脱氢酶、柠碱葡萄糖苷转移酶、柠檬苦素环氧酶、柠檬苦素醇脱氢酶、反式消除酶、乙酰基裂解酶等[8],这些酶可以将柠檬苦素转化为无苦味的柠檬苦素糖苷和17-脱氢柠檬苦素类A-环内酯[9]。涉及到的微生物源如不动杆菌、球形节杆菌、球形节杆菌Ⅱ、假单胞菌和束红球菌等也可以产生柠檬苦素类脱苦酶[10-11]。BARUCH[12]等从土壤中发现的不动杆菌(Acinetobactersp.)可以将柠檬苦素转化为脱氧柠檬苦素(deoxylimonin),进一步将其转化为脱氧柠檬酸(deoxylimonicacid)。HASEGAWA等[13]研究表明,在球形节杆菌Ⅱ、束红球菌中的柠檬苦素醇脱氢酶作用下,可使柠檬苦素转化为柠檬苦素醇。但是上述这些酶最适的作用条件均为碱性,在酸性环境中的活性降低,在实际应用中常因果汁的低pH而易失活,且生产成本高,因此在工业生产中受到很大限制[14]。
本实验旨在从生物脱苦的角度出发,寻找能够在柑橘汁酸性环境中高效降解柠檬苦素的微生物资源,从而为柑橘汁的脱苦应用提供优良的微生物菌株或相关高效酶类。
1 材料与方法
1.1材料与试剂
2种新鲜醋醅,分别取自山西太原古灯调味品厂和紫林醋厂,均取醋酸发酵旺盛时期(第7天)的醋醅;柠檬苦素标准品(纯度≥98%)、柠檬苦素粗品(纯度≥70%),上海金穗生物科技有限公司;琯溪蜜柚:将购于超市的琯溪蜜柚果皮、囊衣切块,洗净后置于60 ℃烘箱内,烘干后粉碎并进行脱脂,放入密封塑料袋中,置于干燥器内保存(提取其柠檬苦素,测定其含量为0.5 mg/g)。乙腈(色谱纯),天津市彪仕奇科技有限公司;其他试剂均为分析纯。
1.2仪器与设备
SW-CJ-2FD型洁净工作台;HRHPY-300恒温培养摇床;HRSP-250H生化培养箱;BL-75型立式压力蒸汽灭菌筒;JA1203N电子天平;RE-52AA型旋转蒸发仪;SHZ-III型循环水真空泵;UV-2800型紫外可见分光光度计;GZX-9023MBE型电热鼓风干燥箱;SB25-12DTDN型超声波清洗机;FE20 pH计;SC-3614低速离心机;HC-2518R高速冷冻离心机。
1.3培养基的种类
1.3.1 选择性固体培养基(柠檬苦素含量20 mg/L)
MgSO45 g、K2HPO410 g、KCl 5 g、KNO33 g、NaCl 2 g、柚子皮 40 g(脱脂且干燥至恒重,柠檬苦素含量为0.5 mg/g)、酵母膏 1 g、琼脂 20 g、蒸馏水 1 000 mL、以HCl调至pH4.0(液体培养基中不添加琼脂)。
1.3.2 酶反应体系(柠檬苦素含量20 mg/L)
MgSO45 g、K2HPO410 g、KCl 5 g、KNO33 g、NaCl 2 g、柚子皮 40 g、蒸馏水 1 000 mL、以HCl调pH至4.0。
1.3.3 牛肉膏蛋白胨培养基
牛肉膏 3 g、蛋白胨 10 g、NaCl 5 g、琼脂 20 g、蒸馏水 1 000 mL、pH 自然(液体培养基中不加琼脂)。
1.4实验方法
1.4.1 柠檬苦素降解菌的分离
在无菌操作台下,准确称取2种醋醅各10.0 g,放入盛有100 mL无菌水的锥形瓶(250 mL)中,30 ℃、150 r/min下摇床振荡30 min后静置,吸取0.1 mL上清液涂布接种于选择性固体培养基表面,37 ℃培养24 h,肉眼观察培养长出的不同菌落,再用平板划线法分离进行纯化培养,直到获得纯菌种,4 ℃斜面保存。
1.4.2 柠檬苦素高效降解菌的筛选
种子液的制备:用接种环轻轻刮取初筛得到的菌株的菌苔,接入50 mL牛肉膏蛋白胨液体培养基中,37 ℃、150 r/min摇床培养12 h后,无菌水调节OD值为0.8。
将种子液按1%的接种量接种到50 mL选择性液体培养基中,37 ℃、150 r/min恒温振荡培养12 h,每个实验重复3次。测定实验前后培养基中柠檬苦素的含量,以不接菌的液体培养基为空白对照,计算各个菌株的柠檬苦素降解率。
1.4.3 柠檬苦素生物转化相关酶系的定位
通过对优势柠檬苦素降解菌培养后的各部分产物(胞外蛋白产物、胞内蛋白、菌液)降解能力的测定比较推断降解酶系的产生部位[17]。具体方法如下:
将优势柠檬苦素降解菌株在牛肉膏蛋白胨培养基上培养活化24 h(37 ℃),按照1.4.2中种子液的制备的步骤,分别制备其种子液,并按8%的接种量接入装有50 mL选择性液体培养基(柠檬苦素最终浓度为20 mg/L)的三角瓶(250 mL)中,37 ℃,150 r/min摇床培养12 h。
培养后的含菌体培养物分成A、B两等份,制备下列培养产物:
①活菌对照:含菌体培养物A。空白对照为在培养相同时间、未接菌的含等量柠檬苦素的培养液。
②胞外蛋白产物:含菌体培养物B经3 500 r/min离心10 min除去菌体。取上清液加入硫酸铵至饱和度为80%,4 ℃静置过夜,12 000 r/min离心10 min分离沉淀蛋白,收集沉淀物,用pH 4.0的柠檬酸缓冲液冲洗两次后,溶解并定容至5 mL即为制得的胞外蛋白产物,采用考马斯亮蓝测定其蛋白含量[18]。
③胞内蛋白:取②中离心所得菌体,用pH 4.6的柠檬酸缓冲液冲洗2次后,经冰浴研磨破碎细胞,6 000 r/min离心10 min除去细胞碎片,取上清液用pH 4.0的柠檬酸缓冲液定容至5 mL,即为胞内蛋白溶液,采用考马斯亮蓝法测定其蛋白含量[18]。
分别吸取上述制备好的菌体培养物A、胞外蛋白溶液和胞内蛋白溶液4 mL,加入50 mL含20 mg/L柠檬苦素的酶反应液中,酶作用的空白对照为相同的液体培养基中加入4 mL无菌水代替粗酶液。然后将上述体系在37 ℃,150 r/min摇床反应30 min。
培养结束后,用DMAB法[15]测定菌液A、酶作用培养液中柠檬苦素残留量,并以相应的空白对照为基准,计算柠檬苦素降解率。对比不同组分和菌培养物对照A的柠檬苦素降解率,判断各组分的降解活性,确定降解酶系的产生部位。
1.4.4 柠檬苦素高效降解菌的分类鉴定
1.4.4.1 形态学特征
将纯化后的菌株接种于牛肉膏蛋白胨固体平板培养基上,37 ℃培养12 h后观察其菌落生长情况和形态,参照文献进行革兰氏染色[10]。挑取单个菌落制成玻片,置于光学显微镜下观察各菌株的显微形态。
1.4.4.2 分子生物学鉴定
根据CTAB法[20]提取以上3株菌的总基因组DNA,采用细菌菌株的通用引物:7F:5’-CAGAGTTTGATCC-TGGCT-3’、5’-AGGAGGTGATCCAGCCGCA-3’;27F:5’-GAGAGTTTGATCCTGGCTCAG-3’、1541R、5’-AGAAAGGAGGTGATCCAGCC-3’进行扩增。
PCR反应体系:Template(基因组 DNA 20~50 ng/μL)0.5 μL,10×Buffer(with Mg2+)2.5 μL,dNTP(各2.5 mmol/L)2 μL,F(10 μmol/L)各0.5 μL,R(10 μmol/L)各0.5 μL,加双氧水至25 μL。
PCR扩增程序为:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃修复延伸10 min;最后4 ℃终止反应。扩增产物用1%的琼脂糖凝胶电泳回收,纯化后的产物测序后获得的16S rDNA序列,登录http://blast.ncbi.nlm.nih.gov/Blast.cgi网站,用Blast程序进行序列比对分析,选取与之相似性高的10株菌的16S rDNA序列,进行Clustal X比对,MEGA软件分析,采用Neighbor-Joining构建系统发育树,Bootstrap 1 000次进行稳定性验证。
1.4.5 柠檬苦素降解率的测定
1.4.5.1 柠檬苦素标准曲线绘制[15]
对二甲氨基苯甲醛(DMAB)指示剂的配制:将高氯酸240 mL、冰醋酸300 mL混合作为贮备酸液用,将1.119 g DMAB溶解于30 mL贮备酸液即得DMAB指示剂,现配现用。
精确称取5.0 mg柠檬苦素标准品,用乙腈(色谱纯)溶解并定容至25 mL,作为标准溶液备用。准确吸取0,0.25,0.5,0.75,1,1.25,1.5,2.0 mL标准溶液于试管中,分别加乙腈(色谱纯)至2.0 mL,再分别快速加入3 mL DMAB指示剂和3 mL酸母液,室温放置30 min后,于470 nm处测定吸光度,以吸光度为纵坐标,柠檬苦素标准液的质量浓度(μg/mL)为横坐标,绘制标准曲线并求得回归方程为y=0.001 9x+0.053 4,R2=0.999 4,柠檬苦素质量浓度在0~0.25 g/L范围内线性关系良好。
1.4.5.2 柠檬苦素降解率的测定[15]
[16],将1.4.2中经过接种培养后的反应体系沸水浴15 min后,于4 000 r/min离心5 min,去掉上清液,加入浓度为85%的丙酮,料液比为1∶47,超声提取32 min,提取2次,旋转蒸发至干后用乙腈定容至10 mL,从中吸取2 mL样液,分别快速加入3 mL DMAB指示剂和3 mL酸母液,室温放置30 min后,以未接入菌种、含有脱脂且干燥至恒重的柚皮粉的选择性液体培养基做参比,在470 nm处测定吸光度,并按公式(1)计算柠檬苦素降解率:
(1)
式中:m1为对照中的柠檬苦素含量;m2为降解后样品中残余柠檬苦素含量。
2 结果及讨论
2.1柠檬苦素降解菌的分离筛选
在选择性固体培养基中,柠檬苦素是唯一的碳源,通过挑取不同形态的菌落,并进行涂板,划线纯化培养,最终纯化出8株菌,分别编号为1、2、3、4、5、6、7、8。测定以上8株菌的柠檬苦素降解率,结果如图1所示。图1表明,从醋醅中纯化出的8株菌对柠檬苦素均具有一定的降解能力,相应的降解率均达到70%以上,其中降解率在70%~80%之间的有4株(1、2、3、4号菌),在90%以上的有3株(6、7、8号菌),柠檬苦素降解率分别为95.14%、98.21%、94.31%,表现出较强的降解优势,为本研究的优势柠檬苦素高效降解菌,用于后续的实验。
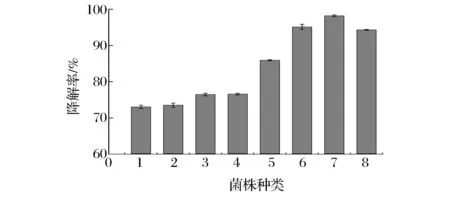
图1 不同菌株柠檬苦素的降解能力(以柠檬苦素降解率表示)Fig.1 Limonin degradation ability of different strains (Showed with limonin degradation rates)
2.2柠檬苦素降解酶系的定位

图2 菌株6、7和8培养物不同组分的蛋白质量浓度Fig.2 The protein concentration of different part of the culture of the strain 6, 7 and 8
图2为3株菌(6、7、8号菌)胞内胞外粗蛋白的质量浓度,由图中可以看出,菌株6、7和8的胞外粗提液中蛋白质质量浓度分别为(0.313 2±0.018 25)g/L、(0.192 7±0.013 88)g/L、0.1968±0.012 66 g/L,远高于3种菌株的胞内蛋白质量浓度,可能是因为实验条件下的冰浴研磨未能将菌体完全破碎,胞内蛋白未完全溶出,但可以推测培养后菌体的大多数蛋白主要分泌到细胞外。
图3为3株菌培养不同组分的柠檬苦素降解能力,3株菌的胞内粗蛋白对柠檬苦素几乎无降解作用,这与胞内蛋白质量浓度较低有关(图2),也可能在胞内粗蛋白的提取过程中部分酶活损失。含菌体培养液、胞外粗酶液加入到柠檬苦素的酶反应体系中均表现出较好的柠檬苦素降解能力,推测出具有降解或转化柠檬苦素的微生物源酶系主要分布在胞外,即在培养液中,酶反应体系中胞外酶的降解作用略低于菌液的,推测可能是由于菌液中包含的微生物细胞含有完整的各种酶系,多种酶的参与对柠檬苦素的转化和利用效率更高,所以相应的菌液作用对柠檬苦素的降解或转化能力较高;其中菌株6胞外粗酶液对柠檬苦素的降解率显著高于菌株7、8的,降解率达到45.57%(图3)。
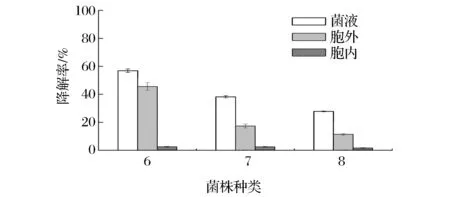
图3 菌株6、7和8培养物不同组分的柠檬苦素降解能力Fig.3 Limonin degradation ability of different part of the culture of the strain 6, 7 and 8
由上述可知,3株菌中具有降解柠檬苦素的酶系主要存在于细胞外,其中菌株6号的降解酶活性最强最强,后期对酶进行纯化并优化作用条件后, 其柠檬苦素降解能力有望进一步提高。
2.3优势柠檬苦素降解菌的分类鉴定
2.3.1 菌落形态特征观察
对3株高效降解菌进行菌落形态及显微特征的观察,对应的菌落特征和显微特征结果见表1,3株菌属于细菌,电子显微镜下观察革兰氏染色后个体形态图如图4所示,其中6、8号菌为革兰氏阴性菌G-,7号菌为革兰氏阳性菌G+,显微下3种菌均呈球状,8号菌的细胞个体较6、7号小。
2.3.2 分子生物学鉴定
菌株6、7、8经过DNA提取、PCR扩增,结果见图5,得到3条分别约为1 481 bp、1 477 bp、1 490 bp的扩增产物,将上述扩增产物测序后得到的结果提交到GenBank,采用BLAST程序进行同源性比对,获取登录号分别为KY445838、KY445839、KY445840,结果显示6、7、8三株菌与解鸟氨酸拉乌尔菌(Raoultellaornithinolytica)的基因序列同源性分别达到100%、100%和99%。

表1 菌株的菌落形态及显微特征

图4 菌株6、7、8号革兰氏染色观察Fig.4 Gram staining of strain 6, 7 and 8

菌株6、7、8的PCR扩增产物;M-Marker图5 菌株6、7、8的16S rDNA PCR扩增结果Fig.5 Electrophoresis of PCR amplification products of bacterial 16S rDNA from 6, 7 and 8
选取与6、7、8三种菌相似度较高(>99%)的10株菌株的16S rDNA基因序列分别进行Clustal X比对后构建系统发育树如图6、7、8所示,菌株6、7、8均与Raoultellaornithinolytica亲缘关系较近。
根据以上形态学特征、显微镜观察以及16S rDNA序列分析结果,将分离得到的6、7、8号菌分别鉴定为拉乌尔菌属(Raoultellasp.)。
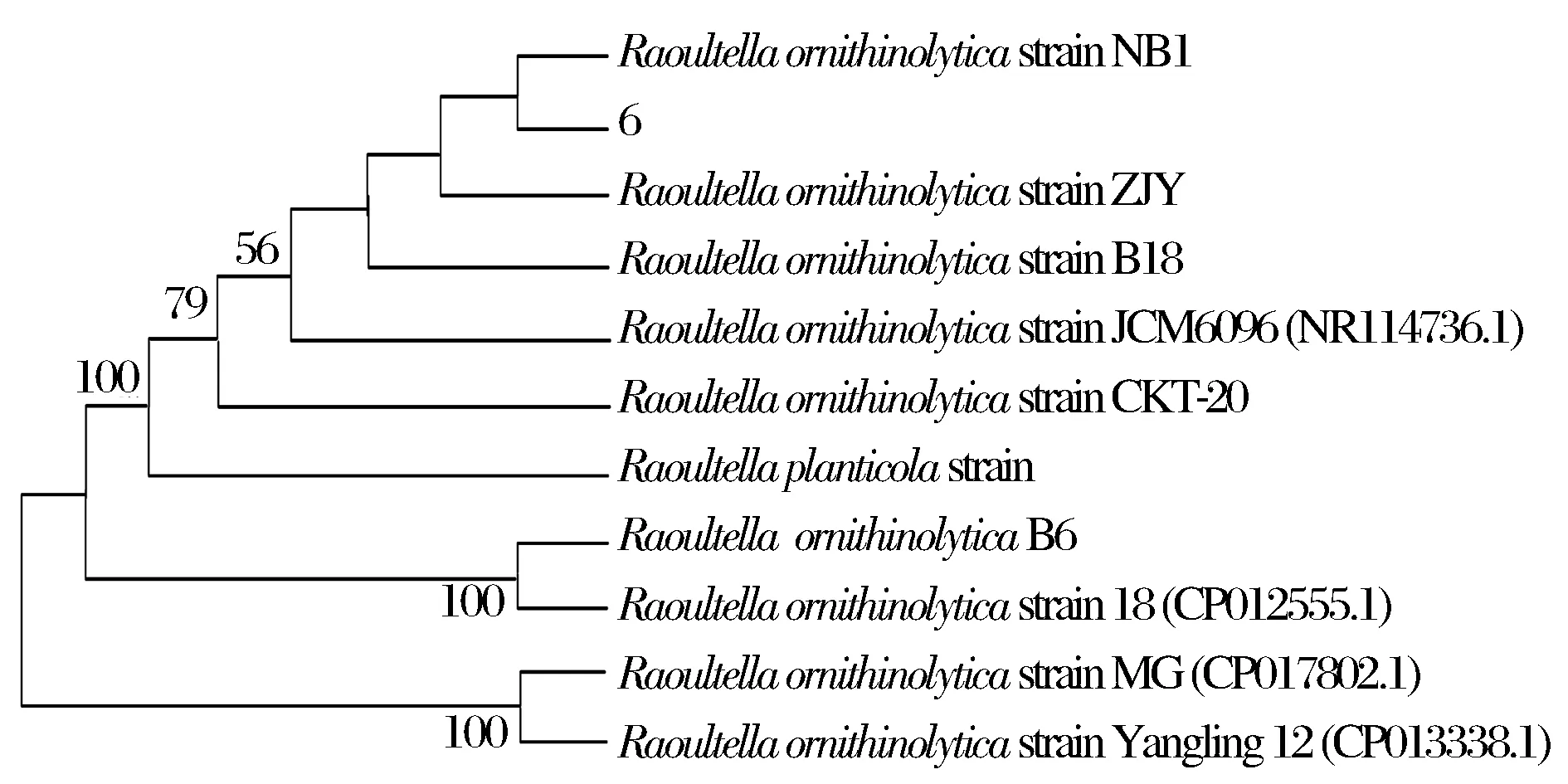
图6 菌株6的16S rDNA系统发育树(节间数字代表bootstrap支持值(50%以下未显示))Fig.6 Phylogenetic tree of strain 6 based on 16S rDNA sequence (The numbers in each node represents bootstrap support value, and the numbers lower than 50 were not shown.)

图7 菌株7的16S rDNA系统发育树(节间数字代表bootstrap支持值(50%以下未显示))Fig.7 Phylogenetic tree of strain 7 based on 16S rDNA sequence(The numbers in each node represents bootstrap support value, and the numbers lower than 50 were not shown.)

图8 菌株8的16S rDNA系统发育树(节间数字代表bootstrap支持值(50%以下未显示))Fig.8 Phylogenetic tree of Strain 8 based on 16S rDNA sequence (The numbers in each node represents boo tstrap support value, and the numbers lower than 50 were not shown.)
3 结论
本研究从新鲜醋醅中筛选分离得到以柠檬苦素为唯一碳源的8株菌, 经过复筛,其中6、7、8号菌对柠檬苦素的降解率达到95.14%、98.21%和94.31%,为优势柠檬苦素降解菌。通过比较以上3株优势高效降解菌发酵各部分产物(胞外蛋白产物、胞内蛋白、菌液)的降解能力,结果表明3株菌中具有降解柠檬苦素的活性蛋白主要存在于细胞外,属于胞外酶,胞内蛋白对柠檬苦素几乎无降解作用,其中菌株6号的酶活性最强,胞外粗酶的柠檬苦素降解率为45.57%,后期将对降解酶的作用条件进行优化,可进一步提高其降解作用。综合3种菌的形态学观察及16S rDNA序列分析结果,鉴定菌株6、7、8均属于拉乌尔菌属(Raoultellasp.)。
本研究从醋醅中筛选到的柠檬苦素降解菌经鉴定为拉乌尔菌属(Raoultellasp.),表现出自然界中柠檬苦素降解菌的存在地域多样性和种类多样性,而且粗筛得到8株细菌对柠檬苦素的降解率均较高,达到70%以上,其中菌株6、7、8对柠檬苦素的降解率达到90%以上,优于上述文献报道中的细菌的降解率,此数值虽与胡阳[11]等筛选得到一株具较高综合脱苦酶活力的曲霉菌的降解率相近,但本实验从酸性环境下筛选得到的菌株更适宜应用于低pH的柑橘果汁加工中,推测其含有的柠檬苦素降解酶系在酸性条件下也具有更好的活性和稳定性,在柑橘果汁的生物脱苦中具有很好的应用前景,后续将优化菌株(粗酶)降解条件以提高柠檬苦素降解率,并对其具有降解柠檬苦素能力的酶进行纯化使之更加适应工业生产。
参考文献
[1] 刘伟. 生物酶法脱除柑橘汁苦味的研究[D].长沙: 中南大学, 2009: 4-12. DOI: 10.7666/d.y1537044.
[2] 郑亚凤, 王琦. 葡萄柚汁树脂脱苦工艺的研究[J]. 中国农学通报, 2010, 26(24): 95-98.
[3] MUNISH P, KAUR L, MARWAHA S S. Partial purification and characterization of limonoate dehydrogenase fromRhodococcusfasciansfor the degradation of limonin[J]. Journal of Microbiology and Biotechnology, 2002, 12(4): 669-673.
[4] ROY A, SARAF S. Limonoids: overview of significant bioactive triterpenes distributed in plants kingdom[J]. Biological and Pharmaceutical Bulletin, 2006, 29(2): 19l-201. DOI: 10.1248/bpb.29.191.
[5] STINCO C M, Fernandez-Vazquez R, Hernanz D, et al. Industrial orange juice debittering: Impact on bioactive compounds and nutritional value[J]. Journal of Food Engineering, 2013, 116(1): 155-161. DOI: 10.1016/j.jfoodeng.2012.11.009.
[6] 王松林, 彭荣, 崔榕. 类柠檬苦素生物转化与脱苦研究进展[J]. 食品科学, 2015, 36(9): 1-5. DOI: 10.7506/spkx1002-6630-201509051.
[7] 李睿晓. 柚子酒的微生物脱苦技术研究[D].重庆: 西南大学, 2010: 4-8. DOI: 10.7666/d.y1671747.
[8] HASHINAGA C F. Isolation and characterization of lirnonoid glucosyltransferase from purnrnelo albedo tissue[J]. Food Chemistry, 2002, 76(4): 431-36.
[9] 纪学芳, 师俊玲, 张锦华. 柠檬苦素降解菌的分离筛选与分类鉴定[J]. 食品科学, 2011, 32(15): 177-181.
[10] SINGH S V, JAIN R K, GUPTA A K, et al. Debittering of citrus juices: a review[J]. Journal of Food Science and Technology, 2003, 40(3): 247-253.
[11] WILSON K W, CRUTEHFIELD C A.Spectrophotometric determination of limonin in orange juice[J]. Journal Agriculture of Food Chemistry, 1968, 16(1): 118-124.
[12] 刘艺文. 产柚苷酶菌株的筛选及其对柑橘汁脱苦的研究[D].长沙: 湖南农业大学, 2013: 2-4.
[13] 贺红宇. 三种脱苦方法对柠檬汁的脱苦效果的研究[D].雅安: 四川农业大学, 2013: 3-10.
[14] 梁泽建.柑桔汁脱苦技术的研究[D].雅安: 四川农业大学, 2007: 6-11.
[15] 胡阳. 蜜柚苦味物的HPLC检测、提取及脱苦菌株的筛选[D].雅安: 四川农业大学, 2007: 36-48.
[16] 刘君. 柑桔种子中类柠檬苦素提取纯化工艺研究[D].重庆: 西南大学, 2008: 11-13. DOI: 10.7666/d.y1262653.
[17] 刘永建, 郝春雷, 胡绍斌, 等. 一株聚丙烯酰胺降解菌的降解性能和机理[J]. 环境科学学报, 2008, 28(11): 2221-2227. DOI: 10.3321/j.issn:0253-2468.2008.11.010.
[18] 邓丽莉, 潘晓倩, 生吉平,等. 考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J]. 食品科学, 2012, 33(24): 185-189.
[19] 全桂静.微生物学实验指导[M]. 北京: 化学工业出版社, 2010: 5-8.
[20] LUCAS T, FRANCOIS J, BOHUON P,et al. Factors influencing mass transfer during immersion cold storage of apples in NaCl/sucrose solutions [J]. Lebensm-Wissu-Technol, 1999, 32: 327-332. DOI: 10.1006/fstl.1999.0556.
Screeningandidentificationofstrainswithhighlimonin-degradingefficiency
DONG Chen,ZHANG Jin-hua, BAI Bao-qin, XU Man
(College of Life Science, Shanxi University, Taiyuan 030006, China)
To screen the limonin-degrading strains with the high efficiency in the acidic environment, the study extended the application area of the bioanalysis to eliminate bitter substances in citrus juice. Eight limonin-degrading strains using limonin as the sole carbon source were isolated from fresh fermented grains of vinegar, and their corresponding limonin degradation rates were all above 70% in the cultured system. Among them, strains 6, 7, 8 exhibited higher degradation rates than others of 95.14%, 98.21%, 94.31% respectively. Comparing the limonin degradation ability of extracellular protein, intracellular protein, and bacterial fluid in three strains 6, 7, 8, the results indicated that enzymes having limonin degradation ability were located at extracellular position of these three strains. There was almost no limonin degradation for intracellular protein of three strains, and extracellular enzymes of strain 6 had the strongest limonin degradation ability with the limonin degradation rate of 45.57%. Based on morphological observations and molecular biology identifications, strains 6, 7, 8 were identified asRaoultellasp.. The strain 6 exhibiting the highest limonin-degrading capacity could be used as an excellent species for the degradation of limonin in the future.
limonin; degradation; screening; identification; enzyme localization
10.13995/j.cnki.11-1802/ts.014507
硕士研究生(张锦华为通讯作者,E-mail:ever840605@sxu.edu.cn)。
山西大学引进人才建设项目(113533801003)
2017-04-11,改回日期:2017-05-04
