月经周期中内源性大麻素与性激素和促性腺激素的相关性研究分析
2017-09-20崔娜王露凝王丽丽赵志明王玮郝桂敏
崔娜,王露凝,王丽丽,赵志明,王玮,郝桂敏
(河北医科大学第二医院生殖医学科,石家庄 050000)
月经周期中内源性大麻素与性激素和促性腺激素的相关性研究分析
崔娜,王露凝#,王丽丽,赵志明,王玮,郝桂敏*
(河北医科大学第二医院生殖医学科,石家庄 050000)
目的分析月经周期中不同时期正常女性血浆中N-花生四烯酸氨基乙醇(AEA)的水平变化及其与性激素和促性腺激素的相关性。方法选择2015年5~10月因输卵管梗阻或男方因素到本院生殖医学科就诊并欲行IVF助孕、月经周期和排卵正常的育龄妇女为研究对象。根据实验目的分为横断面研究组(79例)和纵向研究组(10例),检测AEA在两组女性月经周期中不同时期的变化,以及AEA与FSH、LH、E2、P之间的相关性。结果横断面研究组中早卵泡期、晚卵泡期、排卵期和黄体期AEA水平分别为(9.71±0.86)ng/ml、(10.61±1.05)ng/ml、(12.24±0.73)ng/ml和(7.46±0.71)ng/ml。排卵期AEA水平最高,黄体期最低(P<0.05)。纵向研究组4个时期AEA水平分别(8.76±0.91)ng/ml、(11.61±1.28)ng/ml、(13.85±1.18)ng/ml、(8.50±1.08)ng/ml,排卵期AEA水平最高,黄体期最低(P<0.05)。横断面研究组和纵向研究组各个时期的AEA水平比较均无显著性差异(P>0.05)。AEA与FSH、LH、E2之间存在显著的正相关(P<0.05),与P水平则无显著相关性(P=0.067)。结论正常女性血浆内AEA的浓度随月经周期的变化而变化,且与性激素和促性腺激素呈明显相关。但AEA与FSH、LH、E2、P之间的具体作用机制,有待进一步研究。
内源性大麻素系统; 花生四烯酸乙胺醇; 月经周期; 性激素; 促性腺激素
(JReprodMed2017,26(9):902-906)
内源性大麻素系统(ECS)主要分布在中枢神经系统,在女性生殖系统中通过下丘脑-垂体-卵巢轴参与生殖功能调节,近年来ECS对女性生殖功能的影响越来越被人们关注[1]。ECS影响一系列的生理和病理过程。研究发现在雌性啮齿类动物中ECS在蜕膜化、植入和胚胎发育等过程中起重要作用[2-4]。ECS主要组成部分包括内源性大麻素及其类似物、特异性的受体和与其相关的多种酶类。N-花生四烯酸氨基乙醇(AEA)作为第1种被确定的内源性大麻素样物质,1992年被首次从猪脑中提取出[5-6]。N-酰基磷脂酰乙醇胺磷脂酶D(NAPE-PLD)和脂肪酸酰胺水解酶(FAAH)通过合成和降解途径调控AEA在生物体内的含量[7]。有研究显示,此时孕酮(P)和雌二醇(E2)均参与维持生物体中内源性大麻素水平:P能提高淋巴细胞FAAH活性进而降低AEA水平[8];E2通过激活NAPE-PLD进一步抑制FAAH活性,使内皮细胞释放AEA[9-10]。目前,关于内源性大麻素物质在女性月经周期中变化的研究较为匮乏。本研究通过观察女性月经周期中4个时期AEA的变化,及AEA与FSH、LH、E2、P之间的相关性,旨在了解正常女性月经周期中AEA的变化趋势,及其与性激素和促性腺激素的关系,探讨ECS与女性生殖系统的关系,为深入研究女性不孕的机制及不孕治疗提出新方向,为相关新药研发提供理论依据。
材料与方法
一、研究对象及分组
选择2015年5~10月因输卵管梗阻或男方因素到本院生殖医学科就诊并欲行IVF助孕、月经周期和排卵正常的育龄妇女89例为研究对象。根据前瞻性研究的实验目的,在充分征求患者意愿后将实验分为两组:横断面研究组为79例受试者,按月经周期分为4组:早卵泡期组(21例)、晚卵泡期组(16例)、排卵期组(21例)、黄体期组(21例),检测月经周期中不同时期血浆中AEA的浓度变化。纵向研究组为10例志愿者,在月经周期的4个时期分别采血取血浆,检测每个人月经周期中各时期AEA、FSH、LH、E2和P的浓度变化。所有标本采集均经医学伦理会认可,研究对象均为自愿参加并签署知情同意书。
所有受试者入组标准:(1)年龄20~38岁;(2)月经周期26~32 d,可自发排卵;(3)体重指数(BMI)19~25 kg/m2;(4)基础内分泌正常;(5)近3个月未使用过性激素类药物;(6)排除免疫性不孕;(7)排除合并多囊卵巢综合征、子宫肌瘤、子宫内膜异位症等疾病;(8)非吸烟者。
横断面研究组和纵向研究组均根据正常生理月经周期中性激素和促性腺激素水平的变化将月经周期分为4个时期:早卵泡期(月经2~6 d)、晚卵泡期(月经8~12 d)、排卵期(月经13~16 d)、黄体期(月经18~23 d)。
二、标本采集和检测
1.横断面研究组:依据上个月月经天数并辅助B超监测判断月经时期。于早卵泡期、晚卵泡期、排卵期和黄体期抽取前臂静脉血5 ml。采血时间均为早8:00至10:00。超声检测:无囊肿及其它卵巢疾病。其中早卵泡期21例:卵泡直径<6 mm;晚卵泡期16例:卵泡直径≤15 mm;排卵期21例:卵泡直径>16 mm;黄体期21例:超声检测可见黄体样回声。
2.纵向研究组:方法同横断面研究组。10名志愿者同横断面一致,分别于月经周期4个时期抽取前臂静脉血10 ml检测。
采用UPLC-MS/MS分析方法测量血浆AEA水平,采用美国贝克曼库尔特公司供给的全自动微粒子化学发光系统和试剂盒测量血清中FSH、LH、E2、P水平。
三、统计学处理
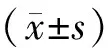
结 果
一、基本资料
横断面研究组与纵向研究组的BMI[(21.82±0.20)kg/m2vs.(21.81±0.20) kg/m2]、年龄[(29.43±0.43)岁vs.(29.57±0.57)岁]比较无显著性差异(P>0.05)。
二、不同月经时期血浆中AEA水平
横断面研究组中早卵泡期、晚卵泡期、排卵期和黄体期期AEA水平分别为(9.71±0.86)ng/ml、(10.61±1.05)ng/ml、(12.24±0.73)ng/ml和(7.46±0.71)ng/ml。排卵期AEA水平最高,显著高于早卵泡期和黄体期AEA水平(P<0.05)。黄体期的AEA水平在4个时期中处于最低,显著低于其他各时期(P<0.05)(图1)。
纵向研究组月经周期中4个时期AEA水平亦具有明显的变化趋势,从早卵泡期、晚卵泡期上升到排卵期达到最高,之后到黄体期降为最低,AEA水平分别为(8.76±0.91)ng/ml、(11.61±1.28)ng/ml、(13.85±1.18)ng/ml和(8.50±1.08)ng/ml。排卵期AEA水平显著高于早卵泡期和黄体期水平(P<0.05)(图1)。
横断面研究组和纵向研究组各个时期的AEA水平比较均无显著性差异(P>0.05)(图 1)。
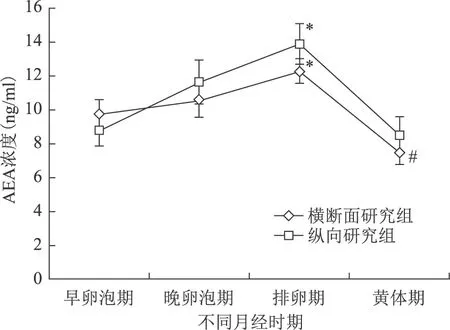
注:与同组早卵泡期、黄体期比较,*P<0.05;与横断面研究组其他时期比较,#P<0.05图1 两组不同月经时期血浆中AEA的浓度比较
三、性激素与AEA的关系
检测结果显示,两组对象中血清FSH、LH、E2、P水平在月经周期4个时期的变化符合正常月经周期中性激素和促性腺激素的变化趋势。AEA与FSH、LH、E2之间存在显著的正相关(P<0.05),与P水平则无显著相关性(P=0.067)(图2,表1)。
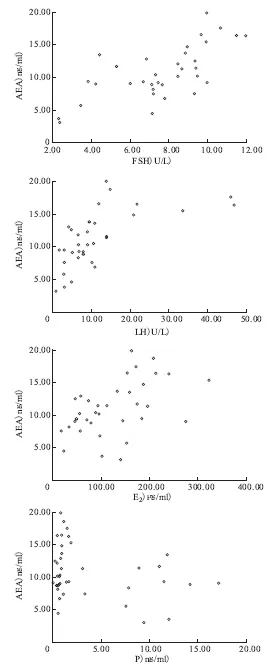
图2 AEA浓度变化随FSH、LH、E2、P浓度变化的散点图

表1 血浆中AEA浓度与 FSH、LH、E2、P浓度的相关性
注:*P<0.05
讨 论
目前,国内研究女性月经周期中内源性大麻素物质变化的相关报道尚少。国外报道雌孕激素对内源性大麻素的影响在人体中的研究也少,动物实验较多[11-12],本文研究了在正常育龄期妇女月经周期中各个时期内源性大麻素样物质AEA水平的变化趋势及其与性激素、促性腺激素变化的相关性,旨在为今后内源性大麻素在女性生殖系统疾病中的研究提供理论依据。
本研究结果显示月经周期中AEA水平会发生周期性变化,且两组中AEA的变化趋势十分相似,均是由早卵泡期上升至排卵期达到峰值,且说明个体差异可能并不影响月经周期中不同时期AEA的水平。有文献报道,AEA水平与卵泡大小相关[13-15],小卵泡液中AEA的浓度高于大卵泡液,可能是由于高浓度AEA促进卵泡发育,随着卵泡发育,卵泡液体积逐渐增大,AEA浓度减小,卵泡发育减缓,直至排卵,卵泡液释放。有研究显示,IVF/ICSI助孕的女性促排卵后,取卵日提取卵泡液检测其中AEA浓度与自然周期排卵期取出的卵泡液中AEA浓度相近[16]。本研究结果显示月经周期中排卵期血浆中AEA水平最高的结果与其相一致,说明AEA可能是由体内与卵泡发育和排卵关系密切的组织产生或者是由卵巢内卵泡局部产生,其浓度可能与排卵有关。
黄体期正是胚胎着床的“窗口期”,此时期子宫内膜容受性最佳,如果子宫内膜调节出现异常将导致子宫内膜容受性下降,可能是反复植入失败的原因之一[17]。曾有实验表明黄体期血浆中低水平AEA有利于胚胎着床[4,18-19]。本研究结果显示黄体期AEA水平明显下降,符合这一观点,提示在黄体期血浆中低AEA水平可能对胚胎成功着床和后续妊娠维持起着十分重要的作用。
Lazzarin等[20]发现在“窗口期”外周血中由单核细胞产生的AEA降解酶FAAH增多,并且FAAH的活性增强。有研究报道黄体期P水平升高,且P能增加FAAH的活性[8]。本研究结果显示在正常月经周期中AEA和P没有明显相关性,提示P可能并不是影响正常月经周期中AEA水平的主要因素。本研究结果显示血清E2水平与AEA有明显的正相关,提示在月经周期中E2可能影响AEA水平,这与之前Maccarrone等[10]提出E2刺激子宫内膜产生AEA的结论一致。El-Talatini等[21]于2009年,对IVF/ICSI-ET的患者进行前瞻性病例对照研究显示,妊娠组患者取卵日到移植日血浆AEA水平显著下降,血浆AEA水平和β-HCG、P、E2没有明显相关性;但在妊娠组患者早期(超声确认妊娠6周时抽取血清)AEA水平有所升高,血浆AEA同E2水平具有显著性相关。本研究发现育龄妇女血浆中AEA与血清FSH、LH、和E2呈正相关,提示性激素和促性腺激素的生成与代谢可能和AEA的生成与代谢之间存在一定的相互作用关系。月经周期中促性腺激素和E2对AEA水平的影响可能是分别起作用,也可能为联合起作用。本研究初步了解了内源性大麻素在人类月经周期中的变化规律,为以后进一步研究其在卵泡发育、排卵和胚胎着床等机制调控中的作用提供了参考。
综上所述,本研究结果显示正常女性血浆内AEA的浓度随月经周期的变化而变化,且与性激素和促性腺激素呈明显相关性,提示性激素和促性腺激素可能参与调节体内AEA水平。ECS与女性生殖之间具有紧密关系,本研究可能为不孕症治疗和新药研发提供理论基础,但AEA与FSH、LH、E2、P之间的具体作用机制,有待进一步研究。
[1] Scotchie JG,Savaris RF,Martin CE,et al.Endocannabinoid regulation in human endometrium across the menstrual cycle[J].Reprod Sci,2015,22:113-123.
[2] Karasu T,Marczylo TH,Maccarrone M,et al.The role of sex steroid hormones,cytokines and the endocannabinoid system in female fertility[J].Hum Reprod Update,2011,17:347-361.
[3] Fonseca BM,Correia-da-silva G,Teixeira NA.Anandamide restricts uterine stromal differentiation and is critical for complete decidualization[J].Mol Cell Endocrinol,2015,411:167-176.
[4] Melford SE,Taylor AH,Konje JC.Of mice and (wo)men:factors influencing successful implantation including endocannabinoids[J].Hum Reprod Update,2014,20:415-428.
[5] Mechoulam R,Ben-shabat S,Hanus L,et al.Identification of an endogenous 2-monoglyceride,present in canine gut,that binds to cannabinoid receptors[J].Biochem Pharmacol,1995,50:83-90.
[6] Sugiura T,Kondo S,Sukagawa A,et al.2-Arachidonoylglycerol:a possible endogenous cannabinoid receptor ligand in brain[J].Biochem Biophys Res Commun,1995,215:89-97.
[7] Taylor AH,Abbas MS,Habiba MA,et al.Histomorphometric evaluation of cannabinoid receptor and anandamide modulating enzyme expression in the human endometrium through the menstrual cycle[J].Histochem Cell Biol,2010,133:557-565.
[8] Maccarrone M,Valensise H,Bari M,et al.Relation between decreased anandamide hydrolase concentrations in human lymphocytes and miscarriage[J].Lancet,2000,255:1326-1329.
[9] Ross RA,Pertwee RG.Cannabinoid receptors and their ligands[J].Prostaglandins Leukot Essent Fatty Acids,2002,66:101-121.
[10] Maccarrone M,Bari M,Battista N,et al.Estrogen stimulates arachidonoylethanolamide release from human endothelial cells and platelet activation[J].Blood,2002,100:4040-4048.
[11] Peterson BM,Martinez LA,Meisel RL,et al.Estradiol impacts the endocannabinoid system in female rats to influence behavioral and structural responses to cocaine[J].Neuropharmacology,2016,110(Pt A):118-124.
[12] Schander JA,Correa F,Bariani MV,et al.A role for the endocannabinoid system in premature luteal regression and progesterone withdrawal in lipopolysaccharide-induced early pregnancy loss model[J].Mol Hum Reprod,2016,22:800-808.
[13] El TM,Lam P,Elson JC,et al.The endocannabinoid,anandamide,is involved in human folliculogenesis and oocyte maturation during IVF treatment[C].2nd SGI international summit in reproductive medicine-from embryo and endometrium to implantation:the translational research.Spain:Valencia,2007.
[14] Marczylo TH,Lam PM,Nallendran V,et al.A solid-phase method for the extraction and measurement of anandamide from multiple human biomatrices[J].Anal Biochem,2009,384:106-113.
[15] Gervasi MG,Marczylo TH,Lam PM,et al.Anandamide levels fluctuate in the bovine oviduct during the oestrous cycle[J/OL].PLoS One,2013,8:e72521.
[16] Schuel H,Burkman LJ,Lippes J,et al.N-Acylethanolamines in human reproductive fluids[J].Chem Phys Lipids,2002,121:211-227.
[17] 徐慧颖,李娜,张云山.胚胎植入—子宫内膜容受性是关键[J].生殖医学杂志,2014,23:198-202.
[18] Wm L,Duan E-k,Cao Y-j.Effects of anandamide on embryo implantation in the mouse[J].Life Sci,2002,71:1623-1632.
[19] Turco MY,Matsukawa K,Czernik M,et al.High levels of anandamide,an endogenous cannabinoid,block the growth of sheep preimplantation embryos by inducing apoptosis and reversible arrest of cell proliferation[J].Hum Reprod,2008,23:2331-2338.
[20] Lazzarin N,Valensise H,Bari M,et al.Fluctuations of fatty acid amide hydrolase and anandamide levels during the human ovulatory cycle[J].Gynecol Endocrinol,2004,18:212-218.
[21] El-Talatini MR,Taylor AH,Konje JC.Fluctuation in anandamide levels from ovulation to early pregnancy in in-vitro fertilization-embryo transfer women,and its hormonal regulation[J].Hum Reprod,2009,24:1989-1998.
[编辑:谷炤]
Correlationamongendocannabinoid,sexsteroidshormoneandgonadotrophininplasmaduringmenstrualcycle
CUI Na,WANG Lu-ning#,WANG Li-li,ZHAO Zhi-ming,WANG Wei,HAO Gui-min*
DepartmentofReproductiveMedicine,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000
Objective: To study plasma anandamide (AEA) level changes and the correlation among AEA,sex hormone and gonadotropin during menstrual cycle in normal women,and further explore whether AEA involves in the regulation of menstrual cycle and human fertility.
Methods: The infertile patients with childbearing age and normal ovulation and menstrual cycle who underwent IVF due to fallopian tube obstruction or male factors in the reproductive medicine center from May to October 2015 were recruited in this study.According to the investigation purpose,the patients were divided into cross-sectional study group (79 patients) and longitudinal study group (10 patients) to examine plasma AEA changes during the menstrual cycle and the correlation among AEA and FSH,LH,E2,and progesterone.
Results: In the cross-sectional study,the plasma AEA levels in the early follicular phase,late follicular phase,ovulation and luteal phase were (9.71±0.86),(10.61±1.05),(12.24±0.73) and (7.46±0.71) ng/ml respectively.The AEA level in ovulation phase was significantly higher than that in the early follicular phase and luteal phase (P<0.05).In the longitudinal study,the plasma AEA level in four phases of menstrual cycle was (8.76±0.91),(11.61±1.28),(13.85±1.18) and (8.50±1.08) ng/ml respectively.The AEA level in ovulation phase was also significantly higher than the early follicular phase and luteal phase (P<0.05).There was no significant difference in the AEA level between the cross-sectional study group and the longitudinal study group (P>0.05).There were significant positive correlations between plasma AEA level and serum LH,FSH and E2level (P<0.05),but not with progesterone level (P=0.067).
Conclusions: The plasma levels of AEA in normal women are changed during menstrual cycle,and were significantly correlated with sex hormones and gonadotropins.However,the specific interaction mechanism between AEA and FSH,LH,E2,progesterone needs to be further studied.
Endocannabinoid; Anandamide; Menstrual cycle; Sex steroid hormones; Gonadotrophin
10.3969/j.issn.1004-3845.2017.09.010
2017-02-22;
2017-04-01
河北省卫计委医学科学研究重点课题计划(指令项目)(20150236)
崔娜,女,河北人,博士,副主任医师,生殖医学专业;王露凝,女,辽宁人,硕士,医师.(#共同第一作者;*
)
