陕北白绒山羊10月龄母羊发情周期血清激素分泌规律的研究
2017-09-20朱蓉慧陈玉林杜明阳张莞煜
朱蓉慧,陈玉林,马 承,杜明阳,张莞煜,屈 雷*
(1.榆林学院,陕西省陕北绒山羊工程技术研究中心,陕西榆林 719000;2.西北农林科技大学动物科技学院,陕西杨凌 712100;3.定边县白泥井镇畜牧兽医站,陕西榆林 719000)
陕北白绒山羊10月龄母羊发情周期血清激素分泌规律的研究
朱蓉慧1,2,3,陈玉林2,马 承1,杜明阳1,张莞煜1,屈 雷1*
(1.榆林学院,陕西省陕北绒山羊工程技术研究中心,陕西榆林 719000;2.西北农林科技大学动物科技学院,陕西杨凌 712100;3.定边县白泥井镇畜牧兽医站,陕西榆林 719000)
本实验旨在分析陕北白绒山羊10月龄母羊发情周期内卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)和孕酮(P4)的含量变化规律,为研究幼龄陕北白绒山羊母羊的繁殖性能和生殖激素的调控提供理论依据。在一个发情周期内,连续20 d每天对8只10月龄陕北白绒山羊母羊进行颈静脉采血(母羊出现发情表现记为发情第0天);在发情期当天和发情间期第5天,从08:00开始,每间隔15 min连续采血3 h,分离血清,用酶联免疫测定法(ELISA)测定发情期、间情期和发情周期血清中FSH、LH、E2和P4的含量。结果表明:在发情期和间情期连续3 h内,FSH、LH、E2和P4均呈波动式分泌,FSH发情期比间情期波动频率快。LH发情期较间情期的波动频率低;在发情期血清内E2含量较间情期高(P>0.05);间情期血清内P4含量显著高于发情期(P<0.05);在测定的20 d内,FSH、LH、E2血清中浓度值差异不显著(P>0.05),而P4浓度在发情当日和发情次日低于发情间期(P<0.05)。
陕北白绒山羊;卵泡刺激素;黄体生成素;雌二醇;孕酮
陕北白绒山羊是根据陕北地区的自然经济条件及市场需求,以辽宁白绒山羊为父本,陕北黑山羊为母本,采用简单育成的杂交方式,在后代中选择理想型个体横交固定,自群繁育,经过20多年培育而形成的绒肉兼用型绒山羊新品种[1]。随着养殖方式由散养逐渐转变为舍饲喂养,陕北白绒山羊开始常年发情。在舍饲条件下,陕北白绒山羊母羊一般在4~5月龄进入初情期,5~6月龄达性成熟。在实际生产中,8月龄母羊开始配种较为常见,但结合母羊体成熟状况和生产经验,母羊10月龄进行配种更为适宜。为了解和掌握10月龄母羊在发情周期中主要生殖激素的变化规律,本实验测定其血清中的促卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)和孕酮(P4),旨在为陕北白绒山羊母羊的早期利用和高效繁殖提供理论依据。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验动物 陕北白绒山羊母羊选自榆林学院陕西省陕北绒山羊工程技术研究中心实验羊场,实行舍饲,自由采食、饮水。2014年11月初,先随机选取9月龄的12只体况中等、健康且空怀的陕北白绒山羊母羊,跟踪观察2个发情周期(38~40 d)后,剔除发情周期不正常和不规律的4只母羊,最后选择发情周期(均为19~20 d)正常,年龄处于10月龄的8只母羊作为供试羊。
1.1.2 试剂盒 测定FSH、LH、E2和P4的ELISA试剂盒购自上海邦奕生物科技有限公司(批号201601,201602)。
1.1.3 主要仪器及设备 酶标仪(iMark型,美国Bio-Rad公司),超低温冰箱(MDF-2136,日本SANYO公司),离心机(5424型,德国EPPENGOR),高速冷冻离心机(AVANTI J-E,国BECKMAN COULTER),Eppendorf移液器系列(德国Eppendorf公司)等。
1.2 实验方法
1.2.1 发情鉴定 当母羊处于发情期时,用试情公羊试情,母羊发情开始时会主动接近公羊,并强烈摆动尾部 ;发情旺期,试情公羊爬跨时母羊静立不动,外阴流少量粘液;母羊发情结束时,拒不接受公羊爬跨。据此进行母羊发情鉴定,一般母羊发情持续24~36 h后,进入发情间期。
1.2.2 血样采集 经发情鉴定,将母羊发情表现明显时,记为第0天,发情前1 d计为负第1 d。于发情开始的每天08:00—09:00采血1次,每次2 mL,连续采集至观察到下一次发情开始为止,收集记录发情期为19 d和20 d母羊的血清。另在发情期当天(第0 天)、发情间期(发情后第5天)的每天08:00开始,每15 min采血1次,连续采血3 h,每次2 mL。血样3 000 r/min离心10 min分离血清,用移液器将血清移入预先标记好的干净离心管中,放入-20℃冰箱内冷存待测。
1.2.3 激素测定 根据ELISA试剂盒使用说明,采用双抗体夹心ELISA法,用iMark型酶标仪,在每个激素所要求的波长内,测定吸光度OD值。根据标准曲线,计算样品中FSH、LH、E2和P4的血清内激素值。以血清采集时间为横坐标,血清激素浓度值为纵坐标,绘制激素不同时间内的分泌曲线图。
1.3 统计分析 采用SPSS 17.0 统计软件,ANOVA单因素方差分析统计各项指标。P<0.05表示差异显著。实验结果均以平均值±标准差表示。
2 结果与分析
2.1 发情期与间情期FSH、LH、E2和P4的含量变化规律与特点 在测定的3 h内,FSH、LH、E2和 P4在发情期和间情期均呈波动式分泌。由表1可知,发情期和间情期FSH的血清内平均浓度分别为7.71、6.91 IU/L,发情期基础浓度均高于间情期(P>0.05)。从图1可看出,在测定的3 h内,发情期和间情期FSH的浓度均出现间隔60 min的波峰,但发情期FSH波动峰比间情期更快进入下1次波动。
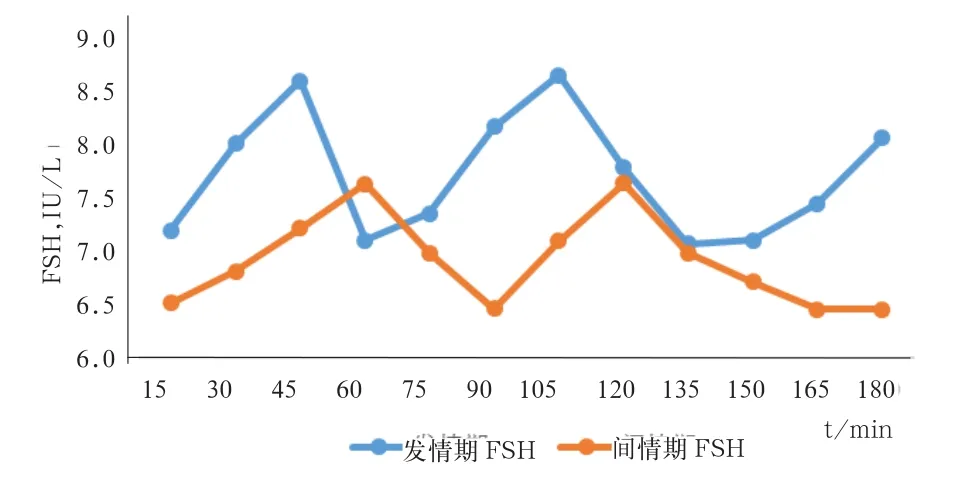
图1 发情期和间情期血清内FSH含量的变化

表1 陕北白绒山羊母羊发情期与间情期FSH、LH、E2和P4的血清浓度值
在发情期LH血清平均浓度显著高于间情期(P>0.05)。由图2可见,在测定时间内,分泌在发情期出现2个波峰,且每75 min产生1个波峰,而在间情期出现了3个波峰,每60 min产生1个波峰,表现为发情期较间情期LH的波动频率低的特点。
在发情期E2血清平均分泌浓度显著高于间情期(P>0.05),也呈波动式分泌(图3),波动峰与LH类似。但是在间情期表现2个持续60 min的波动峰之间,出现一个持续30min的小的波动峰。
间情期血清内P4含量显著高于发情期(P<0.05)。由图4可见,间情期P4分泌有波动,但没有明显的波动规律,发情期P4分泌基本没有波动,且保持较低的分泌浓度。

图 2 发情期和间情期血清内LH含量的变化

图3 发情期和间情期血清内E2含量的变化

图4 发情期和间情期血清内P4含量的变化
2.2 发情周期血清中FSH、LH、E2和P4分泌特点与规律 陕北白绒山羊10月龄母羊在20 d的发情周期内血清中FSH、LH、E2和P4含量变化趋势见图5。在发情周期内血清中FSH、LH、E2和P4均表现为波动式分泌。其中FSH、LH、E2血清中浓度值在测定的20 d内差异不显著(P>0.05),而P4浓度值在发情当日和发情次日显著低于发情间期值(P<0.05)。
FSH在1个发情周期内出现了4个分泌峰,在发情当日出现1个分泌峰,且激素浓度最大,为10.82 IU/L。另外,又于发情后第7、13、18天出现3个分泌峰,波峰值分别为10.63、10.66、10.17 IU/L。
LH、E2浓度均在发情后第0、3、10、16天出现4个分泌峰,LH的波峰值分别为922.31、948.35、925.23、918.35 pg/mL,E2的波峰值分别为14.36、14.28、13.98、14.21 ng/L。
P4在发情期激素水平较低,在发情周期第0~2天血清内P4处于发情周期内较低水平,发情当天为最低水平301.14 pmol/L。第4~18天(间情期)维持一较高水平波动(411.42~447.46 pmol/L),并且于第15天后激素浓度逐渐下降,一直到发情时降至最低水平。
3 讨 论

图5 发情周期中血清内FSH、LH、E2、P4含量的变化趋势
3.1 关于陕北白绒山羊的发情周期 陕北白绒山羊母羊的发情周期一般为18~22 d,发情持续期为30~60 h,群体中个体之间发情表现差异较大,有的安静发情,有的发情表现明显[2]。通过对陕北白绒山羊母羊试验羊群2个发情周期的观察发现,初情期陕北白绒山羊母羊的发情周期为19~20 d(平均19.67 d),发情持续期为26~46 h(平均32 h)。由此可以认为,本试验羊群的组成是合理且具有代表性的。
3.2 关于发情期、间情期FSH、LH、E2、P4的波动分泌特点与种间差异 哺乳动物卵泡发育是一个高度协调且复杂的过程,只有同时具备高振幅和高频率才能使LH浓度升高到促进卵泡成熟和排卵的水平[3]。郑亦辉等[4]认为多胎型湖羊血浆内FSH、LH的基础浓度和峰值均显著高于单胎型的美利奴羊。陕北白绒山羊10月龄母羊血清内FSH、LH发情期基础浓度均比间情期高,这与莱芜黑山羊[5]和济宁青山羊[6-7]相同。血清内FSH波动频率在发情期较间情期高,但LH相反。本实验单胎型的陕北白绒山羊10月龄母羊在发情期FSH和LH的分泌峰值却显著高于多胎型济宁青山羊[6-7],造成这一差异是由于种间差异、年龄、环境因素、试验方法的不同还是试验中血样的采集方式不同造成,尚待进一步研究。
陕北白绒山羊10月龄母羊与在发情期和间情期E2和P4均呈波动式分泌,此规律与莱芜黑山羊[5]和济宁青山羊[6-7]相似。单胎型的陕北白绒山羊10月龄母羊血清内E2的波峰值较多胎型的济宁青山羊低。间情期陕北白绒山羊10月龄母羊血清内P4的基础浓度、波峰与波谷均低于济宁青山羊。在间情期维持较高浓度的P4是保证卵泡正常生长发育所必须的[8],由此推测,在间情期单胎型羊种血清内P4的浓度较多胎型羊种低,这样可保证多胎型羊种有更多卵泡发育成熟并排卵。综上所述,羊种之间繁殖率的高低与发情期和间情期血清中FSH、LH、E2、P4的分泌有密切的关系。
3.3 关于周期性波动分泌和卵泡波 大多数哺乳动物的卵泡发育都是以卵泡波的形式进行的,在一个发情周期中往往出现数个卵泡波,FSH和LH是主导卵泡发育的2个主要因素。在卵泡选择期,起决定性作用的是FSH浓度的下降和LH浓度的上升[9],优势卵泡具有较多的LH受体数目[10],同时在优势卵泡确立时其内膜细胞上LH结合位点增多[11],使得这些卵泡可获得LH的支持而继续发育。Menchaca等[12]研究表明,山羊每个发情周期有3~4个卵泡波。吴延光等[13]和Medan等[14]认为,在发情周期内每个卵泡波的出现都伴随着1个FSH分泌峰。Saanen山羊每个发情周期一般有4个卵泡波,分别出现在排卵周期第0 d、5~6 d、10~11天 d和15 d前后[15]。莱芜黑山羊在整个发情周期中FSH、LH均先后分别出现4个分泌峰,FSH和LH的第1个分泌峰分别出现在第7天和第5天,其余3个分泌峰均同时出现在第10、15、20天[15]。陕北白绒山羊10月龄母羊在1个发情周期内先后出现了4个FSH、LH和E2分泌峰,发情当天FSH、LH的分泌峰同时出现。其余3个分泌峰FSH出现在第7、13、18天,LH分泌峰出现在第3、10、16天。在发情间期,LH峰早于FSH出现且与E2同时波动,推测此时LH主要与E2存在互作效应。Ginther[16]认为,大卵泡产生大量E2对FSH具有负反馈的作用,抑制FSH的分泌,造成FSH下降,同时卵泡的颗粒细胞获得LH受体,从而发育为优势卵泡。现知成熟的卵泡分泌大量的E2,在排卵前达到高峰,可激发LH大量释放(高峰状),诱发LH峰的阈值。此LH和FSH的峰状分泌将激发成熟卵泡排卵,因此两者的峰状分泌称排卵峰(LH更重要),所以LH分泌波动与E2分泌波动峰谷基本同步。陕北白绒山羊10月龄母羊除发情当天外,E2出现峰值时FSH均为较低值,反之亦然。这与Baird等[17]对绵羊的报道相似。发情当天,陕北白绒山羊10月龄母羊P4浓度最低到发情后的第5天保持较大浓度值一直到第15天开始下降的规律,说明发情行为与P4的浓度有很大关系。优势卵泡产生大量E2并在少量的P4协同作用下引起动物发情。
4 小 结
羊种之间繁殖率的高低与发情期和间情期血清中FSH、LH、E2、P4的分泌有密切的关系。本实验中陕北白绒山羊10月龄母羊有4个FSH峰值,即有4个卵泡波;优势卵泡产生大量E2并在少量的P4协同作用下引起动物发情;E2、FSH、LH第1个分泌峰值均出现于发情当天,此LH、FSH的峰状分泌将激发成熟卵泡排卵。
[1] 闫昱, 屈雷. 陕北白绒山羊产业发展现状和策略研究[J].榆林学院学报, 2008, 18(2): 10.
[2] 朱士恩. 家畜繁殖学第五版[M].北京: 中国农业出版社, 2013: 102+104‐106.
[3] Mihm M, Baguisi A, Boland M P, et al. Association between the duration of dominance of the ovulatory follicle and pregnancy rate in beef heifers[J]. J Reprod Fertil, 1994, 102(1): 123‐130.
[4] 郑亦辉, 张德福. 湖羊和美利奴羊发情期外周血浆中促性腺激素脉冲分泌的差异[J]. 中国畜牧杂志, 1991, 27(2): 23‐24.
[5] 侯衍猛, 曹洪防, 徐云华, 等. 莱芜黑山羊发情周期中FSH、LH、E2和P的分泌规律[J]. 中国兽医学报, 2006, 26(3): 340‐343.
[6] 葛仕豪.济宁青山羊生殖激素分泌规律及GnRHR在垂体和卵巢的免疫组化研究[D]. 泰安: 山东农业大学, 2007: 17‐25.
[7] 葛仕豪, 高立坤, 侯衍猛, 等. 济宁青山羊发情周期内促性腺激素和性激素分泌规律的研究[J]. 2007, 20(6): 1348‐1352.
[8] Ginther O J, Kot K. Follicular dynamics during the ovulatory season in goats[J]. Theriogenology, 1994, 42: 987‐1001.
[9] Driancourt M A. Follicular dynamics in sheep and cattle[J].The Riogenology , 1991, 35: 55‐79.
[10] Bodensteiner K J, Wiltbank M C, Bergfelt D R, et al. Alterations in follicular estradiol and gonadotropin receptors during development of bovine antral follicles[J]. Theriogenology, 1996, 45(2): 499‐512.
[11] Stewart R E, Spicer L J, Hamilton T D, et al. Levels of insulin‐like growth factor(IGF) binding proteins, luteinizing hormone and IGF‐I receptors, and steroids in dominant follicles during the fi rst follicular wave in cattle exhibiting regular estrous cycles [J]. Endocrinology, 1996, 137(7): 2842‐2850.
[12] Menchaca A, Rubianes E. Relation between progesterone concentrations during the early luteal phase and follicular dynamics in goats[J]. Theriogenology, 2002, 57(1): 1411‐1419 .
[13] 吴延光, 于远松, 谭景和. 哺乳动物卵泡发育模式及其调控机理[J].动物学杂志, 2002, 37(6): 83‐87.
[14] Medan M S,Watanabe G, Sasaki K, et al. Follicular and Hormonal Dynamics during the estrous cycle in goats[J]. J Reprod Develop, 2005, 51(4): 455‐463.
[15] Schwarz T, Wierzchos E. Relationship between FSH and ovarian follicular dynamics in goats during the estrous cycle[J]. Theriogenology, 2000, 53: 381.
[16] Ginther O J. Minireview: selection of the dominant follicle in cattle[J]. Biol Reprod,1996, 55: 1187‐1194.
[17] Baird D T, Swanston I A, Mcneilly A S. Relationship between LH, FSH, and prolaction concentration and the secretion of androgens and estrogens by the preovulatory follicle in the ewe[J]. Biol Reprod, 1981, 24(5): 1013‐1025.
The Secretion Characteristics of FSH, LH, E2and P4in Serum during the Oestrus Cycle of 10-month-old Female Shanbei Cashmere Goats
ZHU Rong‐hui1,2,3, CHEN Yu‐lin2, MA Cheng1, DU Ming‐yang1, ZHANG Wan‐yu1, QU Lei1*
(1.Yulin University Shaanxi Province Engineering&Technology Research Center of Cashmere Goat,Shaanxi Yulin 719000, China;2.college of animal science and technology ,Northwest A&F University,Shaanxi Yangling 712100, China;3.Bai Ni‐jing Zhen Dingbian County Animal Husbandry and Veterinary Station, Shaanxi Yulin 719000,China)
The objective of this study was to analysis the variation of follicle‐stimulating hormone (FSH), luteinizing hormone (LH), estradiol‐2 (E2) and progesterone (P4) in serum during the oestrus cycle of 10‐month‐old female Shanbei Cashmere Goats , to provide theoretical basis for the regulation of reproductive performance and reproductive hormones of young female Shanbei Cashmere Goats. Blood sample from 8 10‐month‐old female Shanbei Cashmere Goats was obtained via jugular vein every day during the estrous cycle (The day when female goat appeared oestrus was signed as day 0). Serum was collected at 15 min intervals for consecutive 3 h everyday in oestrus and diestrus. The contents of FSH, LH, E2 and P4 in serum during the oestrus, anoestrus and oestrus cycle were detected by enzyme‐linked immunoassay(ELISA). The secretion of FSH, LH, E2and P4for consecutive 3 hours during the oestrus and anoestrus were all wavelike and the FSH expressed the higher wavelike frequency during the oestrus. While the wavelike frequency of LH was lower during oestrus. The E2level was higher during oestrus, but there was no signif i cant dif f erence (P>0.05). In the meanwhile, the P4level was signif i cantly higher during anoestrus than during oestrus (P<0.05). For the entire oestrus cycle, the FSH, LH and E2levels in the serum didn’t show any signif i cant dif f erences, but the P4levels on the day 0 and day 1 were signif i cantly lower than that during anoestrus(P<0.05).
Shanbei cashmere goat; Follicle Stimulating Hormone; Luteinizing Hormone;Estradiol‐2; Progesterone
S827.3
A
10.19556/j.0258-7033.2017-09-061
2017-06-04;
2017-06-29
陕西省科技统筹创新工程计划项目(2014KTDZ02-01)
朱蓉慧(1989-),女,陕西榆林人,助理畜牧师,硕士研究生,主要从事畜牧生产与推广的研究,E-mail: 2633219 23@qq.com
* 通讯作者:屈雷,E-mail: 273790687@qq.com
