基于磁分选技术和间接免疫荧光技术的肺癌A549细胞的分离检测
2017-09-18,
,
(上海师范大学 生命与环境科学学院,上海 200234)
基于磁分选技术和间接免疫荧光技术的肺癌A549细胞的分离检测
周朝辉, 付聪颖,贾能勤*
(上海师范大学 生命与环境科学学院,上海200234)
采用磁分选技术及间接免疫荧光技术分离检测肺癌循环肿瘤细胞(CTCs).将表皮生长因子受体(EGFR)抗体连接到四氧化三铁(Fe3O4)磁珠表面构建免疫磁珠(MNPs-Anti-EGFR),通过EGFR抗体和肺癌A549细胞的表面抗原的特异性结合,将免疫磁珠与肺癌细胞结合.通过磁场作用,使肺癌细胞在磁场的作用下从混合细胞中分离富集.分离出的细胞利用间接荧光技术在其细胞表面连接结合PE荧光团的特异性抗体,并用4′,6-二脒基-2-苯基吲哚(DAPI)对细胞核染色以定位细胞位置.通过倒置荧光显微镜的观察,从而实现对肿瘤细胞的定量计数检测.实验结果显示该方法对肺癌A549细胞具有较好的检测灵敏度和检测下限,检测下限可达3cells/mL.
循环肿瘤细胞; 磁分选技术; 免疫荧光技术; 肺癌A549细胞
0 引 言
循环肿瘤细胞(circulating tumor cell,CTCs)是从肿瘤组织脱落,通过血液循环系统远离肿瘤组织的一类肿瘤细胞,其中大部分的循环肿瘤细胞在循环系统中被吞噬或者凋亡,只有少数的细胞转移并发展成转移灶,形成新的肿瘤组织.恶性肿瘤细胞通过血液转移到身体的其他器官,而CTCs的转移是造成肿瘤患者死亡的主要原因[1-4].因此循环肿瘤细胞的早期诊断及治疗,对于患者的预后判断、疗效评价和个体化治疗都具有重要的意义.
CTCs在肿瘤病人外周血的含量极少,一般10mL血液中只有1~10个细胞,这对CTCs检测系统是一个巨大的挑战[5].需要高敏感性、可重复性、可靠、快速、便宜的富集手段才能解决这个问题.目前CTCs的富集技术主要根据免疫亲和性、物理性质和直接分析这三类技术来进分离富集[6-8].免疫磁珠法是免疫亲和性的一种方法,CTCs的富集主要是利用捕获抗体和CTCs抗原之间的高度特异性反应,免疫作用促使抗原与耦合到磁珠的抗体发生特异性的结合,然后抗原-抗体复合物被置于磁场作用之下,通过磁场对免疫磁珠固定从而使CTCs与其他血液细胞分离,产生富集效果[9-11].
目前已经开发了大量的技术用于检测CTCs,其中有些已经成功的用于测试或者临床评估[12].现有的CTCs检测技术主要包含免疫细胞化学[13]、多聚酶链反应[14]、逆转录聚合酶链反应[15]、流式细胞术[16]等.免疫细胞化学检测方法是基于抗原抗体结合反应的原理,利用单克隆抗体(McAb)与特异的肿瘤标记物结合,并通过酶与底物反应显色来判断肿瘤细胞的存在.检测的肿瘤标志物主要分三类[17]:1)上皮细胞角蛋白(CK),如CK19;2)上皮细胞膜特异性抗原,如黏蛋白类,包括上皮膜抗原(EMA)、人乳球蛋白(HMFG)等;3)肿瘤相关糖蛋白(TAG),如TAG12.目前,这些检测技术仍然存在检测限不够低,检测方法易出现假阳性和假阴性等问题.
免疫荧光细胞化学是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素制成荧光标记物,再用这种荧光抗体(或抗原)作为分子探针检查细胞或组织内的相应抗原(或抗体).在细胞或组织中形成的抗原抗体复合物上含有荧光素,利用荧光显微镜观察标本,荧光素受激发光的照射而发出明亮的荧光,可以通过荧光所在的细胞或组织,来确定抗原或抗体的性质、定位,以及利用荧光定量技术测定含量[18].免疫荧光细胞化学分直接法[19]、夹心法[20]、间接法[21]和补体法[22].本研究发展了一种结合免疫磁珠分离技术和间接免疫荧光技术双重捕获及检测CTCs的方法.选用磁核为Fe3O4的免疫磁珠.在Fe3O4磁珠表面连接EGFR抗体.利用特异性抗体与细胞表面特异性抗原相结合,使得肺癌A549细胞和特异性的免疫磁珠结合,并在外界磁场的作用下,使得目的A549细胞在磁场的作用下从混合细胞中分离出来.分离出的细胞由间接荧光技术在其细胞表面连接结合PE荧光素的特异性抗体,并用4′,6-二脒基-2-苯基吲哚(DAPI)对细胞核染色以定位细胞位置.通过倒置荧光显微镜的观察,从而实现了对肿瘤细胞的定量计数检测.检测的原理如图1所示.
1 实验部分
1.1实验试剂与仪器
免疫磁珠(柏慧康生物技术有限公司);鼠抗人癌胚抗原单克隆抗体(CEA)一抗,荧光素PE标记兔抗鼠IgG(联科生物有限公司);A549细胞,MRC-5细胞(中科院细胞库);磷酸氢二钾,磷酸二氢钾(国药集团化学试剂有限公司);DAPI、DMEM培养基,1640培养基(上海秉新生物科技有限公司);实验用水均为二次蒸馏水.
1.2Fe3O4免疫磁珠(MNPs-Anti-EGFR)的制备
首先通过共沉淀法合成Fe3O4磁珠,具体的合成如下,用电子天平称取FeSO4·7H2O 1.5 g,将其倒入50 mL的小烧杯中,然后加30 mL的二次蒸馏水搅拌溶解.待固体完全溶解后,在65 ℃的温度下搅拌30 min,在搅拌过程中逐渐滴加5 mL的H2O2溶液.在N2保护下,将溶液温度升至40 ℃并保持恒温,然后加入1.5 g的FeSO4固体,搅拌溶解10 min后.将25 mL的NaOH溶液(物质的量浓度为2 mol/L)逐滴滴加到溶液中,将温度升至60 ℃并保持恒温,溶液搅拌2 h.反应结束后,在外界磁场分离后,用二次蒸馏水将所得固体清洗5次.所得固体即为Fe3O4磁珠,将磁珠贮存在4 ℃冰箱备用.

图1 基于磁分选技术与间接荧光技术捕获目的细胞机理示意图
将1,2-二油酰基卵磷脂(DOPC)、壳聚糖十六烷基季胺盐、胆固醇溶于二氯甲烷溶液中,搅拌溶解,标记为A液.将磁珠分散在二氯甲烷溶液中,标记为B液.将A、B溶液一起转移至梨型烧瓶内,加入一定量的磷酸盐缓冲液(PBS)溶液定容到一定体积,孵育后,标记为C液.用旋转蒸发器于真空环境下将超声后的混合溶液中的二氯甲烷溶剂除去.将N-羟基琥珀酰亚胺(NHS)_、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCI)、表皮生长因子受体抗体(Anti-EGFR)混合溶液在4 ℃的环境中搅拌反应12 h后,即得Fe3O4免疫磁珠(以下简称免疫磁珠).所得的免疫磁珠保存在4 ℃冰箱中.
1.3细胞培养
本实验所采用的细胞为细胞表面EGFR抗原阳性表达的人肺腺癌细胞A549细胞,以及对EGFR 抗原不表达的人胚肺二倍体成纤维细胞MRC-5细胞.A549细胞培养在含有质量分数为10%牛血清蛋白的1640培养液中,MRC-5细胞培养在含有质量分数为10%牛血清蛋白的DMEM培养液中.
1.4免疫磁珠特异性和细胞特异性实验
将A549细胞胰酶处理,离心收集,分散计数.在2个1 mL EP管中分别放入100 μL A549细胞样品,命名为a管、b管.在a号样品管中加入免疫磁珠60 μL,在b号样品中加入Fe3O4磁珠60 μL.同时在37 ℃恒温环境下摇床孵育1 h.在外界磁场作用下分离下,将分离得到的样品用PBS溶液清洗3次(以下简称分离,PBS清洗3次).加入50 μL的DAPI染色剂染色处理,放入4 ℃冰箱冷却放置5 min,分离,PBS清洗3次.所得溶液用PBS溶液定容到50 μL.将溶液滴加到透明载玻片上,分别于倒置荧光显微镜下观察.
将A549细胞和MRC-5细胞胰酶处理,离心收集,分散计数,分别取100 μL A549细胞和MRC-5细胞样品于2个1 mL EP管中,在两个样品中加入60 μL免疫磁珠.同时在37 ℃恒温环境下摇床孵育1 h.分离,PBS清洗3次,加入50 μL的DAPI染色剂染色处理,放入4 ℃冰箱冷却放置5 min,分离,PBS清洗3次,定容到50 μL.将溶液滴加到透明载玻片上,分别于倒置荧光显微镜下观察.
1.5实验条件优化
最优孵育时间确定,具体如下:将A549细胞胰酶处理,离心收集,分散计数.在样品中分别加入60 μL免疫磁珠.分别在37 ℃恒温环境下摇床孵育0、15、30、45、60、75 min.最佳免疫磁珠加入量的确定如下:在细胞样品中分别加入免疫磁珠20、40、60、80、100 μL.同时在37 ℃恒温环境下摇床孵育1 h,所有的样品,经分离,DAPI染色处理后,于倒置荧光显微镜下观察.
最佳一抗和二抗稀释浓度确定如下:将经胰酶处理的A549细胞溶液培养在16孔板上,孵育24 h,将鼠抗人CEA一抗(原质量浓度为0.5 mg/mL)用PBS溶液稀释50、100、250倍,各取100 μL不同稀释比例的一抗分别加入到孔板中,在37 ℃恒温环境下摇床孵育1h.吸出培养液,并用PBS缓冲液清洗3次,将荧光素PE标记兔抗鼠IgG二抗(原质量浓度为0.2 mg/mL)PBS溶液稀释100、250、500倍各取100 μL不同稀释浓度的二抗分别加入到孔板中,在37 ℃恒温环境下摇床孵育1 h.并用PBS缓冲液清洗3次.DAPI染色处理后,于倒置荧光显微镜下观察.
1.6结合磁分选技术和间接免疫荧光技术的靶向肿瘤细胞的特异性实验
将A549细胞和MRC-5细胞胰酶处理,离心收集,分散计数,分别取2个100 μL样品A549细胞和MRC-5细胞置于2个1 mL EP管中,分别加入60 μL免疫磁珠.在37 ℃恒温环境下摇床孵育1 h.分离,PBS清洗3次.在两个样品中分别加入100μL用PBS 缓冲溶液稀释100倍的CEA一抗,在37 ℃恒温环境下摇床孵育1 h.分离,PBS清洗3次,然后分别加入100 μL用PBS缓冲溶液稀释100倍的连接荧光素PE标记兔抗鼠IgG二抗,在37 ℃恒温环境下摇床孵育1 h.分离,PBS清洗3次.加入50 μL的DAPI染色剂染色处理,在4 ℃冰箱中冷却放置5 min.再分离,PBS清洗3次,定容到50 μL.将溶液滴加到透明载玻片上,分别于倒置荧光显微镜下观察.
1.7灵敏度实验
将A549细胞和MRC-5细胞胰酶处理,离心收集,分散计数,取7个1 mL的EP管,将含有不同数目的A549细胞分别加入到7个EP管中并定容至100 μL,编号从1~7的EP管中A549细胞的数目分别为50,50,50,50,50,5,3个.从1~7的EP管中,分别加入100 μL不同数目的MRC-5细胞,使A549和MRC-5细胞数目比为1∶10,1∶100,1∶1 000,1∶104,1∶105,1∶106,1∶1.7×106.分别在7个样品管中加入60 μL免疫磁珠,在37 ℃恒温环境下摇床孵育1 h.分离,PBS清洗3次.分别加入100 μL用PBS缓冲溶液稀释100倍的CEA一抗,在37 ℃恒温环境下摇床孵育1 h.分离,PBS清洗3次,然后分别加入100 μL用PBS缓冲溶液稀释100倍的连接PE荧光素的CEA二抗,在37 ℃恒温环境下摇床孵育1 h.分离,PBS清洗3次.加入50 μL的DAPI染色剂染色处理,在4 ℃冰箱内冷却放置5 min.再分离,PBS清洗3次,定容到50 μL.将溶液滴加到透明载玻片上,分别于倒置荧光显微镜下观察.
2 结果与讨论
2.1免疫磁珠的表征
首先通过沉淀法制备出Fe3O4磁珠,通过TEM表征(图2A)可知,Fe3O4磁珠因为团聚出现不规则形状,单个粒子的直径约在6 nm左右.免疫磁珠的TEM图(图2B)所示,包裹EGFR抗体后的Fe3O4磁珠,分散较为均匀,粒径约在13 nm左右.并且从图2可以看到Fe3O4磁珠表面有一层均匀的浅灰色的蛋白包裹,说明免疫磁珠被成功制备,通过粒径分析仪测得免疫磁珠的粒径分布如图2C所示,可知所合成的免疫磁珠粒径比较均匀,平均粒径约为325 nm.所制备的免疫磁珠符合捕获循环肿瘤细胞要求.
X射线衍射(XRD)是一种确定材料结晶情况的表征手段,图3A是Fe3O4磁珠的XRD广角衍射谱图.从图3A可以得到,Fe3O4磁珠的衍射峰分别出现在30.1°,35.5°,43.1°,53.7°,57.2°,62.7°处,分别对应立方相Fe3O4的(220),(311),(400),(422),(511)和(440)晶面.由此可以判断,制备的Fe3O4磁珠是立方相的Fe3O4,且结晶度良好.
紫外吸收光谱用来分析抗体是否成功地连接到Fe3O4磁珠表面.蛋白质中含有色氨酸残基和酪氨酸残基,分子内部存在着共轭双键,因此在280 nm处有特征吸收峰.单独的EGFR抗体的紫外吸收峰出现在280 nm(图3B),为蛋白的特征吸收峰.图3B中Fe3O4磁珠的紫外测试并没有明显的特征吸收峰.而包裹EGFR抗体后的免疫磁珠紫外特征吸收峰也出现在280 nm附近,由于偶联基团的影响,抗体的特征吸收峰发生蓝移.结果证明Fe3O4磁珠表面成功包裹上了EGFR抗体.
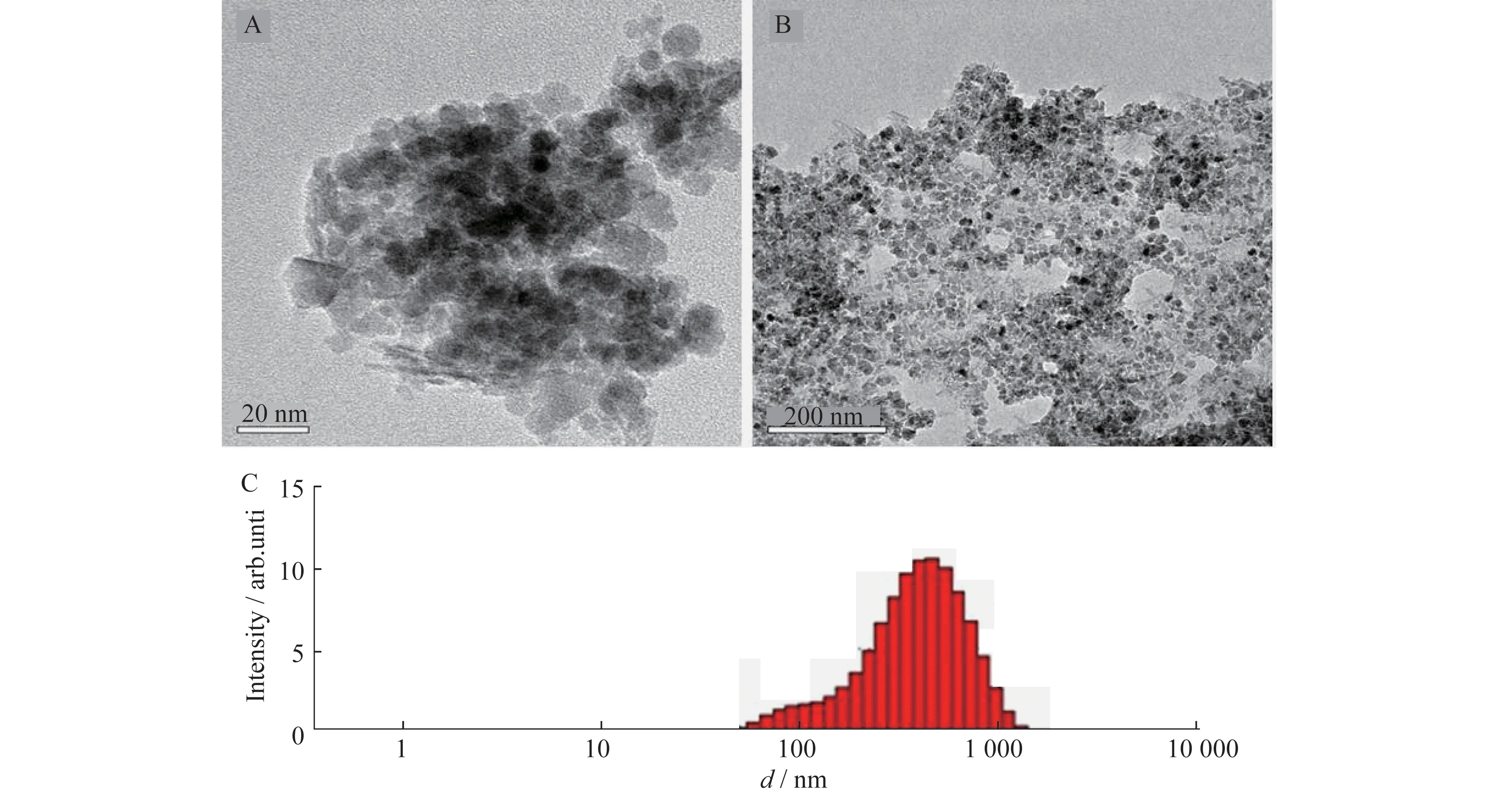
图2 Fe3O4磁珠的TEM图(A)、免疫磁珠的TEM图(B)和免疫磁珠在PBS溶液中的粒径分布图(C)
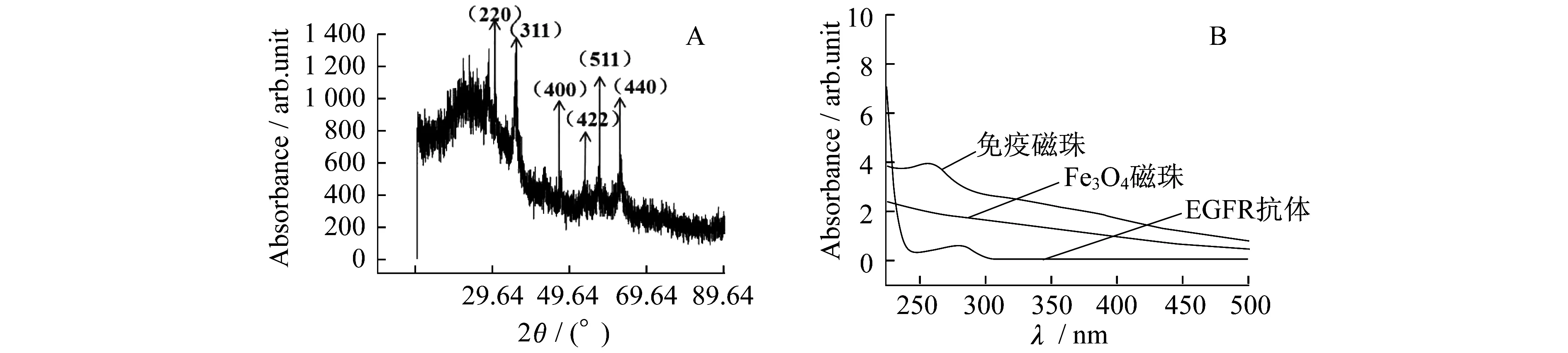
图3 免疫磁珠的XRD图(A)和紫外吸收光谱图(B)
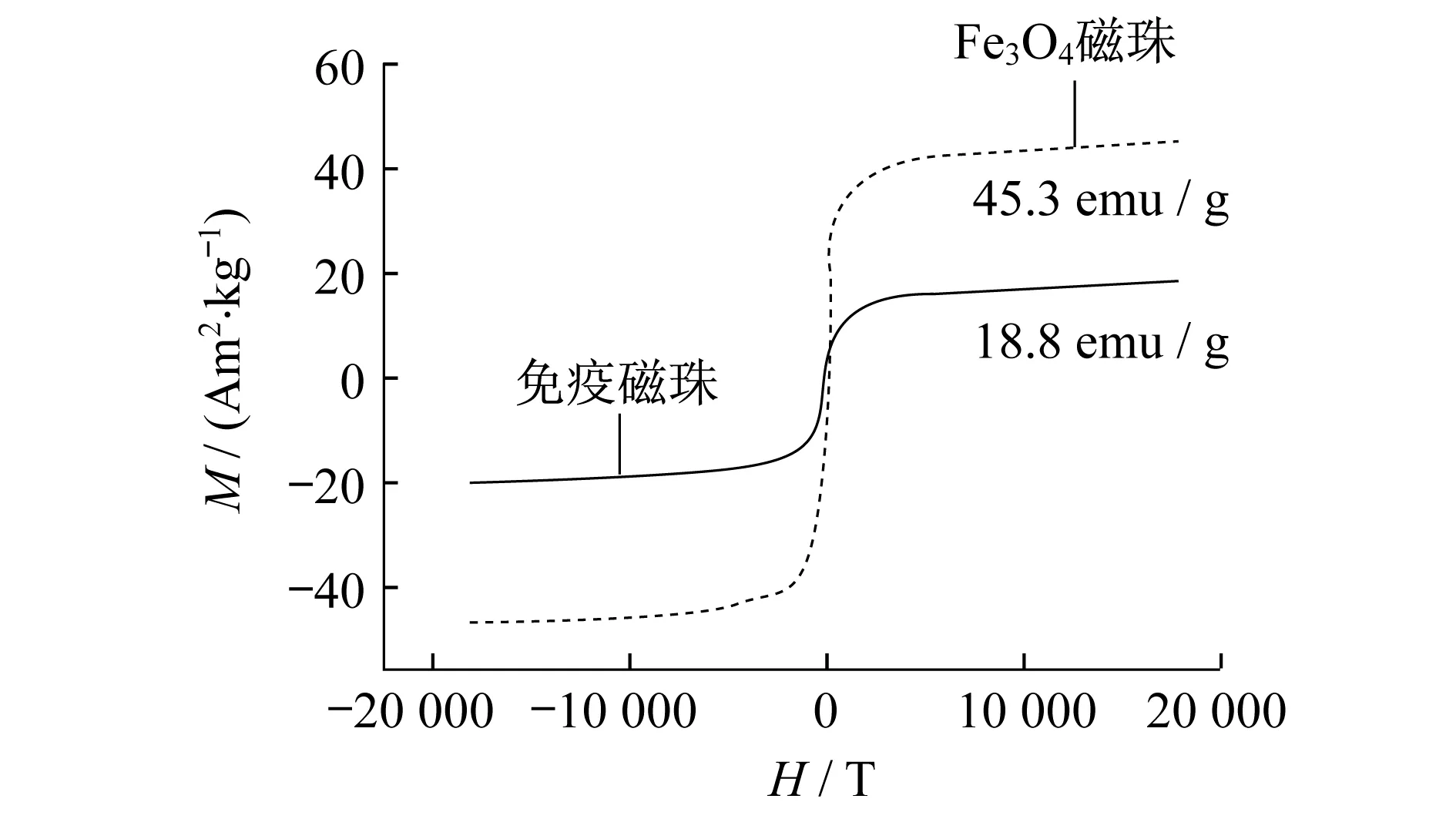
图4 Fe3O4磁珠与免疫磁珠磁滞曲线
然后进一步表征了所合成的免疫磁珠的磁性性能,通过磁强计检测Fe3O4磁珠和免疫磁珠的磁滞强度.从图4中Fe3O4磁珠和免疫磁珠的磁滞曲线可知,Fe3O4磁流体的饱和磁化强度为45.3 emu/g,具有较强的磁强度.合成后的免疫磁珠的饱和磁化强度为18.8 emu/g,磁化强度降低了26.5 emu/g.这是由于EGFR抗体不具有磁性,对于Fe3O4磁流体的包覆从一定程度上降低了粒子的磁性能.从图4中还可以知道两种粒子的矫顽力(Hc)及剩磁(Br)也都非常低.因此Fe3O4磁珠和免疫磁珠在外加磁场的作用下,磁珠被磁化充分,同时在撤掉外界磁场的作用下,磁性粒子磁性残留较少.因此免疫磁珠符合捕获肿瘤细胞的要求.
2.2免疫磁珠捕获A549细胞特异性
将等量的Fe3O4磁珠及免疫磁珠加入到等量的A549细胞溶液中时.从荧光图(图5)中可以看出,加入免疫磁珠的样品中有蓝色荧光标记的细胞,而加入Fe3O4磁珠的样品中则没有,说明免疫磁珠对表面EGFR阳性表达的A549目标细胞具有捕获能力,而表面未包裹EGFR的Fe3O4磁珠对A549目标细胞不具有捕获能力.因此本实验所选用的免疫磁珠是一种特异性的磁珠,对肺癌A549细胞的捕获具有良好的效果.
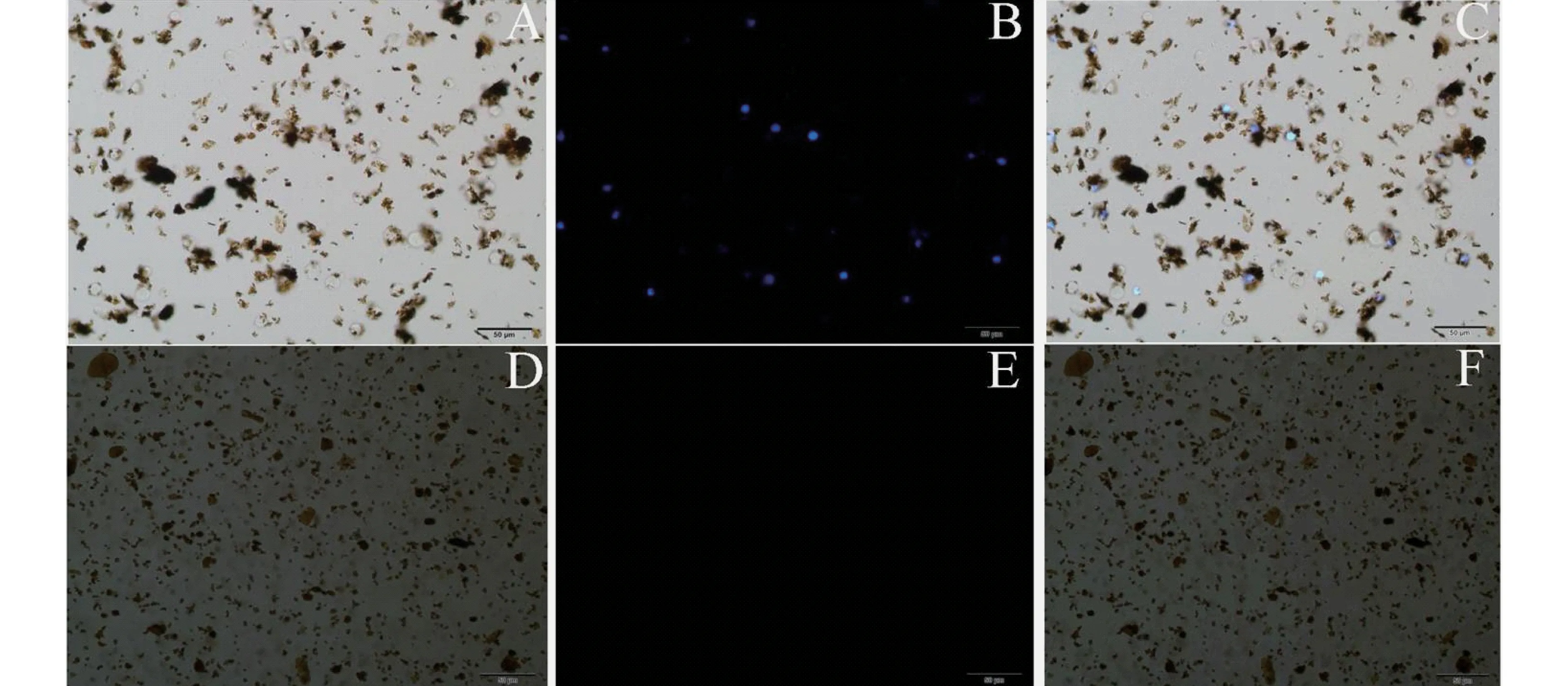
图5 免疫磁珠捕获肺癌A549细胞的倒置荧光显微镜荧光图(A,B,C分别对应加入免疫磁珠的明场、荧光和叠加图;D,E,F分别对应加入Fe3O4磁珠的明场、荧光和叠加图)
2.3免疫磁珠捕获A549细胞和MRC-5细胞的特异性研究
将等量的免疫磁珠加入到等量的A549细胞和MRC-5细胞溶液中时,从图6的荧光图(A,B,C)中可以看出,蓝色的荧光部分是被DIPA染色的细胞核.免疫磁珠对目标细胞A549具有良好捕获能力,这是因为A549细胞表面为EGFR抗体阳性表达.而对于表面EGFR抗原阴性表达的MRC-5对照细胞不具有捕获能力,从暗场图6B,E中可以看出本实验所选用的免疫磁珠对目的细胞A549细胞具有特异性的捕获能力,而对于对照细胞MRC-5细胞不能特异性捕获.
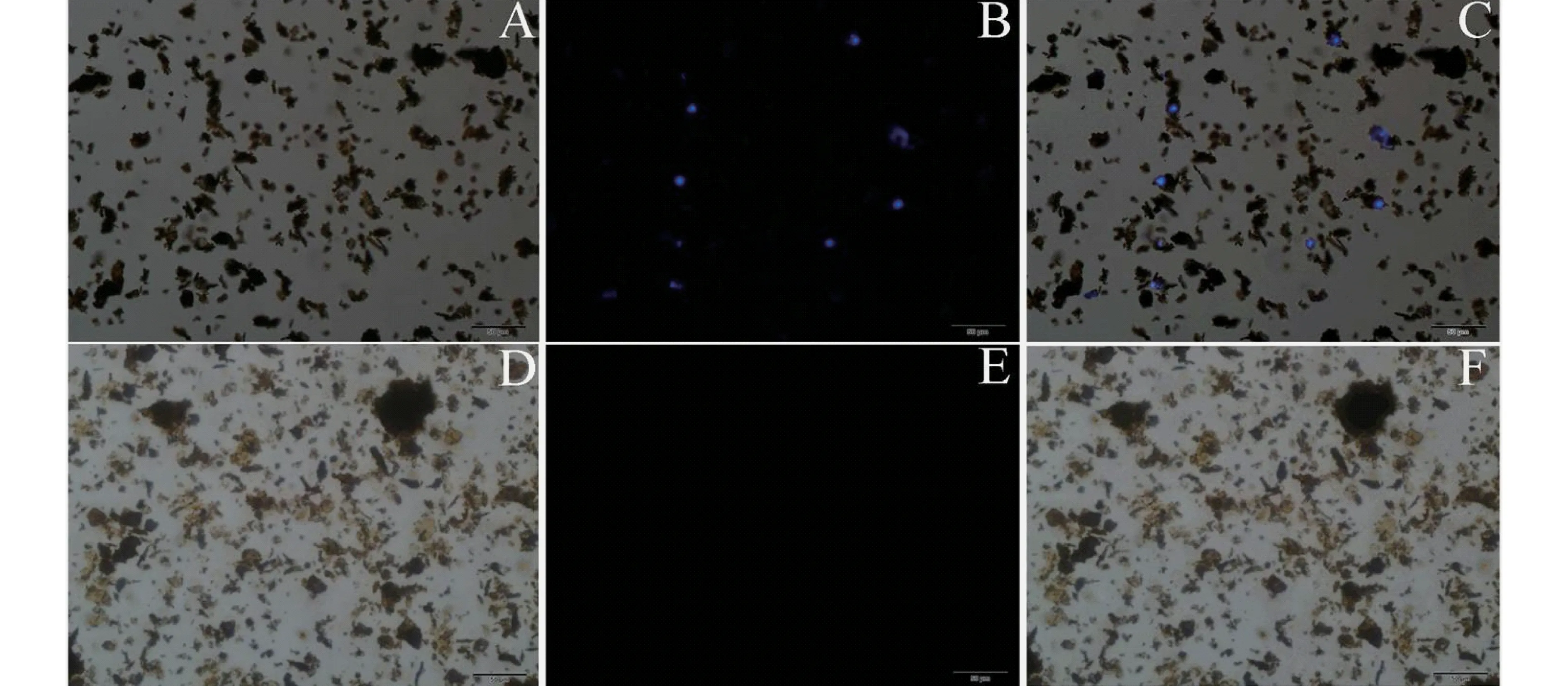
图6 免疫磁珠捕获A549目标细胞和MRC-5对照细胞的倒置荧光图(A,B,C分别对应A549目标细胞的明场、荧光和叠加图;D,E,F分别对应MRC-5对照细胞的明场、荧光和叠加图)
2.4实验条件优化
2.4.1 最优孵育时间的确定
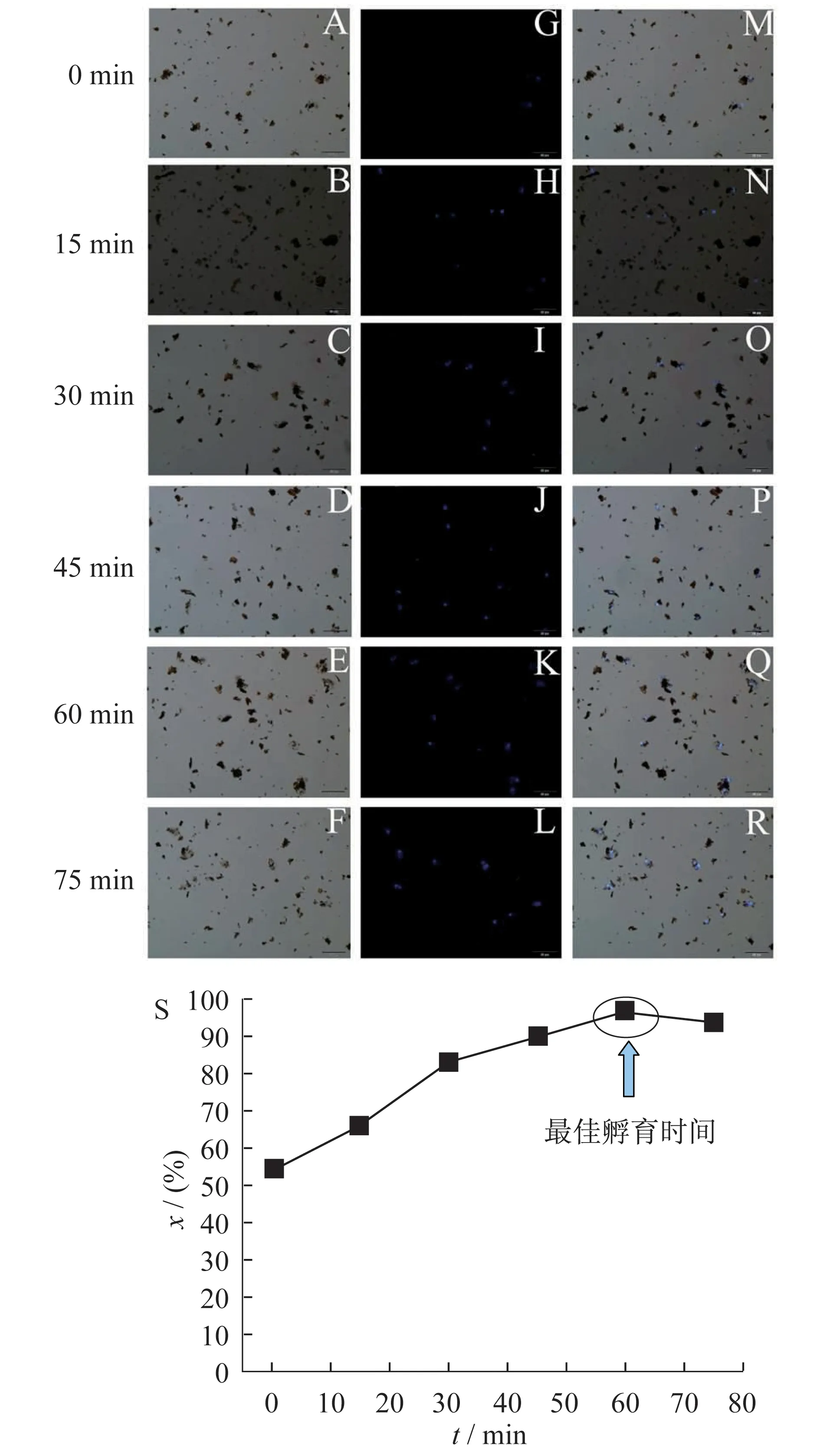
图7 不同孵育时间下免疫磁珠捕获A549细胞的明场、荧光和叠加图(从左至右)的倒置荧光图(A~R)以及不同孵育时间对A549细胞的捕获率图(S)
将等量的免疫磁珠加入到等量的A549细胞溶液中时,分别孵育0、15、30、45、60、75 min后在荧光显微镜下观察,以确定最佳的孵育时间.从图7可以看出,在A549细胞浓度及免疫磁珠用量一定时(A549 细胞浓度为3.5×103cells/mL,免疫磁珠的用量为60 μL),随着免疫磁珠与细胞孵育时间的增加,免疫磁珠捕获的A549细胞的数目逐渐增加,从暗场图中可以看出(图7),到孵育60 min后捕获细胞数目变化不大.这是因为当孵育时间在60 min以后时,在一定的细胞浓度和一定量免疫磁珠的条件下捕获目的细胞已趋于饱和状态.由捕获的A549细胞数目与原加入的A549细胞数目的百分比得到在该孵育时间下的细胞捕获率X(%)(图7S).在60 min时,细胞捕获效率达到最高,因此,免疫磁珠捕获肿瘤细胞所选用的孵育时间为60 min.
2.4.2 最优免疫磁珠加入量确定
在等量的A549细胞溶液中时,分别加入20、40、60、80、100 μL的免疫磁珠后孵育60 min,通过倒置荧光显微镜观察,以确定最优的免疫磁珠加入量.从图8可以看出,当A549细胞浓度及孵育时间一定时(A549 细胞浓度为3.5×103cells/mL,孵育时间为60 min),随着免疫磁珠加入量的增加,蓝色荧光部分逐渐增加,说明免疫磁珠捕获A549细胞的数目逐渐增加,但随着免疫磁珠加入量越多对细胞显现的荧光遮蔽作用越明显,阻碍细胞的观察及计数.计算细胞捕获率,根据免疫磁珠加入量和细胞捕获率得到图8P所示关系图.基于捕获率以及节约免疫磁珠的原则,所选用的最佳免疫磁珠加入量为60 μL.
2.4.3 一抗二抗稀释比例优化
在16孔板上培养A549细胞,待细胞基本长满后,基于间接荧光技术在孔板中分别加入不同稀释比例的CEA一抗(原质量浓度为0.5 mg/mL)和连接PE的CEA二抗(原质量浓度为0.2 mg/mL),在荧光显微镜下观察发现当一抗二抗的稀释比例均为1∶100时,稀释比例下细胞染色效果最佳如图9(C)所示.因此本实验所选用的一抗二抗均选择1∶100的稀释浓度.
2.5磁分选技术和间接免疫荧光技术靶向细胞特异性和捕获A549细胞的灵敏度研究
将60 μL的免疫磁珠加入到等量的A549细胞和MRC-5细胞溶液中时,孵育60 min后,经过染色处理在荧光显微镜下观察,从倒置荧光图(图10)中可以看出,表面具有EGFR抗体和CEA抗原阳性表达的目的细胞A549能被免疫磁珠分选并被间接免疫荧光技术染色,在叠加图10D中可看出,荧光显微镜下细胞显现红色及蓝色的荧光.而表面EGFR抗体和CEA抗原阴性表达的MRC-5细胞,无法被磁分选以及染色(图10H).因此磁分选后在倒置荧光显微镜下具有红色及蓝色荧光的细胞为肺癌A549细胞.
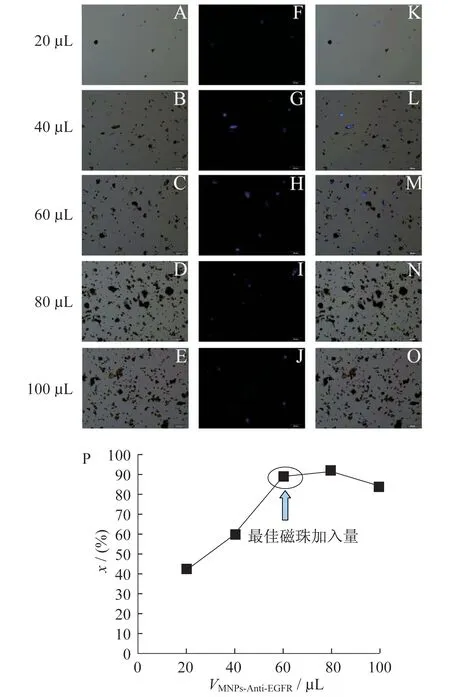
图8 不同免疫磁珠加入量下捕获 A549 细胞的明场、荧光和叠加图(从左至右)的倒置荧光图(A~O)以及不同加入量对A549细胞的捕获率图(P)
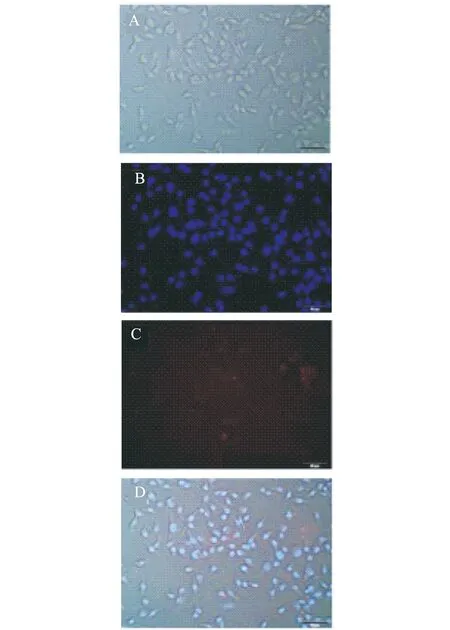
图9 A549细胞的明场图(A)、DIPA染色的荧光图(B)、PE染料染色的荧光图(C)和荧光叠加图(D)(一抗和二抗的稀释比例均为 1∶100)
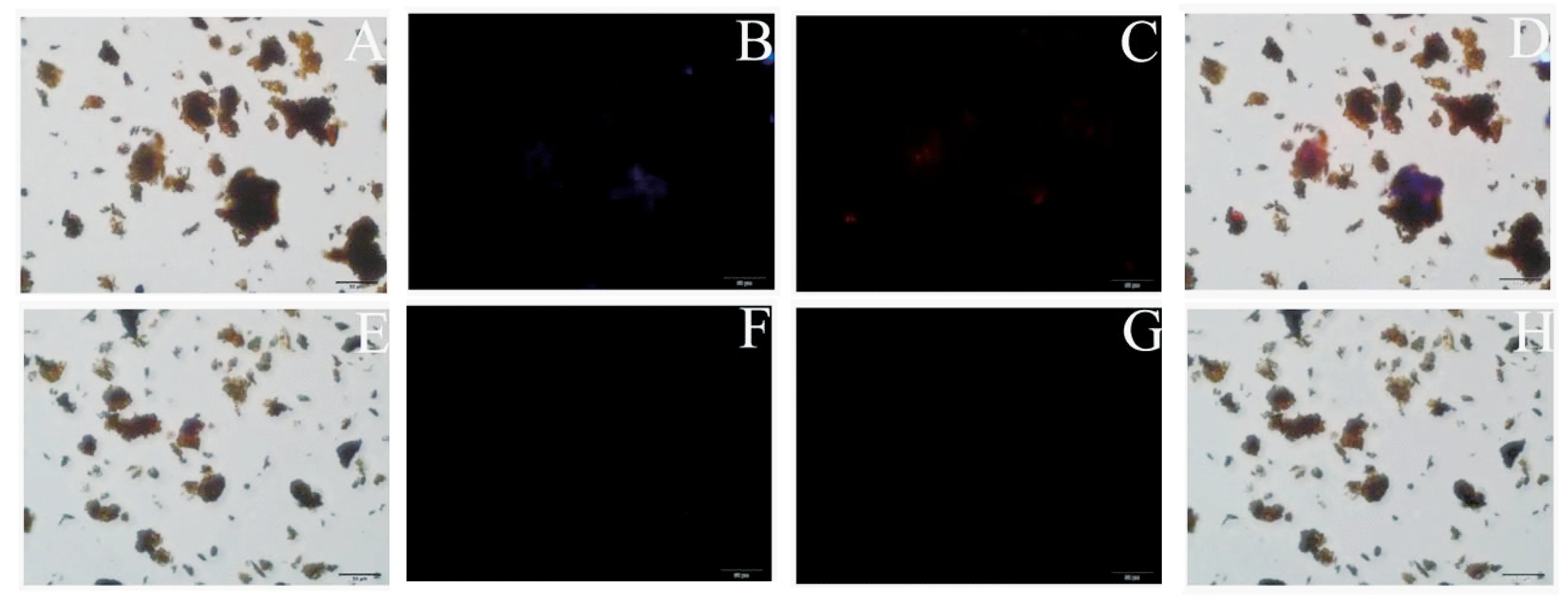
图10 最优实验条件下磁分选免疫磁珠靶向A549细胞和MRC-5细胞的倒置荧光图
将60 μL的免疫磁珠加入到有不同比例的A549细胞和MRC-5细胞组成的混合溶液中时,孵育60 min后,经过染色处理后在荧光显微镜下观察,计数捕获的A549细胞数目,计算细胞捕获率.从表1检测灵敏度表中可知,在A549细胞和MRC-5细胞组成的混合溶液中,通过磁分选技术和间接免疫荧光技术对肺癌A549目标细胞的检测灵敏度可达到3 cells/mL[23].
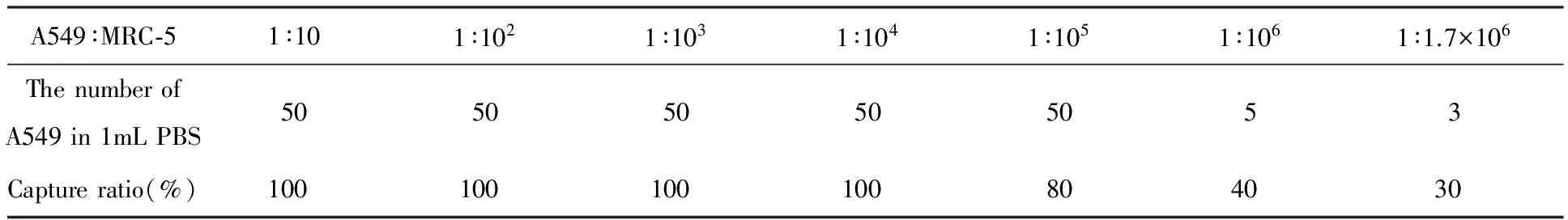
表1 最优实验条件下,磁分选技术和间接免疫荧光技术对肺癌A549目标细胞的检测灵敏度
3 结 论
本工作采用磁分选技术和间接免疫荧光技术从混合细胞中分离检测肺癌A549细胞,在最优条件为免疫磁珠加入量为60 μL,一抗和二抗的稀释比均为1∶100,孵育时间为60 min.对细胞的捕获特异性良好,检测灵敏度可达到3 cells/mL.该方法对肺癌A549细胞具有良好的检测特异性和检测灵敏度,对于实际样品CTCs的检测具有良好的应用前景.
[1] 余锋,张妤,施乐华,等.循环肿瘤细胞检测的临床应用 [J].世界华人消化杂志,2010,18(22):2346-2349.
Yu F,Zhang Y,Shi L H,et al.Detection of circulating tumorcells:recent progress inclinical applications [J].World Chinese Journal of Digestology,2010,18(22):2346-2349
[2] 黄同海,王正,李富荣.循环肿瘤细胞检测的研究新进展 [J].中国肿瘤临床,2007,34(8):476-479.
Huang T H,Wang Z,Li F G.New Advancements in the detection of circulating tumor cells [J].Chinese Journal of Clinical Oncology,2007,34(8):476-479
[3] Coumans F A,Ligthart S T,Uhr J W,et al.Challenges in the enumeration and phenotyping of CTC [J].Clinical Cancer Research An Official Journal of the American Association for Cancer Research,2012,18(20):5711-5718.
[4] Paterlini-Brechot P,Benali N L.Circulating tumor cells (CTC) detection:clinical impact and future directions [J].Cancer Letters,2007,253(2):180-204.
[5] Sun N,Wang J,Ji L,et al.A cellular compatible chitosan nanoparticle surface for isolation andinsituculture of rare number CTCs [J].Small,2015,11(40):5444-5451.
[6] Pantel K,Brakenhoff R H,Brandt B.Detection,clinical relevance and specific biological properties of disseminating tumour cells [J].Nature Reviews Cancer,2008,8(5):329-340.
[7] Song Y,Tian T,Shi Y,et al.Enrichment and single-cell analysis of circulating tumor cells [J].Chemical Science,2017,8(3):1736-1751.
[8] Yeo T,Tan S J,Lim C L,et al.Microfluidic enrichment for the single cell analysis of circulating tumor cells [J].Scientific Reports,2016,6:22076-22088.
[9] Hansel T T,Pound J D,Pilling D,et al.Purification of human blood eosinophils by negative selection using immunomagnetic beads [J].Journal of Immunological Methods,1989,122(1):97-103.
[10] Zhu Y,Kekalo K,Ndong C,et al.Magnetic nanoparticle based immunoassays on chip:materials synthesis,surface functionalization,and Cancer Cell Screening [J].Advanced Functional Materials,2016,26(22):3953-3972.
[11] Huang Y Y.Immunomagnetic microfluidic screening system for circulating tumor cells detection and analysis [D].Texas:The University of Texas at Austin,2013.
[12] Alixpanabières C,Pantel K.Challenges in circulating tumour cell research [J].Nature Reviews Cancer,2014,14(9):623-631.
[13] Julia J,Brigitte R,Friedl T W P,et al.Detection of circulating tumor cells using manually performed immunocytochemistry (MICC) does not correlate with outcome in patients with early breast cancer-Results of the German SUCCESS-A-trial [J].BMC Cancer,2016,16(1):1-11.
[14] Lin W,Wu C,Qiao L,et al.Clinical Significance of Folate Receptor-positive Circulating Tumor Cells Detected by Ligand-targeted Polymerase Chain Reaction in Lung Cancer [J].Journal of Cancer,2017,8(1):104-110.
[15] Yamaguchi K,Takagi Y,Aoki S,et al.Significant Detection of Circulating Cancer Cells in the Blood by Reverse Transcriptase-Polymerase Chain Reaction During Colorectal Cancer Resection [J].Annals of Surgery,2000,232(1):58-65.
[16] Hu Y.Detection of circulating tumor cells in breast cancer patients utilizing multiparameter flow cytometry and assessment of the prognosis of patients in different CTCs levels [J].Cytometry Part A,2010,3(77A):213-219.
[17] 张武,高琦,张岭,等.多项肿瘤标志物对肿瘤敏感性的实测统计 [J].放射免疫学杂志,2001,14(6):355-356.
Zhang W,Gao Q,Zhang L,et al.Multiple tumor markers for tumor sensitivity test statistics [J].Journal of Radioimmunology,2001,14(6):355-356.
[18] Szmulewitz R Z,Wyche A J,Posadas E M,et al.Fluorescence-activated cell sorting (FACS) and immunofluorescence (IF) detection and characterization of circulating tumor cells (CTC) from men with castrate-resistant prostate cancer (CRPC) [J].Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology,2011,29(7_suppl):41.
[19] Ness J M,Akhtar R S,Latham C B,et al.Combined tyramide signal amplification and quantum dots for sensitive and photostable immunofluorescence detection [J].Journal of Histochemistry & Cytochemistry,2003,51(8):981-987.
[20] Green J V,Sun D,Hafezi-Moghadam A,et al.Microfluidic pillar array sandwich immunofluorescence assay for ocular diagnostics [J].Biomedical Microdevices,2011,13(3):573-583.
[21] Villegas J,Schulz M,Vallejos V,et al.Indirect immunofluorescence using monoclonal antibodies for the detection of leukocytospermia:comparison with peroxidase staining [J].Andrologia,2002,34(2):69-73.
[22] Mintz L,Miner R C,Yeager A S,Anticomplement immunofluorescence test that uses isolated fibroblast nuclei for detection of antibodies to human cytomegalovirus [J].Journal of Clinical Microbiology,1980,12(4):562-565.
[23] Wu X,Xia Y,Huang Y,et al.Improved SERS-active nanoparticles with various shapes for CTC detection without enrichment process with supersensitivity and high specificity [J].Acs Applied Materials & Interfaces,2016,8(31):19928-19938.
(责任编辑:郁 慧)
IsolationanddetectionofA549lungcancercellsbasedonmagneticseparationandindirectimmunofluorescencetechnologies
Zhou Chaohui,FuCongying,JiaNengqin*
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai200234,China)
This article reports the development of a combining immunomagnetic separation technology with indirect immunofluorescence technology for separating and determining of the carcinoma A549cells.Magnetic beads weresynthesized by chemical precipitation.Immunomagneticbeads were constructed by grafted EGFR to the surface of Fe3O4nanoparticles coated by lipid.The carcinoma A549cells could specifically bind with the EGFR antibody on the immunomagnetic′s surface.The carcinoma A549cells could be isolatedand enriched from the mixed cellsunder the action of in the magnetic field.The separated cells could connect with the specific antibody contained PE fluorophore and the location of cellnucleus can be confirmed by DAPI to stain the cell nucleus.The carcinoma A549cells could be quantitatively detectedbyobserving inversion fluorescence microscope.All those results indicate that the method of combining Immunomagnetic separation technology and indirect immunofluorescence technology have a good specificity and high sensitivity for isolationand detection of the carcinoma A549cells.thedetection limit is three cells per milliliter.
CTCs; immunomagneticseparationtechnology; immunofluorescencetechnology; carcinoma A549cells
2017-05-31
国家自然科学基金面上项目(21373138);上海教委创新计划项目 (15ZZ070)
周朝辉(1988-),男,助理实验师,主要从事纳米生物技术方面的研究.E-mail:chaohuizhou@shnu.edu.cn
*通信作者: 贾能勤(1970-),男,教授,主要从事纳米生物技术、生物电化学、生物传感器等方面的研究.E-mail:nqjia@shnu.edu.cn
R73-34
:A
:1000-5137(2017)04-0489-10
