秀丽线虫对根际益生菌P13和S3-1传播作用及对植物生长的影响
2017-09-18,,
, ,
(上海师范大学 生命与环境科学学院,上海 200234)
秀丽线虫对根际益生菌P13和S3-1传播作用及对植物生长的影响
刘星星, 杨文武,陈佳佳,肖明*
(上海师范大学 生命与环境科学学院,上海200234)
通过缓慢杀线实验、偏好性实验和共培养毒性实验分析了秀丽线虫(Caenorhabditiselegans)对荧光假单胞菌P13(PseudomonasfluorescensP13)和解淀粉芽孢杆菌S3-1(BacillusamyloliquefaciensS3-1)传播的可能性.通过显微观察与平板稀释涂布对秀丽线虫细菌携带作用进行了定性、定量分析,并对细菌—线虫—植物三者交互作用进行初步探究.结果发现,P13和S3-1对秀丽线虫的慢性致死率分别为12.12%和3.00%,每10s身体弯曲次数分别为4.68和4.33.相对于尿嘧啶缺陷型大肠杆菌(OP50),线虫对P13和S3-1选择系数分别为0.13和0.52,P13、S3-1携带菌量分别为(4.02×103±47)和(9.67×102±22)CFU/条.携细菌线虫将细菌定向传播至植物根际,细菌定殖菌量为105CFU,有效促进植物生长发育.
秀丽线虫; 根际益生菌; 荧光假单胞菌P13; 解淀粉芽孢杆菌S3-1
0 引 言
土壤自由生线虫长期以来被认为是土壤生态的主要参与者,约占土壤线虫的90%[1],它们通过不断捕食细菌获取营养物质,移动能力较强,通过体表携带、肠道内携带与接触传染将细菌传播到营养物质丰富的区域[2].植物根际益生菌 (PGPR),是一类能够在植物根际存活定殖,增强植物防控病害能力或促进植物生长的有益微生物[3],已报道的具有防病促生潜能的根际益生菌包括假单孢菌属(Pseudomonas)、芽孢杆菌(Bacillus)、固氮菌属(Azotobacter)、农杆菌属(Agrobacterium)、沙雷氏属(Serratia)等20多个种属[4],其中芽孢杆菌属(Bacillussp.)和假单胞菌属为主要菌群.植物根际益生菌产生的环境友好型代谢产物可以作为生物肥料、杀虫剂等,在农业生产中有重要的意义.本研究利用秀丽线虫研究了土壤动物与荧光假单胞菌P13(PseudomonasfluorescensP13,以后简称P13)和解淀粉芽孢杆菌S3-1(BacillusamyloliquefaciensS3-1,以后简称S3-1)的相互作用,引入拟南芥和小青菜研究了线虫、细菌、植物三者间的交互关系,证明了土壤动物在环境健康中的重要作用,为两株根际益生菌的生物菌肥应用打下基础.
1 材料和方法
1.1材料
1.1.1 动物和细菌
秀丽线虫N2(CaenorhabditiselegansN2,以后简称线虫)野生型和标准食物尿嘧啶缺陷型大肠杆菌OP50(EscherichiacoliOP50),由华中科技大学吴政星教授提供.
P13具有链霉素抗性,S3-1由上海师范大学微生物分子生物实验室分离、纯化[5].
1.1.2 试剂和培养基
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 5g,琼脂15~20 g,1 000 mL ddH2O,pH=7.4~7.6.
KMB培养基:蛋白胨20 g,甘油10 mL,K2HPO4·3H2O 1.5 g,MgSO4·7H2O 1.5 g,琼脂粉15~20 g,1 000 mL ddH2O,pH自然.
NGM培养基:蛋白胨2.5 g,NaCl 3 g,琼脂粉15~20 g,去离子水975 mL,灭菌后加入物质的量浓度为1 mol/L的 MgSO41 mL,物质的量浓度为1mol/L 的CaCl21 mL,物质的量浓度为1 mol/L 的KPO4缓冲液25 mL,质量浓度为5 mg/mL的胆固醇1 mL,pH自然.
TSB培养基:琼脂粉15 g,胰蛋白酶大豆肉汤300 mg,1 000 mL ddH2O,pH自然.
MS培养基:MS固体粉2.215 g,琼脂粉质量分数为0.7%,1 000 mL ddH2O,用于植物培养.
碱裂解液:NaOH 2 g,体积分数为9%的NaOCl 10 mL溶解于100 mL容量瓶配置成溶液,用于裂解虫体.
M9缓冲液:NaCl 5 g,KH2PO43 g,Na2HPO46 g,物质的量浓度为1 mol/L 的MgSO41 mL,1 000 mL ddH2O.
1.2线虫对细菌传播可能性分析
1.2.1 线虫同步化
线虫正常培养一段时间后,采用新配制的碱裂解液将虫体裂解,获得对碱裂解液具有抵抗力的虫卵,将同步化后得到的卵液接种到覆有大肠杆菌OP50的NGM培养基上,20 ℃恒温培养箱培养同步发育至L4期[6].
1.2.2 缓慢杀线实验
根据Nina Neidig等[7]的方法,用缓慢杀线实验评价P13、S3-1菌株对线虫的毒性.
实验菌株培养24 h,用M9缓冲液洗下,稀释悬液浓度直至OD600=0.5.按10 μL/孔接种到1/100 TSB培养基的24孔板上,28 ℃培养2 h,每组6个重复.将L4期线虫用M9缓冲液洗下,每孔添加20 μL(约60条)线虫.记录开始时和24 h后线虫总数和死亡数.没有可见行动的线虫判断为死亡.
1.2.3 共培养毒性实验
根据文献[8],共培养毒性实验能用来确定S3-1和P13对线虫的长期影响.P13和S3-1在NGM培养基中培养24 h,接种混合虫龄的线虫,20℃培养5 d,记录10 s内线虫身体弯曲的次数.线虫爬行过程中,身体沿垂直咽泵方向的一次改变为一个身体弯曲.各组均随机挑选10条线虫测定.重复3次.
1.2.4 偏好性实验
根据文献[9],偏好性实验能直接反映线虫对不同菌株的捕食强度.采用直径为90 mm 的NGM平板,将10 μL菌株接种在平板两侧,距离板边缘约1.5 cm,直径约为0.5 cm的小孔内,中央接种20 μL(约50条)线虫,20 ℃培养24 h,计数两侧菌落上线虫数.
选择系数(CI):

C=1表示线虫趋向于被测菌株1,C=-1表示线虫趋向于被测菌株2,C=0表示无趋向.
1.3线虫对细菌传播能力测定
1.3.1 线虫肠道P13荧光显微观察
P13能够产生荧光色素,在紫外光下产生黄色荧光,将线虫在P13菌苔中培养5 d后,通过荧光显微镜观察线虫肠道内P13存在情况.将在OP50菌苔中生长的线虫接种至P13菌苔的NGM培养基中,20 ℃培养2 h,用M9缓冲液冲洗至容量为1.5 mL 的EP管,3 000 r/min离心3 min去上清液,重复3次,在荧光显微镜下观察.
1.3.2 线虫肠道细菌透射电镜观察
利用透射电子显微镜技术对线虫肠道横切面进行观察.将线虫接种在涂布有P13和S3-1(菌落浓度为107CFU/mL)的NGM平板中培养20 h,收集线虫;M9 缓冲液冲洗至容量为1.5 mL 的EP管,3 000 r/min离心3 min去上清液,重复3次.用体积分数为2.5%的戊二醛固定,4 ℃保存,样品进行切片观察.
对照组进行饥饿处理.在OP50菌苔中生长的线虫用M9 缓冲液冲洗至容量为1.5 mL的 EP管,3 000 r/min离心3 min去上清液,重复3次.将线虫接种至链霉素质量浓度为50 μg/mL的NGM无菌培养基中,培养24 h.
1.3.3 线虫携带细菌数量测定
将20 μL(约60条)线虫添加到涂有P13和S3-1的NGM平板上,培养3 d.随后将线虫移出至无菌平板,10条成年线虫转移到容量为1.5 mL的离心管,进行细菌数量确定实验.用以下方法计数线虫体表和体内的细菌:第一组在1 mL M9 缓冲液中稀释,轻轻晃动以洗下依附在线虫体表的细菌;第二组加入无菌石英砂,微型杵捣碎,释放线虫身体携带的所有细菌.利用平板稀释涂布法将菌悬液分别涂布在KB、LB培养基中,28 ℃培养24 h后计数菌落.重复3次.
1.4线虫传播细菌对植物生长的影响
1.4.1 植物培养与线虫接种
种子萌发:取优质小青菜种子,在KMnO4的质量分数为0.1%的溶液中浸泡20 min进行表面消毒,置于灭菌培养皿的滤纸上,用无菌水湿润,常温培养,幼苗长出2~3片真叶后进行实验.
在3种菌苔OP50、S3-1和P13中生长的线虫用M9 缓冲液冲洗至EP管,3 000 r/min离心3 min后去上清液,重复3次.将幼苗和20 μL(约60条)线虫接种于NGM平板两侧,20 ℃培养24 h后镜检.对照组只接种20 μL等量的菌悬液,不接种线虫.
1.4.2 植物根部细菌数量确定
培养7 d后的,将植物根部完全浸入无菌水中,充分晃动将根际表面细菌全部洗下,利用平板稀释涂布法将菌悬液分别涂布在KB、LB培养基中,28 ℃培养24 h后计数菌落.实验重复3次.
1.5数据分析
使用SPSS 19.0 和Origin8.5 软件进行数据分析.误差棒显示标准误差(P<0.05).所有重复实验结果相近.
2 结果和分析
2.1线虫对细菌传播可能性
2.1.1 缓慢杀线实验
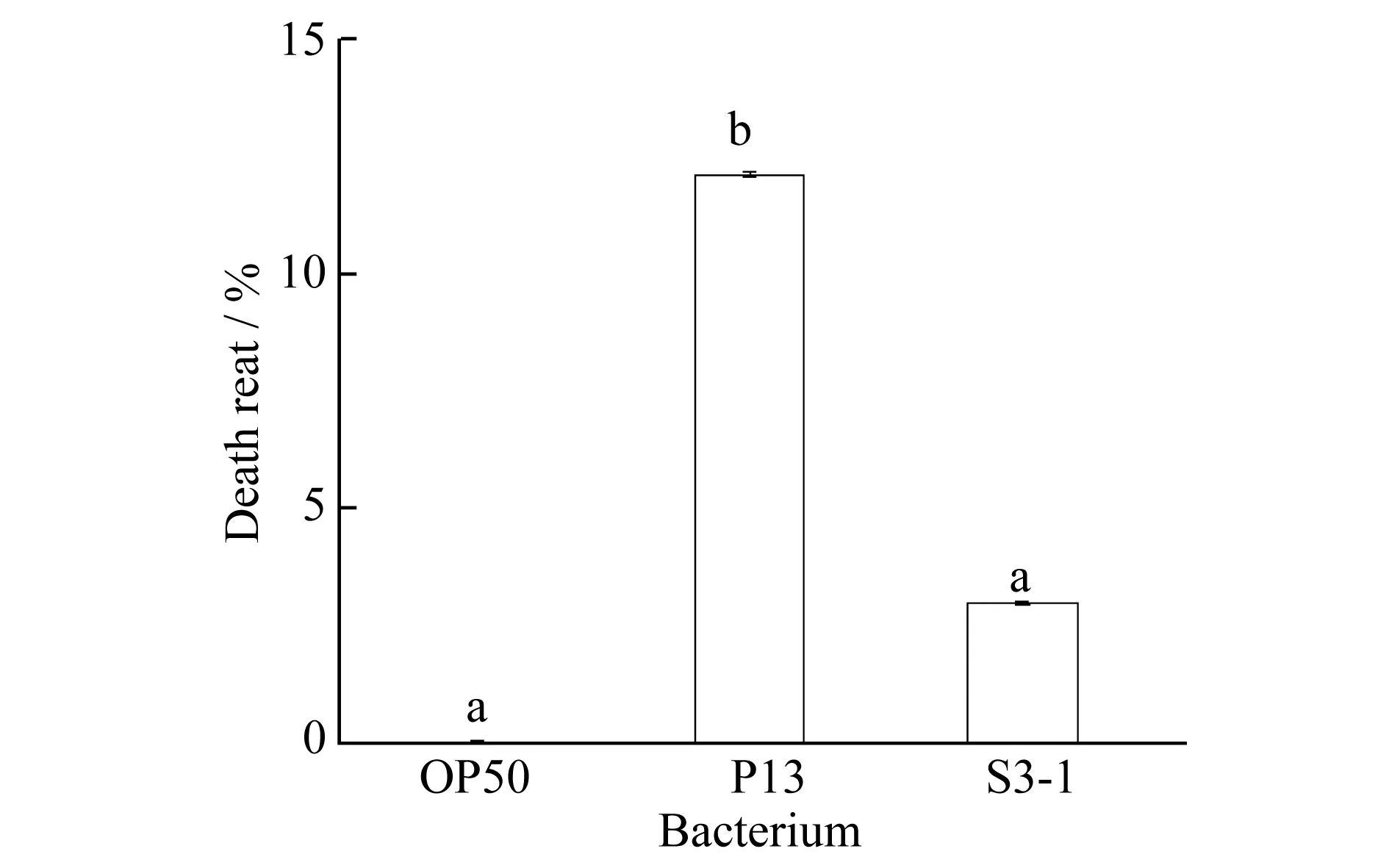
图1 线虫在缓慢杀线实验中的死亡率,多重字母标记法表示显著性差异(p<0.01)
图1为缓慢杀线实验中根际益生菌P13和S3-1对线虫短期致死率.数值为3次实验平均值.P13和S3-1对线虫的慢性致死率分别为12.12%和3.0%.相对于标准菌株OP50(死亡率为0%),P13表现出了杀线活性.S3-1与OP50差异不显著,而P13组与S3-1组表现出显著差异.但总体看来,两株根际细菌并没有表现出强烈的杀线虫活性,与对照组相比,S3-1几乎没有杀线虫能力,P13的杀线虫能力一般.
2.1.2 共培养毒性实验
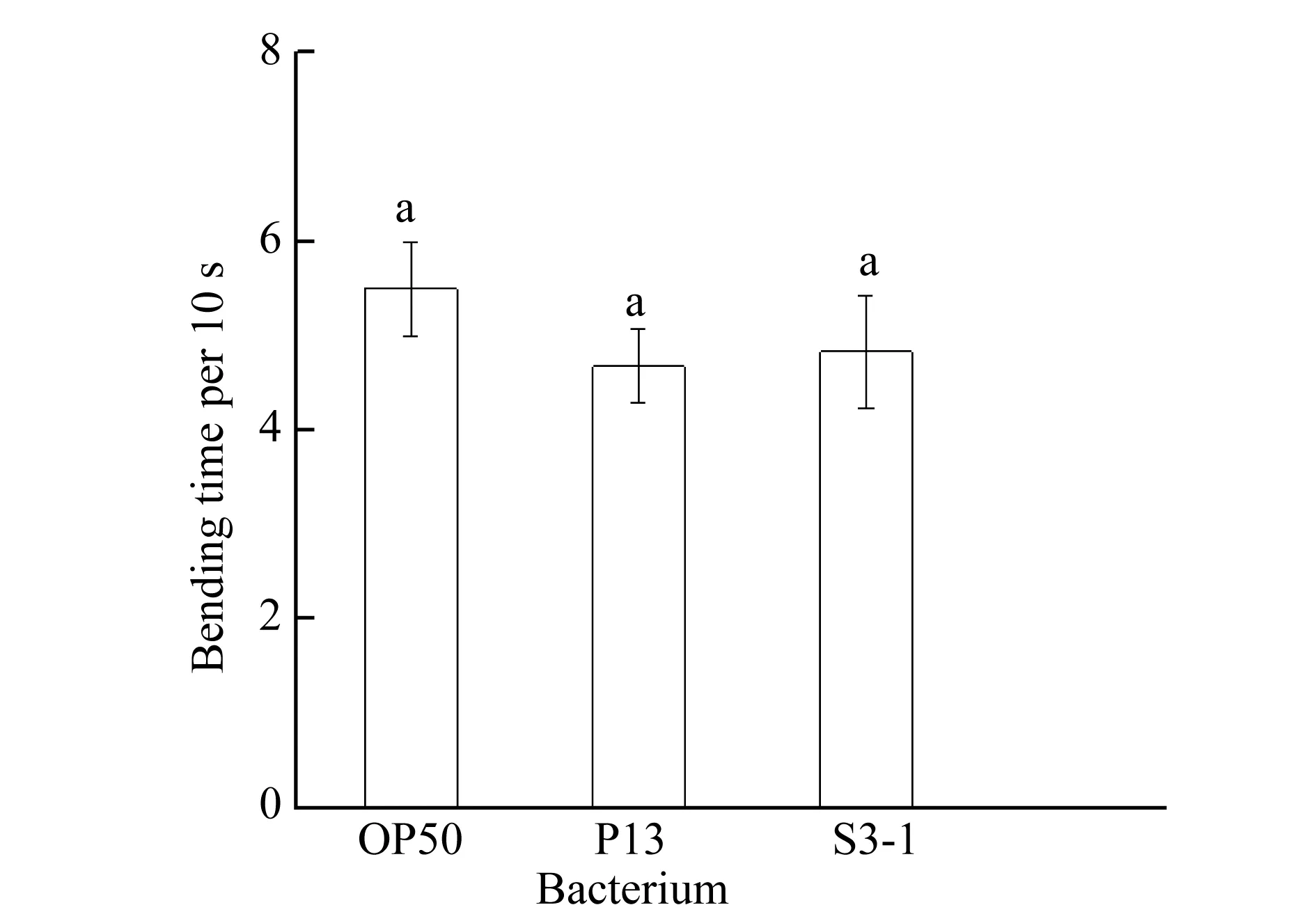
图2 线虫在各菌株内每10 s身体弯曲次数比较多重字母标记法表示显著性差异(p<0.01)
喂食S3-1、P13和OP50菌株5 d后,线虫每10 s身体弯曲次数分别为4.33、4.68和5.50,如图2所示.与标准菌株OP50比,P13和S3-1与对照组没有显著差异.虽然运动线虫的身体弯曲频率差异不显著,但在P13菌苔中线虫运动范围较广,且很少停在固定位置.而在S3-1菌苔中培养的线虫多聚集在菌落周围,有的会长时间停留在菌落上进行摄食不活动.共培养实验中,线虫均能以根际益生菌S3-1和P13为食,且P13中线虫生长较快,成虫较多.
2.1.3 偏好性实验
图3为3种菌株相互对比的选择性系数(CI)的平均值.从图3中可以看出,随机选择几乎不影响实验结果.S3-1和P13相对OP50的选择系数分别为0.52和0.13.与OP50相比,线虫偏好捕食根际益生菌.同时存在S3-1和P13菌株时,S3-1相对P13的选择系数为0.32,即线虫同样偏好捕食S3-1.由此可知,线虫显著偏好S3-1,对P13表现出轻微偏好.实验中,线虫在P13和S3-1菌株均没有明显的死亡现象,且线虫可以正常生长、繁殖.
2.2线虫对细菌传播能力测定
2.2.1 荧光显微成像分析
P13能够产生荧光色素,在紫外光下呈现黄色荧光,如图4所示.喂食P13后,在线虫的咽和中肠观察到了黄色荧光,P13在线虫肠道前部大量聚集.而经饥饿处理的对照组其咽和肠道并没有荧光现象.研究结果进一步证明,线虫能够以P13为食物,且P13能够聚集在线虫的整个消化道中.
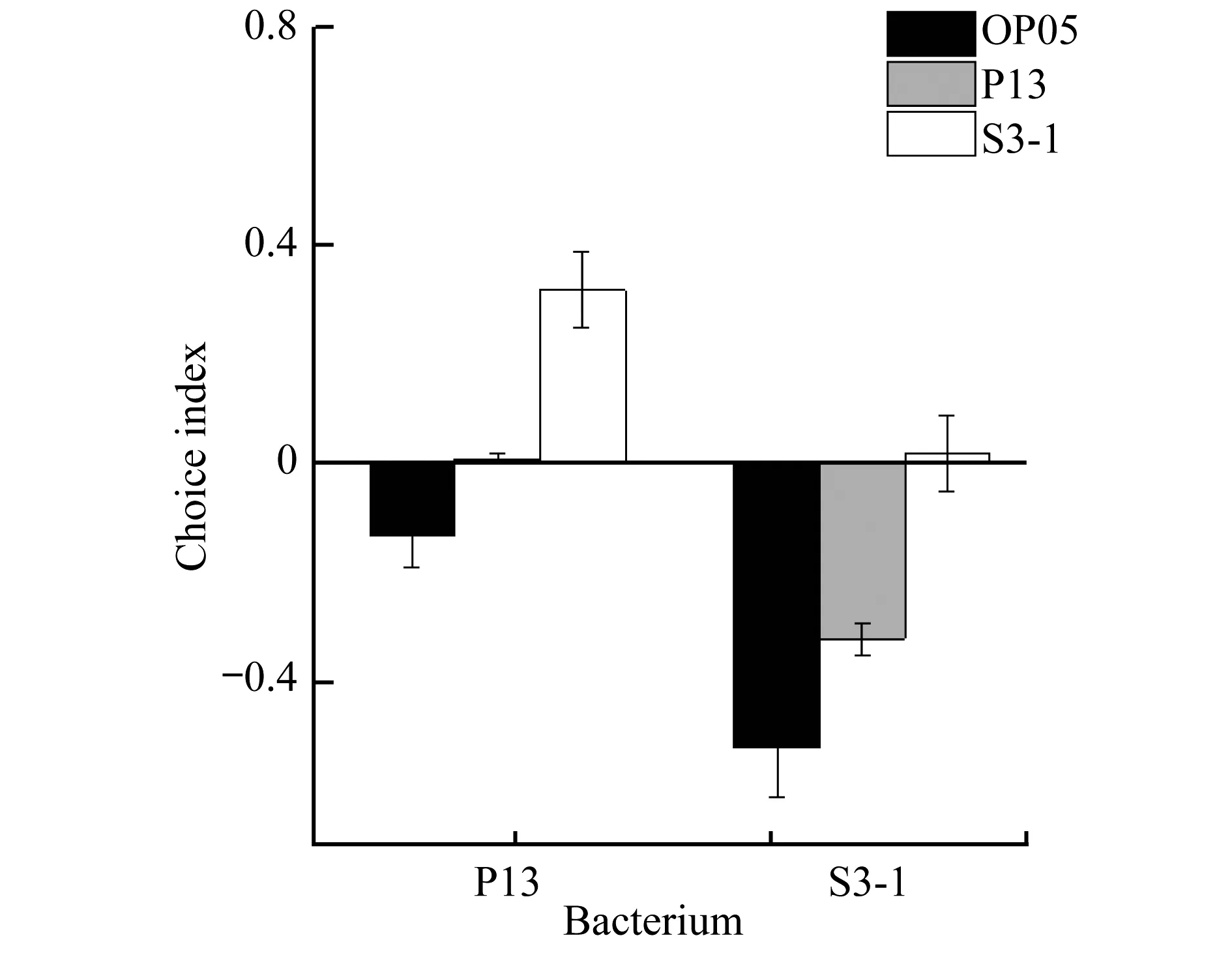
图3 线虫对细菌偏好性
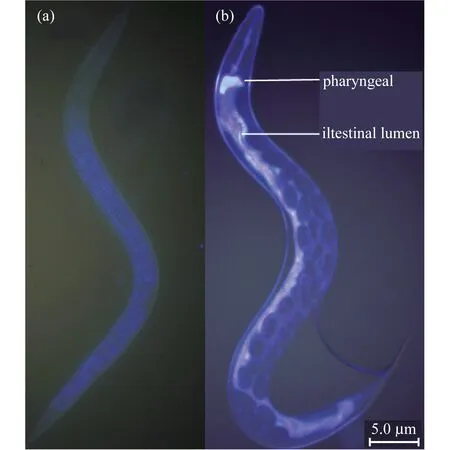
图4 线虫肠道内P13荧光观察结果.(a) 饥饿处理对照组;(b) 线虫与P13共培养
2.2.2 线虫肠道细菌透射电镜观察
用透射电镜对在两株根际益生菌P13和S3-1中培养的线虫进行横向切片观察,在线虫的肠道内均观察到两种细菌,如图5所示,经过饥饿处理的线虫肠道非常干净,没有菌体存在,说明线虫肠道中食物全部清除(图5(a)、5(d)).由图可清楚地观察到被锇酸染成黑色的杆状或短杆状细菌(图5(b)、5(c)).P13 菌苔中培养的线虫肠道中可观察到一些菌体细胞,但大部分菌体细胞已经破碎、不完整,细菌长度为1.4~1.7 μm,宽度为0.5~0.8 μm(图5(e)).而在S3-1 菌苔中培养的线虫肠道中,可观察到许多完整的菌体细胞,及厚厚的荚膜(图5(f)).据此推测,线虫对于P13 细菌消化水平较高,S3-1 菌体在线虫肠道中的完整程度较高,这可能是由于P13为G-菌,线虫易捕食和消化,而S3-1为G+菌,细胞壁较厚且受到芽孢保护,不利于线虫捕食并将其快速消化.
2.2.3 线虫携带细菌数量测定
图6显示,线虫体表携带3种细菌量分别为(3.38×102±12) CFU/条(OP50),(3.07×103±32) CFU/条(P13),(71±12) CFU/条(S3-1),体内携带细菌数量分别为(8.84×102±30) CFU/条(OP50),(9.5×102±36) CFU/条(P13),(8.96×102±21) CFU/条(S3-1).线虫体表携带P13细菌量最高,S3-1细菌携带量最低,对两株菌携带量有显著差异.线虫体内携带OP50、P13和S3-1细菌数量相差不大,约为102.线虫对P13携带总量在三者中最高(4.02×103±47) CFU/条,其次为OP50(1.2×103±37) CFU/条,最低为S3-1(9.67×102±22) CFU/条.可能原因是经线虫长期捕食后,细菌能够稳定地聚集在肠道中,导致含菌数量相差不大.比较结果发现,线虫对G-菌株表现出较强的携带能力且体表和肠道均能被细菌所依附,而对于G+菌株的携带能力相对较弱且主要由肠道发挥携带功能.S3-1能够形成荚膜和生物膜,将菌体凝聚在一起不易分开,再加上菌落本身具有粘性,致使S3-1不易在线虫表面依附.
2.3线虫传播细菌对植物生长的影响
2.3.1 线虫携带细菌趋向植物根际运动
首先利用模式植物拟南芥进行了线虫向植物的趋向性研究.在接种3种细菌和线虫24 h后,根部就有线虫出现,而其他部位没有线虫,如图7所示.线虫表现出根部趋向性,3 d后拟南芥根部聚集了大量线虫.
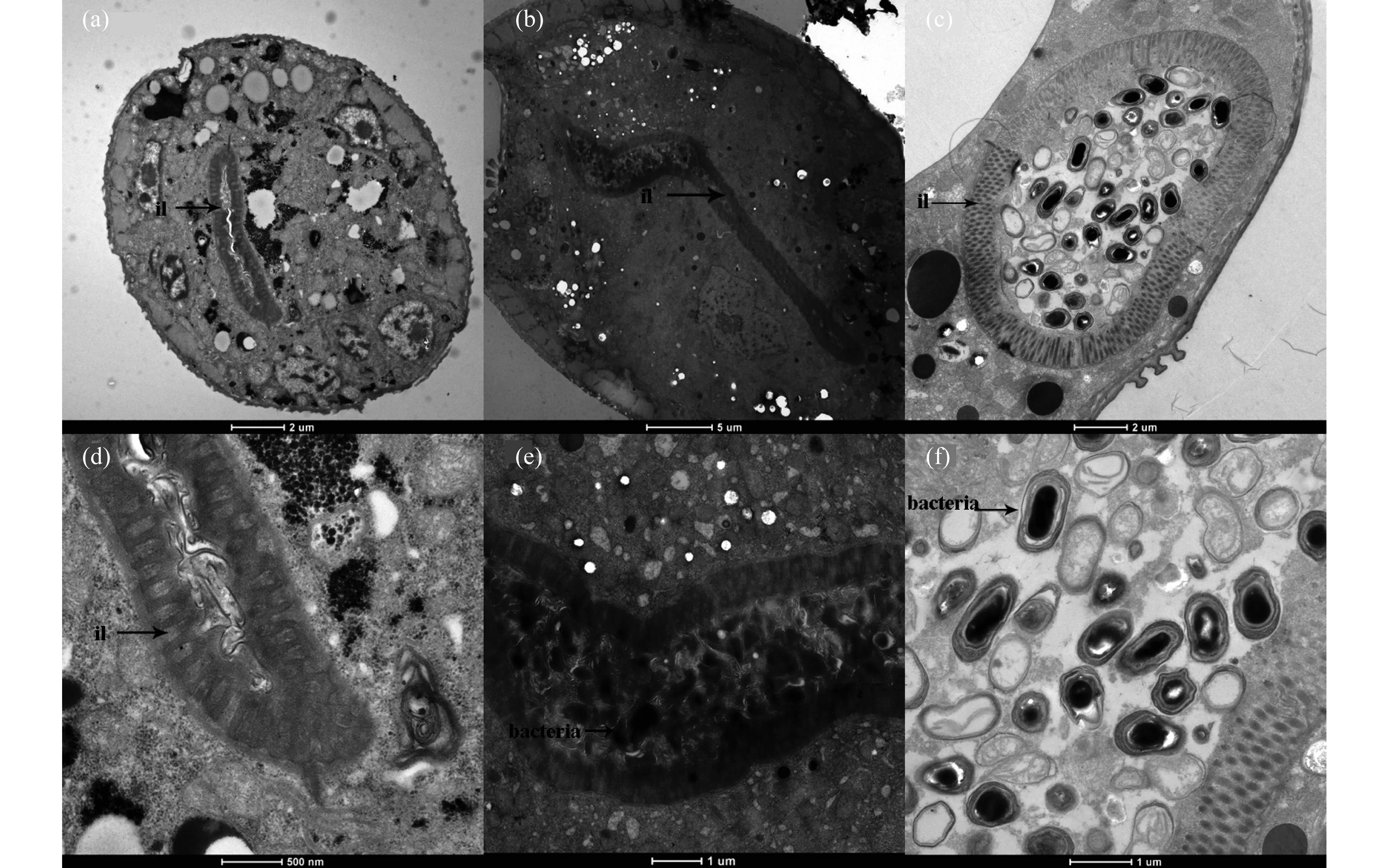
图5 线虫肠道横切面透射电镜图.(a),(d) 饥饿处理线虫;(b),(e) 线虫与P13共培养;(c),(f) 线虫与S3-1共培养(il=intestinal lumen)

图6 线虫携带细菌数量对数平均值,多重字母标记法表示显著性差异(p<0.01)
选择小青菜进一步探索线虫对于其他植物的趋向性运动.在培养24 h后,线虫本身携带的细菌长出菌落.无线虫细菌菌落不能在MS培养基上移动.当细菌与线虫共同接种后,P13 和S3-1细菌沿接种部位向周围扩散,如图8所示.
2.3.2 线虫向植物根部传播细菌数量
P13和S3-1随线虫运动被运送到植物根部,如图9所示,7 d共培养后在根部分离出P13和S3-1.每株植物根际细菌定殖数量分别为(7.4×104± 3218) CFU(OP50),(7.5×104±3251) CFU(P13),(6.1×104± 3329) CFU(S3-1),平均每株细菌总量高达105CFU.
2.3.3 线虫传播细菌对小青菜生长作用影响
与不经菌株处理的对照(CK)相比,经过菌株处理的小青菜的鲜重和干重均有明显增加,如图10(a)所示.接种P13、P13+线虫、S3-1、S3-1+线虫后,小青菜的鲜重分别增加了71.64%,85.07%,101.49%,176.11%.干重分别增加了12.12%,30.30%,42.42%,69.70%.说明根际益生菌和线虫存在时能够增加植物重量.P13组与P13+线虫组植物鲜重和干重并没有显著差异.在4个处理组中,接种了线虫和S3-1组植物的鲜重和干重达到最大值.
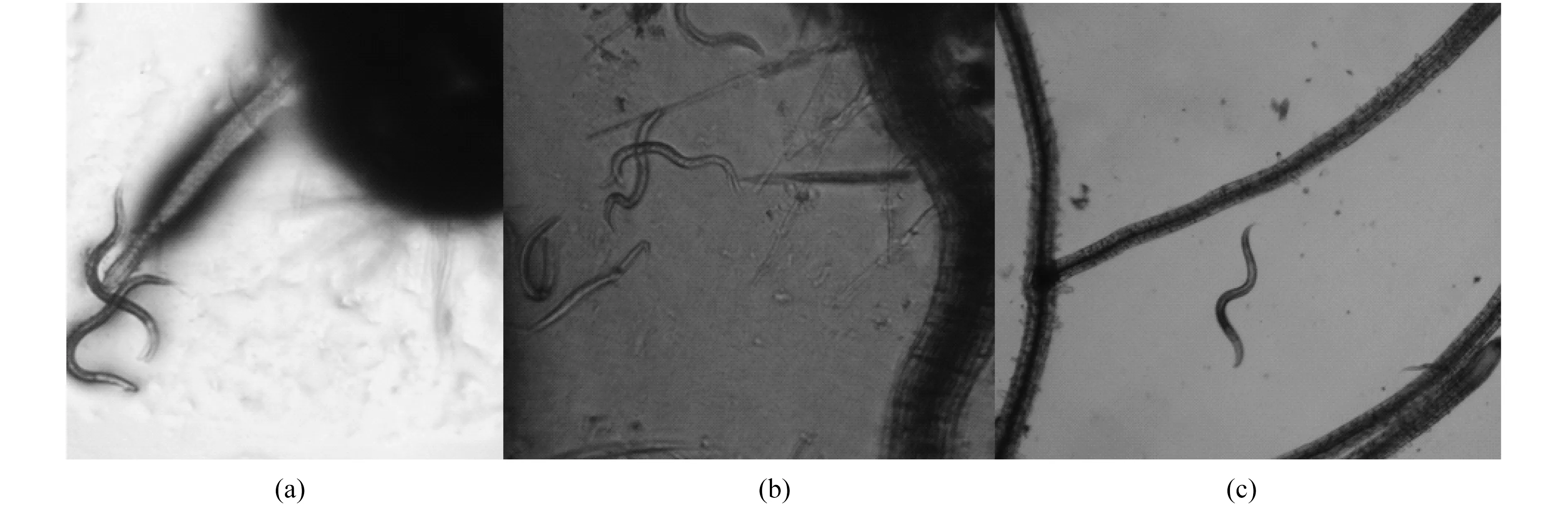
图7 4倍显微镜下植物根部的线虫.(a) OP50;(b) P13;(c) S3-1
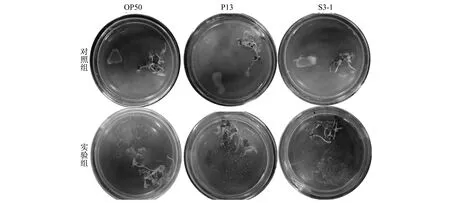
图8 线虫对根际益生菌传播效果
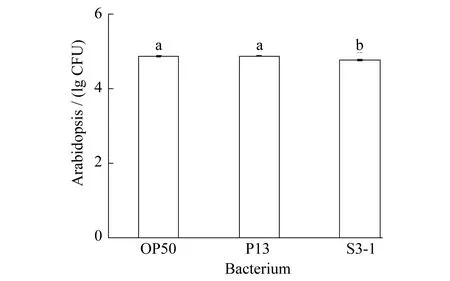
图9 植物根际细菌定殖数量对数平均值,多重字母标记法表示显著性差异(p<0.01)
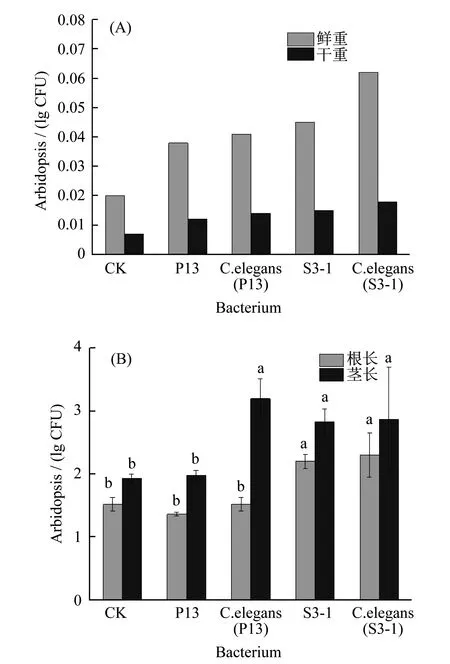
图10 线虫传播细菌对小青菜生长的影响.(A) 质量;(B) 长度,多重字母标记法表示显著性差异(p<0.01)
图10(b)为线虫传播细菌对小青菜根长的影响.在所有处理组中,P13对根长的促进作用最低,线虫存在时,根长恢复到了与对照组相似水平,可能是线虫影响了菌株活性,降低了其毒性作用.S3-1和S3-1+线虫对根长的促进效果明显,较其对照组有显著差异.P13+线虫能够显著影响植株茎长的生长.综合结果,单独接种P13时,其促生效果不明显,与对照组无显著差异.当有线虫存在时,能够显著缓解P13的毒性作用,发挥其促生效果.单独接种S3-1时,与对照组相比,可以有显著地促进根长茎长.与对照相比,S3-1+线虫组同样能够促进植株根、茎伸长,同时比单独接种S3-1时,效果更佳.
3 讨 论
土壤线虫主要通过影响微生物和作物根系的生长来改变土壤的微环境,促进植物地上部分的生长,具有十分重要的生态功能.线虫对细菌的传播是线虫与细菌相互作用、共同影响的.
在自然环境中,线虫对不好吃或有毒的菌种会表现出排斥行为,直接影响其对细菌的捕食与传播能力;而细菌对线虫的吸引能力及其对线虫的生长、繁殖以及寿命的影响会直接影响线虫对细菌的传播.例如,一些细菌产生的代谢产物,如2,4-DAPG[7]、PCA[10]等抗生素,丝氨酸蛋白酶、几丁质酶、胶原酶等胞外蛋白酶[11],氰化氢(HCN)等杀线虫气体[12]能杀死线虫影响传播.Brent等[13]发现培养基的酸化能激活PCA毒性并在几小时内杀死线虫.P13具有广谱抗菌作用,对油菜菌核病菌有较强的拮抗作,其轻微杀线虫能力,可能与其能够产生的HCN有关.
一些细菌的代谢产物能保护线虫免受病原菌伤害.Iatsenko[14]研究了线虫肠道中B.subtilisGS67对病原菌的作用,B.subtilisGS67产生的脂肽抗生素丰原素能直接抑制病原菌感染线虫并增强线虫对病原菌的抵抗能力.S3-1对多种真菌病害具有很好的抗性,能够产生表面活性素和伊枯草菌素,没有杀线虫能力,可能与其能产生脂肽抗生素相关.
线虫在土壤中捕食细菌获取营养物质,通过体表携带[15]、肠道内携带与接触传染[16]将细菌传播到营养物质丰富的区域.有研究表明线虫只吸收20%的食物,将其余80%排出体外[17],线虫摄食的细菌通过肠道后大部分仍保持活性[18].Félix和Duveau[19]研究野外捕获的线虫通常庇护大量微生物于肠道内.Kenney等[20]发现线虫肠道可以帮助细菌对抗环境压力,甚至死后也具备保护能力.本研究中,线虫短期内能迅速捕食S3-1和P13,并能庇护约102活菌于肠道中,不能将两种菌株完全消化.
Jun-ichiro等[21]证实线虫对植物根部具有趋化性,植物根部能产生挥发性有机物(VOCs)吸引线虫向根部运动.他们研究了线虫将有益细菌携带至植物根际的行为,在平板和盆栽条件下观察了植物、根瘤菌和食菌线虫的交互关系[22],发现植物根部分泌的VOCs吸引携带细菌的线虫前往,在苜蓿根部形成根瘤.表明根瘤菌能在线虫体内存活,并有生理活性.本研究中,线虫在24 h内即可对植物根部作定向运动,并且每株植物根际约有105CFU的根际细菌定殖.P13和S3-1在植物根际定殖能够促进植物根和茎的伸长,增加植物干重和鲜重.线虫对于细菌的传播促进了植物生长,对其生长有重要的促进作用.
4 结 论
在实验室条件下,根际益生菌荧光假单胞菌P13对野生型秀丽隐杆线虫N2表现出轻微杀线虫活性,S3-1几乎没有杀线虫活性.同等条件下,线虫更偏好于捕食S3-1.与P13和S3-1共培养后,线虫均能以体表携带和体内携带的方式将根际细菌传播至植物根际,促进植物干重、鲜重增加以及根、茎的伸长.在一个开放的系统中,根际益生菌—线虫—植物三者的互动可能对生态系统的稳定也有积极意义,全面理解线虫、根际益生菌的环境与生态效应还需在多种作物和不同地域进行田间实验.
[1] 凌斌,肖启明.土壤线虫在食物网中的作用 [J].安徽农学通报,2008,14(11):39-40.
[2] Anderson R,Trofymow V J A,Coleman D C,et al.Phosphorus mineralization by a soil pseudomonad in spent oil shale as affected by a rhabditid nematode [J].Soil Biology and Biochemistry,1982,14(4):365-371.
[3] Gray E J,Smith D L.Intracellular and extracellular PGPR:Commonalities and distinctions in the plant-bacterium signaling processes [J].Soil Biology and Biochemistry,2005,37(3):395-412.
[4] 刘琳,孙磊,张瑞英,等.春兰根中可分泌吲哚乙酸的内生细菌多样性 [J].生物多样性,2010,18(2):182-187.
Liu L,Sun L,Zhang R Y,et al.Diversity of IAA-producing endophytic bacteria isolated from the roots of Cymbidium goeringii [J].Biodiversity Science,2010,18(2):182-187.
[5] Li H,Li H,Bai Y,et al.The use of Pseudomonas fluorescens P13 to control sclerotinia stem rot (Sclerotinia sclerotiorum) of oilseed rape [J].Journal of Microbiology,2011,49(6):884-889.
[6] Van Gilst M R,Hadjivassiliou H,Yamamoto K R.A Caenorhabditis elegans nutrient response system partially dependent on nuclear receptor NHR-49 [J].Proceedings of the National Academy of Science of the United States of America,2005,102(38):13496-13501.
[7] Neidig N,Paul R J,Scheu S,et al.Secondary metabolites of Pseudomonas fluorescens CHA0 drive complex nNon-trophic interactions with bacterivorous nematodes [J].Microbial Ecology,2011,61(4):853-859.
[8] Tsalik E L,Hobert O.Functional mapping of neurons that control locomotory behavior in Caenorhabditis elegans [J].Journal of Neurobiology,2003,56(2):178-197.
[9] Abada E A,Sung H,Dwivedi M,et al.C.elegans behavior of preference choice on bacterial food [J].Molecules and Cells,2009,28(3):209-213.
[10] Cezairliyan B,Vinayavekhin N,Grenfelllee D,et al.Identification of pseudomonas aeruginosa phenazines that kill Caenorhabditis elegans [J].PLOS Pathogens,2013,9(1):1-9.
[11] Yang J,Liang L,Li J,et al.Nematicidal enzymes from microorganisms and their applications [J].Applied Microbiology and Biotechnology,2013,97(16):7081-7095.
[12] Gallagher L A,Manoil C.Pseudomonas aeruginosa PAO1 kills Caenorhabditis elegans by cyanide poisoning [J].Journal of Bacteriology,2001,183(21):6207-6214.
[13] Cezairliyan B,Vinayavekhin N,Grenfell-Lee D,et al.Identification of Pseudomonas aeruginosa phenazines that kill Caenorhabditis elegans [J].Plos Pathogens,2013,9(1):1-9.
[14] Iatsenko I,Yim J J,Schroeder F C,et al.B.subtilis GS67 protects C.elegans from Gram-positive pathogens via fengycin-mediated microbial antagonism [J].Current Biology,2014,24(22):2720-2727.
[15] Standing D,Knox O G G,Mullins C E,et al.Influence of nematodes on resource utilization by bacteria—an in vitro study [J].Microbial Ecology,2006,52(3):444-450.
[16] Diaz S A,Restif O.Spread and transmission of bacterial pathogens in experimental populations of the nematode Caenorhabditis elegans [J].Applied and Environmental Microbiology,2014,80(17):5411-5418.
[17] Griffiths B S.Microbial-feeding nematodes and protozoa in soil:Their effects on microbial activity and nitrogen mineralization in decomposition hotspots and the rhizosphere [J].Plant and Soil,1994,164(1):25-33.
[18] Smerda S M,Jensen H J,Anderson A W.Escape of Salmonellae from chlorination during ingestion by Pristionchus lheritieri (Nematoda:Diplogasterinae) [J].Journal of Nematology,1971,3(3):201-204.
[19] Félix M A,Duveau F.Population dynamics and habitat sharing of natural populations of Caenorhabditis elegans and C.briggsae [J].BMC Biology,2012,10:59.
[20] Kenney S J,Anderson G L,Williams P L,et al.Persistence of Escherichia coli O157:H7,Salmonella Newport,and Salmonella Poona in the gut of a free-living nematode,Caenorhabditis elegans,and transmission to progeny and uninfected nematodes [J].International Journal of Food Microbiology,2005,101(2):227-236.
[21] Horiuchi J,Badri D V,Kimball B A,et al.The floral volatile,methyl benzoate,from snapdragon (Antirrhinum majus) triggers phytotoxic effects in Arabidopsis thaliana [J].Planta,2007,226(1):1-10.
[22] Horiuchi J,Prithiviraj B,Bais H P,et al.Soil nematodes mediate positive interactions between legume plants and rhizobium bacteria [J].Planta,2005,222(5):848-857.
(责任编辑:顾浩然)
TheeffectsofCaenorhabditiselegansonplantgrowth-promotingrhizobacteriaandplantgrowth
Liu Xingxing,YangWenwu,ChenJiajia,XiaoMing*
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai200234,China)
The diversity and ecology functions of soil nematodes have gained comprehensive attentions.In this study,we conducted a series of experiments (the slow killing assay,long time toxicity experiment and preference experiment)to test whether nematodesCaenorhabditiselegans(C.elegans) may contribute to the spread of the P13and S3-1.Combining microscopic observation with dilution-plate method,we analyzed the bacteria carried byC.elegans.Furthermore,we preliminarily explored the interactions of bacteria,nematodes and plants.Death rates ofC.elegansin slow killing assay driven by two strains were12.12% (P13) and3.0% (S3-1),separately.The body bending frequencies ofC.eleganswere4.68/10s (P13) and4.33/10s (S3-1),respectively.Choice indexes of P13and S3-1were0.13and0.52,separately.The total numbers of bacteria carried byC.eleganswere4.02×103±47(P13) and9.67×102±22(S3-1).C.eleganscarried bacteria to the rhizosphere where the bacteria content was as high as105CFU per plant root.As a vector of rhizosphere bacteria,C.eleganscan carry P13and S3-1to plant rhizosphere and effectively promote plant growth and development.
Caenorhabditiselegans; plant growth-promoting rhizobacteria;PseudomonasfluorescensP13;BacillusamyloliquefaciensS3-1
2016-07-03
上海市2016年度“科技创新行动计划”项目(16391902100)
刘星星(1989-),女,硕士研究生,主要从事土壤微生物学、动物学等方面的研究.E-mail:sjzliuxing2011@163.com
导师简介: 肖 明(1961-),男,博士后,博士生导师,主要从事环境微生物、分子生物学以及微生物与植物相互关系等方面的研究.E-mail:xiaom88@shnu.edu.cn
Q932
:A
:1000-5137(2017)04-0460-09
*
