氯过氧化物酶与苯酚降解菌株的协同降解动力学研究
2017-09-18张永
, , , , , 张永
(上海师范大学 生命与环境科学学院,上海 200234)
氯过氧化物酶与苯酚降解菌株的协同降解动力学研究
张 莹,楚启玉,陈淼,陈军,肖明,张永明
(上海师范大学 生命与环境科学学院,上海200234)
氯过氧化物酶(CPO)催化苯酚与H2O2发生过氧化反应生成邻苯二酚,能减轻苯酚对降解菌株的抑制作用,加快降解菌株对苯酚的生物降解.实验结果表明:在2h内适量的H2O2存在时10U/L的CPO可以使300mg/L苯酚降解率达到67.85%,而CPO与降解菌株协同作用下苯酚降解率则可达到70.72%,比单一菌株降解率8.52%提高了62.2%.在降解体系中补充邻苯二酚进一步揭示了CPO氧化苯酚的中间产物有利于菌体细胞形成共基质效应,提高细胞的苯酚生物降解效率.降解动力学分析显示:在苯酚质量浓度为100~1200mg/L时,CPO与菌株协同降解体系的最大比降解速率qmax=0.000195h-1,基质饱和常数Ks=1.0501mg/L,基质抑制常数KI=5.1272mg/L.
氯过氧化物酶; 过氧化作用; 协同生物降解; 苯酚残留; 降解动力学
0 引 言
苯酚是许多化工废水的主要污染成分[1-4],苯酚结构中羟基化学性质活泼,苯环结构稳定,因此即使在低剂量污染的状态下,苯酚也会快速与蛋白质等生物活性物质发生反应,同时还会通过食物链的富集效应在生物体中积累,对生物体产生毒害作用[5-6].生物降解苯酚是解除苯酚污染的主要手段,目前对苯酚生物降解的研究多集中在高效降解菌株的筛选和选育等方面[7-10].由于微生物通常需要几小时甚至几十小时的延滞期才能在细胞内合成降解苯酚的酶系,对苯酚污染的生物危害解除速度慢,而且高浓度苯酚也会对降解菌株的生长产生明显的抑制作用[11],影响了生物降解苯酚的效率.
有报道研究了过氧化酶对苯酚、氟酚等芳香族化合物的氧化作用[12-17],其中以辣根过氧化物酶(Horseradish Peroxidase,HRP)的研究最多[18].近年来,氯过氧化物酶(Chloroperoxidase,EC1.11.1.10,CPO)被用于染料氧化脱色[19-20]、芳烃氯化或脱氯[21-22]等方面的研究,具有良好的应用效果.CPO是一种含有高铁(IX)原卟啉为辅基的血红素糖蛋白[24],其结构的多重性赋予了CPO具有广泛的底物适应性,可以催化卤素离子、芳香族化合物、脂肪族化合物和醇类化合物等进行过氧化反应[25-26].已有的研究显示CPO可以更加快捷地钝化芳烃物质化学活泼性,有利于提高微生物对芳烃的可生化性能,对芳烃污染环境的生态修复具有重要的作用[27-29].本研究运用CPO与苯酚降解菌混合处理苯酚废水,探讨CPO与微生物菌株协同降解苯酚的特征,建立一种快速减少苯酚污染的生物毒性,提高苯酚降解速率的复合降解途径.
1 材料与方法
1.1培养基及化学试剂
无机盐培养基(MSM):Na2HPO46 g/L,KH2PO43 g/L,NaCl 0.5 g/L,NH4Cl 1 g/L,FeSO40.025 g/L,酵母膏0.2 g/L,MgSO40.24 g/L,CaCl20.011 g/L,pH=6.5~6.8,按实验需要量加入相应浓度的葡萄糖或苯酚,0.1 MPa,20 min灭菌.
1,1-二甲基-4-氯3,5-环己二酮(MCD)购于Sigma公司,MCD溶于含有20 mmol/L KCl的物质的量浓度为0.1 mol/L的磷酸钾缓冲溶液中,配制成物质的量浓度为0.1 mmol/L的MCD溶液.
过氧化氢溶液:物质的量浓度为10 mmol/L的过氧化氢每周配制新鲜溶液并在4℃下保存于棕色瓶中.
邻苯二酚等试剂购于上海国药有限公司.
1.2CPO及苯酚降解菌株
CPO利用海洋真菌(Caldariomycesfumago)发酵生产[30],发酵液经过纯化至酶浓度为6 146.24 U/mL,蛋白质质量浓度为24.35 mg/mL,RZ=A403 nm/A280 nm=1.12.其中,A403 nm是此酶含铁卟啉结构在403 nm波长下的特定吸光度;A280 nm是蛋白质分子的特定吸光度,Rz为该酶纯度的量值.
苯酚降解菌株分离于上海龙华污水处理场厌氧/好氧(A/O)处理池的活性污泥,经鉴定为Micrococcuscalcoaceticus[31].
1.3实验方法
1.3.1 CPO活力及基质含量测定
CPO活力单位定义及测定方法参照[32].
苯酚含量测定使用Agilent 1260系列HPLC检测,检测条件:柱温25 ℃,柱型号C18 4.6 mm×250 mm,恒流1.0 mL/min洗脱,检测器:紫外检测波长:280 nm,流动相:VA(甲醇)∶VB(体积分数为10%的36%乙酸水溶液)=77∶23.
化学需氧量(COD)的测定采用重铬酸钾比色法[31].
1.3.2 苯酚生物降解实验
经过活化的苯酚降解菌株Micrococcuscalcoaceticus接入添加了质量浓度为500 mg/L的葡萄糖的MSM培养基中,添加50 mL培养液入三角瓶(容量为250 mL),30 ℃,200 r/min培养24 h后,在10 ℃,10 000 r/min高速冷冻离心10 min,用MSM悬浮离心两次制取细胞悬浮液,并在无碳MSM中30 ℃,180 r/min下培养12 h使菌体细胞处于碳饥饿状态,以MSM调节菌悬液浓度至OD600值为1.0作为降解实验接种菌液.
CPO对苯酚转化实验在苯酚质量浓度为100~1 200 mg/L的MSM中,加入最终质量浓度为5 mg/L的H2O2,再加入一定活力浓度的CPO制备液.
菌株苯酚降解实验分别在MSM中添加质量浓度为100~1 200 mg/L的苯酚,接种2 mL菌液.
协同降解实验为CPO与菌株在苯酚质量浓度为100~1 200 mg/L的MSM中同时加入最终浓度为5 mg/L的H2O2,不同活力浓度的CPO和2 mL菌液的情况下进行.以MSM只加5 mg/L的H2O2,不加入CPO和菌液的含相应苯酚浓度的MSM为空白对照.降解反应在30 ℃,150 r/min振荡条件下完成.间隔一定时间测定降解液中苯酚浓度.以上实验均设置3组平行重复.
1.3.3 苯酚协同生物降解动力学特征描述
通过实验描述CPO对苯酚的单独或与苯酚降解菌协同降解苯酚的特征,分析CPO对不同初始质量浓度S0(mg/L)的苯酚降解特性,考察在CPO与降解菌共同降解苯酚的比降解速率q(h-1),选择合适的降解动力学模型,求找实验条件下不同苯酚浓度下的最大比降解速率qmax(h-1),基质饱和常数Ks(mg/L)以及基质抑制常数KI(mg/L).以上实验均设置3组平行重复.
2 结果与讨论
2.1CPO对苯酚降解的影响
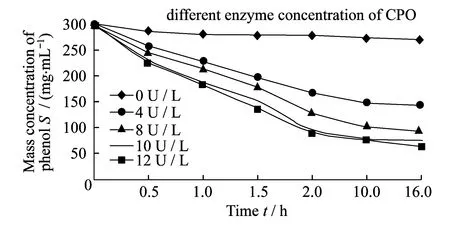
图1 CPO对苯酚的生物降解曲线
单独添加最终浓度0、4、8、10和12 U/L的CPO,同时加入5 mg/L的H2O2,苯酚初始质量浓度为300 mg/L,实验条件下酶解苯酚16 h,考察苯酚初始浓度S0不变,改变CPO浓度E0对苯酚反应速率的影响,考察CPO转化反应中最适酶浓度对苯酚转化的影响,结果如图1所示.
CPO在2 h内对300 mg/L苯酚具有稳定的苯酚转化能力,随着CPO浓度从0增加为12 U/L,2 h内苯酚的降解率(S/S0)分别为7.25%、43.93%、56.62%、67.85%和69.45%.当CPO浓度为12 U/L时,苯酚降解率比10 U/L时只微增1.6%,CPO浓度能已经接近饱和.检测反应1.5 h 时10 U/mL CPO反应液中苯酚质量浓度为152.21 mg/L,而此时测出反应液中邻苯二酚的质量浓度为145.64 mg/L,说明CPO氧化苯酚的主要产物为邻苯二酚,这与Litvintsev等[33-34]观察到的苯酚优先转化为邻苯二酚的现象相符合.
2.2添加邻苯二酚对苯酚降解的共基质效应
分别在两种情况下比较菌株协同降解苯酚的特征.第一组:苯酚质量浓度为300 mg/L时不添加或添加10 U/mL的CPO;第二组:苯酚质量浓度为150 mg/L时不添加或添加150 mg/L邻苯二酚,考察CPO氧化的中间产物邻苯二酚对菌株降解苯酚的促进作用,结果如图2所示.
从图2可知,苯酚初始质量浓度为300 mg/L时添加10 U/mL的CPO,2 h内菌株对苯酚的降解率为70.72%,16 h内为88.31%;而单纯菌株对苯酚的降解率只有8.52%(2 h)和71.63%(16 h).150 mg/L苯酚液与同时补充150 mg/L邻苯二酚的降解液2 h苯酚降解率分别为11.79%和32.18%,16 h分别为48.36%和72.09%.说明添加CPO确实能提高苯酚的初期降解率,能有效降低苯酚对菌体细胞的抑制作用,经CPO转化后的苯酚液更加有利于菌株对苯酚的降解;补加邻苯二酚也可以明显促进苯酚的生物降解.其机制可能为CPO转化了苯酚形成更容易降解的邻苯二酚中间产物,与苯酚形成共基质效应从而提高苯酚的生物降解效率.

图2 菌株的苯酚降解曲线
2.3CPO与降解菌株协同降解苯酚的性能

图3 CPO与降解菌株对苯酚的协同降解特征
以质量浓度分别为100、300、500、700、1 000和1 200 mg/L的苯酚液为转化对象,添加10 U/mL 的CPO,5 mg/L的H2O2,接种2 mL菌液,相同反应条件下降解20 h,苯酚转化结果如图3所示.
从图3可知,CPO和苯酚降解菌株组成的苯酚生物协同降解体系对初始质量浓度较低(<300 mg/L)的苯酚液,2 h内苯酚降解率高于对初始质量浓度较高(>1 000 mg/L)的苯酚液的降解率,随着苯酚初始浓度的提高其生物降解速度呈下降趋势.这与高浓度苯酚对酶活性或细胞生长的抑制有关[35-36].

图4 不同初始浓度的苯酚协同降解过程COD去除率
图4为不同初始苯酚浓度的反应液中COD的去除率测定结果,反应初期(2 h内)苯酚的COD去除率差异不大,3 h后去除率快速上升,至6 h时COD的去除率与苯酚的降解率表现为正相关,反映出苯酚经过CPO的转化其可生化能力得到了明显提高,苯酚结构被彻底分解.
2.4苯酚协同降解动力学特征
在实验条件下探讨苯酚降解的动力学特征,结果如图5所示.图5中直线方程的回归系数R2均大于0.95,数据具有良好的回归性.直线斜率为比降解速率(q),可知初始苯酚质量浓度为100、300、500、700、1 000和1 200 mg/L时,CPO和苯酚降解菌协同降解苯酚的比降解速率分别为:0.6899、0.5429、0.3593、0.2661、0.1038和0.0604 h-1.
2.5降解动力学模型拟合
苯酚的生物降解过程存在基质对酶和细胞的生物抑制作用可以用Haldan 模型[36]描述:
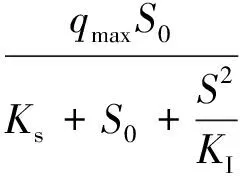

图5 不同初始浓度的苯酚协同降解过程的比降解速率
得到二次方程:
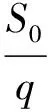

图6 降解动力学特征曲线
二次项趋势线如图6所示,R2=0.9617,实验曲线具有较好的拟合性,分别计算出CPO与降解菌协同降解苯酚时的最大比降解速率qmax=0.000195 h-1,基质饱和常数Ks=1.0501 mg/L,基质抑制常数KI=5.1272 mg/L.参数表明CPO与降解菌共同构成的协同降解苯酚体系具有高降解率,低基质饱和度和高基质浓度抑制的特点.
3 结 论
实验所用的苯酚降解菌株Micrococcuscalcoaceticus是一株以邻苯酚二酚2,3加氧酶开环的细菌[36],菌株独自降解苯酚时先是在胞内苯酚羟化酶催化下形成邻苯酚二酚,再在邻苯酚二酚2,3-加氧酶作用下生成2-羟基粘糠酸半醛,经过进一步代谢最后进入三羧酸循环途径彻底氧化成二氧化碳和水[37].CPO催化苯酚与H2O2发生过氧化反应生成了邻苯二酚,易氧化降解的邻苯二酚与苯酚形成共基质效应加快了对苯酚的生物降解作用,减轻苯酚对降解菌株的抑制作用.因此,CPO与降解菌株协同反应时苯酚降解率比单一菌株降解率明显提高.实验在较广泛的苯酚浓度范围内探讨了CPO与菌株构成的苯酚协同降解体系的特征,结果表明该复合降解体系对苯酚的比降解速率高,基质饱和常数低,基质抑制常数高.研究结果对污染水体中苯酚类有害物质的快速转化和高效降解建立了一种新型模式,并在动力学机制上作出了合理解释.
[1] Lakshmi M V V C,Sridevi V.A review on biodegradation of phenol from industry effluents [J].Journal of Industrial Pollution Control,2009,25(1):13-27.
[2] Lina S H,Juang R S.Adsorption of phenol and its derivatives from water using synthetic resins and low-cost natural adsorbents:A review [J].Journal of Environmental Management,2009,90(3):1336-1349.
[3] Mohan S V,Prasad K K,Rao N C,et al.Acid azo dye degradation by free and immobilized horseradish peroxidase (HRP) catalyzed process [J].Chemosphere,2005,58(8):1097-1105.
[4] Wu Y,Taylor K E,Biswas N,et al.Kinetic model for removal of phenol by horseradish peroxidase with PEG [J].Journal of Environmental Engineering,1999,125(5):451-458.
[5] Busca G,Berardinelli S,Resimi C,et al.Technologies for the removal of phenol from fluid streams:a short review of recent deveopments [J].Journal of Hazardous Materials,2008,160(2):265-288.
[6] Zhang Q,Cheng X D,Chen Z,et al.Roles of manganese oxides in degradation of phenol under UV-Vis irradiation:Adsorption,oxidation,and photocatalysis [J].Journal of Environmental Sciences,2011,23(11):1904-1910.
[7] Kowalska M,Bodzek M,Bohdziewicz J.Biodegradation of phenols and cyanides using membranes with immobilized microorganisms [J].Process Biochemistry,1998,33(2):189-197.
[8] Khokhawala I M,Gogate P R.Degradation of phenol using a combination of ultrasonic and UV irradiations at pilot scale operation [J].Ultrasonics Sonochemistry,2010,17(5):833-838.
[9] Li J M,Jin Z X,Yu B B.Isolation and characterization of aniline degradation slightly halophilic bacterium,Erwiniasp.strain HSA6 [J].Microbiological Research,2010,165(5):418-426.
[10] Bastos A E,Moon D H,Rossi A,et al.Salt-tolerant phenol degrading microorganisms isolated from Amazonian soil sampies [J].Arch Mircobwl,2000,174(5):346-352.
[11] Klibanov A M,Alberti B N,Morris E D.Enzymatic removal of toxic phenols and anilines from waste waters [J].Journal of Applied Biochemistry,1980,2(5):414-421.
[12] Samokyszyn V M,Freeman J P,Maddipatig K R.Peroxidase-catalyzed oxidation of penta chlorophenol [J].Chemical Research in Toxicology,1995,8(3):349-355.
[13] Nicell J A,Bewtra J K,Taylor K E.Enzyme catalyzed polymerization and precipitation of aromatic compounds from wastewater [J].Water Science and Technology,1992(3):157-164.
[14] Nicell J A,Saadi K W,Buchanan I D.Phenol polymerization and precipitation by enzyme and an additive [J].Bioresource Technology,1995(1):5-16.
[15] Kazuga C,Aitken M D,Gold A.Primary product of the horseradish peroxidase-catalyzed oxidation of pentachlorophenol [J].Environmental Science and Technology,1999,33(9):1408-1412.
[16] Choi Y J,Chae H J,Kim E Y.Steady-state oxidation model by horseradish peroxidase for the estimation of the non-inactivation zone in the enzymatic removal of pentachlorophenol [J].Journal of Bioscience and Bioengineering,1999,88(4):368-373.
[17] Szatkowski L,Thompson M K,Kaminski R,et al.Oxidative dechlorination of halogenated phenols catalyzed by two distinct enzymes:Horseradish peroxidase and dehaloperoxidase [J].Archives of Biochemistry and Biophysics,2011,505(1):22-32.
[18] Zhang J,Feng M Y,Jiang Y C,et al.Efficient decolorization/degradation of aqueous azo dyes using buffered H2O2oxidation catalyzed by a dosage below ppm level of chloroperoxidase [J].Chemical Engineering Journal,2012,191(19):236-242.
[20] Vázquezduhalt R,Ayala M,Márquezrocha F J.Biocatalytic chlorination of aromatic hydrocarbons by chloroperoxidase ofCaldariomycesfumago[J].Phytochemistry,2001,58(6):929-933.
[21] Díaz-Díaz G,Blanco-López M C,Lobo-Castaón M J,Miranda-Ordieres A J.Kinetic study of the oxidative dehalogenation of 2,4,6-trichlorophenol catalyzed by chloroperoxidase [J].Journal of Molecular Catalysis B:Enzymatic,2010,66(3):332-336.
[22] Shaw P D,Hager L P.Biological chlorination VI.Chloroperoxidase:A component of the β-ketoadipate chlorinase system [J].Journal of Biological Chemistry,1961,236(6):1626-1630.
[23] Hager L P,Morris D R,Brown F S,Eberwein H.Chloroperoxidase Ⅱ-utilization of halogen anions [J].The Journal of Biological Chemistry,1966,241( 8):1769-1777.
[24] Sanfilippo C,Nicolosi G.Catalytic behavior of chloroperoxidase fromCaldariomycesfumagoin the oxidation of cyclic conjugated dienes [J].Tetrahedron:Asymm,2002,13(17):1889-1892.
[25] Hocking M B,Intihar D J.Oxidation of phenol by aqueous hydrogen peroxide catalysed by ferric ion-catechol complexes [J].Journal of Chemical Technology & Biotechnology,2010,35(7):365-381.
[26] Karakhanov E A,Filippova T Y,M artynova S A,et al.New catalytic system for selective oxidation of aromatic compounds by hydrogen peroxide [J].Catalysis Today,1998,44(1-4):189-198.
[27] Miller V P,Tschirret-Guth R A,Ortiz P R.Chloroperoxidase-catalyzed benzylic hydroxylation [J].Archives of Biochemistry and Biophysics,1995,319(2):333-340.
[28] Vande Velde F,Bakker M,Van Rantwijk F,et al.Chloroperoxidase catalyzed enantioselective oxidations in hydrophobic organic media [J].Biotechnology and Bioengineering,2001,72 (5):523-529.
[29] Aiba S,Shoda M,Nagalani M.Kinetics of product inhibition in alcohol fermentation [J].Biotechnology and Bioengineering,2000,67 (6):671-90.
[30] 孙凌燕.氯过氧化物酶的发酵条件优化 [D].上海:上海师范大学,2009.
Sun L Y.Researches on fermentation conditions for the production of Chloroperoxidase [D].Shanghai:Shanghai Normal University,2009.
[31] 许甜甜.苯酚降解菌的分离鉴定及苯酚降解的相关研究 [D].上海:上海师范大学,2012.
Xu T T.Isolation and identification of phenol degrading bacteria and related studies on phenol degradation [D].Shangai:Shanghai Normal University,2009.
[32] Hager L P,Morris D R,Brown F S,et al.Chloroperoxidase II [J].The Journal of Biological Chemistry,1966,241(8):1768-1767.
[33] Litvintsev I Y,Mimic Y U,Mikhailyuk A I,et al.Kinetics and mechanism of catalytic hydroxylation of phenol by hydrogen peroxide [J].Kinetics and Catalyst,1993,34(1):76-82.
[34] Khokhawala M,Gogate P R.Degradation of phenol using a combination of ultrasonic and UV irradiations at pilot scale operation [J].Ultrasonics Sonochemistry,2010,17(5):833-838.
[35] Ho K L,Lin B,Chen Y Y.Biodegradation of phenol usingCorynebacteriumsp.DJ1 aerobic granulesl [J].Bioresource Technology,2009,100(21):5051-5055.
[36] Wang Y C,Riess R,Nemati M.Scale-up impacts on mass transfer and bioremediation of suspended naphthalene particles in bead mill bioreactors [J].Bioresource Technology,2008,99(17):8143-8150.
[37] Ali S,Lafuente R F,Cowan D A.Meta-pathway degradation of phenolics by thermophilic Bacilli [J].Enzyme and Microbial Technology,1998,23(8):462-468.
(责任编辑:顾浩然)
DynamicsofphenolsynergisticbiodegradationbyChloroperoxidaseandbacterialstrains
Zhang Ying,ChuQiyu,ChenMiao,ChenJun*,XiaoMing,ZhangYongming
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai200234,China)
Chloroperoxidase (CPO) can catalyze phenol reacting peroxide reaction generating with H2O2to catechol,which can reduce the inhibitory effect of phenol degradating generating bacterial strains.At the meantime,it can accelerate the rate of phenol's biodegradation.The results show that10U/L of CPO has67.85% conversion rate of300mg /L phenol within2h with an appropriate amount of H2O2.While the degradation rate of phenol degradation under synergy of strain and CPO is up to70.72%,increased by62.2% comparing with a single strain degradation rate (8.52%).Supplementary catechol in the reaction system can further verified that the intermediate products can be good for forming the co-substrate effect in bacteria,thereby improving the phenol degradation efficiency of biological bacterial cells.Biodegradation dynamics analysis shows that the maximum specific degradation rate of the CPO and strain synergistic.The maximum specific degradation rateqmax=0.000195h-1,the matrix saturation constant Ks=1.0501mg/L,and the substrate inhibition constant KI=5.1272mg/L when phenol concentration in the range of100~1200mg/L.
Chloroperoxidase; peroxidation; synergistic biodegradation; phenol residues; degradation dynamics
2016-04-01
国家自然科学基金 (31070671);上海市科委项目 (11440502300).
张 莹(1992-),女,硕士研究生,主要从事微生物分子、生物学方面的研究.E-mail:18363622613@qq.com
导师简介: 陈 军(1966-),男,副教授,博士,主要从事微生物酶学方面的研究.E-mail:cj7206@shnu.edu.cn
X506
:A
:1000-5137(2017)04-0453-07
*
