L-阿拉伯糖对B型和Q型烟粉虱刺探的影响—膜饲喂评价技术的优化
2017-09-16王雪丽李静静黄翠虹闫凤鸣
王雪丽,李静静,黄翠虹,闫凤鸣
(1.河南农业大学植物保护学院,郑州 450002;2. 顺德职业技术学院医药卫生学院,广东佛山 528333)
L-阿拉伯糖对B型和Q型烟粉虱刺探的影响—膜饲喂评价技术的优化
王雪丽1,李静静1,黄翠虹2*,闫凤鸣1
(1.河南农业大学植物保护学院,郑州 450002;2. 顺德职业技术学院医药卫生学院,广东佛山 528333)
本文以观察人工饲料膜上刺孔直径及数量评价L-阿拉伯糖对B型和Q型烟粉虱刺探及取食行为为例,用人工饲喂的方法,从饲料的最佳蔗糖浓度、L-阿拉伯糖最佳添加浓度、实验最佳实验时间3个方面对膜喂饲评价技术进行优化,为刺吸式昆虫取食行为的基础研究提供简单可行的方法。结果表明:15%蔗糖最适合烟粉虱的饲喂实验,5% L-阿拉伯糖是合适的添加浓度,12 h是检查效果的最佳时间;取食添加5% L-阿拉伯糖的饲料后,B型烟粉虱在人工饲料囊上的刺探所形成的的大孔、中孔及小孔的数量均显著低于对照,而Q型烟粉虱刺探所形成的的大孔、中孔及小孔数量均显著高于对照。即L-阿拉伯糖抑制了B型烟粉虱的刺探和取食行为,却提高了Q型烟粉虱的刺探和取食行为,因此,5% L-阿拉伯糖对两种生物型烟粉虱可能存在不同作用机制。以15%蔗糖的液体人工饲料膜上的刺孔直径及数量来评价生物活性物质对烟粉虱取食行为影响效果的方法是可行的。
烟粉虱;L-阿拉伯糖;刺孔;刺探行为;人工饲料
烟粉虱Bemisiatabaci(Gennadius)属半翅目Hemiptera粉虱科Aleyrodidae小粉虱属Bemisia,又名银叶粉虱、甘薯粉虱、棉粉虱等,是多食性刺吸式昆虫,广泛分布于全球各地(De Barroetal., 2011; Sunetal., 2011; Liuetal., 2012),严重为害农作物、蔬菜、花卉、绿化植物等,已经成为除了南极洲以外所有大陆上农作物的主要害虫(Brownetal., 1995; De Barro and Hart, 2000; Oliveiraetal., 2001; Boykinetal., 2007)。烟粉虱的寄主植物超过600种(Perring, 2001; Inbar and Gerling, 2008),主要通过刺吸植物汁液(Schusteretal., 1990; Yokomietal., 1990)、分泌蜜露引发霉污病(Byrneetal., 1990)、传播植物病毒(Jones, 2003; Hogenhoutetal., 2008; Tzanetakisetal., 2013)等方式为害。烟粉虱已被证明是复合种,包括至少38个形态特征差异不明显的隐种(cryptic species),其中“中东-小亚细亚1种”(Middle East-Asia Minor 1)和“地中海种”(Mediterranean)(通常分别称为B生物型和Q生物型)是我国分布最广泛、为害最严重的入侵隐种(Panetal., 2011)。目前化学药剂仍是防治烟粉虱的主要方法之一,使烟粉虱对多种杀虫剂产生了不同程度的抗性,且抗药性不断增强(邓业成等,2004; Yuanetal., 2012)。大量化学农药的施用,不但增加了防治成本,也对人畜及环境危害较大,因此,寻找新的安全的防治烟粉虱的途径已刻不容缓。
L-阿拉伯糖又称树胶醛糖、果胶糖,是一种戊醛糖,英文名称为L-Arabinose,化学式为C5H10O5,Hu等(2010)研究表明L-阿拉伯糖能降低烟粉虱若虫及成虫的存活率,对其消化酶α-葡萄糖苷酶、海藻糖合酶及烟粉虱内共生菌的活性无影响,但可以显著减少蔗糖、蛋氨酸、菊粉的吸收以及CO2和蜜露的产生。黄翠虹等(2016)也证明L-阿拉伯糖对烟粉虱成虫有一定的杀虫活性,并利用刺吸电位技术(electrical penetration graph,EPG)研究了其对两种烟粉虱生物型取食行为的影响,初步发现B和Q型烟粉虱在含有L-阿拉伯糖的人工饲料膜上的刺孔数量和直径有一定差异,因此,我们考虑是否可以用膜上的刺孔直径和数量来评价生物活性物质对昆虫的作用效果,但人工饲料中的蔗糖浓度对粉虱的生存率有影响,已有文献报道的烟粉虱人工饲料中的蔗糖浓度并不一致(Huetal., 2010; 李晓敏等,2013),一些技术细节有待完善,其稳定性和可行性也有待验证(黄翠虹等,2016)。
刺吸式昆虫在取食人工饲料时口针要刺破封口膜,留下不同直径和数量的刺探孔,刺孔的大小与口针刺入的深度密切相关,因此,根据刺孔直径可判断口针插入不同的深度。小孔表示口针刺探进饲料囊比较浅,又迅速拔出;中孔和大孔表示口针刺探进去的深,可能与取食有关。而刺孔的数量与刺探有关,刺孔的大小与取食有关。因此,中孔和大孔数量越多,越表示这种饲料成分越受喜爱。这种方法也适用于病毒传播机制的研究,如Jahan等(2014)通过此方法研究表明:感染番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)后, 雄性烟粉虱产生更多的小孔,而雌性烟粉虱感染TYLCV后产生更多的中孔,这说明雌性能更有效地传播TYLCV,因为它能产生更多数量的中孔,而中孔的由来可能与唾液分泌和取食过程相关。且已有研究证明雌性烟粉虱成虫传播TYLCV的效率是雄性的5倍(Czosneketal., 2001)。本研究拟在前期研究的基础上,通过膜饲喂法研究L-阿拉伯糖对烟粉虱B和Q生物型刺探行为的影响,完善饲喂配方蔗糖浓度、L-阿拉伯糖添加浓度、评价时间点等技术细节,探索利用人工饲膜上的刺孔评价生物活性物质效果的可行性和可靠性,为刺吸式昆虫取食机理或传毒机理的研究和为生物活性物质的筛选,提供一种新的有效技术和方法。
1 材料与方法
1.1 材料
供试烟粉虱:B和Q型烟粉虱成虫(采自河南农业大学科教园区的烟草叶片),为实验室长期建立起来的种群(饲养笼60 cm×40 cm×80 cm),饲养在温度28℃±0.5℃,相对湿度75%±5%,光周期L ∶D=16 ∶8的人工温室内,饲养植物为烟草Nicotianatabacum(中烟100),每隔3-5代通过mtDNA COI 分子标记的方法检测生物型的纯度(Panetal., 2010)。
试剂:蔗糖(天津市永大化学试剂有限公司);L-阿拉伯糖(美国Sigma公司);牛血清蛋白Albumin Bovine V(瑞士Roche公司);Parafilm膜(型号为PM-996,厚度127 μm,美国Bemis公司生产);VHX-600型超景深三维显微镜(日本KEYENCE公司)。
1.2 方法
1.2.1多头饲养
用两端开口的50 mL离心管与纱布、离心管盖制成小型饲养室,在空心离心管盖上覆上双层Parafilm膜,膜间加入400 μL人工饲料,四周压紧,使之形成液体饲料囊,放置在布满黑色背景的盒子里,将盒子放入温度28℃±0.5℃,相对湿度75%±5%,光周期L ∶D=16 ∶8的人工气候箱内饲养。
1.2.2单头饲养
将1.5 mL离心管作为饲养室,在靠近离心管口的管壁上用针扎两个洞进行空气流通,将离心管盖子提前剪掉,并在盖子里加入300 μL人工饲料,在其上覆盖一层Parafilm膜,四周压紧使之形成液体人工饲料囊。将单头B和Q型烟粉虱饥饿30 min后分别放入含有L-阿拉伯糖和对照饲料的饲养室,盖上做成人工饲料囊的离心管盖,放入温度28℃±0.5℃,相对湿度75%±5%,光周期L ∶D=16 ∶8的人工气候箱内培养。
1.2.3人工饲料配方优化
为了确定实验最佳条件,本文测试了B型烟粉虱成虫在含不同蔗糖浓度(10%、15%、20%)的人工饲料下的存活率。将蔗糖与蒸馏水按质量比配置成蔗糖浓度为10%、15%及20%的人工饲料,pH 7.0,现用现配。在小型饲养室的饲料囊中加入400 μL 含10%、15%或20%蔗糖的人工饲料,每个饲养室放入200头左右的B型烟粉虱成虫按1.2.1多头饲养的方法进行饲喂,每天统计烟粉虱的死亡率。每个处理3个重复,隔天更换新的饲料。
1.2.4L-阿拉伯糖添加浓度及饲喂时间的优化
根据蔗糖浓度优化结果,将蔗糖、L-阿拉伯糖、牛血清蛋白V(Albumin Bovine V)与TE(10 mmol/L Tris-Hcl,1mmol/L EDTA,pH 7.4)按质量比混合成蔗糖浓度为15%人工饲料,其中牛血清蛋白V为1%,L-阿拉伯糖浓度分别为0、1%、5%、10%,根据1.2.1多头饲喂的方法饲喂烟粉虱,每个饲养室内放入100头初羽化B型烟粉虱,每个处理5个重复,每6 h观察烟粉虱死亡率,以确定最佳L-阿拉伯糖浓度及培养时间。
1.2.5刺孔直径法判别L-阿拉伯糖对烟粉虱刺探行为的影响
根据优化结果,采用蔗糖浓度为15%人工饲料配方,实验组L-阿拉伯糖添加浓度为5%,喂饲时间为12 h进行粉虱刺探行为实验。
具体做法采用1.2.2中单头饲喂的方法,将单头B型或Q型烟粉虱饥饿30 min后分别放入含有L-阿拉伯糖和对照饲料(15% 蔗糖为对照饲料,15% 蔗糖+5% L-阿拉伯糖为处理组饲料)的饲养室培养12 h后,取下人工饲料囊,在超景深显微镜下观察其上面的刺孔数量及直径。取食L-阿拉伯糖和对照饲料的B型烟粉虱各重复23次,取食L-阿拉伯糖和对照饲料的Q型烟粉虱分别取得24和23个重复。
1.2.6饲料囊膜上刺孔的识别及直径和数量的测定
烟粉虱在人工饲料囊上取食时,会根据对于饲料的喜好程度,将口针刺入饲料囊不同的深度,而随着口针刺入深度的不同,饲料囊Parafilm膜上会出现大小不同的孔洞,孔洞大小与烟粉虱口针不同部位的直径有关(图1)。孔洞分级参照Jahan等(2014)标准,即将孔洞分为小孔(直径﹤10 μm)、中孔(10-20 μm)、大孔(>20 μm),孔洞直径越大则表示烟粉虱口针刺探进去的越深,因此与取食行为直接相关。
烟粉虱在人工饲料囊上的刺探孔易与气泡相混淆,烟粉虱刺破人工饲料囊上层封口膜后,会留下刺探孔,如下图所示(图2A),白色小点为刺穿的位置,由于封口膜张力的作用,液体从刺探孔冒出形成突起水滴,水滴边缘颜色较深,即刺探孔在镜下呈周围一圈深色,中间白色;而气泡则由于反光,在镜下呈边缘一圈白色中间深色(图2B),用手轻轻触摸即会消失。

图1 烟粉虱的喙及刺探人工饲料囊不同深度图Fig.1 Different depth of Bemisia tabaci proboscis spying in artificial diet producing holes in different diameters注:A,喙;B,小孔刺探图;C,中孔刺探图;D,大孔刺探图。Note: A, Proboscis; B, Small hole; C, Middle hole; D, Big hole.
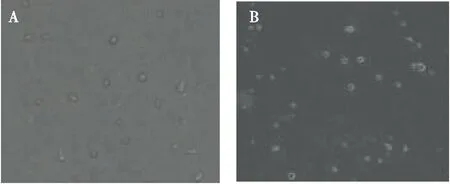
图2 刺探孔和气泡的识别Fig.2 Identification of piercing hole and bubble注:A, 刺探孔; B, 气泡。Note: A, Piercing hole; B, Bubble.
1.3 统计分析
本文利用SPSS 21.0软件进行数据统计分析,不同蔗糖浓度对B型粉虱存活率的影响采用单一变量方差分析-最小显著差测验(One-way ANOVA: LSD test),B型和Q型烟粉虱取食了5% L-阿拉伯糖之后,分别与对照组、B与Q生物型之间人工饲囊膜上不同直径的刺孔数量采用独立样本的t测验进行差异显著性检验,并采用最小显著差LSD法对同种生物型间不同直径的刺孔数量进行了比较。
2 结果与分析
2.1 人工饲料中最佳蔗糖浓度
在只有单一营养物质蔗糖的条件下,第2-4天,B型烟粉虱取食了10%蔗糖后存活率显著低于15%及20%蔗糖,取食15%及20%蔗糖的烟粉虱存活率没有差异,自第5天起,取食10%蔗糖的烟粉虱存活率与取食20%蔗糖没有差异,且均显著低于取食15%蔗糖的存活率,由此可知,在短时间内,15%及20%蔗糖更适合烟粉虱的取食,随着时间的延长,高浓度20%反而不利于烟粉虱的存活(如图3所示),因此,总的来说,在只有蔗糖的饲料中,15%浓度更适合于烟粉虱的饲喂实验。
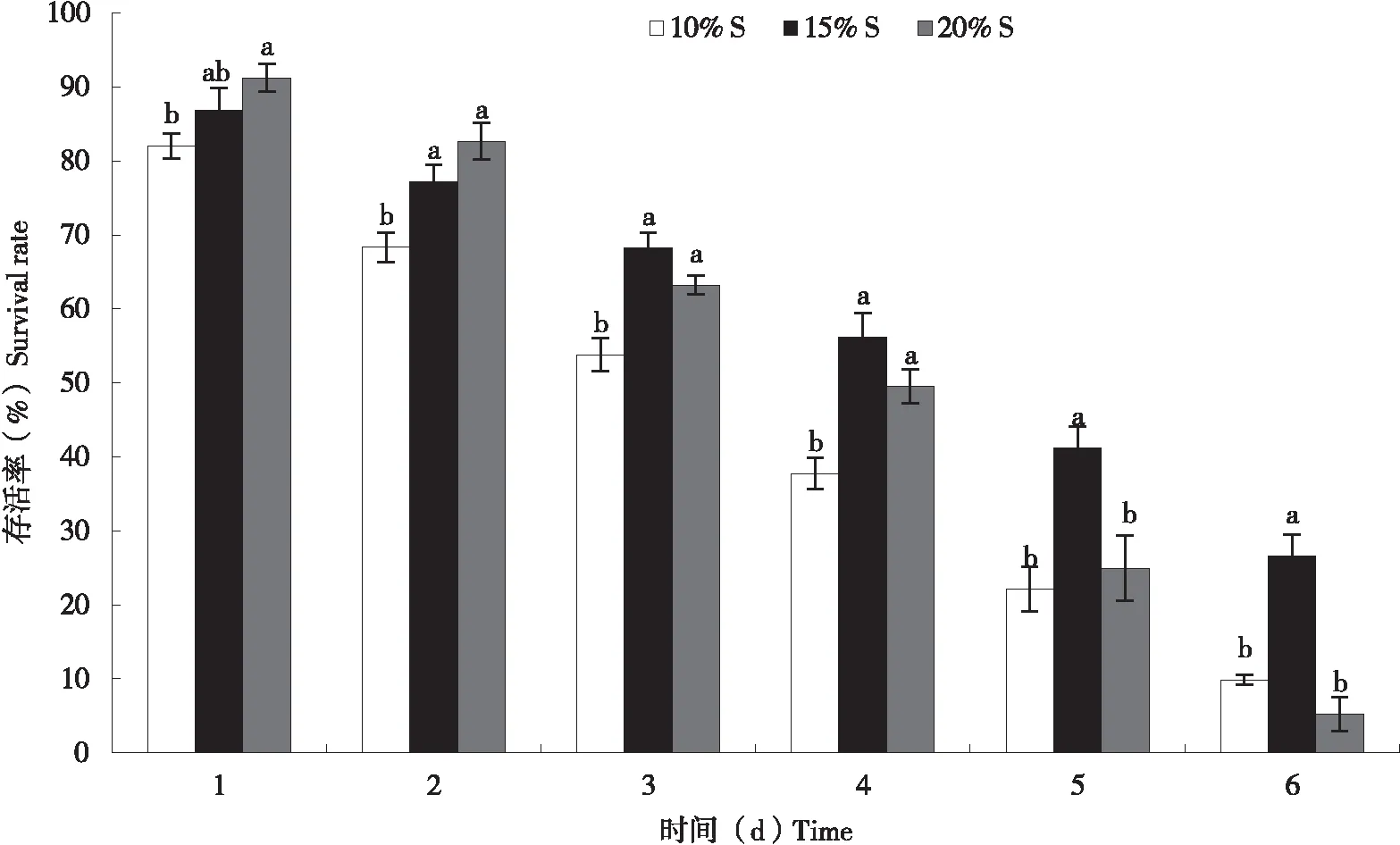
图3 饲喂不同浓度蔗糖后B型烟粉虱存活率Fig.3 Survival rate of Bemisia tabaci B feeding on different concentrations of sucrose
2.2 L-阿拉伯糖的最佳测试浓度及饲喂时间
烟粉虱在添加5% L-阿拉伯糖的人工饲料囊饲养24 h时死亡率达到13.88%,而更高浓度会导致烟粉虱在极短时间内死亡,10% L-阿拉伯糖在24 h时的死亡率达到76.76%,更低浓度对烟粉虱死亡效果不明显,1% L-Arabinose在24 h时的死亡率仅为2.60%(见图4)。本文选择中间浓度5% L-阿拉伯糖作为实验处理组的添加浓度,因为该浓度死亡率与对照组有显著差异但又不会大比例死亡,保证饲养24 h内仍有足够多的个体用于测试,且个体仍然有一定活动能力。
2.3 5% L-阿拉伯糖对烟粉虱刺探行为的影响
2.3.15% L-阿拉伯糖对B型烟粉虱刺探行为的影响
取食了12 h后,单头B型烟粉虱在含15%蔗糖的人工饲料囊上留下刺孔总数主要集中在200以
上(如图5 A所示),在含15%蔗糖+5% L-阿拉伯糖的人工饲料囊上留下的刺孔总数在200以下(如图5 B所示),这说明5% L-阿拉伯糖后降低了B型烟粉虱的刺孔总数。
取食12 h后,B型烟粉虱在饲料囊上留下的刺孔数量统计如表1所示,对照组(15%蔗糖)的大孔、中孔和小孔数量分别是处理组(15%蔗糖+5% L-阿拉伯糖)的1.98、1.65、1.79倍,且B型烟粉虱在对照组和处理组中,其刺探孔小孔的数量均显著高于中孔和大孔。
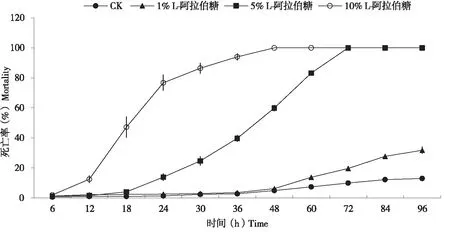
图4 不同浓度L-阿拉伯糖对B型烟粉虱死亡率的影响Fig.4 Mortality of Bemisia tabaci B feeding on artificial diet with L-Arabinose in different concentrations注:图表示为平均值±标准误,不同浓度间采用LSD法比较。Note: The data in the figure indicate the mean±standard error. Compared in different concertrations at P<0.05 by LSD test.

图5 B型烟粉虱取食15%蔗糖与15%蔗糖+5% L-阿拉伯糖12 h后刺孔总数的分布Fig.5 The distribution of the holes produced by Bemisia tabaci B feeding on 15% Sucrose and 15% Sucrose+5% L-Arabinose 12 hours注:A,15% 蔗糖;B,15%蔗糖+5% L-阿拉伯糖。Note: A, 15% Sucrose; B, 15% Sucrose+5% L-Arabinose.

孔类型Holesize大孔Largehole中孔Middlehole小孔Smallhole总计Total15%蔗糖15%Sucrose2317±360B5965±771B28500±4400A36783±51775%L⁃阿拉伯糖5%L⁃Arabinose1169±332B∗3613±677B∗15909±3643A∗20691±4411∗
注:表中数据均为平均值±标准误,同一行中不同的字母表示同一浓度下不同直径刺孔数量在1%水平上差异显著,同一列中*表示同一直径不同浓度下对照与处理刺孔数量在1%水平上差异显著。Note: Values in the table show Means±SE, different letters in the same line indicated that the number of holes at different diameter in the same concentration was significantly different at the 1% level.*indicated that the number of the holes at the same diameter was significantly different at the 1% level.
2.3.25% L-阿拉伯糖对Q型烟粉虱刺探行为的影响
取食了12 h后,单头Q型烟粉虱在对照组(15%蔗糖)的人工饲料囊上留下的刺孔总数主要集中在400以下(如图6 A所示),在处理组(15%蔗糖+5% L-阿拉伯糖)人工饲料囊上留下的刺孔总数在400以上(图6 B),这说明5% L-阿拉伯糖增加了Q型烟粉虱的刺孔总数。
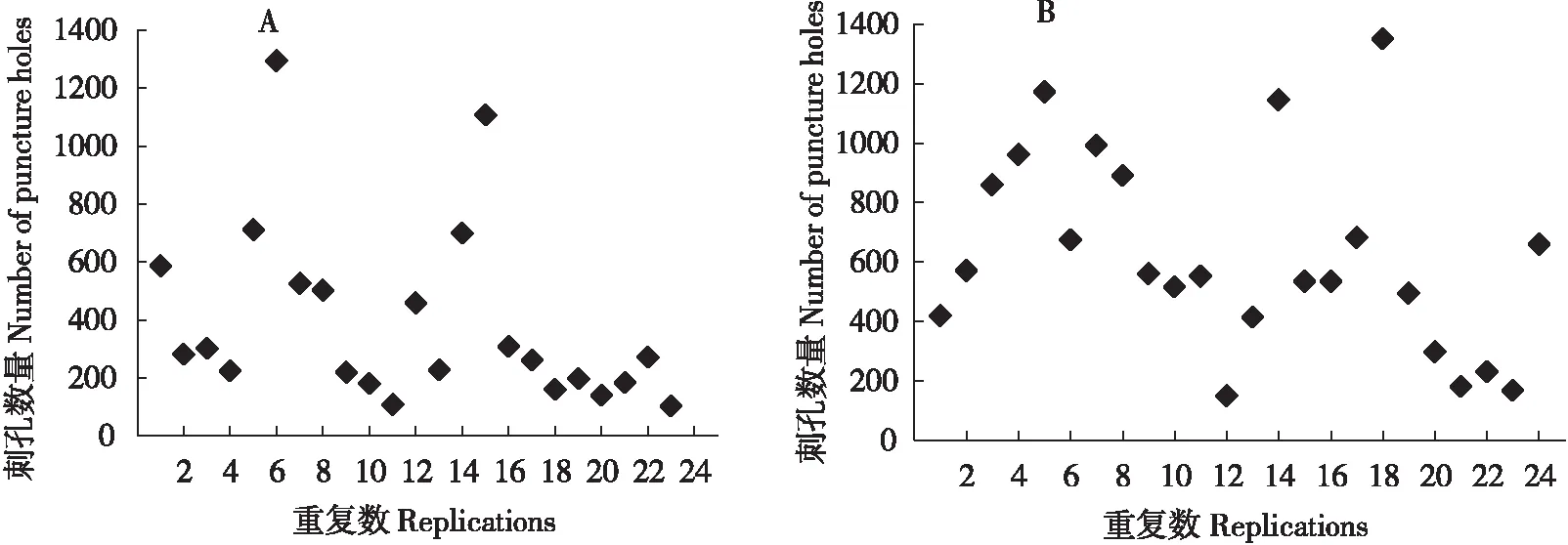
图6 Q型烟粉虱取食15%蔗糖与15%蔗糖+5% L-阿拉伯糖12 h后刺孔数量的分布Fig.6 The distribution of the holes produced by Bemisia tabaci Q feeding on 15% sucrose and 15% sucrose+5% L-Arabinose 12 hours注:A,15%蔗糖;B,15% 蔗糖+5% L-阿拉伯糖。Note: A, 15% Sucrose; B, 15% Sucrose+5% L-Arabinose.
由表2可知:取食了添加5% L-Arabinose人工饲料12 h后,不论是大孔、中孔还是小孔,数量分别是对照组的0.54,0.56,0.65倍,同样的,不论Q型烟粉虱取食了对照组饲料还是取食了添加5% L-阿拉伯糖饲料,其刺探孔小孔的数量均显著高于中孔和大孔。

表2 5% L-阿拉伯糖对Q型烟粉虱刺探行为的影响
注:表中数据均为平均值±标准误,同一行中不同的字母表示同一浓度下不同直径刺孔数量在1%水平上差异显著,同一列中*表示同一直径不同浓度下对照与处理刺孔数量在5%水平上差异显著。Note: Values in the table show Means±SE, different letters in the same line indicated that the number of holes at different diameter in the same concentration was significantly different at the 1% level.*indicated that the number of the holes at the same diameter was significantly different at the 5% level.
3 结论与讨论
利用液体人工饲料膜上的刺孔直径及数量来评价生物活性物质对刺吸式口器昆虫的影响,是一种直观、有效的方法。在研究L-阿拉伯糖对粉虱的行为影响实验中,在蔗糖溶液中添加L-阿拉伯糖非常简单方便,但是也容易受到饲料浓度、添加物浓度、培养时间等L-阿拉伯糖毒性以外的因素影响,对现有文献提供的方法进行优化才能够更好地进行测试。
在实验条件的优化过程中,寻找适合烟粉虱取食及存活的最佳蔗糖浓度是实验的前提,蔗糖浓度过低会影响烟粉虱的营养,造成死亡率升高;蔗糖浓度过高,人工饲料过于粘稠,不利于烟粉虱口针的刺探及抽出,也会造成烟粉虱死亡率升高。经过系列浓度的对比实验显示,15%蔗糖浓度较为适宜。此外,人工饲料中添加的L-阿拉伯糖浓度和饲养时间会影响烟粉虱的寿命,选取适当的添加浓度和实验时间才能清楚地展示L-阿拉伯糖对烟粉虱取食行为的影响。如果添加的L-阿拉伯糖浓度过大,烟粉虱迅速死亡,则无法观察到行为差异,如果浓度太小,在烟粉虱的耐受范围之内同样也观察不到行为差异;饲喂时间过短,L-阿拉伯糖尚未起效,饲喂时间过长饲料变质、烟粉虱活力下降等也会影响行为观察。根据这些原则,确定最佳添加浓度为5%和最佳饲喂时间为12 h。
在优化实验条件的基础上,应用刺孔直径法评价了L-阿拉伯糖对烟粉虱刺探行为的影响。结果发现取食了添加L-阿拉伯糖饲料之后,B型烟粉虱总孔数减少,其中大孔、中孔、小孔数量均显著低于对照,即刺探和取食受抑制;而Q型烟粉虱刺探总孔数大于对照组,其中大孔、中孔、小孔数量均显著高于对照,即Q型烟粉虱刺探增加,寻找更合适的取食位点,取食受到促进。黄翠虹(2016)等利用EPG技术使烟粉虱在含有10%蔗糖及10%蔗糖+5% L-阿拉伯糖的人工饲料上取食了6 h之后,发现其人工饲料囊上不同直径的刺孔数量平均值与对照组之间的差异统计不显著,与本文结果有差别,其主要原因为观察时间节点不一样导致。在饲喂烟粉虱5% L-阿拉伯糖12 h内,烟粉虱还没有开始死亡,在取食6 h时,L-阿拉伯糖对烟粉虱的影响尚未完全展现。
尽管B型和Q型烟粉虱在对照饲料(15% sucrose)刺探的不同直径的孔数量以及总孔的数量均没有差异,但Q型烟粉虱在处理饲料上的大孔、中孔、小孔数量均显著高于B型烟粉虱,且达3倍左右。大孔、中孔是口针插入较深时留下,与取食关系较大,即总体上B型烟粉虱取食较少,Q型烟粉虱取食较多,该结果与EPG记录中Q型烟粉虱取食总时间长于B型烟粉虱相吻合(黄翠虹等,2016)。B型烟粉虱和Q型烟粉虱在寄主适应性、对毒物的耐受性上均有差异(Horowitzetal., 2005; Crowderetal., 2008),它们对L-阿拉伯糖的取食行为差异产生的原因还需更进一步研究。烟粉虱的取食是一个动态的过程,膜饲喂评价可以用更简单直观的方式对取食行为进行观察,虽然提供的取食行为细节不如EPG详尽,但是分析统计方便,在筛选有效抗虫成分及最佳应用浓度方面较为方便,大大减轻波形分析的繁琐工作量,但要注意准确把握实验观察时间节点,增大重复数量以便获得更好的结果。
关于糖类在害虫防治方面的研究报道较少,Neal等(1994)证明了茄科植物产生的糖酯对一些园艺害虫有生物活性,Stanghellini等(2005)则利用糖酯防治蜜蜂的寄生螨。关于L-阿拉伯糖的杀虫活性及其毒性机理鲜有报道,Hu等(2010)研究表明通过L-阿拉伯糖饲喂烟粉虱成虫及若虫在低浓度1%的情况下就可以对烟粉虱有很好的杀虫效果,且随着浓度的升高,烟粉虱死亡率越高,当L-阿拉伯糖浓度达到10%时,烟粉虱2龄、3龄若虫分别只有10.8%和0的存活率,且当饲喂烟粉虱成虫10% L-阿拉伯糖时,烟粉虱的平均存活天数不超过2 d,并发现L-阿拉伯糖可以显著减少烟粉虱对放射性标记的蔗糖、蛋氨酸、菊粉的吸收以及CO2和蜜露的产生,推测出L-阿拉伯糖的杀虫活性可能是由于拒食作用。本文L-阿拉伯糖对B型烟粉虱的作用与之吻合,但对Q型烟粉虱的取食影响不一致,由于刺孔数量并不能反映取食行为的全部,另外L-阿拉伯糖对Q型烟粉虱取食行为影响的时滞性也需考虑,所以下一步计划将要通过蜜露成分分析、消化酶、解毒酶等活性影响进行全面阐明。糖类物质用于虫害防治是植保绿色防控的新视角,阐明其毒性机理和作用方式,是进一步开发利用的基础。利用的方式可以是通过转基因植物表达,或者研发成制剂,或者与常用杀虫剂混用提高杀虫效果,降低杀虫剂用量。
本文筛选出了通过饲喂法烟粉虱来评价L-阿拉伯糖对烟粉虱刺探及取食相关行为影响的条件,即在饲料中蔗糖含量为15%,L-阿拉伯糖的添加浓度为5%,检测时间为12 h;明确了L-阿拉伯糖可抑制B型烟粉虱的刺探和取食行为,却提高了Q型烟粉虱的刺探和取食行为,且取食了添加L-阿拉伯糖饲料之后,Q型烟粉虱在人工饲料囊上的大孔、中孔、小孔数量均显著高于B型烟粉虱,达3倍左右,5% L-阿拉伯糖对两种生物型烟粉虱可能存在不同作用机制。因此,通过膜饲喂技术来判断L-阿拉伯糖对烟粉虱刺探及取食相关行为的影响是可行的,人工饲料膜上的刺孔直径及数量为评价生物活性物质对刺吸式昆虫取食行为影响效果提供了一种简单可行的方法。
References)
Boykin LM, Shatters RG, Rosell RC,etal. Global relationships ofBemisiatabaci(Hemiptera: Aleyrodidae)revealed using Bayesian analysis of mitochondfial COI DNA sequences [J].Mol.Phylogenet.Evol., 2007, 44: 1306-1319.
Brown JK, Frohlich DR, Rosell RC. The sweetpotato or silverleaf whiteflies: biotypes ofBemisiatabacior a species complex? [J].Annu.Rev.Entomol., 1995, 40 (1): 511-534.
Byrne DN, Bellows TS, Parrella MP. Whiteflies in agricultural systems. In: Gerling D, ed. Whiteflies: Their Bionomics, Pest Status and Management [C]. Andover: Intercept, 1990, 227-262.
Crowder DW (Univ Arizona, Dept Entomol, Tucson, AZ 85721 USA); Ellers-kirk, Cyafuso CM,etal. Inheritance of resistance to pyriproxyfen inBemisiatabaci(Hemiptera: Aleyrodidae)males and females (B biotype)[J].J.Econ.Enyomol., 2008, 101: 927-932.Czosnek H, Ghanim M, Morin S,etal. Whiteflies: Vectors-or victims?-of geminiviruses [J].Adv.Virus.Res., 2001, 57: 291-322.
De Barro PJ, Hart PJ. Mating interactions between two biotypes of the whitefly,Bemisiatabaci(Hemiptera: Aleyrodidae)in Australia [J].B.Entoml.Res., 2000, 90 (2): 103-112.
De Barro PJ, Liu SS, Boykin LM,etal.Bemisiatabaci: A Statement of species status [J].Annu.Rev.Entomol., 2011, 56: 1-19.
Deng YC, Xu HH, Lei L. Chemical control and insecticide resistance ofBemisiatabaci[J].Pesticides, 2004, 43 (1): 10-15. [邓业成, 徐汉虹, 雷玲. 烟粉虱的化学防治及抗药性[J]. 农药, 2004, 43 (1): 10-15]
Hogenhout SA, Oshima K, Ammar ED,etal. Phytoplasmas: Bacteria that manipulate plants and insects [J].Mol.Plant.Pathol., 2008, 9: 403-423.
Horowitz AR, Kontsedaloy S, Khasdan V,etal. Biotypes B and Q ofBemisiatabaciand their relevance to neonicotinoid and pyriproxyfen resistance [J].Arch.InsectBiochem., 2005, 58: 216-225
Hu JS, Gelman D, Salvucci ME,etal. Insecticidal activity of some reducing sugars against the sweet potato whitefly,Bemisiatabaci, Biotype B [J].J.InsectSci., 2010, 10 (203): 1-22.
Huang CH, Wang XL, Li JJ,etal. Toxic and feeding behavioral effects of L-arabinose onBemisiatabacibiotypes B and Q [J].J.PlantProtec., 2016, 43 (1): 111-116. [黄翠虹, 王雪丽, 李静静, 等. L-阿拉伯糖对B型和Q型烟粉虱毒性及取食行为的影响[J]. 植物保护学报, 2016, 43 (1): 111-116]
Inbar M, Gerling D. Plant-mediated interactions between whiteflies, herbivores, and natural enemies [J].Annu.Rev.Entomol., 2008, 53 (1): 431-448.
Jahan SH, Lee GS, Lee S,etal. Upregulation of probing-and feeding-related behavioural frequencies inBemisiatabaciupon acquisition of Tomato yellow leaf curl virus [J].PestManag.Sci., 2014, 70 (10):1497-1502.
Jones DR. Plant viruses transmitted by whiteflies [J].Eur.J.PlantPathol., 2003, 109: 195-219.
Li XM, Li JJ, Tang QB,etal. Effects of nicotine on feeding behavior ofBemisiatabaciB and Q biotypes based on EPG and liquid diet sac technique [J].ScientiaAgriculturaSinica, 2013, 46 (10): 2041-2049. [李晓敏, 李静静, 汤清波, 等. 烟碱对B型和Q型烟粉虱取食行为的影响——基于EPG和液体饲囊技术体系[J]. 中国农业科学, 2013, 46 (10): 2041-2049]
Liu SS, Colvin J, De Barro PJ.Species concepts as applied to the whiteflyBemisiatabacisystematics: How many species are there [J].J.Integr.Agr., 2012, 11 (2):176-186.
Neal JW, Buta JG, Pittarelli GW,etal. Novel sucrose esters from Nicotiana gusset: effective biorationals against selected horticultural insect pests [J].J.Econ.Entomol., 1994, 87: 1600-1607.
Oliveira MRV, Henneberry TJ, Anderson P. History, current status, and collaborative research projects forBemisiatabaci[J].CropProt., 2001, 20: 709-723.
Pan HP, Chu D, Ge DQ,etal. Further spread of and domination byBemisiatabaci(Hemiptera: Aleyrodidae)biotype Q on field crops in China [J].J.Econ.Entomol., 2011, 104 (3): 978-985.
Pan HP, Ge DQ, Wang SL,etal. Replacement of B typeBemisiatabaciby Q typeB.tabaciin some areas of Beijing and Hebei [J].JPlantProtection, 2010, 36 (6): 40-44. [潘慧鹏, 戈大庆, 王少丽, 等. 在北京和河北局部地区Q型烟粉虱取代了B型烟粉虱[J]. 植物保护, 2010, 36 (6): 40-44]
Perring TM. theBemisiatabacispecies complex [J].CropProt., 2001, 20: 725-737.
Schuster DJ, Mueller TF, Kring JB,etal. Relationship of the sweetpotato whitefly to a new tomato fruit disorder in Florida [J].Hortscience, 1990, 25: 1618-1620.
Stanghellini M, Hayes J, Burns E,etal. Varroa mite suppression with a simplified sucrocide application method and the effects of sucrose octanoate on honey bee eggs and larvae [J].Am.Bee.J, 2005, 145 (7): 587-590.
Sun DB, Xu J, Luan JB,etal. Eproductive incompatibility between the B and Q biotypes of the whiteflyBemisiatabaciin China: Genetic and behavioural evidence [J].B.Entomol.Res., 2011, 101: 211-220.
Tzanetakis IE, Maryin RR, Wintermantel WM. Epidemiology of criniviruses: an emerging problem in world agriculture [J].Front.Microbiol., 2013, 4: 119.
Yokomi RK, Hoelmer KA, Osborne LS. Relationship between the sweetpotato whitefly and the squash silverleaf disorder [J].Phytopathology, 1990, 80: 895-900.
Yuan L, Wang S, Zhou J,etal. Status of insecticide resistance and associated mutations in Q-biotype of whitefly,Bemisiatabaci, from eastern China [J].CropProt., 2012, 31 (1): 67-71.
EffectsofL-ArabinoseonprobingbehaviorofBemisiatabaciBandQbiotypes—Optimizingthemembranefeedingevaluationmethod
WANG Xue-Li1, LI Jing-Jing1, HUANG Cui-Hong2*, YAN Feng-Ming1
(1. College of Plant Protection, Henan Agricultural University, Zhengzhou 450002, China; 2. School of Medicine & Health Care, Shunde Polytechnic, Foshan 528333, Guangdong Province, China)
This paper took the observation of diameters and amount of probing holes on the artificial diet capsules to evaluate the effects of L-Arabinose on the probing and feeding behavior ofBemisiatabacifor instance, according to the method of artifical feeding. The membrance feeding evaluation technique was optimized from three aspects: The optimum sucrose concentration, the optimum L-Arabinose adding concentration and the optimum experimental time, which provided a simple and feasible method for the basic research of feeding behavior of piercing-sucking insect pests. The results showed that 15% sucrose was the most suitable concentration for the growth of whiteflies, 5% L-Arabinose is the suitable adding concentration, the twelfth hour is the best time to check the result; compared the diameters and amount of probing holes on the artificial diet capsule produced byB.tabaciB After fed on 5% L- Arabinose, it found out that the total number of probing holes as well as big holes, middle holes and small holes produced byB.tabaciB were significantly lower than the control; However, the total number of probing holes as well as big holes, middle holes and small holes produced byB.tabaciQ were significantly higher than the control. That was to say that probing and feeding behavior were inhibited by L-Arabinose in B biotype, but were stimulated in Q biotype. So, 5% L-Arabinose may have different mechanism inB.tabaciB andB.tabaciQ. It is feasible to evaluate the effect of bioactive chemicals on the feeding behavior ofB.tabaciby diameters and amount of probing holes on the artificial diet capsules with 15% sucrose.
Bemisiatabaci; L-Arabinose ; piercing hole; probing behavior; artificial diet
国家自然科学基金(31471776)
王雪丽,女,1991年出生,硕士研究生,研究方向为农业昆虫与害虫防治,E-mail: wxl2010@yeah.net
*通讯作者Author for correspondence, E-mail: cuihong.h@139.com
Received: 2016-11-17; 接受日期Accepted: 2017-01-12
Q968.1;S433.39
:A
1674-0858(2017)04-770-09
王雪丽,李静静,黄翠虹,等.L-阿拉伯糖对B型和Q型烟粉虱刺探的影响—膜饲喂评价技术的优化[J].环境昆虫学报,2017,39(4):770-778.
