基于SRAP和SSR标记的小麦粒长和千粒质量QTL定位及效应分析
2017-09-15郭利建王竹林汪世娟刘香利赵惠贤
郭利建,王竹林,汪世娟,刘香利,赵惠贤
(1. 西北农林科技大学 生命科学学院,陕西杨凌 712100;2. 西北农林科技大学 农学院,陕西杨凌 712100)
基于SRAP和SSR标记的小麦粒长和千粒质量QTL定位及效应分析
郭利建1,王竹林2,汪世娟1,刘香利1,赵惠贤1
(1. 西北农林科技大学 生命科学学院,陕西杨凌 712100;2. 西北农林科技大学 农学院,陕西杨凌 712100)
为探究小麦粒长和千粒质量性状的QTL,以千粒质量差异较大的小麦品种‘西农981’和‘陕麦159’杂交构建的169株F2群体和F2:3家系为研究材料,利用SRAP标记和SSR标记进行遗传图谱的构建,通过统计分析杨凌及三原2个环境下的F2:3家系的表型数据,利用完备区间作图法对粒长和千粒质量进行QTL定位。结果表明,2个环境条件下,亲本‘西农981’和‘陕麦159’在粒长和千粒质量上均表现出极显著差异,F2:3家系表现出明显的超亲分离现象。QTL定位共检测到31个粒长和千粒质量相关的QTL,其中粒长相关QTL检测到7个,分布于5A、6A、7A、2B、3B、4B染色体上,可解释表型变异的4.36%~14.80%,在3B染色体上检测到1个能在2个环境点稳定表达的粒长QTL;千粒质量相关QTL检测到24个,分布于2A、3A、5A、6A、7A、2B、3B、4B、5B、7B染色体上,可解释表型变异的0.25%~8.23%。另外,在2B染色体上检测到5个控制千粒质量的QTL,表明2B染色体与千粒质量关系密切。
小麦;粒长;千粒质量;SRAP;QTL
小麦是世界三大主粮之一,其产量直接关系着粮食安全问题,因此,寻找控制小麦产量性状的基因,提高小麦产量一直是科研工作者的目标。千粒质量是小麦产量的三大主要组成因素之一,对小麦的产量具有极其重要的影响,而籽粒的大小及形态则直接影响着千粒质量的大小[1],粒长(kernel length,KL)作为籽粒大小的重要标志,与千粒质量存在重要的相关性[2],因此,通过研究粒长及千粒质量相关的QTL可为后续的产量研究提供基础。有关小麦产量相关性状的QTL前人已有较多研究,检测到的控制小麦千粒质量的QTL几乎遍布于21条染色体上[3-7], Campbell等[3]将控制粒长的QTL定位到1B、2B、2D、3B、7D染色体上。Tyagi等[8]利用‘中国春’和‘Rye Selection 111’所构建的92个重组自交系为材料,利用SSR(基因间重复序列多态性)标记和AFLP标记共检测到45个与粒长、粒宽、容积相关的QTL,这些QTL分布在除2D和3D外的19条染色体上,可解释表型变异的6.97%~29.87%。Li等[9]利用594个SNP标记和404个SSR标记构建一张高密度遗传连锁图谱,检测到14个与千粒质量相关的QTL,2个与穗数相关的QTL,5个与穗粒数相关QTL,这些加性QTL分布于13条染色体上。姚琴等[10]利用SSR和DArT分子标记,通过2个环境点数据共检测到4个千粒质量QTL,分布于3B、4D、6D染色体上,可解释表型变异的4.79%~31.37%。
前人虽已检测到许多控制小麦粒长和千粒质量相关的QTL,但这些性状遗传基础复杂,易受环境及材料等影响,因此用不同研究材料及不同分子标记揭示能在不同环境下稳定表达的QTL及其效应仍有重要价值。SRAP(基因表达区序列)标记是由Li等[11]首先于芸薹属植物中建立,是一种基于基因表达区序列的功能性分子标记。目前多被应用于植物遗传多样性研究[12-13],目前小麦产量性状QTL研究主要采用SSR、AFLP等分子标记。而在小麦数量性状QTL定位研究应用SRAP标记的报道较少。本研究利用近年来审定的农艺性状优良的小麦品种‘西农981’和‘陕麦159’构建的F2群体和F2:3家系,通过SRAP标记和SSR标记相结合的方法进行遗传图谱的构建,在2个环境条件下对小麦千粒质量和粒长性状进行QTL定位及效应分析。旨在寻找能在不同环境条件下稳定表达的QTL位点,为分子标记辅助小麦的遗传改良提供参考信息。
1 材料与方法
1.1 植物材料及种植
用近年来审定的农艺性状优良的2个小麦品种‘西农981’和‘陕麦159’进行杂交,构建含有169个单株的F2群体和F2:3家系;分别用于作图群体和表型定位。
2012年4月以‘西农981’为母本,以‘陕麦159’为父本,进行杂交。6月收获杂交种子,10月将杂交种子种植于西北农林科技大学杨凌小麦试验田。2013年6月收获F1种子,同年10月,将F1种子种植于杨凌小麦试验田,同时种植2个亲本,田间常规管理。2014年4月分单株挂牌标记169个F2单株,同年6月按单株收获并脱粒。2014年10月将收获的169个F2单株的种子一分为二,分别种植于陕西杨凌试验站(环境E1)(34°17′N,108°4′E,海拔 525 m),和陕西三原试验站(环境E2)(34°36′N,108°52′E,海拔429 m),形成2个环境点的F2:3家系群体;采用随机区组分布,试验设3次重复;单行区,行长2 m,行距0.24 m;同时种植亲本‘西农981’和‘陕麦159’,‘西农979’作对照,田间常规管理。
1.2 SRAP引物与SSR引物
SRAP引物信息来源于Li等[11]以及西北农林科技大学农学院胡胜武实验室,其中正向引物34条,反向引物18条,共能组成612对引物,引物由英潍捷基(上海)贸易有限公司合成。
SSR引物包括Xbarc系列、Xwmc系列、Xgdm系列、Xcfa系列、Xcfd系列等共计1 550对,由西北农林科技大学农学院王竹林老师提供。
1.3 DNA提取及分子标记检测
2个亲本、F1代植株以及F2分离群体中挂牌各单株分别采取幼苗叶片,采用CTAB法[14]进行小麦基因组DNA的提取,提取后通过琼脂糖凝胶电泳及超微量微孔板分光光度计分析DNA纯度及测量DNA浓度。
SRAP引物PCR反应体系为10 μL:ddH2O 2.4 μL,2×EsTaqMasterMix(康为世纪)5 μL,SRAP引物各0.3 μL(10 μmol·L-1),模版DNA 2 μL(20 ng· μL-1)。SRAP引物扩增程序为:95 ℃预变性60 s,94 ℃变性60 s,35 ℃退火60 s,72 ℃延伸60 s,5个循环;94 ℃变性60 s,50 ℃退火60 s,72 ℃延伸60 s,35个循环;72 ℃延伸7 min;4 ℃保存。
SSR引物PCR反应体系为15 μL,ddH2O 5.5 μL,2×EsTaqMasterMix(康为世纪)7.5 μL,SSR引物各0.5 μL(10 μmol·L-1),模版DNA 1 μL(20ng· μL-1)。SSR引物扩增程序为:95 ℃预变性4 min,94 ℃变性45 s,60 ℃退火60 s(每个循环降低0.5 ℃),72 ℃延伸55 s,10个循环;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸60 s,35个循环;72 ℃延伸10 min;4 ℃保存。
扩增产物用80 g/L的聚丙烯酰胺凝胶电泳分离,银染法检测并拍照统计扩增条带。
1.4 性状调查
2015年6月分别收获2个环境点的169个F2:3家系;每株系随机选取6个单株分别收获、脱粒及进行性状分析。粒长采用游标卡尺单粒测定,每个单株重复测定30次,取平均值;千粒质量测定采用200粒种子称量,重复3次,计算平均值并换算成千粒质量。上述性状调查结果取各株系平均值,采用SPSS 19.0软件进行统计分析。
1.5 连锁图谱构建及QTL定位
遗传连锁图谱构建采用软件Icimapping4.1(www.isbreeding.net)。带型记录参照软件要求;各参数值依照软件初始设置,LOD≥2.5。用Kosambi函数和完备区间作图法作图[15]。
2 结果与分析
2.1 亲本及F2:3家系产量性状表型变异
亲本及F2:3家系产量性状表型分析见表1。亲本‘西农981’在杨凌环境点和三原环境点粒长分别为7.32 mm和7.45 mm,而亲本‘陕麦159’在这2个环境点的粒长分别为6.25 mm和6.22 mm;亲本‘西农981’在2环境点的千粒质量分别为50.95 g和50.05 g,亲本‘陕麦159’在2个环境点的千粒质量分别为42.3 g和42.51 g。
双亲中,粒长、千粒质量亲本‘西农981’均显著高于‘陕麦159’。对亲本间进行单因素方差分析表明,粒长和千粒质量在2环境条件下均达到极显著差异。F2:3家系中,粒长性状在2环境点下变异系数分别为2.45%和2.48%;千粒质量性状在2环境点下变异系数分别为8.19%和6.65%,且表现出超亲分离现象,说明双亲及F2:3家系存在真实的遗传差异,符合数量性状遗传分析的要求。

表1 2个环境条件下亲本及F2:3群体表型及分析Table 1 Phenotypic analysis of F2:3 population and parents in two environment sites
注:**极显著差异。
Note:** level of highly significant difference.
2.2 分子标记连锁图谱
利用SRAP引物和SSR引物在‘西农981’和‘陕麦159’2个亲本之间进行单重复筛选及双重复验证,最终筛选获得81对有多态性的SRAP引物和150对有多态性SSR引物。将这些在亲本间有多态性的引物再用F2群体进行检测,SRAP引物有66对出现多态性,SSR引物有63对具有多态性。其中,SSR引物和SRAP引物在F2群体的部分个体中扩增多态性如图1和图2所示。最终在F2群体存在115个多态性标记(55个SRAP标记,60个SSR标记),这些标记被正确定位到遗传连锁图谱上。图谱全长3 203.67 cM,标记主要定位于A染色体组和B染色体组,其中2B染色体标记数量最多,共有21个标记,D基因组1D染色体最少,定位到3个标记。

P1.西农981 Xinong 981;P2.陕麦159 Shaanmai 159;1~88.部分F2群体 Part of F2 population;下图同 The same below 图1 SSR引物Xgwm66在F2群体的部分个体之间的扩增多态性检测图谱Fig.1 Polymorphism results of SSR primer pair Xgwm66 in partial F2 population

图2 SRAP引物对Me11Em1在F2群体的部分个体之间的扩增多态性检测图谱Fig.2 Polymorphism results of SRAP primer pair Me11Em1 in partial F2 population
2.3 小麦粒长和千粒质量性状的QTL定位及效应分析
在杨凌和三原2个环境点共检测到31个粒长和千粒质量相关QTL(图3及表2);其中粒长相关QTL检测到7个,分布于5A、6A、7A、2B、3B、4B染色体上;千粒质量相关QTL检测到24个,分布于2A、3A、5A、6A、7A、2B、3B、4B、5B、7B染色体上。
粒长QTL中,杨凌环境点只检测到1个QTL,位于3B染色体Xgwm376-Em1Me10-3,可解释表型变异的8.18%。三原环境点检测到6个粒长相关QTL,分别分布于2B、3B、4B、5A、6A和7A染色体上;其中,在三原环境点3B染色体Xgwm376-Em1Me10-3同样检测到1个粒长QTL,可解释表型变异的5.47%,表明该控制粒长的QTL能在2个不同环境条件下稳定表达;在5A染色体Xgwm126-Xgwm291检测到1个粒长QTL,可解释表型变异的5.81%;在6A染色体上检测到1个粒长QTL,位于Em8Me18-2-Em5Me28-2,可解释表型变异的4.36%。在7A染色体上检测到1个粒长QTL,位于WMC273-Xgwm282-1,可解释表型变异的4.69%。在2B染色体上检测到1个粒长QTL,位于Em8Me32-Em9Me12,可解释表型变异的14.8%。可能为一主效QTL。
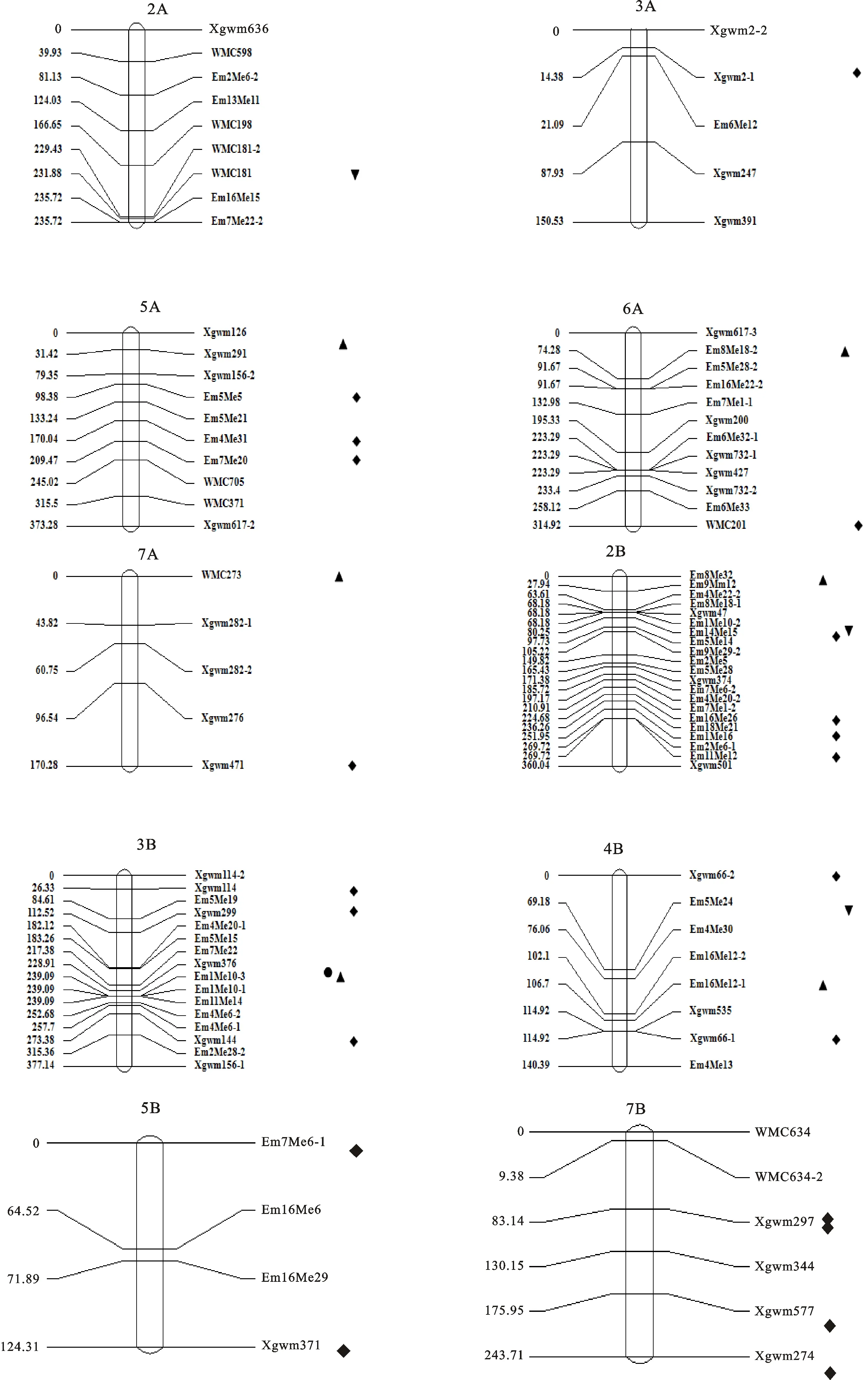
●.杨凌粒长 Kernel length measured in Yangling;▲.三原粒长 Kernel length measured in Sanyuan;◆.杨凌千粒质量 1 000-grain mass measured in Yangling▼.三原千粒质量 1 000-grain mass measured in Sanyuan

图3 小麦粒长和千粒质量相关QTL位点定位Fig.3 Location of QTLs related kernel length and 1 000-grain mass in wheat表2 完备区间作图法检测粒长和千粒质量的QTLTable 2 QTLs determined by inclusive composite interval mapping
千粒质量QTL中,在杨凌环境点共检测到21个QTL。其中3A染色体上1个;5A染色体上3个;6A染色体上1个,7A染色体上1个;2B染色体上4个,3B染色体上3个;4B染色体上2个,5B染色体上2个;7B染色体上4个。加性效应值表明,千粒质量QTL的增效等位基因来源于亲本‘西农981’。三原环境点检测到3个千粒质量QTL,分别位于2A、2B、4B染色体上。
3 讨 论
3.1 SRAP标记能有效增加基于SSR标记的小麦遗传图谱中分子标记的密度
SSR标记是基于高等植物基因组中基因间短的中度或高度重复序列在物种间的多态性而建立的分子标记,其在作物遗传多样性、遗传连锁图的构建及数量性状QTL定位、目标基因定位及分子标记辅助育种选择等方面已得到广泛应用[16]。SRAP标记技术是首先在芸薹属植物中建立的,李媛媛等[17]利用SRAP标记、SSR标记和AFLP标记对甘蓝型油菜进行遗传图谱的构建,发现SRAP多态性检出率最高。本研究构建小麦遗传连锁图谱时,多态性筛选结果表明SRAP标记的多态性检出率高于SSR标记。SRAP引物不受物种限制,不同引物可以随意组合,大大提高引物的使用效率,进而降低引物合成的成本。因此,SRAP标记在作物遗传图谱构建中具有很大的利用空间。在小麦遗传连锁图谱构建中,SRAP标记能够弥补SSR标记的不足,使基于SSR标记的遗传连锁图的标记密度能够进一步增加。
此外,由于本试验所用SSR标记多位于A染色体组和B染色体组,因此所得遗传图谱中,分子标记多位于A染色体组和B染色体组,D染色体组较少,贾继增等[18]对来自世界11个国家的小麦品种进行遗传多样性分析,结果发现A染色体组和B染色体组遗传多样性较高,而D基因组较差,这可能是导致D染色体组标记较少的原因之一。
3.2 小麦粒长和千粒质量QTL定位结果比较
由于小麦基因组庞大且复杂,因此利用不同的材料和不同的方法对小麦进行QTL定位得到的结果往往有所差异并可能得到新的结果,这与不同的材料携带的基因不同有关,同时也受环境差异和不同标记方法的共同影响。本研究利用近年来审定的农艺性状优良的小麦品种‘西农981’和‘陕麦159’构建的F2群体和F2:3家系为研究材料,在三原和杨凌2个环境条件下对小麦千粒质量和粒长性状进行QTL定位及效应分析,结果共检测到31个小麦粒长和千粒质量QTL位点;其中,其7个粒长QTL;24个千粒质量QTL。前人已研究得到的粒长QTL基本遍布于小麦21条染色体上[19-21]。余曼丽等[20]将粒长QTL定位到5A、7A、1B、2B、3B、1D、6D、7D染色体上,其中5A、1B、2B、3B染色体上的粒长QTL可在2环境条件下稳定表达;本研究同样在5A、7A、2B、3B染色体上检测到粒长QTL,但是只在3B染色体上检测到1个能在2环境条件下稳定表达的粒长QTL;本研究在3B染色体所得的粒长QTL与余曼丽等[20]在3B染色体所得的粒长QTL所处位置不同,邻近标记也不同,但是否为新的QTL仍需要进一步增加标记密度才能确定。此外,本研究在2B染色体上的粒长QTL可解释表型变异的14.8%,可能为一主效QTL;Ramya等[21]利用SSR标记在小麦2B染色相近位置同样发现了一个控制粒长的QTL;但是由于本研究在该位置临近标记为SRAP标记,所以,无法确定二者是否为同一QTL位点,还需进一步研究分析才能明确。本研究除在5A、7A、2B、3B染色体上检测到粒长QTL外,还在6A、4B染色体上检测到控制粒长的QTL,其中位于6A染色体上的QTL前人未检测到,可能为一新的粒长QTL。
已报道的小麦千粒质量QTL分布于小麦21条染色体上[3,22-23]。Ramya等[21]将小麦千粒质量QTL定位于1A、2B、4B、5B、6B、1D、2D染色体上,其中位于2B染色体上的千粒质量QTL能够在4个环境条件下稳定表达;周淼平等[24]和丁安明等[25]也在2B染色体上检测到千粒质量相关QTL;本研究在2B染色体上未检测到2环境下稳定表达的千粒质量QTL,但是在2B染色体共检测到5个千粒质量QTL,这5个千粒质量QTL与Ramya等[21]以及周淼平等[24]和丁安明等[25]所检测得到的千粒质量QTL所处位置均不相同,这5个千粒质量QTL多数与SRAP标记相关,由于SRAP标记与其他标记如SSR标记的扩增区间不同,因此推测可能为新的千粒质量QTL,但是其贡献率都较低,属于微效QTL。王瑞霞等[2]曾在3B染色体上检测到3个千粒质量QTL;本研究也在3B染色体上检测到3个千粒质量QTL,这表明2B及3B染色体上可能存在控制千粒质量相关的基因,但是3B染色体上检测得到的千粒质量QTL贡献率也较低。此外,本研究还在5A和7B染色体上分别检测到3个和4个千粒质量QTL,这与前人在相应染色体上得到的千粒质量QTL的位置有所不同,是否为新的千粒质量QTL位点尚需进一步分析。本研究只在粒长性状上检测到1个能在2环境条件下稳定表达的QTL;2个环境条件下检测得到的粒长QTL及千粒质量QTL结果差异较大,这可能是受2地环境条件影响所导致;李巧云等[26]研究曾指出小麦产量性状易受地理环境和生产条件的影响,同一品种在不同地区或同一地区不同种植地点都可能存在明显差异。
本研究所采用的2个亲本‘西农981’和‘陕麦159’是近年来审定的农艺性状优良的小麦品种,本研究结果对利用这2个亲本进行新品种的选育具有一定的借鉴;在后续的研究中将重点对2B及3B染色体区段进行加密研究,为利用分子标记辅助育种及培育具有高产、优质的品种提供有用信息。
Reference:
[1] GIURA A,SAULESCU N N.Chromosomal location of genes controlling grain size in a large grained selection of wheat (TriticumaestivumL.)[J].Euphytica,1996,89(1):77-80.
[2] 王瑞霞,张秀英,伍 玲,等.不同生态环境下冬小麦籽粒大小相关性状的QTL分析[J].中国农业科学,2009,42(2):398-407.
WANG R X,ZHANG X Y,WU L,etal.QTL analysis of grain size and related traits in winter wheat under different ecological environments.[J].ScientiaAgriculturaSinica,2009,42(2):398-407(in Chinese with English abstract)
[3] CAMPBELL K G,BERGMAN C J,GUALBERTO D G,etal.Quantitative trait loci associated with kernel traits in a soft × hard wheat cross[J].CropScience,1999,39(4):1184-1195.
[4] VARSHNEY R K,PRASAD M,ROY J K,etal.Identification of eight chromosomes and a microsatellite marker on 1AS associated with QTL for grain weight in bread wheat[J].Theoretical&AppliedGenetics,2000,100(8):1290-1294.
[5] AMMIRAJU J S S,DHOLAKIA B B,SANTRA D K,etal.Identification of inter simple sequence repeat (ISSR) markers associated with seed size in wheat[J].Theoretical&AppliedGenetics,2001,102(5):726-732.
[6] 李斯深.小麦产量性状QTL的分子标记定位[D].济南:山东农业大学,2002.
LI S SH.QTL mapping for yield traits using molecular markers in wheat[D].Jinan:Shandong Agricultural University,2002(in Chinese).
[7] 宋彦霞,景蕊莲,霍纳新,等.普通小麦(T.aestivumL.)不同作图群体抽穗期QTL分析[J].中国农业科学,2006,39(11):2186-2193.
SONG Y X,JING R L,HUO N X,etal.Detection of QTLs for heading in common wheat (T.aestivumL.) using different populations[J].ScientiaAgriculturaSinica,2006,39(11):2186-2193 (in Chinese with English abstract).
[8] TYAGI S,MIR R R,BALYAN H S,etal.Interval mapping and meta-QTL analysis of grain traits in common wheat (TriticumaestivumL.)[J].Euphytica,2015,201(3):367-380.
[9] LI C,BAI G,CARVER B F,etal.Single nucleotide polymorphism markers linked to QTL for wheat yield traits[J].Euphytica,2015,206(1):89-101.
[10] 姚 琴,周荣华,潘昱名,等.小麦品种偃展1号与品系早穗30重组自交系群体遗传连锁图谱构建及重要农艺性状的QTL分析[J].中国农业科学,2010,43(20):4130-4139.
YAO Q,ZHOU R H,PAN Y M,etal.Construction of genetic linkage map and QTL analysis of agronomic important traits based on a RIL population derived from common wheat variety Yanzhan 1 and Zaosui 30.[J].ScientiaAgriculturaSinica,2010,43(20):4130-4139(in Chinese with English abstract).
[11] LI G,QUIROS C F.Sequence-related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theoretical&AppliedGenetics,2001,103:455-461.
[12] 祁建民,梁景霞,陈美霞,等.应用ISSR与SRAP分析烟草种质资源遗传多样性及遗传演化关系[J].作物学报,2012,38(8):1425-1434.
QI J M,LIANG J X,CHEN M X,etal.Genetic diversity and evolutionary analysis of tobacco (NicotianatabacumL.)germplasm resources based on ISSR and SRAP markers[J].ActaAgronomicaSinica,2012,38(8):1425-1434(in Chinese with English abstract).
[13] 韩 芳,亓佳佳,马守才,等.黄淮麦区部分小麦品种(系)遗传多样性的SRAP分析[J].西北农业学报,2014,23(12):60-67.
HAN F,QI J J,MA SH C,etal.Genetic diversity of some wheat varieties in Huang-Huai wheat area revealed by SRAP marker[J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(12):60-67(in Chinese with English abstract).
[14] SAGHAI-MAROOF M A,SOLIMAN K M,JORGENSEN R A,etal.Ribosomal DNA spacer-length polymorphisms in barley:mendelian inheritance,chromosomal location,and population dynamics[J].ProcedingoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1984,81(24):8014-8018.
[15] JIANG Y F,LAN X J,LUO W,etal.Genome-wide quantitative trait locus mapping identifies multiple major loci for brittle rachis and threshability in Tibetan semi-wild wheat (Triticumaestivumssp.tibetanumShao)[J].PlosOne,2013,9(12):114066-114066.
[16] 程小毛,黄晓霞.SSR标记开发及其在植物中的应用[J].中国农学通报,2011,27(5):304-307.
CHENG X M,HUANG X X.Development and application of SSR markers in plants[J].ChineseAgriculturalScienceBulletin,2011,27(5):304-307(in Chinese with English abstract).
[17] 李媛媛,沈金雄,王同华,等.利用SRAP、SSR和AFLP标记构建甘蓝型油菜遗传连锁图谱[J].中国农业科学,2007,40(6):1118-1126.
LI Y Y,SHEN J X,WANG T H,etal.Construction of a linkage map using SRAP,SSR and AFLP markers inBrassicanapusL.[J].ScientiaAgriculturaSinica,2007,40(6):1118-1126(in Chinese with English abstract).
[18] 贾继增,张正斌.小麦21条染色体RFLP作图位点遗传多样性分析[J].中国科学(C辑:生命科学),2001,31(1):13-21.
JIA J Z,ZHANG ZH B.Genetic diversity of 21 chromosome for wheat by RFLP marker[J].ScienceinChina(SeriesC),2001,31(1):13-21(in Chinese).
[19] LI Q,ZHANG Y,LIU T,etal.Genetic analysis of kernel weight and kernel size in wheat (TriticumaestivumL.) using unconditional and conditional QTL mapping[J].MolecularBreeding,2015,35(10):1-15.
[20] 余曼丽,赵林姝,郭会君,等.小麦籽粒性状的 QTL 定位[J].麦类作物学报,2014,34(8):1029-1035.
YU M L,ZHAO L SH,GUO H J,etal.QTL mapping for kernel traits in wheat[J].JournalofTriticeaeCrops,2014,34(8):1029-1035(in Chinese with English abstract).
[21] RAMYA P,CHAUBAL A,KULKARNI K,etal.QTL mapping of 1 000-kernel weight,kernel length,and kernel width in bread wheat (TriticumaestivumL.)[J].JournalofAppliedGenetics,2010,51(4):421-429.
[22] HUANG X Q,KEMPF H,GANAL M W,etal.Advanced backcross QTL analysis in progenies derived from a cross between a German elite winter wheat variety and a synthetic wheat (TriticumaestivumL.)[J].TheoreticalandAppliedGenetics,2004,109(5):933-943.
[23] HUANG X Q,CLOUTIER S,LYCAR L,etal.Molecular detection of QTLs for agronomic and quality traits in a doubled haploid population derived from two Canadian wheats (TriticumaestivumL.)[J].Theoretical&AppliedGenetics,2006,113(4):753-766.
[24] 周淼平,任丽娟,张 旭,等.小麦产量性状的 QTL 分析[J].麦类作物学报,2006,26(4):35-40.
ZHOU M P,RENG L J,ZHANG X,etal.Analysis of QTLs for yield traits of wheat [J].JournalofTriticeaeCrops,2006,26(4):35-40(in Chinese with English abstract).
[25] 丁安明,崔 法,李 君,等.小麦单株产量与株高的 QTL 分析[J].中国农业科学,2011,44(14):2857-2867.
DING A M,CUI F,LI J,etal.QTL analysis on grain yield per plant and plant height in wheat[J].ScientiaAgriculturaSinica,2011,44(14):2857-2867(in Chinese with English abstract).
[26] 李巧云,李 磊,刘万代,等.河南省小麦产量及其构成因素变化规律分析[J].河南农业科学,2011,40(4):38-40.
LI Q Y,LI L,LIU W D,etal.Analyses of yield and its composition property of wheat in henan province [J].JournalofHenanAgriculturalSciences,2011,40(4):38-40(in Chinese with English abstract).
(责任编辑:史亚歌 Responsible editor:SHI Yage)
The QTL Mapping and Effect Analysis of Wheat Kernel Length and 1 000-grain Mass Based on SRAP and SSR Markers
GUO Lijian1, WANG Zhulin2, WANG Shijuan1, LIU Xiangli1and ZHAO Huixian1
(1.College of Life Sciences,Northwest A&F University, Yangling Shaanxi 712100, China;2. College of Agronomy, Northwest A&F University, Yangling Shaanxi 712100, China)
In order to explore QTLs related to kernel length and 1 000-grain mass, wheat variety ‘Xinong 981’ and ‘Shaanmai 159’ were used to develop 169 F2population and F2:3lines. The F2population was exploited to construct genetic map and the F2:3lines grown in two different environments of Yangling and Sanyuan for testing the phenotypic data. The results showed that highly significant difference of environment variance was detected for kernel length and 1 000-grain mass.Thirty-one related QTLs were detected in two environments. Of all, seven QTLs account for 4.36%-14.80% phenotypic variance of wheat kernel length, scattered in 5A, 6A, 7A, 2B, 3B, and 4B chromosomes, and on 3B chromosome, one kernel length-related QTL was detected in both locations; 24 QTLs for 1 000-grain mass, distributed on 2A, 3A, 5A, 6A, 7A, 1B, 2B, 3B, 4B,5B, and 7B chromosome and can explain 0.25%-8.23% phenotypic variance. Five QTLs related to 1 000-grain mass were detected on 2B chromosome, suggesting that 2B chromosome might closely related to kernel mass.
Wheat; Kernel length; Grain mass; SRAP; QTL
2016-04-14 Returned 2016-06-02
The National Natural Science Foundation of China (No.31471482).
GUO Lijian, male,master student. Research area:wheat QTL reseach. E-mail:baiheichaye@163.com
ZHAO Huixian, female, doctoral supervisor. Research area:biochemistry and molecular biology. E-mail:hxzhao212@nwsuaf.edu.cn
日期:2017-08-18
2016-04-14
2016-06-02
国家自然科学基金(31471482)。 第一作者:郭利建,男,硕士研究生,从事小麦QTL定位研究。E-mail:baiheichaye@163.com
赵惠贤,女,博士,教授,主要从事生化与分子生物学研究。E-mail:hxzhao212@nwsuaf.edu.cn
S512.1
A
1004-1389(2017)08-1165-08
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170818.0938.020.html
