羊口疮病毒B2L基因的原核表达、纯化及鉴定
2017-09-15白银荣应海刚张七斤
李 智,仲 亮,白银荣,代 兄,应海刚,张七斤
(1. 内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2. 巴林左旗农畜产品质量安全管理中心,内蒙古赤峰 025450)
羊口疮病毒B2L基因的原核表达、纯化及鉴定
李 智1,仲 亮1,白银荣1,代 兄1,应海刚2,张七斤1
(1. 内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2. 巴林左旗农畜产品质量安全管理中心,内蒙古赤峰 025450)
[目的] 获取羊口疮病毒B2L基因编码蛋白。[方法]根据GenBank上羊口疮病毒ORFV/ShanXi/2011/ China株B2L基因序列,设计并合成1对特异性引物,利用PCR方法扩增B2L全基因序列,然后将扩增的B2L基因克隆到PMD18-T载体上;对构建的重组克隆质粒(PMD18-T-B2L)经过测序鉴定后,将目的基因亚克隆到PET-32a(+)原核表达载体上,获得重组表达质粒PET-32a-B2L,然后通过双酶切和测序进行鉴定;将重组菌于37 ℃、终浓度含1 mM IPTG的LB培养基中,诱导表达3 h后进行SDS-PAGE分析;表达的目的蛋白经过层析纯化后,进行Western Blot鉴定。[结果] 原核表达重组质粒构建成功;SDS-PAGE鉴定发现目的条带的分子量与预期大小相符;纯化的目的蛋白经Western Blot鉴定正确,表明蛋白表达成功。[结论] 本研究成功构建了羊口疮病毒B2L基因原核表达重组质粒,并成功表达和纯化了B2L蛋白,为后续羊口疮病毒检测方法的建立打下了基础。
羊口疮病毒;B2L基因;原核表达
羊口疮(Orf)是由羊口疮病毒(Orf virus,ORFV)引起山羊和绵羊的一种急性、接触性传染病,人也可感染。本病以羊口唇等处的皮肤和粘膜形成红斑、丘疹、脓疮、溃疡和结痂等为主要特点[1]。近年来,随着我国养羊业的快速发展,羊口疮引起的经济损失越来越严重。目前,尚无治疗羊口疮的特效药。国内外虽有商品化的羊口疮病毒灭活疫苗和弱毒疫苗,新型疫苗也在研究之中,但迄今为止尚未成功研制出安全、高效的羊口疮病毒疫苗。羊口疮病毒全基因组大小为135~139 kb,是双链线性DNA病毒,基因组包含131个基因。B2L基因位于基因组的左末端,病毒在宿主细胞内增值时,B2L基因在病毒的DNA尚未开始复制时便大量转录和翻译出42 KDa大小的蛋白。该蛋白是羊口疮病毒的主要囊膜蛋白,可强烈刺激宿主免疫系统产生免疫应答[2]。张海瑞[3]、李杰[4]、李瑞芳等[5]曾利用原核表达系统表达过该蛋白。刘媛等[6]利用真核表达系统也对该蛋白进行了表达。本研究克隆了羊口疮病毒B2L基因,并在原核表达系统中进行表达,纯化出高浓度的重组B2L蛋白,为后续建立羊口疮病毒的血清学检测方法等工作提供重要的材料,为建立羊口疮病毒间接ELISA检测方法奠定基础[4,7]。
1 材料与方法
1.1 材料
1.1.1 病毒。羊口疮病毒是2015年由涂明亮从青岛市分离的,命名为ORFV/QD/2015。通过病毒滴度的测定,其TCID50为10-5.5/0.1 mL。毒株由内蒙古农业大学传染病实验室保存。
1.1.2 细胞与菌株。DH5α、BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司。
1.1.3 主要试剂。2×Easy Taq SuperMix,购自北京全式金生物技术有限公司;氨苄青霉素(Ampicillin),购自AMERSCO公司;DL2000、DL5000、PMDTM18-T Vector Cloning Kit、T4 DNA Ligase、QuickCutTMHind Ⅲ、QuickCutTMBamHⅠ,均购自宝生物(大连)工程有限公司;病毒基因组DNA/RNA提取试剂盒、凝胶回收试剂盒、质粒小提试剂盒,均购自天根生化科技(北京)有限公司;镍柱,购自北京全式金生物技术有限公司;原核表达载体PET-32a-c(+),购自美国Novagen公司;Binding Buffer和Elution Buffer,均购自生工生物工程(上海)有限公司;蛋白Marker、蛋白预染 Maker,购自Thermo公司;PVDF膜,购自Bio-Rad;Anti-6 X His antibody(一抗),购自上海生工;山羊抗兔抗体(二抗)、蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒、BeyoECL Plus,均购自碧云天。其他试剂均为标准化学分析纯试剂。
1.1.4 主要设备。22331型PCR仪,购自德国Eppendorf公司;水平电泳仪BG-Power600i和BG-verMINI垂直电泳仪均购自BAYGENE公司;Syngene G:BOX凝胶成像仪,购自英国SYNGENE公司;恒温水浴锅,购自北京市长风仪器仪表公司;5417R型低温高速离心机,购自德国Eppendorf公司;恒温振荡培养箱(HZC-250),购自培英仪器公司;250D型数字式细胞粉碎仪,购自美国BRANSON公司。
1.2 方法
1.2.1 引物设计与合成。根据GenBank中羊口疮病毒(ORFV/ShanXi/2011)B2L基因序列,利用Primer 5.0软件在基因保守区设计特异性引物。引物由生工生物工程(上海)有限公司合成[8](表1)。划线处为上游BamH I和下游Hand III的酶切位点。

表1 B2l基因引物序列及产物大小
1.2.2 PCR扩增。采用病毒基因组DNA提取试剂盒提取ORFV/QD/2015株全基因组;以提取的羊口疮病毒基因组为模板,以生理盐水做阴性对照,用设计的B2L特异性引物对其进行PCR扩增。PCR扩增反应体系(25 µL)为:2×Taq PCR Master Mix 12.5 µL,上游引物(10 μmol/L)1.0 μL,下游引物(10 μmol/L)1.0 μL,模板 DNA 1.0 µL,RNase-Free ddH2O 9.5 µL。PCR扩增反应参数为:94 ℃预变性5 min,94 ℃变性30 s,53 ℃退火45 s,72 ℃延伸30 s,35个循环,72 ℃终延伸10 min。对扩增得到的产物进行1%琼脂糖凝胶电泳检测。
1.2.3 基因克隆。回收纯化的目的DNA片段连接至PMD18-T载体上,转化到大肠杆菌DH5α感受态中,利用含氨苄青霉素抗性的LB平板筛选阳性重组质粒。用质粒小提试剂盒提取重组质粒,然后进行PCR和质粒双酶切鉴定,将产物经1%琼脂糖凝胶电泳检测,对鉴定为阳性的重组质粒命名为PMD18-T-B2L,送往北京华大生物工程有限公司测序[9]。
1.2.4 目的基因原核表达载体的构建。将测序正确的PMD18-T-B2L质粒与PET-32a(+)表达载体用 Hind Ⅲ、BamHⅠ限制性内切酶进行双酶切;对双酶切产物进行1%琼脂糖凝胶电泳检测,然后用胶回收试剂盒将双酶切产物回收。将回收产物用T4 DNA连接酶16 ℃过夜连接,将连接产物转化至大肠杆菌BL21感受态细胞中,利用含氨苄青霉素抗性的LB平板筛选阳性重组质粒。提取重组质粒,对其进行PCR和质粒双酶切鉴定,将产物经1%琼脂糖凝胶电泳检测,对鉴定为阳性的重组质粒命名为PET-32a-B2L,送往北京华大生物工程有限公司测序[7]。
1.2.5 重组表达质粒的诱导表达。将菌株划线接种于含1%的Amp(+)的LB固体培养基,37 ℃过夜培养;将过夜菌挑单菌落接种于3 mL含氨苄抗性的新鲜 LB液体培养基,摇菌培养12 h,按1%的比例将纯化培养的菌液接种于200 mL含氨苄抗性的新鲜 LB液体培养基,37 ℃ 200 r/min 摇菌培养;当用分光光度计测OD值为0.6~0.8时,加入终浓度为1 mM的IPTG诱导3 h,收集菌液,12 000 r/min离心10 min,弃上清,用Binding Buffer洗涤2次,然后重悬,于冰浴中进行超声破碎(以超声菌液清亮为止);将超声裂解菌液以4 ℃,12 000 r/min离心5 min,分离上清和沉淀,沉淀用尿素溶解,经过SDS-PAGE电泳测定,并且以未诱导菌和诱导空载体菌为阴性对照[3-4,7]。
1.2.6 重组蛋白纯化。将2 mL Ni-NTA镍柱填料放入层析柱中,加入5 mL RNase-Free ddH2O平衡5次,加入5 mL Binding Buffer平衡10次;将蛋白加入平衡好的Ni-NTA镍柱填料中,在冰上或者4 ℃静置过夜结合。第2天收集流穿液,加5 mL Binding Buffer洗5次,收集洗涤液,加Elution Buffer 5 mL洗2次,收集洗脱液[10-12]。
1.2.7 重组蛋白Western Blot鉴定。将经SDSPAGE电泳的蛋白条带转印到PVDF膜上,用TBST洗4次,每次10 min;用5%牛血清白蛋白室温封闭2 h,封闭后用TBST洗3次,每次10 min;然后膜上加入Anti-6 X His antibody(1:1 000稀释),4 ℃过夜孵育,第2天用TBST洗3次,每次10 min;再将膜放入1:5 000稀释的辣根过氧化物酶标记的山羊抗兔抗体中孵育1 h,取出膜后用TBST洗3次,每次10 min;在PVDF膜上加ECL显影液,放于荧光显色仪中显色。
2 结果与分析
2.1 B2L基因PCR扩增
利用特异性引物,以提取的ORFV/QD/2015株基因组DNA为模板,经PCR扩增获得B2L基因片段,产物经1%琼脂糖凝胶电泳检测,在1 000~2 000 bp并且靠近1 000 bp的地方出现特异性条带,与B2L预期的目的条带1 137 bp大小相符(图1)。

图1 ORFV/QD/2015株B2L基因PCR扩增产物电泳图
2.2 重组表达质粒普通PCR和双酶切鉴定结果
挑取单菌落于5 mL LB液体培养基中37 ℃培养12 h,提取质粒作为模板,进行普通PCR扩增,产物经1%琼脂糖凝胶电泳检测,在大约1 137 bp的地方出现特异性条带,与B2L的目的条带1 137 bp大小相符(图2)。用 Hind Ⅲ、BamHⅠ限制性内切酶将重组质粒进行双酶切,对产物经1%琼脂糖凝胶电泳检测,结果与预期大小相符(图3)。重组质粒测序结果显示,目的基因与ORFV/ ShanXi/2011株同源性高达97.7%。以上鉴定结果表明,重组表达质粒构建成功。
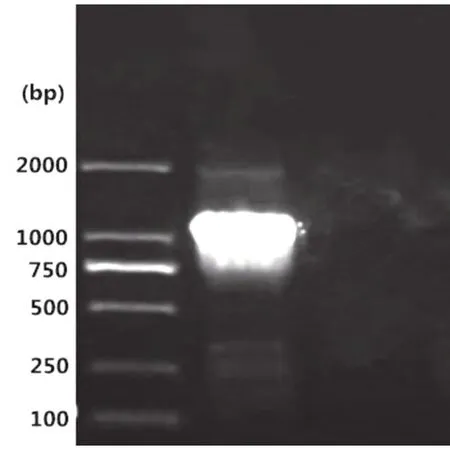
图2 重组表达质粒PCR结果

图3 重组表达质粒双酶切鉴定结果
2.3 重组蛋白SDS-PAGE分析
将重组表达载体转入大肠杆菌BL21(DE3)中,经过摸索和条件优化,最终确定37 ℃、IPTG终浓度为1 mM、诱导培养3 h为最佳条件。结果显示,诱导的PET-32a-B2L重组菌经超声破碎后,沉淀中62 KDa大小附近出现清晰的条带,而诱导的PET-32a-B2L重组菌超声后上清、未诱导PET-32a-B2L重组菌、诱导的PET-32a空载体菌、未诱导的PET-32a空载体菌和未诱导的BL21空菌中在这一位置均未观察到条带(图4)。结果表明,B2L重组蛋白是以包涵体形式表达。
2.4 重组蛋白纯化
诱导表达得到的B2L蛋白经镍柱亲和层析后,分别取收集到的流穿液、洗涤液和洗脱液20 µL进行SDS-PAGE电泳。结果显示,虽然流穿液和洗涤液中有少许重组蛋白存在,但大量重组蛋白均存在于洗脱液中(图5)。本研究结果说明,重组蛋白得到了较好的纯化。使用BCA蛋白浓度测定法测的纯化的蛋白浓度为0.9 mg/mL。

图4 重组蛋白表达情况分析

图5 蛋白纯化产物SDS-PAGE电泳
2.5 重组蛋白Western Blot检测
将纯化的蛋白经Western Blot鉴定,结果发现在62 KDa附近出现一条清晰条带,大小与预期相符,而未诱导的重组菌和诱导的空表达载体菌样品均未检测到条带,表明重组蛋白在大肠杆菌中成功表达(图6)。

图6 纯化蛋白Western Blot鉴定结果
3 讨论
目前,羊口疮广泛流行于全球各养殖国家或地区,并且发生的频率和流行的范围呈逐年上升的趋势,特别是我国黑龙江、新疆、内蒙、西藏、青海、吉林等养殖地区近年频频暴发羊口疮疫情,给养羊业带来了一定的经济损失[2]。但由于国内对羊口疮的关注度不高,相关科研机构没有对该病进行系统性研究,对该病进行检测的试剂盒市场需求相对小,国内也缺乏相关检测试剂盒。真核表达系统存在表达量低、操作复杂、费用高昂等问题,所以本研究选用原核表达系统表达羊口疮病毒B2L蛋白。通过PET-32a表达载体成功构建B2L重组表达质粒,在原核系统中表达后,获得羊口疮B2L蛋白并进行了纯化和鉴定,结果表明B2L蛋白得到成功表达。研究结果将为正在进行的羊口疮病毒抗体间接ELISA检测方法的建立提供必要的生物材料,进而为准确诊断羊口疮和进行流行病学调查提供简便快捷的方法。
李杰[4]将B2L基因与PET-32a载体连接后转化到BL21(DE3)感受态中,在10 ℃、IPTG终浓度为0.3 mM、4 h诱导条件下,B2L重组蛋白在上清中高效表达。本研究也曾尝试使用同样的条件进行诱导表达,但是在上清中并未发现有融合蛋白,相反包涵体的表达量也大大降低。虽然本研究和李杰所选载体、诱导条件、感受态细胞都一样,但两个研究中的毒株和感受态细胞的代次等可能存在差异,导致试验结果不同。
为了提高B2L重组蛋白的产量,本研究在试验中通过对诱导表达条件的摸索和优化,结果表明:在37 ℃、IPTG终浓度为1 mM、诱导时间为3 h的条件下,目的蛋白表达能得到最佳表达。另外,通过大肠杆菌表达蛋白时,由 于表达量高,往往形成无活性、不溶的包涵体。而包涵体又需经过变性和复性的过程才能获得有一定活性的目的蛋白。根据对B2L蛋白可溶性分析,菌体表达B2L蛋白是以不溶的包涵体形式存在,所以本研究选择了8 M尿素溶解包涵体。但试验中发现,只有在所有缓冲液中都加入终浓度为8 M的尿素时,蛋白才能与镍柱中的填料发生特异性结合,才可以使重组蛋白得到很好的纯化。这与国外发表文献中提到的样品缓冲液与结合缓冲液、洗脱缓冲液尽可能一致的观点相符[13-14]。蛋白变性后,如何提高目的蛋白的复性效果,以及复性的蛋白是否具有良好的反应原性,能否与抗体特异性结合等问题,目前正在进一步研究。
[1] 李旭东. 羊传染性脓疱实时荧光定量PCR方法的建立[D].呼和浩特:内蒙古农业大学,2015,6.
[2] 涂明亮. 羊口疮病毒生物学特性研究[D]. 呼和浩特:内蒙古农业大学,2016,6.
[3] 张海瑞. 羊口疮病毒的分离鉴定及其ELISA检测方法的建立[D]. 北京:中国农业科学院,2011,6.
[4] 李杰. 羊口疮抗体ELISA检测方法的建立及应用[D]. 杨凌:西北农林科技大学,2013,5.
[5] 李瑞芳,李国华,孟仁,等. 新疆羊口疮病毒分离鉴定及B2L基因分析与表达[J]. 中国预防兽医学报,2015,35(3):202-205.
[6] 刘媛,冯将,鲜思美,等. 羊口疮病毒F1L和B2L基因真核表达质粒构建及其在MDBK细胞中的表达[J]. 中国人兽共患病学报,2015,31(12):1124-1128.
[7] 张博,李守军,杨保收,等. 猪流行性腹泻病毒部分N基因的原核表达及表达产物反应原性分析[J]. 中国畜牧兽医,2016,43(3):637-643.
[8] 李金明. 实时荧光PCR技术[M]. 北京:人民军医出版社,2011,4-5.
[9] 安维雪. 羊痘病毒内蒙古分离株生物学特性的研究[D].呼和浩特:内蒙古农业大学,2016,6.
[10] 陈爱春,彭伟,汪生鹏. 亲和标签在重组蛋白表达和纯化中的应用[J]. 中国生物工程杂志,2012,32(12):93-103.
[11] 崔超,呼延霆,尹大川. 重组标签蛋白在蛋白质纯化中的研究进展[J]. 现代生物医学进展,2014,32(43):6372-6378.
[12] 麻晓庆,王继红,韩晓熙,等. 基因重组蛋白L243诱导表达包涵体的变性、复性和纯化[J]. 吉林医药学院学报,2007,28(1):1-3.
[13] PORATH J. Immobilized metal ion affinity chromatography[J]. Protein Expr Purif,1992,3(4):263-281.
[14] PORATH J,CARLSSON J,OLSSON I,et al. Metal chelate affinity chromatography,a new approach to protein fractionation[J]. Nature,1975,258(5536):598-599.
(责任编辑:朱迪国)
Prokaryotic Expression,Purifcation and Identifcation of ORFV B2L Gene
Li Zhi1,Zhong Liang1,Bai Yinrong1,Dai Xiong1,Ying Haigang2,Zhang Qijin1
(1. College of Veterinary Medicine,Inner Mongolia Agricultural University,Hohhot,Inner Mongolia 010018;2. Quality and Safety Management Center of Agricultural and Livestock Products,Chifeng,Inner Mongolia 025450)
[Objective] To obtain the B2L protein of Orf virus(ORFV). [Methods] Based on ORFV/ShanXi/2011/ China strain B2L gene sequence in GenBank,a pair of specific primers were designed and synthesized. The primers were used to amplify the B2L ORF fragment of ORFV by PCR. The PCR product was cloned into PMD18-T vector to form recombinant PMD18-T-B2L,which was identified by enzymatic digestion and sequencing. The B2L fragment of interest was digested and subcloned into Prokaryotic Expressing Vector PET-32a(+)and was verified by sequencing. The recombinant plasmid(PMD18-T-B2L)was cloned and sequenced,and the target gene was subcloned into PET-32a(+)prokaryotic expression vector. Recombinant expression plasmid PET-32a-B2L was obtained and identified by double restriction digestion and sequencing. The recombinant strain was induced at 37 ℃ and the final concentration of 1 mM IPTG in LB medium. After 3 h expression,SDS-PAGE analysis was carried out. The expressed protein was purified by chromatography and identified by Western and Blot. [Results] The B2L protein was expressed with the expected size successfully. The SDS-PAGE identification results showed that the molecular weight of the target band was in line with the expected size. The purified protein was identified by Western Blot,indicating the successful expression of the protein. [Conclusion] The recombinant plasmid of ORFV B2L gene was constructed successfully in this study,and the B2L protein were expressed and purified successfully,which laid a foundation for the establishment of sheep ORFV detection method.
ORFV;B2L gene;prokaryotic expression
S852.65
B
1005-944X(2017)09-0102-05
10.3969/j.issn.1005-944X.2017.09.027
国家重点研发计划项目(2017YFD0500900)
