湖北省某规模化猪场猪繁殖与呼吸综合征的诊断及流行毒株GP5基因特性分析
2017-09-15李孝文章洪皲樊翠华
李孝文,章洪皲,樊翠华,姜 平
(1. 南京农业大学动物医学院,江苏南京 210095;2. 国家生猪产业技术体系黄陂综合试验站,湖北武汉 430344;3. 西藏新好科技有限公司,西藏拉萨 850000)
湖北省某规模化猪场猪繁殖与呼吸综合征的诊断及流行毒株GP5基因特性分析
李孝文1,3,章洪皲2,樊翠华2,姜 平1
(1. 南京农业大学动物医学院,江苏南京 210095;2. 国家生猪产业技术体系黄陂综合试验站,湖北武汉 430344;3. 西藏新好科技有限公司,西藏拉萨 850000)
2016年湖北省某猪场暴发一起疫情。通过病史调查、临床观察、实验室诊断,确诊该疫情为猪繁殖与呼吸综合征。对病原测序分析的结果显示:其Nsp2基因存在30个氨基酸缺失;ORF5基因与WUH1野毒株同源性最高。此外,生产母猪群和后备猪群血清样品的猪繁殖与呼吸综合征病毒(PRRSV)ELISA N蛋白抗体S/P值离散度较大,证明该病原为高致病性PRRSV。
猪繁殖与呼吸综合征病毒;诊断;ORF5;感染状态
猪繁殖与呼吸综合征(Porcine Reproductive and Respiratory Syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种严重危害全球养猪业的重要疫病[1-3]。1996年我国首次发生该病[4]。2006年由高致病性PRRSV(HP-PRRSV)引发的疫情在我国多个养猪省份暴发,给我国养猪业带来了巨大经济损失[11]。PRRSV为不分节段的单股正链RNA病毒,基因全长约15 kb[5-6],基因变异性较高[7]。PRRSV可分为2个基因型(Genotype),基因组同源性为60%[8-10]。ORF5基因编码的GP5蛋白与病毒免疫保护相关。不同基因型毒株的ORF5基因存在较大变异,同型毒株中ORF5的变异也较大。此外,PRRSV 的Nsp2基因变异也较大。相对PRRSV传统毒株VR2332,我国HP-PRRSV Nsp2编码区存在30个不连续氨基酸缺失[11-14]。我国商品化的PRRS活疫苗有高致病性弱毒疫苗(JXA1-R株、HuN4-F112株、TJM-F92株和GDr180株)及经典弱毒疫苗(CH-1R株、R98株)和进口减毒活疫苗(Ingelvac PRRS MLV VR2332株)。这些疫苗对控制和减缓PRRS疫情起到了积极作用。但近年来,临床上不断出PRRS疫情,疫情有抬头趋势。
通过对2016年湖北省某规模化猪场一起疫情的病史调查、临床诊断、实验室诊断,确诊该疫情为高致病性PRRS疫情。本研究为该地区规模化猪场的PRRS防控提供了参考。
1 材料与方法
1.1 发病猪场基本情况
该猪场免疫PRRS江西毒株(JXA1-R)减毒活疫苗。110日龄后备猪免疫1头份,母猪产后1周免疫1头份,产房仔猪2周后免疫0.5头份,公猪不免疫。
该猪场定期进行猪瘟、伪狂犬病抗原监测,持续进行猪瘟和伪狂犬病的免疫跟踪,为猪瘟和伪狂犬病抗原双阴性场。伪狂犬病 gE抗体阳性率为0,猪瘟抗体阳性率为100%。2015年11—12月该猪场曾暴发猪流行性腹泻疫情,产房死淘率超过30%。
1.2 疫病调查和临床观察
根据病猪体温、食欲、精神状态、皮肤发绀等表观症状以及是否有咳嗽、流鼻涕等呼吸道症状进行判断,然后根据发病猪有无神经症状进行分析。
1.3 病理学检查
按照常规方法对发病和死亡猪进行系统解剖,观察主要内脏器官的病理变化。同时,采集病变肺脏样本,固定于4%的多聚甲醛中,室温放置至少48 h,常规石蜡包埋制片,并用苏木精&伊红染色(H&E染色),光学显微镜下观察。
1.4 RT-PCR检测
病毒核酸提取:采用Takara公司的RNAiso Plus试剂盒,按产品说明书,对采集的发病猪新鲜组织样品进行核酸提取。
根据GenBank中Lelystad(M96262)、CH-1a(AY032626)和JXA1(EF112445)毒株基因序列,设计并合成2对引物。Nsp2 F:5´-CAAAGAYCAGATGGAGGAG-3´;Nsp2 R:5´-ATRATGGCTTGAGCTGAG-3´。HPPRRSV和经典PRRSV毒株Nsp2基因扩增长度分别为678 bp和768 bp。ORF7 F:5´-TCGCCCTAATTGAATAGGTG-3´;ORF7 R:5´-ATGGCCAGCCAGTCAATCA-3´。欧洲型毒株和美洲型毒株ORF7基因扩增长度分别为389 bp和434 bp。引物由生工生物工程(上海)股份有限公司合成。
RT-PCR:反转录操作按照Takara反转录试剂盒进行。反转录体系20 µL,反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 5 min。PCR反应体系25 µL:10×Easy Taq Buffer 2.5 µL、dNTP 2 µL、上下游引物各1 µL、rTaq DNA聚合酶0.5 µL、ddH2O 14 µL、cDNA模板4 µL。反应参数:94 ℃预变性 5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;最后72 ℃终延伸7 min。反应结束后,取5 µL PCR产物,在1%琼脂糖中凝胶电泳,凝胶成像系统上观察目的片段。
1.5 ORF5基因扩增与序列分析
PCR引物序列:ORF5 F:5´-ATGTTGGGGAAGTGCTTGACCGCGTGCTGT-3´;ORF5 R:5´-GAGACGACCCCATTGTTCCGCTGAAACTCTG-3´。利用ORF5引物对PRRSV阳性样品进行PCR扩增。反应体系及反应参数见上述步骤。将PCR产物胶回收纯化后与pMD-18T载体连接。对重组质粒经酶切鉴定正确后送至生工生物工程(上海)股份有限公司进行序列测定。应用MegAlign软件对测序获得的GP5序列进行比对分析,并利用MEGA5.2软件,根据Neighbor-Joining运算法绘制遗传进化树(比对值为1 000个重复)。
1.6 ELISA抗体检测
采集血清样品59份,其中生产母猪44份、后备母猪15份。采用ELISA方法检测PRRS抗体。关于PRRS抗体的阳性或阴性,通过计算样品与阳性对照的比值(S/P)进行判定:S/P值大于2.5时,判定样品可能存在PRRSV野毒感染。具体操作方法和步骤按照IDEXX试剂盒说明书进行。
2 结果
2.1 发病情况调查结果
该猪场位于湖北省南部,2013年初从某种猪公司引入后备猪投产使用,至2014年5月存栏基础母猪1 200头左右。该规模场持续生产至2016年4月,生产成绩稳定。2016年4月引入后备母猪1 200头。此后猪群出现持续20余天的发烧和呼吸道症状。2016年6月后备猪入群、配种。随后母猪群出现零星流产、返情和产死胎现象。10月后备母猪在妊娠后期出现持续发烧、流产症状;11月经产母猪出现繁殖障碍。产仔舍仔猪发烧、出现神经症状、腿部肿胀等;断奶转至保育舍,在42日龄左右出现喘气、发烧、突然倒地死亡现象,咳喘比例超过20%,腿部肿胀、角弓反张等神经症状多见。保育期呼吸道症状明显,伴随高烧和高死淘率,外观耳尖发绀(图1)。

图1 猪场妊娠母猪流产和保育仔猪临床症状
2.2 病理变化
产房仔猪肺脏支气管和细支气管中充满大量白色粘液;肺部出现明显的“间质性肺炎”外表观状;肺尖叶开始呈现弥漫性病变,肺脏发生实变;2周龄仔猪出现肺脏肋骨压痕。扁桃体、颌下淋巴结、腹股沟淋巴结等器官未见眼观病变。保育仔猪淋巴结肿大,支气管充满大量泡沫,肺脏质地变硬,肺尖叶呈现弥散性病变(图2)。
组织病理学检查:病猪肺脏显微结构完全消失;小叶间隔增厚;大量炎性细胞及坏死细胞碎片浸润于肺泡腔及支气管周围(图3)。

图2 发病仔猪肺脏肉眼病变
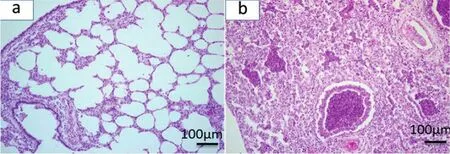
图3 发病仔猪肺脏组织病理学观察结果(放大倍数为20×10)
2.3 RT-PCR检测结果
PRRSV ORF7基因RT-PCR结果显示,检测样品中可扩增出434 bp的片段,表明该猪场中有美洲型PRRSV存在(图4-a)。
PRRSV Nsp2基因RT-PCR结果显示,扩增条带大小约678 bp(图4-b),表明该猪场存在HPPRRSV毒株感染。

图4 猪场临床样品ORF7基因和Nsp2基因RT-PCR扩增结果
2.4 ORF5基因序列分析结果
针对4个临床样品和12株GenBank公布的有代表性毒株的ORF5基因全序列进行遗传进化树分析,结果显示,本次研究的4株PRRSV分离株均属美洲型毒株,与HP-PRRSV WUH1毒株同源性最高,隶属同一分支(图5)。
2.5 种猪血清抗体调查结果
利用IDEXX PRRSV抗体检测试剂盒,对生产母猪群和后备猪群血清样品中N蛋白抗体进行检测。结果表明,母猪群与后备猪群PRRS抗体S/ P值大于2.5的占比分别为40.9%和30.0%,离散系数分别是61.6%和48.5%(表2),提示生产母猪与后备母猪感染了PRRSV野毒。
3 讨论
PRRSV具有广泛的变异和毒株多样性特点,导致疫病的局部暴发和再流行[3,11,16-18]。2006年HP-PRRSV导致的疫情在我国南方多省暴发,并成为我国优势流行毒株。2011年高致病性PRRS活疫苗在我国获批,并在田间得到广泛使用,为该病的控制发挥了重要作用。但随着猪群免疫选择压力的增加,PRRSV遗传和演化相应加速[20]。一些毒力稍低的PRRSV毒株Nsp2基因同样存在30个不连续氨基酸缺失[15]。PRRSV经典毒株和低致病性毒株时有报道[19]。欧洲型PRRSV在我国相继出现,使得PRRSV感染更为复杂[21]。因此,定期监测和调查猪场PRRSV毒株多样化及分析野生毒株的遗传及演化进程,对临床上PRRS的防控具有重要意义。本研究通过临床诊断、病理变化、RT-PCR、血清学检测和测序分析,确诊本次疫情为高致病性PRRS疫情。
PRRSV致病和免疫机制目前尚不十分清楚,疫苗免疫效果尚不理想,因此该病防控需要依靠综合性防控措施。该猪场建场以来,疫情一直稳定,但本次发病严重,持续时间较长,其原因可能是:首先,猪场原本无PRRSV感染情况,为扩大养猪生产规模引进后备母猪,但没有经过系统检测,引进的后备母猪可能存在健康带毒问题。其次,该猪场采用母猪舍、保育舍和育肥舍组成的两点式饲养管理模式,发生疫情时无法迅速切断病毒的水平传播途径,导致猪场疫情持续时间较长。本次发病病原属于HP-PRRSV。该流行毒株可能存在抗原性变异。由该病原引发的疫情近年来在湖北省其它猪场也有类似报道[22]。因此,加强该流行毒株的变异监测,建立该病综合防控体系十分必要。
同时,我国猪场尚缺乏完善的生物安全措施;无序引种和引入带毒种猪造成多毒株在猪场共存和循环。还有,不加限制地大范围使用PRRSV减毒活疫苗造成了PRRSV的广泛传播。因此,合理、有条件地使用PRRSV减毒活疫苗对该病防控十分重要。
[1] NEUMANN E J,KLIEBENSTEIN J B,JOHNSON C D,et al. Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States [J]. Javma-J Am Vet Med A,2005,227(3),385-392.
[2] PEJSAK Z,STADEJEK T,MARKOWSKADANIEL I. Clinical signs and economic losses caused by porcine reproductive and respiratory syndrome virus in a large breeding farm [J]. Veterinary microbiology,1997,55(1/2/3/4):317.
[3] ZHOU L,YANG H C,LUNNEY J K,et al. Porcine reproductive and respiratory syndrome in China [J]. Virus research,2010,154(1/2):31.
[4] 郭宝清,陈章水,刘文兴,等. 从疑似PRRS流产胎儿分离PRRSV的研究 [J]. 中国预防兽医学报,1996(2):1-5. [5] MEULENBERG J J,PETERSEN-DEN Besten A,DE KLUYVER E P,et al. Characterization of proteins encoded by ORFs 2 to 7 of Lelystad virus [J] . Virology,1995,206(1):155-163.
[6] MEULENBERG J J,PETERSEN DEN BESTEN A,DE KLUYVER E,et al. Molecular characterization of Lelystad virus [J]. Veterinary microbiology,1997,55(1/2/3/4):197-202.
[7] KIM H S,KWANG J,YOON I J,et al. Enhanced replication of porcine reproductive and respiratory syndrome(PRRS)virus in a homogeneous subpopulation of MA-104 cell line [J]. Archives of virology,1993,133(3/4):477-483.
[8] MAGAR R,ROBINSON Y,DUBUC C,et al. Evaluation of the persistence of porcine reproductive and respiratory syndrome virus in pig carcases [J]. The veterinary record,1995,137(22):559-561.
[9] MURTAUGH M P,ELAM M R,KAKACH L T. Comparison of the structural protein coding sequences of the VR-2332 and Lelystad virus strains of the PRRS virus [J]. Archives of virology,1995,140(8):1451-1460.
[10] NELSON E A,CHRISTOPHER-HENNINGS J,DREW T,et al. Differentiation of U.S. and European isolates of porcine reproductive and respiratory syndrome virus by monoclonal antibodies [J]. Journal of clinical microbiology,1993,31(12):3184-3189.
[11] TIAN K,YU X,ZHAO T,et al. Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark [J]. PloS one,2007,2(6):e526.
[12] LI Y,WANG X,BO K,et al. Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China [J]. Veterinary journal,2007,174(3):577-584.
[13] ZHOU Y J,HAO X F,TIAN Z J,et al. Highly virulent porcine reproductive and respiratory syndrome virus emerged in China [J]. Transboundary and emerging diseases,2008,55(3/4):152-164.
[14] ZHOU L,ZHANG J,ZENG J,et al. The 30-amino-acid deletion in the Nsp2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence [J]. Journal of virology,2009,83(10):5156-5167.
[15] ZHOU L,YANG X,TIAN Y,et al. Genetic Diversity Analysis of Genotype 2 Porcine Reproductive and Respiratory Syndrome Viruses Emerging in Recent Years in China [J]. Biomed research international,2014:748068-748068.
[16] KEY K F,HAQSHENAS G,GUENETTE D K,et al. Genetic variation and phylogenetic analyses of the ORF5 gene of acute porcine reproductive and respiratory syndrome virus isolates [J]. Veterinary microbiology,2001,83(3):249-263.
[17] KARNIYCHUK U U,GELDHOF M,VANHEE M,et al. Pathogenesis and antigenic characterization of a new East European subtype 3 porcine reproductive and respiratory syndrome virus isolate [J]. BMC veterinary research,2010,6(1):30.
[18] CHAIKHUMWANG P,TANTITUVANONT A,TRIPIPAT T,et al. Dynamics and evolution of highly pathogenic porcine reproductive and respiratory syndrome virus following its introduction into a herd concurrently infected with both types 1 and 2 [J]. Infection genetics & evolution,2015,30:164-174.
[19] ZHOU L,CHEN S,ZHANG J Y,et al. Molecular variation analysis of porcine reproductive and respiratory syndrome virus in China [J]. Virus research,2009,145(1):97-105.
[20] COSTERS S,LEFEBVRE D,VAN DOORSSELAERE J,et al. GP4 of porcine reproductive and respiratory syndrome virus contains a neutralizing epitope that is susceptible to immunoselection in vitro [J]. Archives of virology,2010,155(3):371-378.
[21] CHEN N,CAO Z,YU X,et al. Emergence of novel European genotype porcine reproductive and respiratory syndrome virus in mainland China [J]. Journal of general virology,2011,92(4):880-892.
[22] 李彬,王豪男,彭忠,等. 华中地区猪繁殖与呼吸综合征病毒临床流行毒株Nsp2和GP5氨基酸的遗传变异分析[J].中国畜牧兽医,2015,42(11):3026-3036.
(责任编辑:朱迪国)
Diagnosis of Porcine Reproductive and Respiratory Syndrome and Characteristics Analysis of GP5 Gene of Epidemic Strains in a Large-scaled Swine Farm in Hubei Province
Li Xiaowen1,3,Zhang Hongjun2,Fan Cuihua2,Jiang Ping1
(1. College of Veterinary Medicine,Nanjing Agricultural University,Nanjing,Jiangsu 210095;2. Huangpi Comprehensive Experimental Station,National Pig Industry Technology System,Wuhan,Hubei 430344;3. Tibet Xinhao Technology Co. Ltd,Lasa,Tibet 850000)
An outbreak of PRRS was confirmed at a swine farm in Hubei Province in 2016,by means of history investigations,clinical symptom observations and laboratory diagnoses. The results of the PRRSV isolate sequencing indicated that it had a 30-amino-acid(30-aa)deletion in the Nsp2-coding region. And the homology between ORF5 gene and WUH1 wild strain was the highest. In addition,the S/P values of PRRSV,ELISA and N protein antibodies were highly dispersed in sows and reserve pig serum samples,indicating that the pathogen was highly pathogenic PRRSV.
Porcine reproductive and respiratory syndrome virus(PRRSV);diagnosis;ORF5;infection status
S852.23
B
1005-944X(2017)09-0011-05
10.3969/j.issn.1005-944X.2017.09.004
国家生猪产业体系项目(CARS-36)
姜 平
