siRNA靶向沉默hTERT基因对宫颈癌Caski细胞特性的影响
2017-09-14岳天孚
王 彦 岳天孚
(天津市静海县医院妇产科,天津 301600)
siRNA靶向沉默hTERT基因对宫颈癌Caski细胞特性的影响
王 彦 岳天孚1
(天津市静海县医院妇产科,天津 301600)
目的研究siRNA靶向沉默hTERT基因后对宫颈癌Caski细胞特性的影响。方法设计、合成特异性针对hTERT mRNA的siRNA,将其克隆入pGenesil-1.1质粒中,重组成hTERT mRNA-siRNA的表达载体,导致目的基因沉默,是由电转染入宫颈癌Caski细胞,从而产生RNA干扰作用。应用Western印迹法及RT-PCR法检测沉默hTERT基因后对于宫颈癌Caski细胞的蛋白及mRNA的表达情况;检测细胞周期运用流式细胞仪;沉默hTERT基因后宫颈癌Caski细胞的增殖能力可通过CCK-8 增殖实验检测。沉默hTERT基因后宫颈癌Caski细胞的侵袭能力可通过小室侵袭实验检测。结果hTERT基因沉默48 h以后,与空白组及未转染组相比,转染组宫颈癌Caski细胞的蛋白及mRNA表达出现明显降低(P<0.05);细胞周期的检测结果显示S期的细胞数目明显减低,转染组的宫颈癌Caski细胞停留于G0/G1周期,空白组、转染组及未转染组相比差异显著(P<0.05);宫颈癌Caski细胞在转染组的增殖过程中被明显抑制(P<0.05);转染组穿过滤膜的细胞数量明显减少(P<0.05)。结论Si RNA靶向沉默hTERT基因电转染后,使宫颈癌Caski细胞的增殖和迁移能力得到抑制,一定程度上改善了宫颈癌患者的预后。
宫颈癌;hTERT基因;基因沉默;Caski细胞特性;RNA干扰
宫颈癌的发病率与病死率位居女性恶性肿瘤的第二位〔1~3〕。我国统计数据显示每年宫颈癌新发病例数已占全球的14.3‰,大约每年有3.4万名妇女因患宫颈癌死亡〔4,5〕。目前,临床上对于宫颈癌的复发、转移、侵袭及预后不良等问题还尚未有好的方法。近些年来随着干细胞移植及基因技术的发展,为宫颈癌的有效预防和治疗带来新的希望〔6~8〕。hTERT基因是非常重要的一种营养因子,对于原发性肿瘤、癌细胞系中均呈现高表达〔9〕,但是对于正常组织中并无表达,故具有重要的临床价值和多重生物学效应。本研究采用沉默hTERT基因后电转染入宫颈癌Caski细胞中,探讨此法对宫颈癌治疗的有效性。
1 材料和方法
1.1主要材料 由天津医科大学中心实验室惠赠人宫颈癌Caski细胞。DMEM培养液由美国Becon Dickinson公司生产,胎牛血清由美国Abcam公司生产,0.25%胰酶、Ⅱ胶原酶由Sigma公司生产,RT-PCR两步法试剂盒、mRNA提取试剂盒由杭州吉诺公司生产,端粒酶反转录酶由本元正阳基因技术股份有限公司生产,siRNA链由美国HyClone公司生产,兔抗人hTERT多克隆抗体、β-actin兔抗鼠多克隆抗体和兔抗鼠MBP抗体由美国New Jersey公司生产,β-actin引物由上海Excell生物工程公司合成生产,AMV逆转录试剂盒由美国Sigma公司生产,Western试剂盒是美国Promega公司产品,Western印迹凝胶成像仪由FUJIFILM Corporation生产。
1.2设计合成及转染hTERT的siRNA序列 设计hTERT siRNA引物(根据参考文献〔10〕)序列为:上游引物:5′-CTGAAGTGTCACAGCCTGTTT-3′,下游引物:5′-CACACATGCGTGAAACCTGTA-3′,产物大小:111 bp;β-actin上游引物:5′-TATCGGACGCCTGGTTAC-3′,下游引物:5′-CTCAGCCTTGACTGTGCC-3′,产物大小:151 bp。PCR反应条件:94℃变性5 min,95℃变性30 s,54℃退火36 s,72℃延伸30 s,36个周期循环后,72℃延伸6 min。于4℃下保存产物。PCR反应重复进行3次。取5 ml PCR产物进行电泳,用β-actin作为内参照。放置GDSS000凝胶自动成像仪上拍照并保存,应用Image-Pro Plus8.0软件对于β-actin条带与hTERT的条带灰度的相对比值进行mRNA半定量分析。DMEM培养基中培养宫颈癌Caski细胞,培养基中含10%小牛血清。5%CO2的饱和湿度培育箱中培育,置于37℃下恒温密闭式。每2天传代一次,把处于对数生长期的细胞经PBS清洗并由胰酶消化后,制成单细胞悬液离心收集Caski,用电穿孔缓冲液重悬,离心,静置5 min,清洗细胞3次,离心,重悬于电转液中,移至电击杯,加入并混匀20 μg的质粒DNA,置于冰上30 min后,以电压350 V/cm,电容25 μF,时间常数T为0.9 ms的电转化参数,进行电穿孔。把转染后的hTERT-Caski细胞,室温放置30 min,细胞移入含10%小牛血清,1%双抗的DMEM培养基中,5%CO2、37℃恒温孵箱内培育。进行电转染时分为3组:电转染hTERT-siRNA载体者为Caski/hTERT-siRNA组(转染组);转染NC siRNA载体者为Caski/control组(对照组),未转染的宫颈癌Caski细胞为Caski组(空白组),并于转染48 h后行RNA干扰效应的检测。
1.3RT-PCR检测沉默hTERT mRNA的表达 把处于对数生长期的宫颈癌细胞Caski,接种在10 cm2培养皿中,置于37℃、5%CO2,湿度饱和的培养箱至90%左右,运用cDNA合成试剂盒逆转录合成cDNA;运用TRIzol法提取总RNA。将产物cDNA反应结束后作为PCR反应模板,放置于-20℃冰箱中保存。设计特异性hTERT基因序列引物,hTERT和内参β-actin引物序列:上游引物:5′-CTGAAGTGTCACAGCCTGTTT-3′,下游引物:5′-CACACATGCGTGAAACCTGTA-3′,产物大小:111 bp;β-actin上游引物:5′-TATCGGACGCCTGGTTAC-3′,下游引物:5′-CTCAGCCTTGACTGTGCC-3′,产物大小:151 bp。待调制好PCR反应液后,设置PCR仪反应参数为:94℃变性5 min,95℃变性30 s,54℃退火36 s,72℃延伸30 s,循环35个周期后,终末延伸72℃、6 min。并于4℃下保存产物。PCR每一反应重复进行3次。取5 ml PCR产物经2%琼脂糖凝胶进行电泳(152 V,90 min)。稳压100 V电泳30 min后观察结果,运用GDSS000凝胶自动成像仪电泳后显像并拍照保存,判定扩增带位于阳性扩增带的标本为阳性,用hTERT/β-actin 代表hTERT mRNA的相对表达量。
1.4Westem印迹检测沉默hTERT蛋白的表达 将宫颈癌Caski细胞胰酶消化后收集保存,弃掉培养液后冲洗3次,进行总蛋白的提取,采用BCA法检测蛋白质浓度,吸取50 μg总蛋白。设置60 V电压开始电泳,经电转移以40 V、150 min的转印条件下印迹到PVDF膜上,取出PVDF膜浸后泡入5%脱脂奶粉的FIBS液中封闭,37℃下孵育2 h。一抗孵育:加入hTERT多克隆一抗,稀释浓度1∶1 000,4℃过夜,洗膜5次,5 min/次,二抗孵育:加入HRP标记的GAPDH和二抗,稀释浓度1∶5 000,37℃下孵育2 h,PBS洗涤后运用ECL法检测。暗室曝光X 光片,通过GDSS000凝胶自动成像系统摄像,漂洗并干燥后避光保存图片。Image-Pro Plus8.0 软件分析条带灰度值,以h TERT/GAPDH代表代表hTERT的相对表达量。
1.5流式细胞仪检测细胞周期变化 将以上三组Caski细胞收集,细胞浓度调整为1×106L-1,冷PBS清洗两遍后,用70%的冷乙醇(4℃)将细胞沉淀后混匀备用,细胞洗涤后再调整细胞浓度为1×106L-1(用PBS)与含50 μg/ml RNA 酶的Tris-Hcl缓冲液(pH7.4) 共同孵育30 min。用100 μg/ml碘化丙啶(PI)对细胞DNA染色,暗室中放置1 h,运用流式细胞仪检测细胞DNA含量及分布,并计算各周期细胞所占百分比。
1.6小室侵袭实验检测Caski细胞侵袭能力 将Caski细胞种于Transwell小室的上室,聚碳酸酯膜上室侧铺上一层基质胶。在聚碳酸酯微孔滤膜上以50 μg/孔铺Matrigel,在Transwell小室下室中加入胎牛血清作为条件培养液。体积分数为10%。把处理过的Caski细胞悬液100 μl(3×105/L),溶胶后置于4℃下培养24 h;PBS漂洗3遍,重悬细胞,获取消化后的细胞;并于35℃下孵育,观察细胞迁移结果并进行染色和计数,用苏木精染色10 min,以PBS冲洗小室,将上室的聚碳酸酯滤膜待自然风干后沿边缘小心取下,并固定于载玻片上,固定时膜外面朝下,封片后进行干燥,200×光镜下每膜直径上分别于左、右、上、下、中计数5个视野的侵袭细胞数目,并计算出其平均值。实验重复3次,每组设定3个平行小室。
1.7CCK-8实验检测Caski细胞的增殖能力 将转染后各组处于对数生长期Caski细胞收集,胰酶消化后采用有血清培养皿配制成的单细胞悬液。以每孔1×103个细胞接种在96孔板中,并在每组设6个复孔,培育24 h后,于转染后1~4 d,每天各取96孔板经CCK-8试剂室温融化,每孔里加入CCK-8 20 μl,Caski细胞的增殖情况以CCK-8法检测。培养基温育4 h后,以只加CCK-8溶液和培养液不加细胞空白孔对比,其他实验步骤均相同。每孔的光吸光度OD值采用酶联免疫检测并记录结果,其参考波长为630 nm,波长为450 nm,第2~4天后重复以上的操作。并将各组的细胞生长及影响绘制曲线图。
1.8统计学方法 采用SPSS17.0统计软件进行t检验,q检验及单因素方差分析。
2 结 果
2.1RT-PCR检测沉默hTERT mRNA的表达 RT-PCR检测结果显示,hTERT mRNA的表达在转染组(Caski/hTERT-siRNA组)的条带呈明显变窄,转染组(0.48±0.05)与未转染组(0.82±0.10)和空白组(0.86±0.08)比较有统计学差异(P<0.05)。见图1。
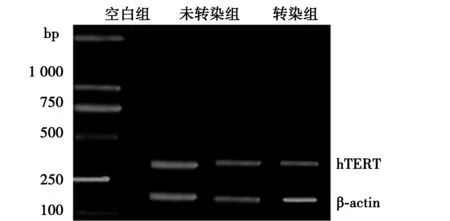
图1 RT-PCR检测Caski细胞中hTERT mRNA的表达
2.2Western印迹检测沉默hTERT蛋白的表达 hTERT蛋白的表达在转染组的条带明显变窄,转染组(0.74±0.06)与未转染组(0.92±0.09)和空白组(0.97±0.02)的灰度值有统计学差异(P<0.05,P<0.01)。见图2。

图2 Western印迹检测Caski细胞中hTERT蛋白的表达
2.3细胞周期检测结果 转染组与未转染组和空白组比较,G0/G1期细胞比例明显增大,S期细胞明显降低(均P<0.05),G2/M期Caski细胞无统计学差异(P>0.05),说明S期细胞受到明显阻滞。见表1。
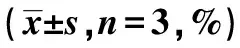
表1 siRNA抑制hTERT表达对Caski细胞周期的影响
与转染组比较:1)P<0.05,下表同
2.4小室侵袭实验检测结果 未转染组和空白组穿过滤膜的细胞数量分别为(45.01±0.02)%和(44.06±0.08)%;转染组穿过滤膜的细胞数量较未转染组与空白组明显下降〔(25.03±0.23)%,P<0.05〕。见图3。
2.5CCK-8增殖实验检测结果 与空白组和未转染组相比,转染组Caski细胞的增殖明显受到抑制(P<0.05),见表2。

图3 各组穿过滤膜细胞(×200)
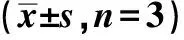
表2 hTERT siRNA对Caski细胞增殖的影响
3 讨 论
临床实践发现,放、化疗可因正常组织的可耐受性而受到限制,进而影响宫颈癌生存率的提高。目前,基因治疗肿瘤是实验研究中的一个热点问题,国内外研究表明,新型基因作为宫颈癌的治疗手段之一,为其开辟了一条新的治疗方向〔11,12〕。近年来新发展的RNAi是一项沉默基因技术,siRNA的基因特异性更高。临床研究中将建立的两个表达HPV16 E6 siRNA的真核表达质粒以及阴性对照质粒,成功转染到宫颈癌Caski细胞中,转染效率能够达到50%以上,表明转染 E6 siRNA 质粒能使E6 mRNA 的表达明显下降〔13〕,本研究将hTERT mRNA-siRNA克隆入pGenesil-1.1质粒中,重组成hTERT mRNA-siRNA的表达载体,通过RT-PCR检测得知hTERT mRNA的表达降低,表明目的基因沉默,与成海恩等〔13〕的研究结果相一致。研究数据表明,端粒酶是一种反转录酶,能够维持端粒长度,hTERT是端粒酶的催化亚单位〔14〕,是能以RNA为模板反转录合成端粒酶,hTERT与细胞生长、发育和增殖、分化有密切关联,hTERT可以明显抑制癌细胞生长,存在多重生物学效应〔15,16〕。hTERT表达在正常组织中是被抑制的,但在癌细胞、肿瘤系中却呈现着高表达。研究发现hTERT基因经电转染可以取得有效而持久的作用〔17~19〕。研究发现用电穿孔法转染基因的目的基因瞬时表达率远远高于脂质体转染方法,所以电转染法可以作为一个有效且简单可行的方法〔4,20,21〕。
本文显示siRNA靶向沉默hTERT基因电转染入宫颈癌Caski细胞后,可以对宫颈癌的治疗起到积极指导作用,hTERT基因可在宫颈癌及其他肿瘤的基因治疗方面提供新的靶点。
1Schuijers J,Clevers H.Adult mammalian stem cells:the role of Wnt,Lgr5 and Rspondins〔J〕.EMBO J,2012;31(12):2685-96.
2Shi Y,Xia YY,Wang L,etal.Neural cell adhesion molecule modulates mesenchymal stromal cell migration via activation of MAPK/ERK signaling〔J〕.Exp Cell Res,2012;318(17):2257-67.
3Hasebe Y,Hasegawa S,Hashimoto N,etal.Analysis of cell characterization using cell surface markers in the dermis〔J〕.Dermatol Sci,2011;62(2):98-106.
4Park Y,Chen Y,Ordovas L,etal.Hepatic differentiation of human embryonic stem cells on microcarriers〔J〕.J Biotechnol,2014;174(20 ):39-48.
5Han Z,Jing Y,Zhang S,etal.The role of immunosuppression of mesenchymal stem cells in tissue repair and tumor growth〔J〕.Cell Biosci,2012;2(1):8.
6Park SA,Chung HR,Seong MK,etal.CXCR4-transfected human umbilical cord blood-derived mesenchymal stem cells exhibit enhanced migratory capacity toward gliomas〔J〕.Int J Oncol,2011;38(1):97-103.
7陆晓楣,李 晶.年轻宫颈癌患者的病理特点和预后分析〔J〕.中国妇产科临床杂志,2011;12(1):10-3.
8Fong D,Yeh A,Naftalovich R,etal.Curcumin inhibits the side population(SP)phenotype of the rat C6 glioma cell line:towards targeting of cancer stem cells with phytochemicals〔J〕.Cancer Lett,2010;293(1):65.
9李海侠.影响子宫颈癌根治术后并发症的因素分析〔J〕.中国中医药咨讯,2011;13(3):353.
10Klopp AH,Gupta A,Spaeth E,etal.Concise review:dissecting a discrepancy in the literature:do mesenchymal stem cells support or suppress tumor growth〔J〕?Stem Cells,2011;29(1):11-9.
11王 欢,刘富萍.VEGF-C在宫颈癌中的研究现状与展望〔J〕.四川解剖学杂志,2011;19(3):30-3.
12Yan X,An RF,Zhang D,etal.Detection of survivin expression in cervical cancer cells using molecular beacon imaging:new strategy for the diagnosis of cervical cancer〔J〕.Eur J Obstet Gynecol Reprod Biol,2011;159(1):204-8.
13成海恩,张 溢,张翠莉,等.HPV-16 E6 基因沉默对宫颈癌 CaSki 细胞的影响〔J〕.第四军医大学学报,2006;27(20):1888-91.
14曾广平.子宫颈恶性肿瘤介入治疗及护理进展〔J〕.齐齐哈尔医学院学报,2011;32(9):1454-6.
15Kristien E,Reekmans KP,Praet J,etal.Clinical potential of intravenous neural stem cell delivery for treatment of neuroinflammatory disease in mice〔J〕.Cell Transplantation,2011;20(6):851-69.
16朱素文.子宫颈病变筛查的研究进展〔J〕.医学理论与实践,2011;24(7):774-5.
17Lu H,Gan M,Zhang G,etal.Expression of survivin,caspase-3 and p53 in cervical cancer assessed by tissue microarray:correlation with clinicopathology and prognosis〔J〕.Eur J Gynaecol Oncol,2010;31(6):662-6.
18王 伟,殷红梅.宫颈癌组织中Fhit、survivin和Bcl-2的表达变化及意义〔J〕.山东医药,2011;51(30):42-3.
19Park SA,Chung HR,Seong MK,etal.CXCR4-transfected human umbilical cord blood-derived mesenchymal stem cells exhibit enhanced migratory capacity toward gliomas〔J〕.Int J Oncol,2011;38(1):97-103.
20Tian Y,Han X,Tian DL.The biological regulation of hTERT〔J〕.Iubmb Life,2012;64(10):795-800.
21靳 斌,王 伟,刘泽阳,等.外源hTERT基因转染对老年大鼠供肝缺血再灌注损伤的防护作用〔J〕.山东大学学报(医学版),2013;51(8):13-6.
〔2016-08-03修回〕
(编辑 苑云杰/曹梦园)
王 彦(1979-),女,主治医师,硕士,主要从事妇科肿瘤研究。
R737.33
A
1005-9202(2017)17-4199-03;doi:10.3969/j.issn.1005-9202.2017.17.013
1 天津医科大学总医院
