色烯衍生物的合成及其在生物硫醇检测中的应用
2017-09-07阴彩霞岳永康霍方俊
阴彩霞,岳永康,霍方俊
(1.化学生物学与分子工程教育部重点实验室,能量转换与存储材料山西省重点实验室,山西大学 分子科学研究所,山西 太原 030006;2.山西大学 应用化学研究所,山西 太原 030006)
色烯衍生物的合成及其在生物硫醇检测中的应用
阴彩霞1,岳永康2,霍方俊2
(1.化学生物学与分子工程教育部重点实验室,能量转换与存储材料山西省重点实验室,山西大学 分子科学研究所,山西 太原 030006;2.山西大学 应用化学研究所,山西 太原 030006)
合成了一个色烯衍生物并将其应用于生物硫醇的识别检测。基于“硫醇-色烯点击化学”,该探针对生物硫醇表现出高的特异性和灵敏性,其对Hcy的检出限为7.6×10-6mol/L。
色烯;硫醇;点击化学
0 引言
生物小分子硫醇包括半胱氨酸(Cys)、同型半胱氨酸(Hcy)和谷胱甘肽(GSH),它们在维持人体代谢中扮演着重要的角色[1-3]。Cys是细胞内含硫衍生物的代谢中心,其与胱氨酸的转化能够调节细胞内活性氧的水平,起到抗衰老的作用[4-5]。Hcy是蛋氨酸酶促生成Cys的中间产物,其正常血浆总浓度为9~13 μmol,过高的血Hcy含量与肾病、心血管和脑血管疾病密切相关[6]。目前,人体血浆中总Hcy的水平已经成为临床预测患心脏病、中风和老年痴呆症的主要指标。GSH是细胞内主要的还原性物质之一,其与氧化型谷胱甘肽的转变能够有效特异地清除细胞内自由基,起到保健、抗衰老的作用。同时,GSH的三肽结构能够与铅、汞、砷等重金属离子生成稳定的配合物从体内排出,起到解毒、维持正常的新陈代谢过程和免疫系统的功能[7]。
为了深化三种生物小分子硫醇在体内的生理学和病理学研究,非侵入性的荧光探针技术受到了广泛的关注。目前,已报道的生物硫醇荧光探针反应类型主要包括硫醇-探针亲核加成反应[8-10]、硫醇-探针亲核取代反应[11-13]和硫醇-探针亲核取代-分子内取代反应[14-19]。基于这些反应类型设计发展的硫醇荧光探针能够实现小分子硫醇的特异性识别。但是,用于可逆识别生物硫醇的探针却鲜有报道。这极大地限制了生物硫醇在体内的浓度变化研究。
2009年,我们将色烯分子用于生物硫醇的特异性检测,并将该识别反应命名为“硫醇-色烯点击反应”[9]。该反应在重金属离子诱导下可以实现色烯分子的再生[7,20]。基于此,我们进一步以色烯为荧光团,发展了一个色烯衍生物(CHMPC)用于生物硫醇的特异性识别。CHMPC对生物硫醇表现出高的特异性,能够用于生物硫醇的比色、荧光双通道检测。探针对生物硫醇的响应机理如图1所示。
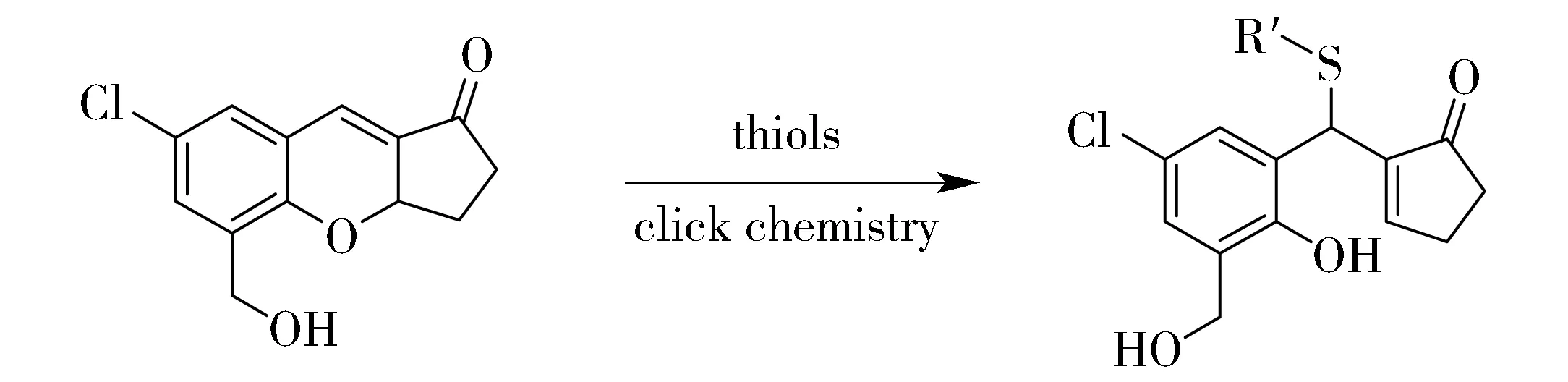
Fig.1 Structure and sensing mechanism of CHMPC toward thiols图1 CHMPC的结构及其对硫醇的识别机理
1 基本原理
1.1 实验仪器与试剂
梅特勒托莱多FE20 pH计,上海华美实验器材PO-120(10 mm)石英比色皿,荧光光谱仪Cary Eclipse,紫外-可见分光光度计Cary 50 Bio,液质相色谱仪waters UPLC,质谱仪LC-MS 2010A (Shimadzu),核磁共振仪Bruker DRX-300 MHz核磁共振仪,X射线单晶衍射仪R-AXIS Rapid IP (Rigaku)。所用试剂均为分析纯试剂,水为去离子水。
1.2 探针的合成
合成路线如图2所示[21]。
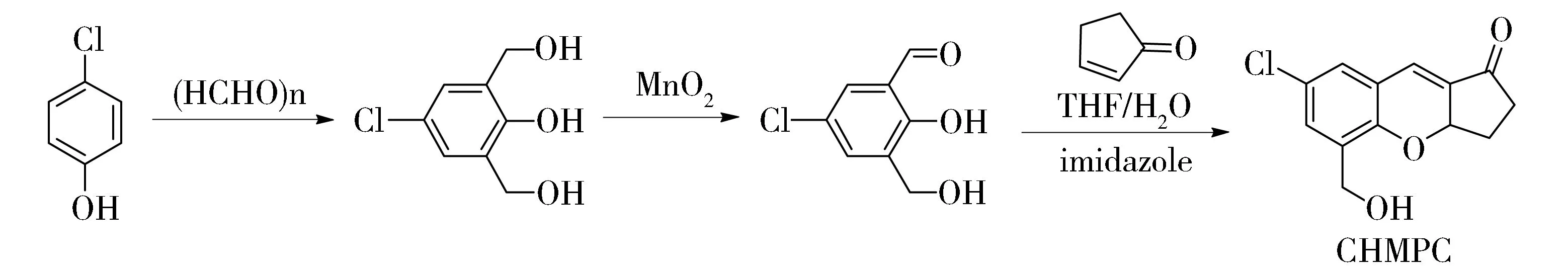
Fig.2 Synthesis of CHMPC图2 CHMPC的合成
CHMPC:1H NMR (300 MHz, 25℃, CDCl3): δ 7.30 (s, 1H), 7.13 (s, 1H), 7.09 (s, 1H), 5.28 (t, 1H), 4.60-4.65 (m, 2H), 2.54-2.72 (m, 2H), 2.13-2.39 (m, 3H);EI-MS m/z 250[M]+.晶体数据:C13H11ClO3, FW=250.67,晶体大小: 0.3×0.2×0.2 mm,三斜晶体,空间群P-1 (No.61),a=8.180 9(9) Å,b=10.338 7(12) Å,c=14.147 9(16) Å,α=109.808(2),β=91.556(2),γ=96.558(2),V=1 115.7(2) Å3,Z=4,T=296 K,θmax=25.00°, 11 915 reflections measured,3 935 unique(Rint=0.047 7).最终残留I> 2σ(I)的309个参数和3 935次反射:R1=0.049,wR2=0.119 5和GOF=1.014.
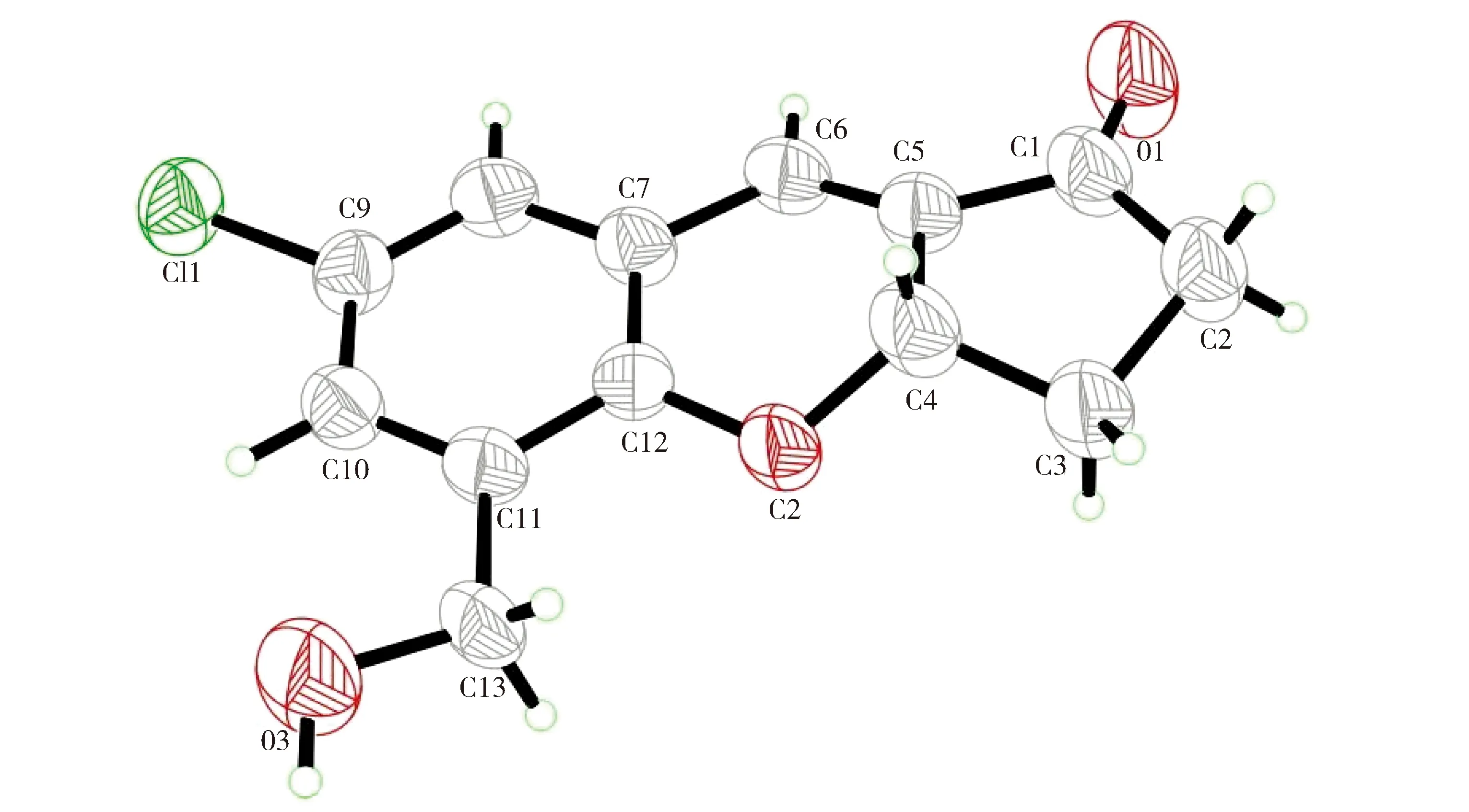
Fig.3 Crystal structure of CHMPC图3 CHMPC的晶体结构
1.3 光谱测定
配置2 mmol/L CHMPC的乙醇储备液,取10 μL储备液于含有2 mL Hepes(pH 7.0)溶液的石英比色皿中混匀。在室温下,分别向其中加入各种氨基酸溶液混匀,放置5 min后进行光谱测试。
2 结果与讨论
2.1 探针的选择性研究
为了检验探针CHMPC对生物硫醇的选择性,我们首先在含有10 μmol/L CHMPC的Hepes(pH 7.0)体系中分别加入终浓度为0.2 mmol/L Cys、Hcy、GSH、丙氨酸、精氨酸、天冬酰胺、天冬氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、缬氨酸、氰根、焦磷酸根、硫氢根、氟离子、氯离子、溴离子、碘离子、磷酸根、草酸根、硝酸根、次氯酸根,避光放置5 min后,分别测试其紫外吸收光谱。如图4所示,CHMPC与硫醇作用后,体系在306 nm和382 nm处的紫外吸收强度降低。该体系与其他氨基酸和阴离子作用后无明显紫外吸收光谱变化。实验结果表明,探针CHMPC可用于生物硫醇的特异性比色检测。由于CHMPC对Hcy响应较为明显,我们后续测定主要针对Hcy进行。
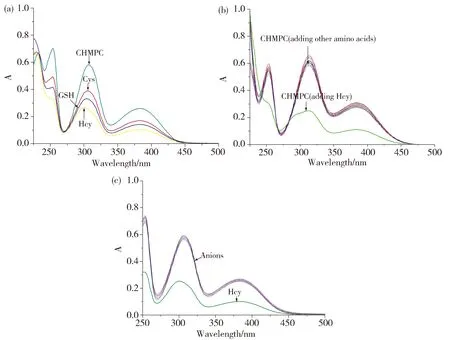
Fig.4 UV-vis spectra of CHMPC toward thiols, various amino acids and anions, respectively图4 CHMPC对生物硫醇、各种氨基酸及阴离子的紫外吸收光谱响应
2.2 CHMPC对Hcy的滴定梯度及检出限研究
图5a是在含有10 μmol/L CHMPC的Hepes(pH 7.0)体系中逐渐加入Hcy(0~0.18 mmol/L)后的紫外光谱变化图。体系在306 nm和382 nm处紫外吸收强度逐渐降低,体系颜色由黄色变为无色,这意味着Hcy的加入打开了探针分子的共轭结构[20]。对应的荧光光谱变化如图5b所示,CHMPC在532 nm(λex=425 nm)处有荧光发射,Hcy的加入使得体系荧光逐渐猝灭。我们进一步在探针体系中分别加入0.025、0.05、0.075、0.1、0.125、0.15、0.175 mmol/L Hcy。如图5c所示,其对应紫外吸收强度与Hcy浓度所得线性拟合方程为A=0.554-0.179C(C为加入Hcy后的终浓度,A为对应306 nm处紫外吸收强度),计算得到CHMPC对Hcy的检出限为7.6×10-6mol/L。
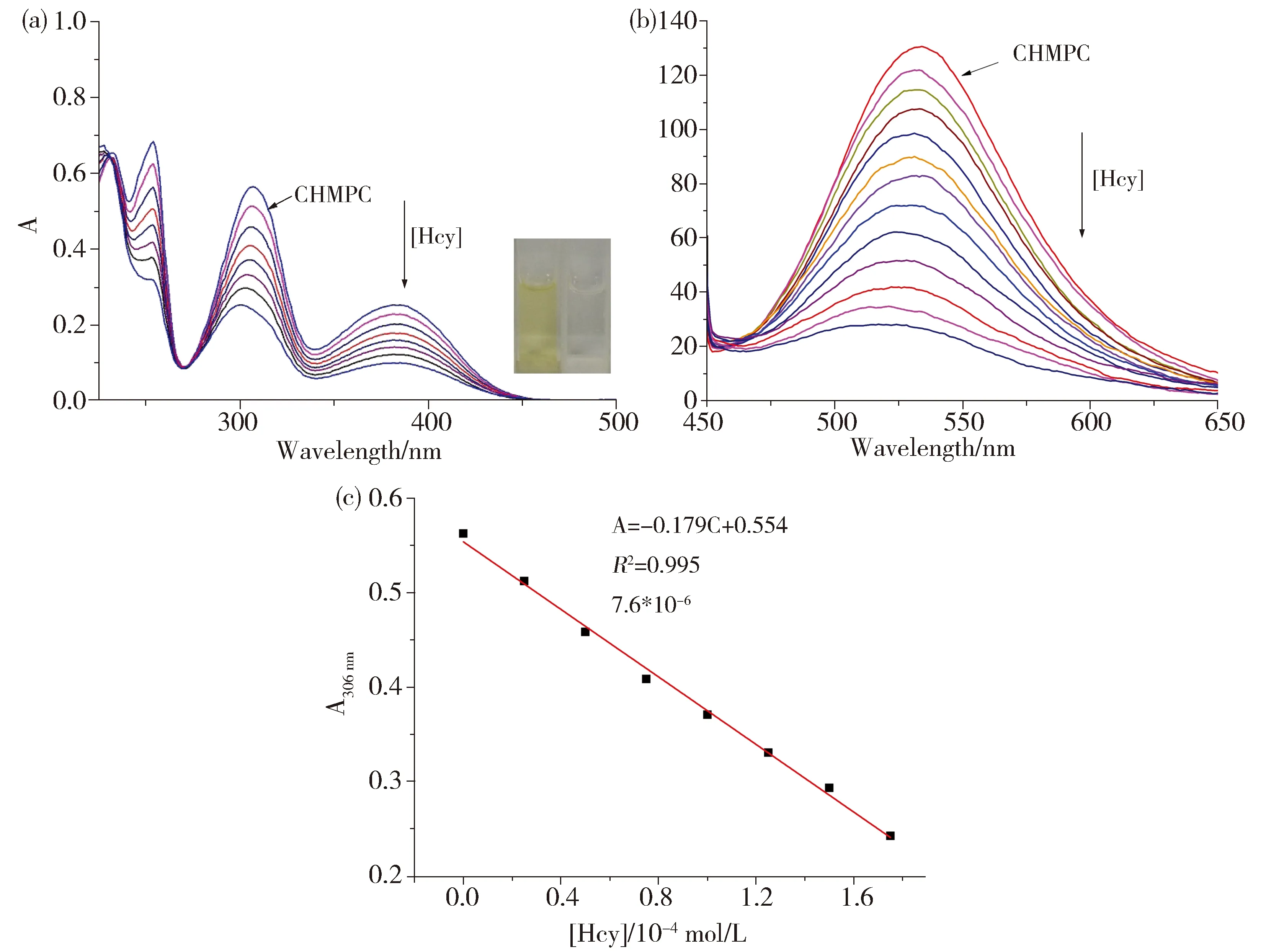
Fig.5 Titration experiments of CHMPC toward Hcy图5 CHMPC对Hcy的紫外吸收梯度和荧光滴定梯度图
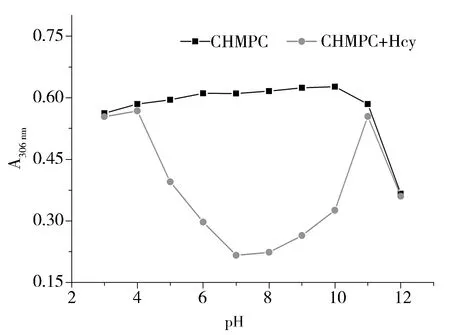
Fig.6 UV-vis absorption at 306 nm of CHMPC and the Hcy added system in different pH values图6 不同pH环境中CHMPC和CHMPC-Hcy在306 nm处的紫外吸收强度
2.3 pH对CHMPC识别Hcy的影响研究
为了研究CHMPC用于检测Hcy的pH适用范围,我们在不同pH的Hepes缓冲溶液(pH 3~12)中分别测试了Hcy加入前后CHMPC的紫外吸收光谱。如图6所示,在pH 3~11的条件下,CHMPC在306 nm处吸收较为稳定。加入Hcy后,pH 5~10体系中306 nm处吸收出现明显降低,其中,在pH 7环境中变化最明显。
2.4 CHMPC检测Hcy的机理研究
三种生物硫醇相似的结构导致目前大多数硫醇探针无法实现其三者的区分识别。近期,我们发展的香豆素衍生物用于生物硫醇的区分识别结果表明,三种生物硫醇的活性受到pH的调控,在相同pH条件下其活性为Cys>Hcy>GSH[22]。为了进一步解释CHMPC对Hcy表现出较Cys高的活性,我们基于密度泛函理论在m062x/6-31+G(d)水平对其作用的过程进行了模拟计算研究。如图7所示,过渡态中S…C1和O…H键长缩短到2.347~2.351和1.946~1.981 Å,O…C2键长增长到2.893~2.894 Å。此结果表明,探针与硫醇作用后,S…C1和O…H键形成而O…C2键断裂(图1)。另外,CHMPC与Cys和Hcy作用的活化能垒分别为40.24和33.89 kcal/mol,因此,CHMPC与Hcy作用较Cys表现出更高的活性。
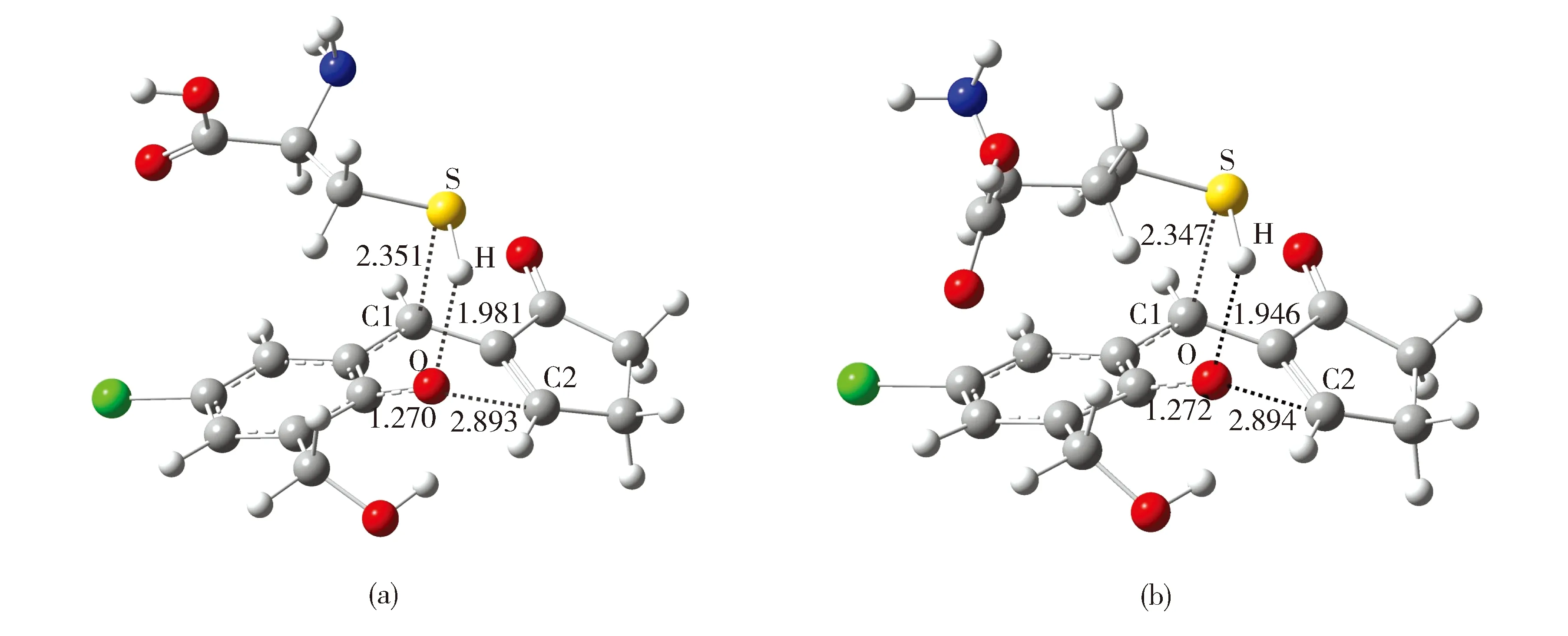
Fig.7 Optimized transition state structures for CHMPC reaction withCys (a) and Hcy (b) n gas phase. Selected interatomic distances (in Å) are indicated图7 CHMPC与Cys和Hcy反应的过渡态结构优化
3 结论
本文基于Baylis-Hillman反应合成了一个色烯衍生物(CHMPC),并将其应用于生物硫醇的比色、荧光识别检测。随着硫醇的加入,CHMPC在306 nm和382 nm处紫外吸收强度逐渐降低。同时,体系在532 nm处荧光发射逐渐猝灭。CHMPC对生物硫醇表现出高的灵敏性和选择性。其中,与Hcy作用最为灵敏。CHMPC对Hcy的检出限为7.6×10-6mol/L。基于理论计算,我们对CHMPC识别生物硫醇的作用机理和反应活性进行了研究。
[1] Yin C X,Huo F J,Zhang J J,etal.Thiol-Addition Reactions and Their Applications in Thiol Recognition[J].ChemSocRev,2013,42:6032-6059.DOI:10.1039/c3cs60055f.
[2] Niu L Y,Chen Y Z,Zheng H R,etal.Design Strategies of Fluorescent Probes for Selective Detection among Biothiols[J].ChemSocRev,2015,44:6143-6160.DOI:10.1039/c5cs00152h.
[3] Jung H S,Chen X Q,Kim J S,etal.Recent Progress in Luminescent and Colorimetric Chemosensors for Detection of Thiols[J].ChemSocRev,2013,42:6019-6031.DOI:10.1039/c3cs60024f.
[4] Yue Y K,Huo F J,Yin C X.Thiol Nucleophilic Reactions and Their Applications in Thiol Fluorescent Recognition[J].SciSinChim,2016,47:249-257.DOI:10.1360/N032016-00138.
[5] Yue Y K,Huo F J,Ning P,etal.Dual-Site Fluorescent Probe for Visualizing the Metabolism of Cys in Living Cells[J].JAmChemSoc,2017,139:3181-3185.DOI:10.1021/jacs.6b12845.
[6] Zhang Y L,Shao X M,Wang Y,etal.Dual Emission Channels for Sensitive Discrimination of Cys/Hcy and GSH in Plasma and Cells[J].ChemCommun,2015,51:4245-4248.DOI:10.1039/c4cc08687b.
[7] Yang Y T,Huo F J,Yin C X,etal.Thiol-Chromene Click Chemistry:A Coumarin-Based Derivative and Its Use as Regenerable Thiol Probe and in Bioimaging Applications[J].BiosensBioelectron,2013,47:300-306.DOI:10.1016/j.bios.2013.03.007.
[8] Hoyle C E,Lowe A B,Bowman C N.Thiol-Click Chemistry:A Multifaceted Toolbox for Small Molecule and Polymer Synthesis[J].ChemSocRev,2010,39:1355-1387.DOI:10.1039/b901979k.
[9] Huo F J,Sun Y Q,Su J,etal.Colorimetric Detection of Thiols Using a Chromene Molecule[J].OrgLett,2009,11:4918-4921.DOI:10.1021/ol901951h.
[10] Yang X F,Guo Y X,Strongin R M.Conjugate Addition/Cyclization Sequence Enables Selective and Simultaneous Fluorescence Detection of Cysteine and Homocysteine[J].AngewChemIntEd,2011,50:10690-10693.DOI:10.1002/anie.201103759.
[11] Ma T,Ding H,Xu H J,etal.Dual-Functional Probes for Sequential Thiol and Redox Homeostasis Sensing in Live Cells[J].Analyst,2015,140:322-329.DOI:10.1039/c4an01441c.
[12] Yang L,Qu W S,Zhang X,etal.Constructing a FRET-Based Molecular Chemodosimeter for Cysteine over Homocysteine and Glutathione by Naphthalimide and Phenazine Derivatives[J].Analyst,2015,140:182-189.DOI:10.1039/c4an01732c.
[13] Zhang Q,Liu H,Pan Z Y.A General Approach for the Development of Fluorogenic Probes Suitable for No-Wash Imaging of Kinases in Live Cells[J].ChemCommun,2014,50:15319-15322.DOI:10.1039/c4cc07429g.
[14] Niu L Y,Guan Y S,Chen Y Z,etal.BODIPY-Based Ratiometric Fluorescent Sensor for Highly Selective Detection of Glutathione over Cysteine and Homocysteine[J].JAmChemSoc,2012,134:18928-18931.DOI:10.1021/ja309079f.
[15] Guo Z Q,Nam S W,Park S,etal.A Highly Selective Ratiometric Near-Infrared Fluorescent Cyanine Sensor for Cysteine with Remarkable Shift and Its Application in Bioimaging[J].ChemSci,2012,3:2760-2765.DOI:10.1039/c2sc20540h.
[16] Lee Y H,Ren W X,Han J Y,etal.Highly Selective Two-Photon Imaging of Cysteine in Cancerous Cells and Tissues[J].ChemCommun,2015,51:14401-14404.DOI:10.1039/c5cc06038a.
[17] Liu J,Sun Y Q,Huo Y Y,etal.Simultaneous Fluorescence Sensing of Cys and GSH from Different Emission Channels[J].JAmChemSoc,2014,136:574-577.DOI:10.1021/ja409578w.
[18] Lim S Y,Hong K H,Kim D I,etal.Tunable Heptamethine-Azo Dye Conjugate as an NIR Fluorescent Probe for the Selective Detection of Mitochondrial Glutathione over Cysteine and Homocysteine[J].JAmChemSoc,2014,136:7018-7025.DOI:10.1021/ja500962u.
[19] Yin J,Kwon Y,Kim D,etal.Cyanine-Based Fluorescent Probe for Highly Selective Detection of Glutathione in Cell Cultures and Live Mouse Tissues[J].JAmChemSoc,2014,136:5351-5358.DOI:10.1021/ja412628z.
[20] Huo F J,Sun Y Q,Su J,etal.Chromene “Lock”,Thiol “Key”,and Mercury(Ⅱ) Ion “Hand”:A Single Molecular Machine Recognition System[J].OrgLett,2010,12:4756-4759.DOI:10.1021/ol101771j.
[21] Yue Y K,Yin C X,Huo F J,etal.Thiol-Chromene Click Chemistry:A Turn-On Fluorescent Probe for Specific Detection of Cysteine and Its Application in Bioimaging[J].SensActuatorsB,2016,223:496-500.DOI:10.1016/j.snb.2015.09.127.
[22] Yue Y K,Huo F J,Li X Q,etal.pH-Dependent Fluorescent Probe That Can Be Tuned for Cysteine or Homocysteine[J].OrgLett,2017,19:82-85.DOI:10.1021/acs.orglett.6b03357.
The Synthesis of Chromene Derivate and Its Application in Biothiols Detection
YIN Caixia1,YUE Yongkang2,HUO Fangjun2
(1.Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education,Key Laboratory of Materials for Energy Conversion and Storage of Shanxi Province,Institute of Molecular Science, Shanxi University,Taiyuan 030006,China;2.Research Institute of Applied Chemistry,Shanxi University,Taiyuan 030006,China)
A new chromene based chemodosimeter (CHMPC) for thiols has been developed by Baylis-Hillman reaction. Based on the thiols-chromene ‘click’reaction, CHMPC displayed colorimetric and fluorimetric responses toward thiols with high selectivity and sensitivity.
Chromene;thiols;click reaction
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.03.017
2017-06-10;
2017-06-19
国家自然科学基金(21472118;21672131);山西省组织部拔尖人才专项基金(2014401)
阴彩霞(1978-),女,博士,教授,主要从事荧光探针及其生物传感方面的研究。E-mail:yincx@sxu.edu.cn
O436
A
0253-2395(2017)03-0527-06
