高效双接种田菁修复黄河三角洲盐碱土壤研究
2017-09-03任承钢杨金保李项岳孔存翠徐华凌解志红
任承钢, 李 岩, 刘 卫, 杨金保, 李项岳, 孔存翠, 徐华凌, 解志红
高效双接种田菁修复黄河三角洲盐碱土壤研究
任承钢1, 李 岩1, 刘 卫1, 杨金保1, 李项岳1, 孔存翠1, 徐华凌2, 解志红1
(1. 中国科学院烟台海岸带研究所, 海岸带生物学与生物资源利用重点实验室, 山东烟台264003; 2. 山东省农业科学院盐生植物与生态农业研究所, 山东东营257000)
为了治理黄河三角洲土地盐碱化问题, 在山东省东营市垦利县永安镇(37.56°N, 118.74°E)选取一块面积为70 m2的土地作为试验地, 进行根瘤菌和丛枝菌根真菌接种田菁()进行降盐试验。试验设置3个处理, 分别为对照组(不种植田菁)、不接种组、双接种组(根瘤菌和丛枝菌根真菌接种田菁)。监测高效根瘤菌和丛枝菌根真菌接种田菁对田菁降盐效果及对土壤营养元素的影响。结果显示, 田菁质量和叶绿素含量等长势指标, 双接种组>不接种组>对照组, 双接种组田菁植株的地上部干物质质量比不接种组增加了26.12%, 地下部干物质质量增加了46.15%。不接种组田菁使土壤含盐量控制在0.9~2.0, 与对照组相比土壤含盐量降低了67%~79%。与不接种组田菁相比, 双接种处理土壤含盐量降低了20%~25%。此外, 双接种组土壤中速效氮、磷、钾含量比不接种组土壤明显增加。综上, 接种高效田菁根瘤菌和丛枝菌根真菌能有效提高田菁的降盐和肥田能力, 为治理黄河三角洲土地盐碱化问题提供技术参考。
根瘤菌; 丛枝菌根真菌; 盐碱土壤; 田菁(); 黄河三角洲
黄河三角洲作为国家黄河三角洲开发战略和蓝色经济战略的交汇处, 是山东省重点开发区域, 土地后备资源丰富, 拥有近5 000 km2未利用土地, 另有近10 000 km2浅海区域, 由于黄河冲积作用, 土地面积还以1 km2/a的速度增长[1-2]。然而由于成陆时间短以及特殊的地理位置等因素, 黄河三角洲土壤熟化程度低, 含盐量高, 极易盐碱化。调查显示黄河三角洲有光板地1.5 hm2, 重度盐碱地(含盐量为6~ 12)5.2 hm2, 中度盐碱地(含盐量4~6)8.7 hm2, 轻度盐碱地(含盐量2~4)21.5 hm2, 盐碱地约为黄河三角洲总面积的二分之一[3]。严重的土地盐碱化, 是制约黄河三角洲农业可持续发展的主要因素[4]。改良盐碱地、扩大粮食种植面积势在必行。
利用田菁()改良盐碱地在国内外均进行过广泛的试验研究。田菁为耐盐植物, 在土壤含盐量为8的条件下, 生物量能达到在正常土壤中的95%, 基本不受影响[5]。田菁耐盐极限值接近10[6]。Rao等[7]在印度北部低氮、低有机质的碱性土壤中连续两年种植田菁, 发现不但获得可观的生物量, 而且可以使土壤pH由8.6降到8.2, 有效氮从80 kg/hm2增加到101.5 kg/hm2, 获得良好的经济效益和生态效益。巴基斯坦的Qadir等[8]比较了田菁的植物修复与石膏肥料的化学修复盐碱土壤效果, 得出, 田菁的修复效果与化学修复效果相似, 但更加经济环保。我国利用田菁改良盐碱地始于20世纪60年代, 取得过良好的效果。据测定, 在沧州市海兴县种植田菁1 年,可使耕层土壤含盐量从2.5降到1.2, 第2年降到0.7, 在耕层土壤含盐量5.9的盐碱地上连续种植田菁4年可使含盐量降到1.9, 脱盐率达67.8%[9]。河南省农业科学院土壤肥料研究所试验表明, 在盐碱地种植田菁, 生长盛期时的行间表层土壤含盐量较未种田菁的含盐量降低了55.2%[10]。山东省农业科学院土壤肥料研究所试验表明, 在盐碱洼地种植田菁可使0~10 cm的表层土壤含盐量下降32%~64%, 0~20 cm土层含盐量下降了10%~30%[11]。许开华等[12]大棚轮作田菁和草莓, 发现田菁使土壤含盐量下降了36.23%, 减轻土壤的次生盐渍化, 从而确保主栽培作物草莓持续优质高产。
田菁在耐盐碱、降低土壤盐含量、增加土壤养分、改善土壤结构、促进土壤微生物活动等方面相对碱蓬、柽柳等典型盐生植物具有比较大的优势。田菁高效根瘤菌的固氮作用和丛枝菌根真菌的促抗逆作用[13-14], 可以进一步增强田菁对贫瘠盐碱化土壤的耐受能力。因而, 在盐碱地面积广阔、作物产量低、大范围施用化肥不现实的黄河三角洲地区, 种植田菁并接种高效共生菌将是一种改良盐碱化土壤的较好选择。我国黄河三角洲地区已有多年种植田菁的历史。本研究前期筛选了高效结瘤固氮且促生效果显著的根瘤菌和丛枝菌根真菌菌种。如能充分发挥田菁-根瘤菌-丛枝菌根真菌共生固氮体系的功能, 将对促进田菁生长, 提高田菁植物生物量, 增强降盐肥田效果具有重要意义。因此, 本研究在黄河三角洲轻、中度盐渍土壤中, 接种高效根瘤菌和丛枝菌根真菌, 考察其对田菁的生长状况以及土壤改良效果的影响, 评估接种高效共生菌促进田菁改良盐碱土壤的潜力。
1 材料与方法
1.1 试验地概况
试验地位于山东省东营市垦利县永安镇的试验基地, 37.56°N, 118.74°E。地处黄河入海口, 濒临渤海, 为温带季风气候, 年平均气温13.8℃, 年均降水量570 mm。土壤类型为典型河流冲积的沙质盐碱土, 播种前该地块经过春灌, 底墒充足, 没有预施肥料, 没有根瘤菌接种史。土壤含盐量为1.3~4.2, pH为7.93~8.11, 营养成分速效氮、Olsen-P、速效钾、有机碳和全氮的质量比分别为61.6 mg/kg, 8.8 mg/kg, 65.2 mg/kg, 1.64 g/kg和0.51 g/kg。
1.2 试验设置与材料
田菁根瘤采集于东营市利津县仙河镇、山东省农业科学院田菁种植地、黄河三角洲生态湿地保护站三个样点。在田菁植株生长旺盛的6—8月采集根瘤, 分离根瘤菌进行分类鉴定[15]。筛选出固氮能力和促生长能力最好的sp.YIC4027为待用菌株。丛枝菌根真菌(GM, BGC NM03D)购自北京市农林科学院, 用三叶草(L.)为宿主扩繁菌种, 达每10克基质含有116个孢子。供试验用的田菁种子为山东省农业科学院提供的2013年秋季收获的田菁种子。
2014年4月30日上午开始田菁降盐试验。共进行3组处理: 不种植田菁对照组、根瘤菌和丛枝菌根真菌双接种田菁组、不接种田菁组。每组处理重复3次, 随机排列。种植行距50 cm, 株距30 cm, 各处理小区之间起垄, 总试验地面积约70 m2。播种前用热水浸泡种子24 h, 播种量14 kg/hm2, 将根瘤菌液喷洒在播入种子的垄沟里, 同时撒入丛枝菌根真菌接种物, 用土填平。
1.3 田菁生长指标
待子叶脱落后, 用叶绿素计SPAD-502 Plus测田菁叶片叶绿素含量。生长70 d后, 将新鲜植株的根从第一片真叶的叶痕处剪下, 测量地上部株高、鲜质量, 同时测根质量、主根长、侧根长、根部茎粗等生理指标。
1.4 根瘤菌占瘤率及菌根定殖率
2014年7月11日采集田菁根瘤, 称质量并对根瘤个数计数, 分离纯化, 随机挑取菌落进行基因测序, 根据测序结果统计根瘤菌占瘤率, 分析接种菌株的占瘤率。用台盼蓝-苯酚溶液对田菁须根进行染色, 然后用十字交叉法观察计算菌根定殖率[16]。
1.5 土壤理化性质
分别采集距地面10 cm深、距离田菁主根5 cm远和15 cm远的表层土壤, 用于检测土壤pH及含盐量。土壤含盐量以土水比1︰5浸提液用DDBJ-350电导率仪测定; 土壤pH采用去离子水(土水比1︰2.5(质量︰体积))浸提30 min, 用Mettler toledo 320 pH计测定。土壤全氮含量采用碳氮分析仪(Vario-MAX C/N)测定, 土壤有机碳、有效磷和有效钾含量测定按南京土壤研究所编的《土壤理化分析》进行[17]。
2 结果
2.1 菌株的定殖情况
为明晰所接种菌株的有效性, 分别对根瘤菌的占瘤率和菌根菌的定殖率进行检测。结果如图1所示, 对基因序列的分析表明, 双接种组田菁根瘤菌群中sp. I YIC4027菌株占99%, 土著优势种sp. I YIC4261占1%[15]。不接种组田菁根瘤菌中土著sp. I YIC4261占绝对优势, YIC4072占13%, 表明接种菌株的竞争结瘤能力及垄沟喷洒的接种方式能够保证接种菌株在实验组田菁根瘤菌种群结构中占绝对优势地位, 并保证对田菁生长产生有效的影响。双接种组田菁的根瘤数量及质量均明显高于未接种组田菁根上由于土著菌侵染所形成的根瘤(表1)。
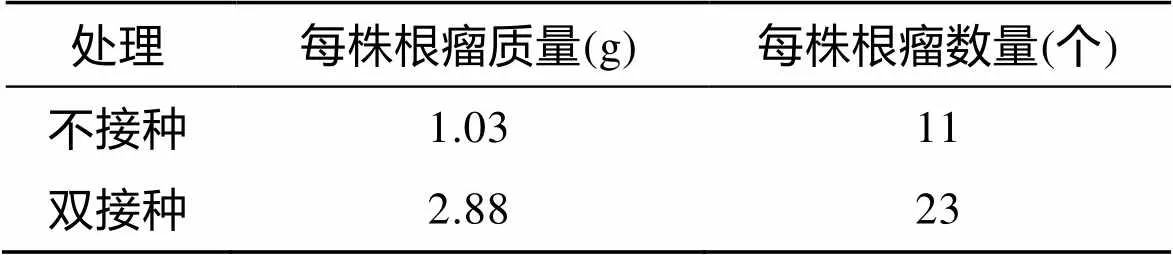
表1 各处理组田菁的结瘤情况
同时, 双接种组和不接种组田菁根染色镜检结果显示, 不接种组田菁的丛枝菌根真菌定殖率为35%, 而接种菌种的田菁根部定殖率达73%, 差异极显著(图2)。这说明双接种处理能有效提高所试土壤环境中丛枝菌根真菌对田菁的定殖率。以上结果表明, 使用根瘤菌可以高效定殖田菁, 且对菌根菌定殖率有明显促进作用。
**表示差异极显著
**significant difference
2.2 高效根瘤菌和菌根菌对田菁生长的影响
田间监测结果显示, 在供试土壤条件下, 田菁生长正常。对比双接种组与不接种组田菁的根部茎粗、株高、地上部质量、地下部质量、主根长、侧根长及叶绿素含量, 可以看出双接种组田菁比不接种组田菁长势更好, 对应的各项指标分别增长了31.81%、1.55%、26.12%、46.15%、6.06%、11.23% 和10.38%(增长率=[(双接种的量–不接种的量)/不接种的量] ×100%), 其中株高、主根长、侧根长增幅不明显, 而反映植株初生代谢能力的叶绿素含量和生物量的茎粗(直径)、地上部质量、地下部质量均增幅较大并达到显著水平(表2)。
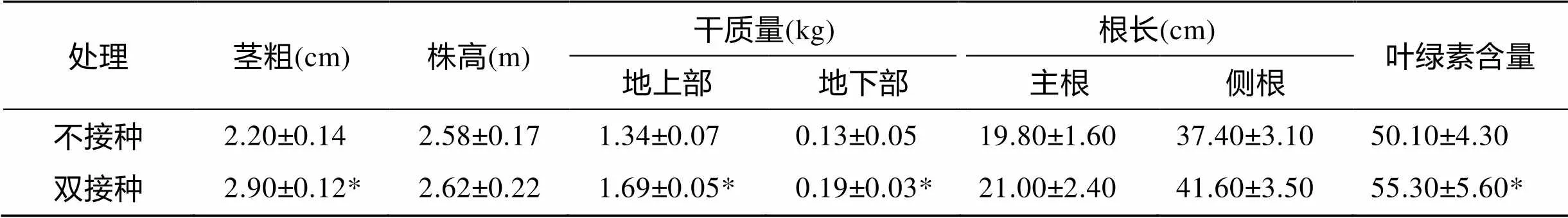
表 2 高效根瘤菌和丛枝菌根真菌对田菁生长指标的影响
注: 叶绿素含量为叶绿素仪直接测得的数值, 没有单位
2.3 双接种田菁对土壤含盐量的影响
土壤含盐量监测结果如图3所示, 由于种植前土壤底墒充足, 4月份所测土壤含盐量较低, 相当于非盐渍土。随着水分的蒸发, 地下水位上升, 到7月份和10月份, 没有种植田菁的对照空地土壤总盐含量逐渐升高到4, 属轻度盐渍土。比较对照样品(空地土壤), 样品A(田菁不接种0~5 cm土壤), 样品B(田菁不接种15 cm土壤), 样品C(田菁双接种0~5 cm土壤)和样品D(田菁双接种15 cm土壤)在7月份和10月份的土壤含盐量, 可以看出, 样品C<样品A<样品D<样品B<对照, 土壤含盐量变化幅度较大, 种植田菁的土壤与空地土壤相比含盐量降低十分明显, 降低了67%~79%。同时, 双接种组与不接种组相比含盐量降低也十分明显。从时间上比较分析每组样品的土壤含盐量: 7月<10月<4月。总体看, 种植田菁土壤含盐量明显低于空地土壤, 保持在较低水平, 为非盐渍土。综上所述, 种植田菁有效降低了土壤盐含量, 靠近根系(0~5 cm)的土壤含盐量低于远离根系(15 cm)的土壤, 双接种组的田菁土壤含盐量要比不接种组的土壤含盐量低20%~25%。
2.4 双接种田菁对土壤酸碱度的影响
土壤酸碱度的监测结果如图4所示, 对比4月、7月和10月3个时间点的各组样品的pH: 样品C<样品A<样品D<样品B<对照, 但差异变化均在0~ 0.12, 变化幅度都不大, 只有10月的根际土壤pH值与对照相比下降幅度最大, 达0.12。比较不同月份的各组土壤样品的pH值可以看出, 7月<10月<4月, 和盐含量变化趋势基本一致。10月份土壤的pH值, 样品C>样品A>样品D≈样品B>对照, 变化幅度为0~0.15。综上可知, 种植田菁降低了土壤的pH值, 近根系的土壤pH降低幅度略大于离根系远的土壤, 而接菌的效果要比不接菌的效果好, 但这种降低幅度总体很小。
2.5 双接种田菁对土壤营养成分的影响
对10月份采集的对照组、双接种组、不接种组的土壤进行理化性质分析发现, 各组土壤中的速效氮、速效磷、速效钾含量, 双接种组>不接种组>对照组; 全氮和有机质的含量, 对照组>双接种组>不接种组。和对照组土壤相比, 双接种组的土壤的速效氮、速效钾、速效磷含量分别增长了39.45%、14.50%、161.96%, 双接种组土壤比不接种组土壤分别增长了17.94%、6.54%、78.52% (表3)。双接种组土壤比不接种组土壤有机质和全氮含量分别增长了36.16%、4.00% (表3)。综上所述, 土壤易于利用的营养成分增加, 双接种组土壤中营养成分增量大于不接种组土壤; 同时, 土壤有机质和全氮减少, 不接种组土壤中有机质和全氮减少量小于双接种组土壤。
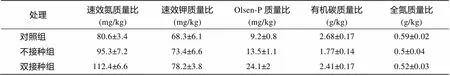
表3 10月份各处理组土壤的营养情况
3 讨论
黄河三角洲地区属于温带季风气候, 降水的周期性变化导致本地土壤含盐量周期性变化, 一般表现为春季(3—5月)、秋季(10—11月)为积盐高峰期, 夏季(7—9月)为脱盐期, 冬季(12月至次年2月)为稳定期[6]。土壤pH的变化周期与土壤含量基本相同。因而, 本试验7月份土壤样品盐含量和pH值降低后, 虽然伴随田菁生长效应, 但10月份土壤盐含量和pH值再次升高(图3、图4)。
本研究在黄河三角洲中度盐渍土上种植绿肥作物田菁, 在不施肥的情况下, 田菁能正常完成生长史并获得较大的生物量, 说明其可以适应黄河三角洲中度盐碱土环境。盆栽筛选的高效共生菌施入土壤后, 能适应中度盐碱土壤环境, 表现出较强的竞争结瘤能力和促生效果。高效共生菌显著促进了田菁的生长, 与不接种组相比, 使田菁的地上部及地下部生物量分别提高了31.6%和46.2%, 同时增强了其降盐能力, 比不接种组降盐量增加了20%~25%。有研究表明, 田菁是拒盐植物, 虽然能够在盐土中生长, 但其根细胞不透盐, 而是将盐离子积累在液泡和根部木质部薄壁组织中, 不同于聚盐与泌盐盐生植物直接在土壤中吸收盐来降低土壤含盐量。田菁枝叶繁茂, 生物量大, 覆盖面大, 种植区域比暴晒或其他生物量小的植物生长区域的温度低, 蒸发少, 有效抑制表层土壤返盐; 植物的蒸腾作用替代了物理蒸发, 也部分抑制了土壤盐的积累[16]。此外, 田菁庞大的根系伸入土壤可以疏松土壤, 增加土壤孔隙, 同时种植田菁使有机质增加, 促使土壤的团粒形成, 这都改善了土壤结构, 提高土壤的入渗率, 使盐更容易向下淋溶而抑制土壤盐向地表积累[6]。侯贺贺等[17]研究表明, 在盐碱地种植田菁, 3年后使表层土壤容重降低了28.65%, 土壤入渗率提高4.76倍, 土壤脱盐率达56.11%。种植田菁增加了土壤有机质及氮素含量, 促进了土壤微生物活动, 增加了阴阳离子的吸收和溶解。根瘤菌和丛枝菌根真菌双接种可有效增加田菁的地上部和地下部的生物量(表3), 使得上述抑制地表蒸发以及脱盐等效应进一步扩大。
土壤酸碱度是土壤的一个重要指标, 其变化会直接对土壤养分动态以及土壤微生物群落结构及活性等产生影响, 关系着植物根系的生长发育[18]。盐碱地种植耐盐作物, 植物根系和根系微生物分泌的有机酸以及根系微生物分解动植物残体产生的各种有机酸, 均会中和部分土壤碱性物质。但由于黄河三角洲的盐碱类型主要为氯化物和硫酸盐类型盐土, 因而对pH值的影响不大。在侯贺贺等人的研究中, 种植盐生植物降低了土壤的pH, 但和本研究的结果一样, 降幅都较小[19-20]。
已有大量研究发现, 种植田菁等作物能增加土壤养分, 如速效氮、速效磷、速效钾、有机质、全氮等[21]。在本研究中田菁的生长, 土壤速效氮、速效磷、速效钾含量增长, 有机质和全氮含量下降(表3)。另有研究表明, 植物根系分泌物能增强根系微生物的活动, 加快土壤有机质的分解以及土壤营养元素如钾、磷的矿化[22]。此外, 从4月份开始, 黄河三角洲地区温度不断升高, 降雨量增大, 有利于土壤微生物的繁殖与有机物的分解。土壤中的氮素绝大多数是以有机态存在的。因此, 在4到10月份的种植田菁期间, 土壤微生物活动加剧, 促进了土壤有机质分解及营养物质的矿化, 使土壤中易于利用的营养物质如速效氮、速效磷、速效钾增加。同时, 由于植物生长, 需要从土壤中带走大量的营养物质, 且植物根系分泌量低于吸收量, 导致土壤全氮的下降。此外, 从10月份开始, 田菁根系与根瘤开始分解, 土壤中全氮及有机质含量将随之增加。值得注意的是, 虽然双接种组田菁生物量大于不接种组, 但其土壤的各营养指标仍优于不接种组的土壤。可能的原因是, 接种的根瘤菌进入土壤后, 大幅增加了土壤的微生物数量, 且根瘤菌在独立生活条件下, 作为腐生细菌, 增大了土壤微生物的降解能力; 在共生情况下, 高效共生固氮使宿主生物量增大, 土壤中有机质和氮素的积累相比不接菌的土壤也会更多。
要发挥根瘤菌和田菁高效共生固氮体系的功能, 必须要针对生长环境筛选最合适的菌株, 因为区域地理环境对根瘤菌与宿主共生关系的影响很大。本研究, 从采集自黄河三角洲的土著田菁根瘤菌中筛选得到固氮结瘤能力强、促生作用显著的菌种, 在黄河三角洲小区实验中, 很好地适应了当地环境, 表现出高的存活量及强的竞争结瘤能力, 显著促进了田菁的生长, 尤其是田菁的地上部生物量。另外, 接种丛枝菌根真菌不仅可以促进田菁的生长和抗逆, 还能使田菁的根系效应进一步扩大。高效根瘤菌和丛枝菌根真菌的施用在促进田菁生长的同时, 也提高了田菁的降盐肥田能力。
4 结论
1) 菌株sp. I 4027在双接种田菁根瘤菌种群组成中占绝对优势, 说明该菌株具有较强的竞争结瘤能力, 本试验所使用接种方式能够保证接种效果。
2) 根瘤菌和丛枝菌根真菌双接种田菁长势优于不接种田菁。种植田菁可以有效降低土壤含盐量, 而双接种可以进一步促进田菁的降盐能力。同时土壤养分也得到明显改善。因此, 根瘤菌、丛枝菌根真菌和田菁联合修复是一种有效的盐碱土壤修复技术。
[1] 郭永盛. 近代黄河三角洲海岸的变迁[J]. 海洋科学, 1980, 4(1): 30-34. Guo Yiongsheng. The changes of the modern Yellow River delta coast [J]. Marine Sciences, 1980, 4(1): 30-34.
[2] 栗云召, 于君宝, 韩广轩. 基于遥感的黄河三角洲海岸线变化研究[J]. 海洋科学, 2012, 36(4): 99-106. Li Yunzhao, Yu Junbao, Han Guangxuan. Coastline change detection of the Yellow River Delta by satellite remote sensing [J]. Marine Sciences, 2012, 36(4): 99-106.
[3] 关元秀, 刘高焕, 刘庆生, 等. 黄河三角洲盐碱地遥感调查研究[J].遥感学报, 2001, 1: 46-52. Guan Yuanxiu, Liu Gaohuan, Liu Qingsheng, et al. The study of salt-affected soils in the Yellow River delta based on remote sensing [J]. Journal of Remote Sensing, 2001, 1: 46-52.
[4] 许学工. 黄河三角洲地域结构与综合开发[J]. 地理研究, 1994, 1: 119. Xu Xuegong. Domain structure and comprehensive development of Yellow River delta [J]. Geographical Research, 1994, 01: 119.
[5] 李燕青, 孙文彦, 许建新, 等. 华北盐碱地耐盐经济作物筛选[J]. 华北农学报, 2013, S1: 227-232. Li Yanqing, Sun Wenyan, Xu Jianxin, et al. The evaluation of salt tolerant cash crops in northern china [J].Acta Agriculturae Boreali-Sinica, 2013, S1: 227-232.
[6] 张立宾. 盐生植物的耐盐能力及其对滨海盐渍土的改良效果研究[D]. 泰安: 山东农业大学, 2005. Zhang Libin. Salt tolerance capacity of halophytes and their effects on coastal saline soil improvement [D]. Taian: Shandong Agricultural University, 2005.
[7] Rao D L N, Gill H S. Biomass and biofertilizer production byin alkaline soil [J]. Bioresource Technology, 1995, 53(2): 169-172.
[8] Qadir M, Qureshi R H, Ahmad N, et al. Salt-tolerant forage cultivation on a saline-sodic field for biomass production and soil reclamation [J]. Land Degradation & Development, 1996, 7(1): 11-18.
[9] 郭立新, 许勇. 黑龙港地区发展田菁绿肥在耕作改制中的作用及前途[J]. 土壤肥料, 1981, 6: 14-16. Guo Lixin, Xu Yong. The role of farming system and the future of development sesbania green manure in the black dragon harbor area [J]. Soils and Fertilizers, 1981, 6: 14-16.
[10] 白鸿翔, 高占夫, 李世通. 河南省田菁试验示范成果报告[J]. 土壤通报, 1965, 6: 23-25. Bai Hongxiang, Gao Zhanfu, Li Shitong. Henan sesbania experiment and demonstration results report [J]. Chinese Journal of Soil Science, 1965, 6: 23-25.
[11] 王景生, 卜金明, 贾树均, 等. 盐碱地改良与田菁种植[J]. 内蒙古农业科技, 1999, S1: 181-183. Wang Jingsheng, Bu Jinming, Jia Shujun, et al. saline land improvement and Sesbania planting [J]. Inner Mongolia Agricultural Science and Technology, 1999, S1: 181-183.
[12] 许开华, 茅孝仁, 蔡娜丹, 等. 大棚轮作田菁对土壤降盐效果试验[J]. 现代农业科技, 2010, 23: 258-263. Xu Kaihua, Mao Xiaoren, Cai Nadan, et al. Greenhouse rotation of sesbania for soil testing the effect of salt reduction [J]. Modern Agricultural Sciences and Technology, 2010, 23: 258-263.
[13] 李项岳, 李岩, 姜南, 等. 如东田菁根瘤菌遗传多样性及高效促生菌株筛选[J]. 微生物学报, 2015, 55(9): 1105-1116. Li Xiangyue, Li Yan, Jiang Nan, et al. Genetic diversity of the Rhizobia and screening of highefficient growth- promoting strains isolated fromin Rudong County [J]. Acta Microbiologica Sinica, 2015, 55(9): 1105-1116.
[14] Rosa P, Ricardo A, Juan M R. Salinity stress alleviation using arbuscular mycorrhizal fungi: a review [J]. Agron Sustain Dev, 2012, 32: 181-200.
[15] Li Yan, Li Xiangyue, Liu Yajing, et al. Genetic diversity and community structure of rhizobia nodulatingin saline–alkaline soils[J]. Systematic and Applied Microbiology, 2016, 39(3): 195-202.
[16] Giovannetti M, Mosse B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots [J]. New Phytologist , 1980, 84: 489-500.
[17] 侯贺贺. 黄河三角洲盐碱地生物措施改良效果研究[D].泰安: 山东农业大学, 2014. Hou Hehe. Study of improvement effects by biological measures in the Yellow River Delta saline-alkali soil[D]. Taian: Shandong Agricultural University, 2014.
[18] 刘浩. 吉林省西部盐碱地治理技术综述[J]. 长春工程学院学报(自然科学版), 2016, 4: 41-43+47. Liu Hao. The technical measures of saline-alkaline soil treatment in the west area of Jilin Province china [J]. Journal of Changchun Institute of Technology (Natural Sciences Edition), 2016, 4: 41-43+47.
[19] 樊利勤, 庄培亮, 马兰珍, 等. 厚荚相思根瘤菌对盆栽苗木生长及土壤肥力的影响[J]. 生态科学, 2004, 4: 289-294. Fan Liqin, Zhuang Peiliang, Ma Lanzhen. Responses ofseedlings and soil nutrition to rhizobia isolated from[J]. Ecologic Science, 2004, 4: 289-294.
[20] 李志丹, 干友民, 泽柏. 牧草改良盐渍化土壤理化性质研究进展[J]. 草业科学, 2004, 6: 17-21. Li Zhidan, Gan Youmin, Ze Bai. Research progress on forage to improve saline-alkali soil [J]. Pratacultural Science, 2004, 6: 17-21.
[21] 谢文军, 王济世, 靳祥旭, 等. 田菁改良重度盐渍化土壤的效果分析[J]. 中国农学通报, 2016, 6: 119-123.Xie Wenjun, Wang Jishi, Jin Xiangxu. Effect ofcultivation on severe salinity soil fertility improvement [J]. Chinese Agricultural Science Bulletin, 2016, 6: 119-123.
[22] 孙佳杰, 尹建道, 解玉红, 等. 天津滨海盐碱土壤微生物生态特性研究[J]. 南京林业大学学报(自然科学版), 2010, 3: 57-61.Sun Jiajie, Yin Jiandao, Xie Yuhong. Microbial ecological characteristics of saline-alkali soil in coastal area of Tianjin [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2010, 3: 57-61.
Effect of efficient inoculants on coastal saline soil phytorehabilitation byin the Yellow River Delta
REN Cheng-gang1, LI Yan1, LIU Wei1, YANG Jin-bao1, LI Xiang-yue1, KONG Cun-cui1, XU Hua-ling2, XIE Zhi-hong1
(1. Key Laboratory of Biology and Utilization of Biological, Resources of Coastal Zone, Yantai Institute of Coastal Zone Research, the Chinese Academy of Sciences, Yantai 264003, China; 2. Halophytes Institute of Ecological Agriculture, Shandong Academy of Agricultural Sciences, Dongying 257000, China)
A plot experiment was conducted to monitor the effects of dual-inoculation of efficientand arbuscular mycorrhizal fungi on the salt reducing effect and soil nutrition in moderate saline-alkali soil of the Yellow River Delta hinterland to explore the application prospects for microbe-plant associations during saline-alkali soil rehabilitation. The results showed that the up-ground biomass increased by 28.6% and below-ground biomass increased 51.3% in dual-inoculating planted soil >planted soil > unplanted soil. The soil salt content ofplanted soil was maintained at 0.9–2.0, which was 67%–79% lower compared to unplanted soil. The salt content in dual inoculating planted soil was 20%–25% lower than that in planted soil. The dual inoculation treatment increased available nitrogen, phosphorus, and potassium in soil greater than theplanted soil. These results indicate that dual-inoculation of efficientrhizobia and arbuscular mycorrhizal fungi improved the ability of green manure crops to fertilize and rehabilitate saline-alkali soil.
rhizobia; arbuscular mycorrhizal fungi; saline-alkali soil;; the Yellow River Delta
(本文编辑: 刘珊珊)
[National Natural Science Foundation of China, No. 31601238, No. 31570063; Key Research Program of the Chinese Academy of Sciences, No. KZZD-EW-14]; Yantai Key Project of Research and Development Plan, No. 2016ZH074; Yantai Science and Technology Development Plan, No. 2013JH021]
Jul. 13, 2016
S156.4
A
1000-3096(2017)05-0001-07
10.11759/hykx20160713001
2016-07-13;
2016-11-14
国家自然科学基金项目(31601238, 31570063); 中国科学院重点部署项目(KZZD-EW-14); 烟台市重点研发计划项目(2016ZH074); 烟台市科技发展计划项目(2013JH021)
任承钢(1985-), 男, 安徽阜阳人, 助理研究员, 博士, 主要从事盐碱土壤生物修复, E-mail: cgren@yic.ac.cn; 解志红(1970-), 通信作者, 研究员, 博士, E-mail: zhxie@yic.ac.cn
