水分条件对滨海芦苇湿地土壤微生物多样性的影响
2017-09-03张洪霞郑世玲魏文超王炳臣王欧美刘芳华
张洪霞, 郑世玲, 魏文超, 王炳臣, 王欧美, 刘芳华
水分条件对滨海芦苇湿地土壤微生物多样性的影响
张洪霞1, 2, 郑世玲1, 魏文超1, 2, 王炳臣1, 2, 王欧美3, 刘芳华1
(1. 中国科学院烟台海岸带研究所, 海岸带生物学与生物资源利用所重点实验室, 山东烟台 264003; 2. 中国科学院大学, 北京 100049; 3. 滨州医学院, 山东烟台 264003)
滨海湿地因受河流和海水的交互作用, 其土壤氧化还原电位及营养元素等条件复杂且处于不断变化之中, 为了阐明此种环境下不同水分条件对滨海芦苇湿地土壤微生物多样性的影响, 尤其是对铁还原菌群落结构的影响, 作者以黄河三角洲滨海湿地为对象, 研究了淹水和非淹水芦苇湿地表层(0~30 cm)土壤理化特性、微生物多样性(采用T-RFLP技术)和培养条件下湿地土壤微生物的Fe(III)还原能力的变化。结果表明, 淹水芦苇湿地土壤有机碳、全氮、盐度、Fe(II)含量和pH值显著(<0.05)高于非淹水芦苇湿地土壤, 而淹水芦苇湿地土壤铵态氮含量显著(<0.05)低于非淹水芦苇湿地。淹水芦苇湿地土壤主要优势细菌和古菌分别为铬还原菌属()、纤维单胞菌属()、鞘脂单胞菌属()、假单胞菌属()和甲烷杆菌属()、甲烷八叠球菌属(); 而纤维单胞菌属、食酸菌属()、地杆菌属()、硫杆菌属()和甲烷八叠球菌属分别为非淹水芦苇湿地土壤主要优势细菌和古菌。淹水芦苇湿地土壤主要优势铁还原菌为副球菌属()、地杆菌属、铬还原菌属和硫单胞菌属(), 而非淹水芦苇湿地土壤为地杆菌属和固氮螺菌属()。说明淹水能增加芦苇湿地土壤细菌、古菌和铁还原菌的多样性。培养条件下, 淹水芦苇湿地土壤铁还原菌的还原Fe(III)能力在培养后期(25d后)低于非淹水芦苇湿地, 说明淹水条件在一定程度上抑制了芦苇湿地土壤铁还原菌的铁还原能力。
水分条件; 芦苇湿地; 微生物群落; 铁还原菌; 多样性
滨海湿地处于陆地—海洋—大气相互作用最活跃的地带, 是全球环境变化的缓冲区[1], 频繁受淡水与海水交互作用影响, 滨海湿地土壤中的氧、氮、硫、铁等元素含量随水文条件和生物化学过程而变化复杂[2], 电子供体及电子受体浓度也受土壤氧化还原条件的改变而剧烈变化。湿地水位增高及土壤含水量增加能够降低氧化还原电位与溶解氧浓度[3], 降低湿地微生物种类与活性[4], 进而影响土壤微生物对湿地有机碳的分解转化和利用。土壤水分条件成为影响湿地生态系统的最主要因素之一。
已有研究[5-7]表明, 水分条件是影响土壤微生物群落结构的重要因素, 淹水条件能够明显改变水稻土和湿地微生物群落结构和活性。Unger等[8]研究也发现, 持续淹水条件降低了土壤微生物量, 且影响土壤微生物群落结构。牛佳等[9]对高寒湿地干湿土壤条件下微生物群落结构特征研究发现, 常年淹水土壤的微生物总生物量、细菌生物量均表现为高于非淹水土壤, 且不同水分条件的两种土壤微生物群落结构显著不同。因此, 滨海湿地这种特殊水文条件对土壤微生物群落结构及其参与的生物地球化学循环过程都会产生重要影响。
黄河三角洲滨海湿地处于黄河入海口, 黄河水颗粒物浓度高而携带大量泥沙入海, 使该区域成为世界上造陆速度最快的河口三角洲之一。黄河三角洲湿地生态系统受河水、海水交互作用的影响, 且地下水位较高, 水分条件成为影响滨海湿地盐度、营养元素转化、植被演替及微生物群落结构的最主要环境影响因素。芦苇是湿地植物群落的重要建群种, 在黄河三角洲湿地区域分布广泛, 是该地区的典型优势物种之一和生态修复的关键种[10-11]。芦苇与微生物具有密切的相互作用关系, 芦苇种植能够使土壤细菌和古菌的丰度明显上升, 提高微生物活性, 而且芦苇根际能够释放氧改变氧化还原条件, 从而促进土壤中有机氮矿化、硝化作用及反硝化作用[12]。微生物能够提高植物根际土壤养分有效性, 还能促进植物对微量(铁)元素的吸收[13], 增加植物在极端环境中的生存能力, 提高植物对高盐、干旱及淹水等胁迫的耐性。此外, 有研究表明在不同水分梯度下湿地芦苇植被生态特征表现出异质性, 芦苇在水淹条件下能够表现出较高的生长速率[14-15], 而在此环境下土壤微生物群落结构对水分条件变化的响应了解甚少。
近年来尽管已有一些对黄河三角洲湿地微生物群落结构的研究报道, 但还未见对不同水分盐度条件下典型植物群落土壤微生物资源分布的报道, 特别是功能微生物(铁还原菌)群落结构变化的研究报道。本研究选取黄河三角洲滨海不同水分条件芦苇湿地表层土壤为研究对象, 分析水分条件变化下芦苇湿地表层土壤微生物多样性以及铁还原菌群落组成变化, 以期为进一步了解滨海湿地水分条件对微生物群落结构及其参与元素生物地球化学循环过程的影响机理及湿地生态修复等提供依据。
1 材料与方法
1.1 样品来源
样品于2014年3月取自黄河三角洲(东营)国家级湿地自然保护区内(37°40′~38°10′N, 118°41′~119°16′E),该区为黄河入海口处,保护区总面积为15.3×104hm2, 属温带大陆性季风气候, 年平均气温12.1℃, 多年平均降水量约551.6 mm。区内植被以水生植被和盐生植被为主(85%以上), 植物群落组成简单, 建群种少, 以芦苇()、柽柳()及翅碱蓬()分布较广。土壤质地以轻壤土和中壤土为主, 土壤类型以潮土和盐土为主。
本研究在保护区内选择2处不同水分条件的芦苇湿地, 分为常年淹水芦苇湿地(FP)和非淹水区芦苇湿地(WP)(图1)。每个芦苇湿地随机设置3个3 m× 3 m 的样方, 在芦苇生长季的每个样方内按“S”型采集X点表层0~30 cm土壤样品, 土壤样品去除杂质并混合均匀后放入冰盒内带回实验室, 分3部分处理: 一部分样品风干后过2 mm筛用于土壤理化特性测定, 一部分冻存于–80℃用于土壤微生物DNA提取, 另一部分保存于4℃, 用于铁还原微生物富集培养。
1.2 富集培养
铁还原富集培养采用淡水富集培养基(FWM), 配方参照Lovley的方法[16], 成分如下: NaHCO32.5 g/L, CaCl2·2H2O 0.1 g/L, KCl 0.1 g/L, NH4Cl 1.5 g/L, NaH2PO40.6 g/L, NaCl 0.1 g/L, MgCl2·6H2O 0.1 g/L, MgSO4·7H2O 0.1 g/L, MnCl2·4H2O 0.005 g/L, NaMoO4·2H2O0.001 g/L, NaAc 20 2.7 g/L, 并加入终体积分数相当于60 mmol/L的无定形铁氧化物[Amorphous Fe(III) oxides], 调pH至 7.0。将配好的培养基分装入血清瓶中, 每瓶50 mL, 充入混合气体(N2︰CO2=80︰20)至少30 min, 灭菌。无定形铁氧化物的实验室合成参照Lovley的方法[16]。
将芦苇湿地土壤样品混合均匀后, 取5 g样品加入装有10 mL去离子水的血清瓶, 充入混合气体(N2︰CO2=80︰20)至少30 min。再用无菌注射器抽取3 mL土壤悬浮液接入50 mL淡水富集培养基中, 置于30℃下黑暗培养30 d。每种芦苇湿地土壤样品重复3次。培养期间每隔5 d取混合液样品测定Fe(II)含量。
1.3 测定方法
1.3.1 土壤理化特性测定
土壤pH采用去离子水(土水比1︰2.5,)浸提15 min, 用Mettlertoledo 320 pH 计测定; 土壤盐度用电导率仪测定(土水比1︰5,); 土壤有机碳和总氮含量用元素分析仪(ElementarVario Macro, 德国)测定; 土壤铵态氮和硝态氮采用2 mol/L KCl提取, 用连续流动分析仪(Seal, 德国)测定。操作方法参照南京土壤研究所编《土壤理化分析》[17]。
1.3.2 Fe(II)/Fe(III)测定
富集培养体系中Fe(II)含量测定采用紫外菲啰嗪(Ferrozin)显色法。在培养期间每隔5 d取样, 取0.5 mL混合液样品加入到4.5 mL 0.5 mol/L的盐酸中, 黑暗静置24 h。离心5 min (8 000 r/min), 取上清100 μL, 加入1.9 mL含0.1%菲啰嗪的HEPES缓冲液, 反应5 min后, 在562 nm波长下测定吸光值, 根据标准曲线计算Fe(II)浓度。每个样品重复3次。取100 µL上述浸提后的离心上清样品, 与2 mL的0.25 mol/L的溶于等浓度盐酸中的羟胺盐酸混合, 在60℃保温2 h, 取100 µL与1.9 mL的菲洛嗪试剂混合, 然后按上述测Fe(II)的步骤操作, 计算得可提取态总Fe浓度, 其与Fe(II)测定浓度之差, 即为Fe(III)测定浓度。
1.4 DNA提取及T-RFLP分析
土壤样品及富集培养样品总DNA采用FastDNATMSPIN Kit for soil试剂盒提取, 根据试剂盒说明书标准流程操作。参考Zheng等[18]的方法进行T-RFLP分析, 以DNA为模版, 细菌以通用引物对Ba27f/Ba907r, 古菌以通用引物对Ar109f/Ar915r进行PCR, 其中引物Ba27f的5′端和Ar915r的3′端标记6-羧基荧光素(FAM)。PCR反应参数为: 94℃2 min; 94℃ 30 s; 55℃30 s; 72℃1 min, 25个循环, 72℃10 min。PCR产物经纯化后, 古菌用I酶, 细菌用I酶进行酶切, 酶切产物采用自动测序仪ABI PRISM 3730XL分析。特异T-RF相对丰度采用每个T-RF峰高值与总T-RFs峰高值的百分数计算, 每个样品重复3次。
1.5 数据分析
本研究中的T-RFs片段所代表的属水平上的细菌或古菌的鉴定参照文献及课题组研究滨海湿地样品所建的细菌和古菌克隆文库。利用SPSS19.0和Origin7.5进行数据分析和作图。并利用T检验分析不同水分条件芦苇湿地土壤理化性质的差异显著性。
2 结果与讨论
2.1 不同水分条件下芦苇湿地土壤理化特性变化
两种类型芦苇湿地土壤有机碳、全氮、铵态氮、盐度、Fe(II)含量及pH存在显著差异(<0.01)(表1)。常年淹水芦苇湿地土壤有机碳、全氮、盐度、Fe(II)含量及pH均明显高于非淹水芦苇湿地土壤, 而两者土壤硝态氮和Fe(III)含量差异不显著。这可能由于淹水环境使土壤通气性变差, 限制微生物对有机质的分解, 使有机质及其他一些营养元素更易于积累。以往对若尔盖湿地的研究发现, 土壤含水量与有机碳、全氮等含量成正比[9,19], 这与本研究中常年淹水芦苇湿地土壤有机碳和全氮含量较高的结果一致。而土壤碳、氮含量被认为是土壤微生物生长的主要限制因素[20]。所以水分条件可以通过影响土壤盐度、有机碳和全氮含量等理化性质, 对土壤微生物群落结构产生影响。所有芦苇湿地土壤pH均呈碱性(pH范围为7.90~8.24)。
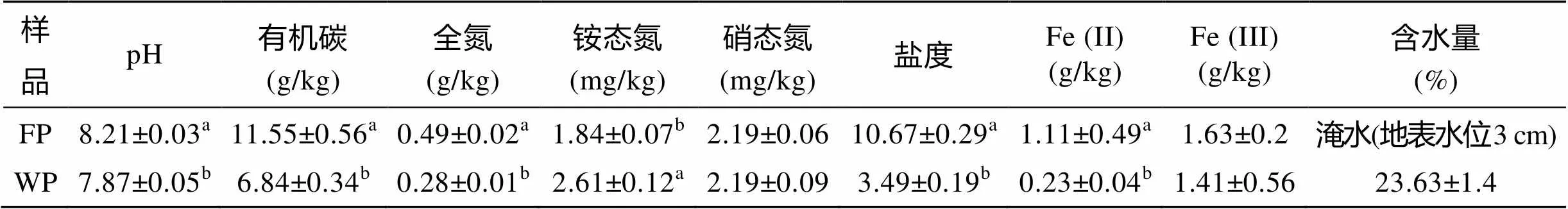
表1 不同水分条件芦苇湿地土壤基本特性(平均值±标准误差)
注: FP. 淹水芦苇湿地, WP. 非淹水芦苇湿地; 下同。同一列中不同字母表示处理间差异显著(< 0.05)
2.2 不同水分条件芦苇湿地土壤细菌和古菌群落结构
微生物在湿地生态系统的生物地球化学循环过程中起到至关重要的作用, 参与湿地土壤中有机质分解、矿化与积累以及介导N、P、S、Fe等其他元素的循环过程[21-22]。微生物活性与种类对环境条件变化十分敏感, 干旱、降水以及土壤含水量的改变都会引起土壤中微生物群落结构及其活性的变化[4]。
如图2a所示, 黄河三角洲不同水分条件芦苇湿地表层土壤细菌群落存在明显差异。淹水芦苇湿地土壤细菌群落T-RFs片段以472、80、435和497 bp为主要优势片段, 非淹水芦苇湿地土壤细菌群落T-RFs片段以80、484、160和490 bp为主。
参照已建克隆文库, 各T-RFs片段代表的属水平上的细菌见表2。由此可知, 淹水芦苇湿地土壤主要优势细菌为铬还原菌属、纤维单胞菌属、鞘脂单胞菌属()和假单胞菌属(); 非淹水芦苇湿地土壤占主要优势的为纤维菌属()、食酸菌属()、地杆菌属()和硫杆菌属()。此外, 91、120、128、141、165和522 bp T-RFs片段分别代表拟杆菌属()、嘉利翁氏菌属()、副球菌属()、芽孢杆菌属()、和梭菌属()。
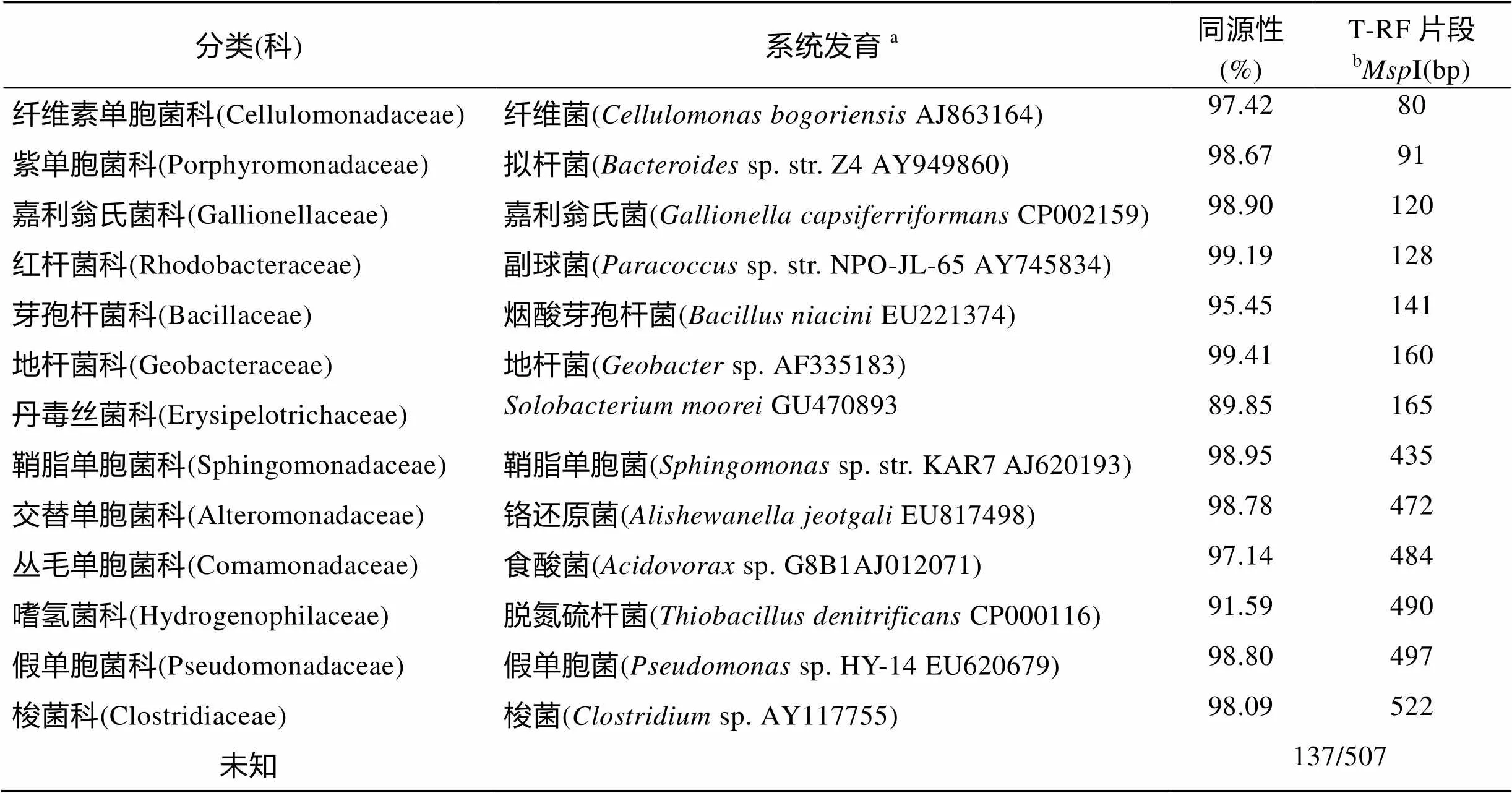
表2 采用限制性内切酶MspI产生的细菌片段构建克隆文库的16S rRNA基因系统发育关系(原位土壤)
注:a用Greengene进行BLAST比对的结果,b限制性内切酶I切割后的T-RF片段长度, 表4同
如图2b所示, 淹水与非淹水芦苇湿地土壤古菌群落结构也存在差异。黄河三角洲淹水芦苇湿地土壤古菌T-RF以86、181bp为主要片段, 非淹水芦苇湿地土壤古菌T-RF片段以181、717bp为主。各T-RFs片段代表的属水平上的细菌见表3, 86和181bp T-RFs片段分别代表甲烷杆菌属和甲烷八叠球菌属, 而其他T-RFs片段代表古菌未知。所以, 淹水芦苇湿地土壤主要优势古菌为甲烷杆菌属和甲烷八叠球菌属, 而甲烷八叠球菌属为非淹水芦苇湿地土壤主要优势古菌。同样地, 淹水芦苇湿地样品古菌T-RFs片段多样性高于非淹水芦苇湿地样品。

表3 采用限制性内切酶TaqI产生的古菌片段构建克隆文库的16S rRNA基因系统发育关系
注:a用Greengene进行BLAST比对的结果,b限制性内切酶I切割后的T-RF片段长度
Ligi等[23]研究表明水分条件是影响湿地反硝化细菌丰度最显著的环境变量, 不同水分条件改变反硝化细菌群落结构和丰度。刘岳燕等[6]研究发现水分条件(淹育、淹育晾干、非淹育)的变化导致水稻土微生物群落结构多样性和活性发生明显变化。本研究中黄河三角洲淹水与非淹水芦苇湿地土壤细菌和古菌群落结构均存在明显差异, 淹水芦苇湿地样品细菌和古菌T-RFs片段多样性均高于非淹水芦苇湿地样品, 说明水分条件对滨海芦苇湿地细菌和古菌多样性产生明显影响。淹水条件对土壤细菌数量没有明显影响[24], 且淹水环境能使土壤微生物对底物的利用能力增加、土壤碳素周转速率加快[6], 这可能由于淹水条件下土壤细菌和古菌多样性较高, 对环境条件变化适应性更强。长期淹水湿地的CH4氧化速率高于间歇性淹水湿地, 淹水环境下CH4浓度是影响甲烷氧化菌最主要的因素[25], 所以淹水湿地环境产甲烷菌具有更高的多样性和活性。
2.3 黄河三角洲不同水分条件芦苇湿地土壤显著差异物种分析
对黄河三角洲不同水分条件芦苇湿地的细菌和古菌相对丰度做元数据统计, 分析两种类型芦苇湿地微生物群落结构差异以及不同湿地的特别优势微生物。结果表明(图3), 淹水芦苇湿地代表性细菌T-RFs为128、141和435 bp, 分别代表副球菌属、芽孢杆菌属和鞘氮醇单胞菌属。非淹水芦苇湿地代表性细菌T-RFs有80、120、160和490 bp, 分别代表纤维单胞菌属、嘉利翁氏菌属、地杆菌属和硫杆菌属; 古菌T-RFs181bp, 代表甲烷八叠球菌属。不同水分条件湿地土壤微生物群落结构存在显著差异, 说明土壤微生物具有通过调整自身群落结构以适应环境条件变化的生存机制。
2.4 不同水分条件芦苇湿地土壤铁还原菌群落结构变化
为了分析不同水分条件下湿地土壤铁还原菌群落结构特征, 对黄河三角洲不同水分条件芦苇湿地土壤样品进行铁还原菌富集培养, 结果如图4所示, 淹水与非淹水芦苇湿地样品富集得到不同的细菌T-RFs片段。淹水芦苇湿地样品细菌群落T-RFs片段主要为128、160、475和487 bp; 而非淹水芦苇湿地样品细菌群落T-RFs片段主要为137、160、323、464和480 bp。
参照已建克隆文库, 各T-RFs片段代表的属水平上的细菌见表4。由此可知, 淹水芦苇湿地富集样品主要优势细菌为副球菌属、地杆菌属、铬还原菌属()和硫单胞菌属(); 非淹水芦苇湿地富集样品占主要优势的为地杆菌属和固氮螺菌属。而富集得到的古菌T-RFs片段没有差别, 均为181bp, 代表甲烷八叠球菌。

表4 采用限制性内切酶Msp I产生的细菌片段构建克隆文库的16S rRNA基因系统发育关系(富集培养体系)
铁还原菌是一类在代谢过程中以Fe(III)为外在电子受体, 把Fe(III)还原成Fe(II)的微生物, 其介导的过程是自然界中Fe(III)还原的主要途径[26]。厌氧条件下, 它可以乙酸、甲酸、琥珀酸等为电子供体、Fe(III)为末端电子受体, 还原多种有毒重金属、降解利用有机和无机污染物[27-28]。可能因为水分条件变化引起的土壤盐分及电子受体和供体含量的变化, 对铁还原菌群落结构产生影响。不同水分条件芦苇湿地土壤样品经过铁还原富集培养形成不同的铁还原菌群落结构, 说明芦苇湿地土壤铁还原菌对水分胁迫做出选择, 以适应环境条件的变化。可能由于在自然环境中甲烷八叠球菌属能够与铁还原菌()形成团聚体[18], 能够进行直接种间电子传递[29], 所以在铁富集培养系统中更占优势。
由图5可知, 在整个铁还原菌富集培养期间中(0~30 d), 对照(CK)处理Fe(II)含量保持稳定, 而淹水与非淹水芦苇湿地样品Fe(II)含量均呈明显逐渐上升趋势。在培养的第5天, WP样品Fe(II)含量上升至6.0 mmol/L, 之后逐渐上升至第30天的47.36 mmol/L; FP样品Fe(II)含量在培养的第5天仅上升了2.99 mmol/L, 之后呈明显上升趋势, 并且在培养的10~20 d与WP样品差异不明显, 到培养的第30天, Fe(II)含量为39.32 mmol/L, 明显低于WP样品的Fe(II)含量。
CK. 对照; FP. 淹水芦苇湿地; WP. 非淹水芦苇湿地
CK. Control; FP. Flooded reed wetlands; WP. Non-flooded reed wetlands
侯翠翠等[30]研究发现, 水位增高会抑制常年淹水湿地土壤微生物活性, 水位是影响湿地微生物活性的首要环境因素, 水分增加对微生物活性具有明显抑制作用。本研究中非淹水芦苇湿地样品的Fe(II)生成量较高于淹水芦苇湿地样品, 说明不同水分条件芦苇湿地异化铁还原菌的Fe还原能力具有差异, 长期淹水环境改变了铁还原菌群落结构, 降低了铁还原菌活性。此外, 淹水环境引起的土壤盐度上升也可能是影响铁还原菌还原能力的重要因素。
3 结论
黄河三角洲常年淹水与非淹水芦苇湿地表层土壤微生物群落结构发生明显变化, 说明湿地土壤微生物群落结构与植物对水分条件的响应具有相似性, 同样对环境条件的变化做出响应。常年淹水芦苇湿地主要优势细菌和古菌分别为铬还原菌属、纤维单胞菌属、鞘脂单胞菌属、假单胞菌属和甲烷杆菌属、甲烷八叠球菌属; 而纤纤单胞菌属、食酸菌属、地杆菌属、硫杆菌属和甲烷八叠球菌属分别为非淹水芦苇湿地主要优势细菌和古菌。
非淹水芦苇湿地样品铁还原能力略高于淹水芦苇湿地样品, 但不显著, 说明常年淹水对铁还原菌活性有一定的抑制作用。铁还原菌主要优势菌在淹水与非淹水芦苇湿地中同样存在群落结构差异。副球菌属、地杆菌属、铬还原菌属和硫单胞菌属为淹水芦苇湿地主要优势铁还原细菌, 而地杆菌属和固氮螺菌属在非淹水芦苇湿地富集样品中占主要优势。
[1] 叶翔, 王爱军, 马牧, 等. 高强度人类活动对泉州湾滨海湿地环境的影响及其对策[J]. 海洋科学, 2016, 40(1): 94-100. Ye Xiang, Wang Aijun, Ma Mu, et al. Effects of high-intensity human activities on the environment variations of coastal wetland in the Quanzhou Bay, China[J]. Marine Sciences, 2016, 40(1): 94-100.
[2] Macdonald D J, Findlay A J, Mcallister S M, et al. Using in situ voltammetry as a tool to identify and characterize habitats of iron-oxidizing bacteria: from fresh water wetlands to hydrothermal vent sites[J]. Environmental Science Processes & Impacts, 2014, 16(9): 2117-2126.
[3] Oorschot M V, Gaalen N V, Maltby E, et al. Experimental manipulation of water levels in two French riverine grassland soils[J]. Acta Oecologica, 2000, 21(1): 49-62.
[4] Kraigher B, Stres B, Hacin J, et al. Microbial activity and community structure in two drained fen soils in the Ljubljana Marsh[J]. Soil Biology & Biochemistry, 2006, 38(9): 2762-2771.
[5] Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities: phospholipid fatty acid profiles and substrate utilization patterns[J]. Microbial Ecology, 1998, 35(3): 265-278.
[6] 刘岳燕, 姚槐应, 黄昌勇. 水分条件对水稻土微生物群落多样性及活性的影响[J]. 土壤学报, 2006, 43(5): 828-834. Liu Yueyan, Yao Huaiying, Huang Changyong. Influence of soil moisture regime on microbial community diversity and activity in a paddy soil[J]. Acta Pedologica Sinica, 2006, 43(5): 828-834.
[7] Peralta A L, Ludmer S, Kent A D. Hydrologic history influences microbial community composition andnitrogencycling under experimental drying/wetting treatments[J]. Soil Biology & Biochemistry, 2013, 66(11): 29-37.
[8] Unger I M, Kennedy A C, Muzika R M. Flooding effects on soil microbial communities[J]. Applied Soil Ecology, 2009, 42(1): 1-8.
[9] 牛佳, 周小奇, 蒋娜, 等. 若尔盖高寒湿地干湿土壤条件下微生物群落结构特征[J]. 生态学报, 2011, 31(2): 474-482. Niu Jia, Zhou Xiaoqi, Jiang Na, et al. Characteristics of soil microbial communities under dry and wet condition in Zoigealpine wetland[J]. Acta Ecological Sinica, 2011, 31(2): 474-482.
[10] 崔保山, 赵欣胜, 杨志峰, 等. 黄河三角洲芦苇种群特征对水深环境梯度的响应[J]. 生态学报, 2006, 26(5): 1533-1541. Cui Baoshan, Zhao Xinsheng, Yang Zhifeng, et al. The response of reed community to the environment gradient of water depth in the Yellow River Delta[J]. Acta Ecological Sinica, 2006, 26(5): 1533-1541.
[11] Xi J, Song Y, Xing S, et al. The characteristics and succession law of ecosystem in the Yellow River Delta area[J]. Journal of Northeast Forestry University, 2002, 30(6): 111-114.
[12] Toyama T, Nishimura Y, Ogata Y, et al. Effects of plantingon nitrogen removal, microbial nitrogen cycling, and abundance of ammonia-oxidizing and denitrifying microorganisms in sediments[J]. Environmental Technology, 2016, 37(4): 478-485.
[13] 艾超, 孙静文, 王秀斌, 等. 植物根际沉积与土壤微生物关系研究进展[J]. 植物营养与肥料学报, 2015, 5: 1343-1351. Ai Chao, Sun Jingwen, Wang Xiubin, et al. Advances in the study of the relationship between plant rhizodeposition and soil microorganism[J]. Journal of Plant Nutrition and Fertilizer, 2015, 5: 1343-1351.
[14] 管博, 栗云召, 夏江宝, 等. 黄河三角洲不同水位梯度下芦苇植被生态特征及其与环境因子相关关系[J]. 生态学杂志, 2014, 33(10): 2633-2639. Guan Bo, Li Yunzhao, Xia Jiangbao, et al. Ecological characteristics ofvegetation at different water table levels and their relation to environmental factors in the Yellow River Delta[J]. Chinese Journal of Ecology, 2014, 33(10): 2633-2639.
[15] Vretare V, Weisner S E B, Strand J A, et al. Phenotypic plasticity inas a functional response to water depth[J]. Aquatic Botany, 2001, 69(2-4): 127-145.
[16] Lovley D R, Phillips E J. Organic matter mineralization with reduction of ferric iron in anaerobic sediments[J]. Applied and Environmental Microbiology, 1986, 51(4): 683-689.
[17] 中国科学院南京土壤研究所编. 土壤理化分析[M]. 上海: 科学技术出版社, 1978. Institute of Soil Science, Chinese Academy of Sciences. Soil Agricultural Chemistry Analysis[M]. Shanghai: Science and Technology Press, 1978.
[18] Zheng S, Zhang H, Li Y, et al. Co-occurrence ofandin an iron (III)-reducing enrichment culture[J]. Frontiers in Microbiology, 2015, 6: 941.
[19] Tian Y, Xiong M, Song G. Restoration succession of wetland soils and their changes of water and nutrient in Ruoergai Plateau[J]. Chinese Journal of Ecology, 2005, 24(1): 21-25.
[20] Wardle D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil[J]. Biological Reviews, 2008, 67(3): 321-358.
[21] Hu Y, Wang L, Tang Y, et al. Variability in soil microbial community and activity between coastal and riparian wetlands in the Yangtze River estuary-Potential impacts on carbon sequestration[J]. Soil Biology & Biochemistry, 2014, 70: 221-228.
[22] Liu F H, Lin G H, Gao G, et al. Bacterial and archaeal assemblages in sediments of a largeshallow freshwater lake, Lake Taihu, as revealed by denaturing gradient gel electrophoresis[J]. Journal of Applied Microbiology, 2009, 106(3): 1022-1032.
[23] Ligi T, Truu M, Truu J, et al. Effects of soil chemical characteristics and water regime on denitrification genes (S,K, andZ) abundances in a created riverine wetland complex[J]. Ecological Engineering, 2013, 72: 47-55.
[24] 张洪霞, 肖和艾, 谭周进, 等. 添加稻草和选择性抑制剂的红壤旱地和稻田可培养微生物的变化[J]. 农业现代化研究, 2011, 32(2): 248-252. Zhang Hongxia, Xiao Heai, Tan Zhoujin, et al. Changes of culturable microorganisms in upland and paddy red soils following rice straw and selective inhibitors amendments[J]. Research of Agricultural Modernization, 2011, 32(2): 248-252.
[25] Chowdhury T R, Mitsch W J, Dick R P. Seasonal methanotrophy across a hydrological gradient in a freshwater wetland[J]. Ecological Engineering, 2014, 72: 116-124.
[26] Lovley D R, Holmes D E, Nevin K P. Dissimilatory Fe (III) and Mn (IV) reduction[J]. Advances in Microbial Physiology, 2004, 49: 219-286.
[27] Rotaru D E H, Franks A E, Orellana R, et al.: the microbe electric’s physiology, ecology, and practical applications[J]. Advances in Microbial Physiology, 2011, 59: 1.
[28] 刘洪艳, 王红玉, 谢丽霞, 等. 海洋沉积物中一株铁还原细菌分离及Fe(III)还原性质[J]. 海洋科学, 2016, 40(3): 65-70. Liu Hongyan, Wang Hongyu, Xie Lixia, et al. Isolation and characterization of Fe(III)-reducing bacteriumsp. KB52 from marine sediment[J]. Marine Sciences, 2016, 40(3): 65-70.
[29] Liu F H, Rotaru A E, Shrestha P M, et al. Promoting direct interspecies electron transfer with activated carbon[J]. Energy & Environmental Science, 2012, 5(10): 8982-8989.
[30] 侯翠翠, 宋长春, 李英臣, 等. 不同水分条件沼泽湿地土壤轻组有机碳与微生物活性动态[J]. 中国环境科学, 2012, 32(1): 113-119. Hou Cuicui, Song Changchun, Li Yingchen, et al. Light fractions of soil organic carbon and microbial activity dynamics in marshes under different water conditions[J]. China Environmental Science, 2012, 32(1): 113-119.
Effects of water conditions on the diversity of soil microbial communities in the coastal reed wetlands
ZHANG Hong-xia1, 2, ZHENG Shi-ling1, WEI Wen-chao1, 2, WANG Bing-chen1, 2, WANG Ou-mei3, LIU Fang-hua1
(1. Key Laboratory of Coastal Biology and Biological Resources Utilization, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Binzhou Medical University, Yantai 264003, China)
River-sea waterinteractions in coastal wetlands dramatically affect soil redox potential and cause variations in nutrient elements. In this study, we analyzed the changes in physicochemical properties of soil, diversity in the microbial community, and the Fe(III) reduction activity of microorganisms in reed wetlands of the Yellow River Delta under different water conditions. The results showed that the salinity, pH value, and concentrations of organic carbon, total nitrogen, and Fe(II) in the soil were higher in the flooded reed wetlands as compared with the ammonium concentration. The genera,,andwere the dominated bacteria in flooded reed wetlands, whereasandwere the dominant archaea. Further, the dominated bacteria and archaea in the non-flooded reed wetlands were,,,and, respectively. A shift in the iron-reducing bacterial community structure was also observed in the enrichment samples from flooded and non-flooded reed wetlands.,,andwere the dominant iron-reducing bacteria in the flooded reed wetlands, and the dominant genera of iron-reducing bacteria in the non-flooded reed wetlands wereand. The diversity of soil bacteria, archaea, and iron-reducing bacteria was higher in the flooded reed wetlands. The Fe(III) reduction activity of iron-reducing bacteria in the reed wetlands was lessened to a certain extent by perennial flooded conditions.
water condition; reed wetlands; microbial community; iron-reducing bacteria; diversity
(本文编辑: 谭雪静)
[General Program of National Natural Science Foundation of China, No. 41371257, 41573071; Young Scientists Fund of National Natural Sci ence Foundation of China, No. 41401285, 31600370; The Key Program of the Chinese Academy of Sciences, No. KZZD-EW-14; The Key Research Project of Frontier Science of Chinese Academy of Sciences, No. QYZDJ-SSW-DQC015; Young Taishan Scholars Program of Shandong Province, No. tsqn20161054]
Oct. 18, 2016
Q936
A
1000-3096(2017)05-0144-09
10.11759//hykx20161018001
2016-10-18;
2017-03-22
国家自然科学基金面上项目(41371257、41573071); 国家自然科学基金青年项目(41401285、31600370); 中国科学院重点部署项目(KZZD-EW-14); 中国科学院前沿科学重点研究项目(QYZDJ-SSW- DQC015); 泰山学者青年专家项目(tsqn20161054)
张洪霞(1985-), 女, 山东费县人, 博士研究生, 主要从事滨海湿地微生物生态研究, E-mail: hxzhang@yic.ac.cn; 刘芳华, 通信作者, 研究员, 电话: 0535-2109268, E-mail: fhliu@yic.ac.cn; 王欧美, 通信作者, 副教授, 电话: 0535-6913374, E-mail: ziou79@hotmail.com
