酵母双杂交筛选小麦TaMBD2互作蛋白
2017-09-01杨艳敏侯江涛孟凡荣
凌 娜,杨艳敏,侯江涛,孟凡荣
(1.商丘学院 风景园林学院,河南 商丘 476000; 2.河南农业大学 生命科学学院,河南 郑州 450002)
酵母双杂交筛选小麦TaMBD2互作蛋白
凌 娜1,杨艳敏1,侯江涛1,孟凡荣2*
(1.商丘学院 风景园林学院,河南 商丘 476000; 2.河南农业大学 生命科学学院,河南 郑州 450002)
为探讨小麦甲基结合域蛋白(TaMBD2)在植物生长发育过程中的调控功能,以TaMBD2基因的全长cDNA为模板,构建诱饵载体pGBKT7-TaMBD2,利用酵母双杂交系统从小麦cDNA文库中筛选TaMBD2互作蛋白。结果共筛选到91个菌斑显蓝色的克隆,对其进行菌液PCR检测并测序,然后在NCBI上进行BLAST比对分析,共获得8个可能与TaMBD2互作的蛋白,分别为二磷酸核苷激酶(NDPK)、ENTH结构域蛋白、SIAN蛋白、Agenet结构域蛋白、C2H2型锌指蛋白、磷酸激酶和2个假定蛋白,其中最有可能的TaMBD2互作蛋白为NDPK。这些候选蛋白主要参与细胞信号传导、抗逆、能量代谢和蛋白质运输等。其中,检测结果中参与植物抗逆胁迫的蛋白质为主要互作蛋白,所占比例为54.9%;参与蛋白质运输的互作蛋白所占比例为25.3%,其余互作蛋白所占比例较小。因此,推测TaMBD2可能主要参与植物对干旱、低温和高盐等非生物胁迫逆境的响应及调控。
小麦; 酵母双杂交; TaMBD2; 互作蛋白
DNA甲基化是生物体普遍存在的一种基因修饰现象,其与基因表达调控等密切相关[1]。有关其调控机制的研究表明,甲基化DNA能特异结合甲基结合域蛋白(methy-binding domain protein,MBD)等反式作用因子,从而参与植物生长发育过程中依赖于DNA 甲基化的基因的表达调控[2]。
目前,关于植物MBD的研究表明,拟南芥AtMBD11被沉默表达后,植物体会发生一系列的表型变化,如叶片锯齿状、开花延迟以及花器易位等[3]。MBD等调控蛋白必须与其他调控因子共同作用才能行使其生物学功能。Scebba等[4]利用酵母双杂交系统筛选发现,拟南芥AtMBD7与AtPRMT11存在互作关系,AtPRMT11可以对AtMBD7进行翻译后甲基化修饰。Yano等[5]研究发现,在细胞分裂期间AtRNA2协助AtMBD7结合到染色质上并维持染色质结构。
随着植物生物化学与分子生物学的发展,更多植物MBD基因将会被分离鉴定,小麦是重要的粮食作物,探讨MBD在小麦生长发育过程中的调控机制具有重要意义。Li等[6]以小麦为材料首次克隆得到了6个小麦MBD基因,命名为TaMBD1-TaMBD6。孟凡荣等[7]利用RACE技术获得了TaMBD2的全长cDNA序列,并通过RT-PCR分析发现,TaMBD2基因在小麦不同叶龄叶片及种子形成过程中差异表达。目前,有关TaMBD2的具体功能研究还未见报道。为此,利用酵母双杂交系统从小麦 cDNA 文库中初步筛选TaMBD2的互作蛋白,为探讨TaMBD2在小麦生长发育中的生物学功能及调控机制积累重要资料。
1 材料和方法
1.1 试验材料
酵母菌株Y2HGold、Y187和酵母表达载体pGBKT7-BD、pGBKT7-AD及酵母转化试剂盒、YPDA、各种营养缺陷型培养基均购于Clontech公司,大肠杆菌DH5α为国家小麦工程技术研究中心保存,DNA连接酶、限制性内切酶均购自TaKaRa公司。
1.2 试验方法
1.2.1 酵母双杂交诱饵载体pGBKT7-TaMBD2的构建 根据已知的TaMBD2基因全长cDNA序列,设计带有NcoⅠ和SalⅠ酶切位点的引物TaMBD2-1(5′-CTTGCAGAATCCATGGACAG-3′)和TaMBD2-2(5′-TCGATGTCGACCACTGGGTA-3′),以实验室保存的pBS-TaMBD2质粒为模板进行PCR扩增,回收目的片段,连接pGEM-T载体并转化大肠杆菌DH5α感受态细胞,PCR扩增鉴定阳性克隆,然后提取质粒;利用内切酶NcoⅠ和SalⅠ双酶切重组质粒pGEM-TaMBD2和酵母表达载体pGBKT7-BD,纯化产物经连接后转化DH5α感受态细胞,阳性克隆经PCR扩增及酶切鉴定正确后,进行测序分析。
1.2.2 Western blot检测诱饵蛋白TaMBD2的表达 将pGBKT7-TaMBD2 诱饵载体转化到Y2HGold酵母感受态细胞中,30 ℃培养 3 d,挑取单菌落利用酵母表达载体pGBKT7-BD的通用引物pGBKT7-1(5′-TCATCGGAAGAGAGTAGT-3′)和pGBKT7-2(5′-GAGTCACTTTAAAATTTGTAT-3′)进行PCR鉴定,鉴定正确的单克隆接种于 5 mL 的液体培养基 SD/-Trp中,30 ℃、220 r/min培养至OD600为0.4~0.6,采用Urea/SDS法提取酵母蛋白质,进行Western blot检测。
1.2.3 酵母双杂交诱饵蛋白TaMBD2的毒性和诱饵载体pGBKT7-TaMBD2的自激活检测 将诱饵载体pGBKT7-TaMBD2和空载体pGBKT7-BD分别转化酵母Y2HGold感受态细胞。转化产物分别涂布在SD/-Trp、SD/-Trp/X-α-Gal(SD/X)、SD/-Trp/X-α-Gal/AbA(SD/X/A)培养基上,30 ℃培养3 d,观察平板上的菌斑生长情况以判断诱饵载体在酵母细胞中是否有自激活作用和诱饵蛋白是否有毒性作用。
1.2.4 酵母双杂交筛选TaMBD2互作蛋白 从含有pGBKT7-TaMBD2 的酵母 Y2HGold培养平板SD/-Trp上挑取1个单克隆于 50 mL SD/-Trp培养基中,30 ℃、220 r/min培养至OD600达到0.8,吸取4~5 mL培养液和1 mL Y187 小麦 cDNA 文库置于50 mL含有50 μg/mL 卡那霉素的2×YPDA液体培养基中,30 ℃、50 r/min培养24 h,用相差显微镜(40×)检测培养液,观察合子的出现,将培养液分别涂布 SD/-Trp平板5~10个、SD/-Leu平板 5~10个、SD/-Leu/-Trp(DDO)平板 5~10个、SD/-Ade/-His/-Leu/-Trp(QDO)平板50~60个,30 ℃培养3~5 d,从QDO平板上挑选白色菌斑划线培养于SD/-Ade/-His/-Leu/-Trp/X-α-Gal/AbA(QDO/X/A )平板上,30 ℃培养3~5 d。用酵母表达载体pGBKT7-AD通用性引物pGADT7-1 (5′-CTATTCGATGATGAAGATACCCCACCAAACCCA-3′)和pGADT7-2(5′-GTGAACTTGCGGGGTTTTTCAGTATCTACGATT-3′)对蓝色菌斑进行菌液 PCR 扩增,测序,在NCBI上对TaMBD2互作蛋白序列用BLAST进行比对分析。
2 结果与分析
2.1 pGBKT7-TaMBD2的构建和鉴定
以pBS-TaMBD2质粒为模板,TaMBD2-1和TaMBD2-2为引物进行PCR扩增,在目的基因中引入NcoⅠ和SalⅠ酶切位点,然后连接pGEM-T载体构建pGEM-TaMBD2质粒载体并转化大肠杆菌DH5α感受态细胞,挑选阳性克隆进行PCR鉴定,获得了约为991 bp 的DNA 片段(图1A)。经测序分析显示,pGEM-TaMBD2载体中TaMBD2基因序列无异常且引入了NcoⅠ和SalⅠ酶切位点。
利用NcoⅠ和SalⅠ双酶切pGEM-TaMBD2和 pGBKT7 载体,酶切产物回收并用 T4连接酶连接,构建重组载体pGBKT7-TaMBD2,转化大肠杆菌 DH5α感受态细胞,挑取单克隆进行培养,用引物pGBKT7-1和pGBKT7-2进行阳性鉴定(图1B),将阳性菌液送至测序公司进行测序,提取阳性质粒,用HindⅢ酶切后,获得大小约为1 498、1 881、4 938 bp的3个片段(图1C),证明诱饵载体pGBKT7-TaMBD2构建成功。
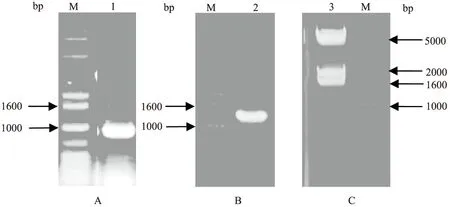
A.pGEM-TaMBD2菌液PCR鉴定结果;B.pGBKT7-TaMBD2菌液PCR鉴定结果;C.pGBKT7-TaMBD2质粒 Hind III酶切结果;M.1 kb plus DNA ladder图1 pGEM-TaMBD2和诱饵载体pGBKT7-TaMBD2的鉴定结果
2.2 Western blot 检测诱饵蛋白TaMBD2的表达
采用Urea/SDS法分别提取转化pGBKT7-TaMBD2、阳性对照pGBKT7-AtMBD7的酵母细胞和未转化诱饵载体(空白对照)的酵母细胞总蛋白质,Western blot 检测结果显示,pGBKT7-TaMBD2能够正常表达目的蛋白TaMBD2,且目的蛋白约为57 ku(图2)。

M.蛋白质Marker;1.阳性对照pGBKT7-AtMBD7;2.空白对照;3.pGBKT7-TaMBD2图2 Western blot检测诱饵蛋白TaMBD2的表达情况
2.3 诱饵蛋白毒性和诱饵载体自激活检测
将空载体pGBKT7-BD和pGBKT7-TaMBD2分别转化酵母Y2HGold感受态细胞,转化产物涂布在SD/-Trp培养基上,30 ℃培养3 d,结果(图3A)显示,含pGBKT7-TaMBD2载体酵母的培养平板上长出的菌斑与含空载体酵母的培养平板上长出的菌斑大小相差不多,说明诱饵蛋白TaMBD2对Y2HGold酵母细胞没有毒性。
将诱饵载体pGBKT7-TaMBD2转化到酵母Y2HGold感受态细胞中,将100 μL转化体系稀释10倍,分别涂布在 SD/-Trp、SD/X、SD/X/A培养基上,30 ℃倒置培养3 d,结果(图3B)显示,在SD/-Trp 和SD/X上长出的菌斑为白色,没有蓝色菌斑出现,而在SD/X/A上没有任何菌斑生长,说明诱饵载体在Y2HGold酵母细胞中不能自发激活报告基因的表达。
2.4 TaMBD2互作蛋白的筛选
将含有pGBKT7-TaMBD2 的酵母Y2HGold与含有小麦 cDNA 文库的酵母Y187进行杂交。取杂交产物200 μL涂布在直径为150 mm的QDO平板上,共涂布58个平板,30 ℃培养3 d后长出64个白色菌斑(图4),30 ℃继续培养至5 d,共长出118个白色菌斑,最后2 d长出的菌斑较小,直径在0.5~1.0 mm。

A.诱饵蛋白毒性检测;B.诱饵载体自激活检测;1—6.SD/-Trp 培养基;7.SD/X培养基;8.SD/X/A培养基图3 诱饵蛋白毒性和诱饵载体自激活检测

图4 SD/-Ade/-His/-Leu/-Trp筛选
将118个候选克隆在QDO/X/A培养基上进一步筛选(图5),30 ℃培养3 d后,其中91个长出的菌斑为蓝色,说明筛选到互作蛋白,而且蓝色菌斑的颜色深浅程度不同,说明互作蛋白的相互作用强度可能存在差异;另外有17个长出白色菌斑,10个基本未长出菌斑,说明没有筛选到互作蛋白。

图5 SD/-Ade/-His/-Leu/-Trp/X-α-Gal/AbA筛选
对91个菌斑为蓝色的克隆进行菌液 PCR 检测(图 6),PCR扩增出的目的条带介于900~3 000 bp,回收目的条带,用连接酶与T载体连接,转化大肠杆菌 DH5α感受态细胞,测序。将测得序列在NCBI网站上采用BLAST进行比对分析,去除重复序列后,共获得 8个与TaMBD2互作的候选蛋白(表1),即二磷酸核苷激酶(nucleoside diphosphate kinase,NDPK)、ENTH结构域蛋白、SIAN蛋白、Agenet结构域蛋白、C2H2型锌指蛋白、磷酸激酶和一些假定蛋白。

M.1 kb plus DNA ladder;1—12.SD/-Ade/-His/-Leu/-Trp/X-α-Gal/AbA平板上显蓝菌斑的菌液PCR鉴定结果图6 TaMBD2互作蛋白的菌液PCR鉴定结果

表1 TaMBD2互作蛋白序列分析结果
TaMBD2最有可能的互作蛋白为NDPK(NP_192839.1),其在91个候选蛋白序列中出现了50次。NDPK是生物体中广泛存在的一类酶,存在于细胞质、叶绿体和线粒体中,主要功能是在细胞的新陈代谢过程中维持ATP和其他三磷酸核苷(NTPs)之间的平衡,并通过催化NDP和NTP之间磷酸基的转移反应来维持细胞内NTP浓度。近年来的研究发现,NDPK可以调节细胞增殖、分化、发育、凋亡,在高盐和低温等非生物胁迫响应中发挥重要作用;还可以介导细胞内吞过程,激活G蛋白活性,参与多条信号转导途径[8]。
保守结构域分析发现,有23个候选蛋白序列含有典型的ENTH结构域,其由位于N末端的大约150个氨基酸通过α-螺旋形成球状结构。ENTH结构域蛋白在植物中广泛分布,参与招募泛素化蛋白结合在特异位点。
SIAN蛋白(XP_002881813.1)含有305个氨基酸残基,第171—299个氨基酸是一个SINA结构域。E3是泛素化降解中重要的泛素连接酶,E3连接酶就是典型的SINA结构域蛋白,其协同E2将泛素蛋白连接到底物蛋白上,使底物蛋白通过蛋白酶途径降解来调控这一途径。
Agenet结构域蛋白(NP_191789.2)含722个氨基酸残基,保守结构域分析发现,其含有4个邻近的Agenet结构域。其主要功能为特异结合RNA,参与DNA损伤应答的早期反应。
C2H2型锌指蛋白是一类含有一到多个由大约30个氨基酸组成的“手指”型多肽结构的蛋白,是真核生物中具有重要调控作用的一类核酸结合蛋白,其可以通过指型结构的α-螺旋与DNA双螺旋大沟上的特异碱基序列接触,进而与DNA稳定结合。
此外,TaMBD2互作的候选蛋白中还有1个磷酸激酶,其介导微管的聚合和解聚过程中转磷酸作用;2个假设蛋白,功能推测其分别为假设磷酸载体蛋白和假设转运蛋白,参与磷酸转移和促使氨基酸等多肽物质在内膜之间的转运等。
综上,这些TaMBD2互作的候选蛋白主要参与细胞信号传导、抗逆、能量代谢和蛋白运输等。其中,参与植物抗逆胁迫的蛋白为主要互作蛋白,所占比例为54.9%;参与蛋白运输的互作蛋白所占比例为25.3%;其余互作蛋白所占比例较小,其中还有10.2%的假设蛋白。
3 结论与讨论
蛋白质是体内多种生命活动都必须依赖的物质基础,研究生物体内蛋白质与核酸、蛋白质与蛋白质间的相互作用,有助于揭示生命的本质。Fields等[9]在1989年创立了能迅速、灵敏地研究蛋白质相互作用的酵母双杂交技术。本研究以小麦TaMBD2为诱饵蛋白,利用酵母双杂交筛选小麦 cDNA 文库,得到与其互作的候选蛋白,为进一步研究TaMBD2在小麦生长发育过程中的作用机制奠定基础。
孟凡荣等[7]利用RT-PCR研究发现,TaMBD2基因在叶片和种子的不同发育时期差异表达,推断该基因在小麦生长发育及种子形成过程中发挥着某种调控功能。拟南芥MBD家族的13 个成员AtMBD1—AtMBD13可以通过招募染色体修饰因子、去乙酰化酶和组蛋白甲基转移酶等抑制转录复合体,从而引起转座子基因沉默等表达抑制[10]。
本试验筛选到与TaMBD2互作的主要候选蛋白有NDPK、ENTH结构域蛋白、SIAN蛋白、Agenet结构域蛋白和C2H2型锌指蛋白,其中最有可能的TaMBD2互作蛋白为NDPK。NDPK蛋白可能在高盐和低温胁迫响应中发挥重要作用[8]。Kalthoff等[11]推测ENTH结构域蛋白作用方式可能是使多个作用因子聚合在一起。Riezman[12]研究发现,SIAN蛋白参与泛素化途径中招募泛素化蛋白结合在特定位点。Xie等[13]研究发现,拟南芥SINA5结合转录因子NAC1影响侧根形成。拟南芥SINA2作用于转录因子AtRAP2.2,参与胡萝卜素的形成[14]。拟南芥STZ基因(C2H2型锌指蛋白)参与冷和高盐胁迫应答[15]。综上可见,TaMBD2互作候选蛋白大多参与植物非生物胁迫的应答。
植物体在应对温度、干旱、盐渍、高压等环境胁迫时,为了适应环境变化会诱导某些能够抵抗逆境的基因表达。Kovarik等[16]和Steward等[17]发现,烟草和玉米受到冷胁迫后,其基因组甲基化水平都有所下降,由此看来,植物在生长发育过程中对环境变化的适应与甲基化水平密切相关。MBD作为能特异结合甲基结合域的反式作用因子,也必将参与DNA甲基化在植物应答非生物胁迫中的基因表达调控。因此,推测TaMBD2可能主要参与植物对干旱、低温和高盐等非生物胁迫逆境的响应及调控,但具体的作用机制及生物学功能有待进一步研究。
[1] Finnegan E J,Genger R K,Peacock W J,etal.DNA methylation in plants[J].Annual Review of Plant Physiology and Plant Molecular Biology,1998,49:223-247.
[2] Jorgensen H F,Bird A.MeCP2 and other methyl-CpG binding proteins[J].Ment Retard Dev Disabil Res Rev,2002,8:87-93.
[3] Berg A,Meza T J,Mahic M,etal.Ten members of theArabidopsisgene family encoding methyl-CpGbinding domain proteins are transcriptionally active and at least one,AtMBD11,is crucial for normal development[J].Nuc Acids Res,2003,31(5):5291-5304.
[4] Scebba F,De Bastiani M,Bernacchia G,etal.PRMT11:A new Arabidopsis MBD7 protein partner with arginine methyltransferase activity[J].The Plant Journal,2007,52(2):210-222.
[5] Yano A,Kodama Y,Koike A,etal.Interaction between methyl CpG-binding protein and ran GTPase during cell division in tobacco cultured cells[J].Annals of Botany,2006,98(6):1179-1187.
[6] Li Y C,Meng F R,Yin J,etal.Isolation and comparative expression analysis of six MBD genes in wheat[J].Biochimica Biophysica Acta,2008,1779(2):90-98.
[7] 孟凡荣,李占英,凌娜,等.TaMBD2基因cDNA全长的克隆及其在小麦叶片和种子中的表达[J].麦类作物学报,2010,30(1):6-10.
[8] Im Y J,Kim J I,Shen Y,etal.Structural analysis ofArabidopsisthaliananucleoside diphosphate kinase-2 for phytochrome-mediated light signaling [J].Journal of Molecular Biology,2004,343(3):659-670.
[9] Fields S,Song O.A novel genetic system to detect protein interactions[J].Nature,1989,340:245-246.
[10] Zemach A,Grafi G.Characterization ofArabidopsisthalianamethyl-CpG-binding domain(MBD)proteins[J].Plant J,2003,34:565-572.
[11] Kalthoff C,Alves J,Urbanke C,etal.Unusual structural organization of the endocytic proteins AP180 and epsin 1[J].Biol Chem,2002,277(10):8209-8216.
[12] Riezman H.Cell biology:The ubiquitin connection[J].Nature,2002,416(2):451-455.
[13] Xie Q,Guo H S,Dallman G,etal.SINAT5 promotes ubiquitin-related degradation of NAC1 to attenuate auxin signals[J].Nature,2002,419:167-170.
[14] Welsch R,Maass D,Voegel T,etal.Transcription factor RAP2.2.and its interacting partner SINAT2:Stable elements in the carotenogenesis ofArabidopsisleaves[J].Plant Physiol,2007,145(3):1073-1085.
[15] Sakamoto H,Araki T,Meshi T,etal.Expression of a subset of theArabidopsisCys(2)/His(2)-type zinc-finger protein gene family under water stress[J].Gene,248(1/2):23-30.
[16] Kovarik A,Koukalova B,Bezdek M,etal.Hypermethylation of tobacco heterochromatic loci in response to osmotic stress[J].Theoretical and Applied Genetics,1997,95(1):301-306.
[17] Steward N,lto M,Yamaguchi Y,etal.Periodic DNA methylation in maize nucleosomes and demethylation by environmental stress[J].Journal of Biological Chemistry,2002,277:37741-37746.
Screening of Interacted Proteins of TaMBD2 in Wheat by Yeast Two-hybrid System
LING Na1,YANG Yanmin1,HOU Jiangtao1,MENG Fanrong2*
(1.College of Landscape Architecture,Shangqiu University,Shangqiu 476000,China;2.College of Life Science,Henan Agricultural University,Zhengzhou 450002,China)
In order to understand more regulatory functions of methyl-binding domain protein TaMBD2 during the growth and development in wheat,bait vector pGBKT7-TaMBD2 was constructed with the full length cDNA ofTaMBD2 gene as template,and the interacted proteins of TaMBD2 from wheat cDNA library were screened by yeast two-hybrid system.The result showed that a total of 91 blue clones were screened,which were analyzed through PCR and homology analysis using the BLAST in NCBI,and eight possible interacted proteins of TaMBD2 were obtained,which were nucleoside diphosphate kinase(NDPK),epsin N-terminal homology domain-containing protein,seven in absentia family protein,Agenet domain-containing protein,zinc finger C2H2type family protein,phosphate kinase and two hypothetical proteins.The most likely interacted protein of TaMBD2 was NDPK.These candidate proteins were related to mediate cell signal transduction,stress resistance,energy metabolism and protein transport,etc.Among them,the proteins involved in resistance to plant stress were the main interacted protein,the proportion was 54.9%;the proportion of proteins participated in protein transport was 25.3%,and the proportion of the rest interacted proteins was smaller.Therefore,TaMBD2 may mainly participate in response and regulation to abiotic stress,such as drought,low temperature and high salt.
wheat; yeast two-hybrid; TaMBD2; interacted proteins
2017-04-10
国家自然科学基金项目(30300195)
凌 娜(1986-),女,河南商丘人,讲师,硕士,主要从事植物遗传育种研究。E-mail:lingnas1985@163.com
*通讯作者:孟凡荣(1973-),女,河南郑州人,教授,博士,主要从事植物表观遗传学研究。 E-mail:mengfanrong73@yahoo.com.cn
S512.1;Q78
A
1004-3268(2017)08-0007-06
