城市再生水中病毒对浮选过程的影响规律
2017-08-31窦培谦孙春宝谷至君北京科技大学北京0008中国劳动关系学院北京00048中国黄金集团公司北京000
窦培谦,寇 珏,孙春宝,谷至君(.北京科技大学,北京 0008;2.中国劳动关系学院,北京 00048;.中国黄金集团公司,北京 000)
城市再生水中病毒对浮选过程的影响规律
窦培谦1,2,寇 珏1,孙春宝1,谷至君3
(1.北京科技大学,北京 100083;2.中国劳动关系学院,北京 100048;3.中国黄金集团公司,北京 100011)
为探讨城市再生水回用于浮选工艺的安全性,以再生水模拟浮选试验和实施吸附、解吸试验分析,研究了城市再生水中病毒在浮选过程中的迁移规律。结果表明:再生水中的病毒能够快速被矿物颗粒吸附,尾矿废水继续回用于浮选流程是安全的,但精矿、中矿、尾矿中吸附了大量的病毒,在特定暴露水平下会对从业人员构成健康风险;矿物颗粒对病毒的不可逆吸附或者灭活是影响再生水中病毒在浮选过程迁移的主要因素,随着pH值升高,病毒-矿物颗粒体系作用能障增大,对病毒的吸附呈下降趋势,矿物颗粒对噬菌体MS2的吸附率低于ΦΧ174,矿物颗粒粒径的减小明显提高了矿物颗粒对病毒的吸附。
再生水;病毒;浮选;迁移;吸附
浮选是目前被普遍采用的一种选矿方法,耗水量很大,但对水质没有严格要求。在广大缺水地区,将城市中水用于耗水量巨大的矿业开发,是充分利用城市再生水,有效利用水资源,降低矿业用水成本的根本途径。满洲里乌努格吐山铜钼矿首次将城市再生水回用到浮选流程中,使用海拉尔再生水和经过臭氧氧化处理后的满洲里再生水,无论是铜钼混合浮选,还是铜钼分离浮选,浮选指标均良好,选矿技术经济指标稳定,在节约用水、保护环境的同时有效降低了浮选用水成本[1]。但是,城市再生水中含有大量的病原微生物,由此引起的疾病传播风险是再生水回用过程中面临的主要问题之一。加拿大、美国等国家的研究表明,回用的污水中已经发现的微生物主要有:细菌、原虫、寄生虫及病毒等[2-3],如沙门氏菌是市政污水中普遍存在的致病菌之一,可能导致伤寒、败血病、急性肠胃炎等[4]。市政污水中还存在志贺氏菌,可能导致痢疾[5]。污水中存在的弧形大肠杆菌曾在1988年引起细菌性痢疾的暴发。尤其是在经历了欧美“军团病”、“贾第虫病”、“隐孢子虫病”和我国“非典”、“禽流感”等大规模病毒传染事件之后,人们对城市再生水回用的卫生安全问题给予特别关注[6-7]。因此研究城市再生水中病原微生物在传播介质中的迁移过程,对再生水的安全回用意义重大。
研究表明,病原微生物在土壤等多孔介质中迁移和存活主要经历了吸附质对病原微生物的吸附和灭活两个过程[8-9],此过程影响因素复杂,吸附质的粒径、化学组成[10-11]、表面性质[12-13]、病原微生物种类、温度[14-15]等都会影响吸附质对病原微生物的吸附和迁移。上述研究多集中在病原微生物与土壤、沙砾等颗粒物之间的相互作用,病原微生物在浮选体系迁移规律鲜有报道,本文通过试验室室内模拟浮选试验和吸附、解吸附试验分析,研究了城市再生水中病毒在浮选过程中的迁移规律及矿物颗粒对病毒的吸附机理。
1 试验材料及试验方法
1.1 矿样
试验所用矿样由中国黄金集团内蒙古矿业公司铜钼矿提供。矿物化学组成见表1。病毒吸附、解吸附试验矿样经手工捶碎、挑选、球磨,磨矿细度为-0.074 mm的占65%,矿样烘干后高压灭菌锅115℃灭菌1 h;城市再生水模拟浮选试验所用矿样无需灭菌处理。
注:* Au 和 Ag 单位( g/t)。
1.2 供试病毒
环境样品中病毒感染剂量低、测定烦琐、价格昂贵,而且在实验室加入大量致病病毒会对人体健康造成极大危害,通常噬菌体是指示病毒的最佳选择,因为噬菌体只能感染特定宿主细菌对人畜没有健康危害,测定相对简单,而且噬菌体跟肠道病毒的大小、形状及表面性质相似。噬菌体MS2和ΦΧ174曾广泛作为指示病毒进行相关研究,MS2是单链F-RNA噬菌体,宿主细菌E.coli(ATCC15597),颗粒大小24 nm,等电点3.9;ΦΧ174是单链DNA噬菌体,宿主细菌E.coli(ATCC13706)颗粒大小27 nm,等电点6.6。噬菌体及宿主细菌来自中国人民解放军总医院,噬菌体经过3次分离纯化后得到浓度107~108PFU/mL的噬菌体悬液,噬菌体计数方法采用双层琼脂平板法以噬菌斑形成单位(plaque forming unit,PFU)表示[16]。
1.3 病毒及矿物颗粒Zeta电位、接触角的测定
用美国Brookhaven公司的Zetaplus90电位仪来测定zeta电位。称取0.5 g矿样于50 mL蒸馏水中,用0.01 mol·L-1NaOH或0.01 mol·L-1HCl调节pH值为2~12,电解质KNO3浓度为0.01 mol·L-1,然后用3~5 mL悬液润洗Zeta电位仪的测定杯,再将测定杯用待测悬液注满,然后小心插入测定电极,使杯内不留气泡,即可开始测定程序。设定每个样品测定5次,取平均值为最终的Zeta电位数据。病毒的Zeta电位测量同上。
接触角采用CA100接触角测定仪测定。将浓度为108PFU/mL噬菌体悬液用生物膜过滤,在室温环境下晾干2 h,平放在盖玻片上,测量时用微量进样器将检测液体垂直滴在生物膜表面,迅速测定接触角值,测量3次取平均值;用台式粉末压片机把铜钼矿样品加压到2.5×104kPa,制成直径20 mm表面光滑的压片,按上述方法测定其接触角。
1.4 城市再生水模拟浮选试验
浮选试验使用XFD型槽式浮选机(3 L),试验用矿样未经灭菌处理,试验用水采用城市再生水,取自北京某污水处理厂二沉池出水,该污水处理厂处理工艺为预处理+循环式活性污泥法(C-TECH)+次氯酸钠消毒工艺。城市再生水中轮状病毒检出频率较高,浓度范围在1~1×103PFU/mL,受到病毒检测水平的限制,病毒的实际浓度可能至少低估了10倍[17-18],为模拟城市再生水中病毒的浓度水平,将二沉池出水在121 ℃、0.105 MPa下灭菌处理2 h,加入一定量的噬菌体悬液,使其浓度为104PFU/mL,按图1所示加药制度,完成三次扫选分别检测浮选泡沫和三次扫选矿浆中的噬菌体浓度。
1.5 病毒吸附试验
取12个50 mL的玻璃离心管,分别加入矿物颗粒3 g,并加入一定浓度的噬菌体悬液10 mL,将上述加入噬菌体悬液后的离心管放置恒温摇床上,以200 r/min振荡,分别在0 min、5 min、10 min、15 min、20 min、30 min、45 min、60 min、75 min、90 min、100 min、120 min后,取其中一个管,4 000 r/min离心2 min,测上清液噬菌体浓度。每个时间点作3个平行,取平均值,并设置只加10 mL噬菌体悬液的离心管作为对照组。
矿物颗粒对病毒的吸附采用式(1)计算。
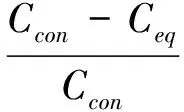
(1)
式中:R为噬菌体吸附率,%;Ccon为吸附平衡时对照组噬菌体浓度,PFU/mL;Ceq为吸附平衡时样品上清液噬菌体浓度,PFU/mL。
1.6 病毒解吸附试验
病毒解吸附试验用来检验矿物颗粒对病毒的吸附为可逆吸附还是不可逆吸附(灭活)[13]。吸附试验完成后,将离心管静置2 h,无菌注射器小心将上清液吸净,加入质量分数为3%牛肉膏提取液(其中含0.04 mol·L-1焦磷酸钠)10 mL,涡旋混合,放入摇床振荡30 min,取上清液测定噬菌体浓度C*。噬菌体回收率公式见式(2)。噬菌体灭活率/不可逆吸附率见式(3)。
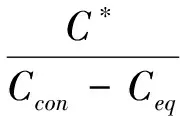
(2)
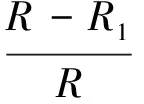
(3)
式中:R1为噬菌体回收率,%;Ccon为吸附平衡时对照组噬菌体浓度,PFU/mL;Ceq 为吸附平衡时样品上清液噬菌体浓度,PFU/mL;C*为提取液噬菌体浓度,PFU·mL-1;R2为噬菌体灭活率/不可逆吸附率,%。
1.7 病毒与矿物颗粒相互作用的扩展XDLVO能量计算
扩展的DLVO理论(XDLVO)是由经典DLVO理论发展而来的,在范德华作用能和静电作用能基础上考虑了疏水作用力能来反应胶体颗粒之间总作用力随分割距离的变化趋势。噬菌体与矿物颗粒之间的总作用能由式(4)来表示,静电作用能ΔGdl(h)由式(5)表示[19]。
ΔGtot(h)=ΔGvdw(h)+ΔGdl(h)+ΔGhyd(h)
(4)
ΔGdl(h)=πεrp
(5)
式中:ε为溶液的介电常数,F·m-1;rp为噬菌体半径,μm;ψp和ψc分别为矿物颗粒和噬菌体的Zeta电位,mv;k为德拜-休克尔长度取值为0.328×1010(I)1/2m-1,I为溶液离子强度,mol/L;h为胶体颗粒之间的距离,nm。
范德华作用能ΔGvdw(h)由式(6)表示[20]。
(6)
式中:A123为有效Hamaker常数,取值7.5×10-21J;λw为特征波长,100 nm。
疏水作用能ΔGhyd(h)由式(7)表示[21]。
(7)
式中θ1、θ2为噬菌体、矿物颗粒接触角。
2 结果与讨论
2.1 城市再生水中病毒在浮选过程中的迁移
城市再生水中病毒在浮选流程中的分布情况如表2所示,试验中铜钼矿经三次扫选过程后,再生水中噬菌体浓度逐级减小,扫选Ⅰ中矿上清液、扫选Ⅱ中矿上清液、尾矿上清液中噬菌体ΦΧ174和 MS2均未检测到,衰减率为100%,但在各级浮选泡沫中均检测到噬菌体。病毒存活试验表明浮选药剂Pj-053、煤油、2号油、钼友、CaO对噬菌体灭活作用较小,在试验条件下,噬菌体ΦΧ174和 MS2浓度分别减少0.01%~0.1%、0.02%~0.2%,且试验中采用对照组浓度来抵消噬菌体自然衰减带来的误差,因此可以推断再生水中的噬菌体的衰减是由矿物颗粒对噬菌体的吸附和灭活引起的。噬菌体能够被矿物颗粒迅速吸附,磨矿过程矿物颗粒已经完成绝大部分噬菌体的吸附。我国再生回用水水质标准中,并未对病毒的浓度指标做出明确规定,根据世界卫生组织发布的水质风险评估指南,再生水中病毒浓度为110 CFU/100L时,其年健康风险值为10-4~10-9处于可接受水平[22]。结合噬菌体的时空分布情况,尾矿废水继续回用于浮选流程是安全的,但精矿、中矿、尾矿吸附了大量的噬菌体,在特定暴露水平下会对从业人员构成健康风险。
矿物颗粒对病毒的吸附是影响再生水中病毒在浮选过程迁移的主要因素,由于再生水水质不稳定,病毒浓度较低,而且化学组分复杂,在一定程度上会对吸附行为造成干扰,为了进一步揭示矿物颗粒对病毒的吸附机理,采用一定浓度的噬菌体悬液和灭菌矿物按照上文1.5节和1.6节中表述的方法进行吸附和解吸附试验,分析pH值、矿物颗粒细度对吸附的影响。
2.2 pH值对病毒吸附的影响
取1 g矿样,放入50 mL离心管,加入噬菌体悬液10 mL,噬菌体浓度6.9×108PFU/mL,温度25℃,0.1 mol·L-1HCl和NaOH调整吸附体系pH值(pH=7.5、9.5),按照上文1.5节、1.6节所述方法进行吸附试验,分析pH值对吸附的影响。
不同pH值条件下矿物颗粒对噬菌体的吸附数据见图2,pH值从7.5增加到9.5,矿物颗粒对噬菌体的吸附能力下降,pH=7.5时,达到吸附平衡后噬菌体MS2和ΦΧ174的衰减分别为1.99-log10PFU/mL、2.15-log10PFU/mL,吸附率分别为98.56%、99.03%;当pH值增加至9.5时,噬菌体MS2、ΦΧ174的衰减有所下降分别为1.23-log10、1.95-log10,吸附率下降为92.6%、98.53%。上述数据表明在pH值为7.5时矿物颗粒对噬菌体的吸附要高于pH=9.5,Zeta电位和扩展DLVO理论可以解释这一现象。如图3所示,在试验条件下,矿物颗粒与噬菌体均带负电荷,两者之间的静电作用力表现为静电斥力,pH值为9.5时,矿物颗粒与噬菌体带更多的负电荷,矿物颗粒与噬菌体之间的静电斥力增大,导致了矿物颗粒与噬菌体之间的吸附能力减弱。与MS2相比,矿物颗粒对噬菌体ΦΧ174吸附率更高,噬菌体MS2等电点为4.0,噬菌体ΦΧ174等电点为6.5,在相同pH值条件下,噬菌体MS2比ΦΧ174带更多的负电荷,而矿物颗粒pH>5的范围内带负电荷,因此矿物颗粒对噬菌体MS2的静电斥力要大于ΦΧ174。此外,作用能结果(图4、表3)表明,噬菌体与矿物颗粒之间的能障随pH值升高而增大,pH值从7.5升高到9.5,噬菌体MS2-矿物颗粒体系作用能障由30.9 KBT升高到1213 KBT,噬菌体ΦΧ174-矿物颗粒体系作用能障由17.7 KBT升高到828 KBT。噬菌体MS2-矿物颗粒体系作用能障高于噬菌体ΦΧ174-矿物颗粒体系,导致了矿物颗粒对噬菌体MS2的吸附率低于ΦΧ174。通过扩展的DLVO理论可以发现,噬菌体与矿物颗粒在0~10 nm的分隔距离范围内遇到斥力,以静电斥力为主,噬菌体-矿物颗粒体系能障越大吸附越弱,当噬菌体跨过作用能障后,吸附于次级小能位置,此时疏水作用力和范德华力对吸附的贡献超过静电斥力,表现为引力,且次级小能绝对值随pH值增加而降低。
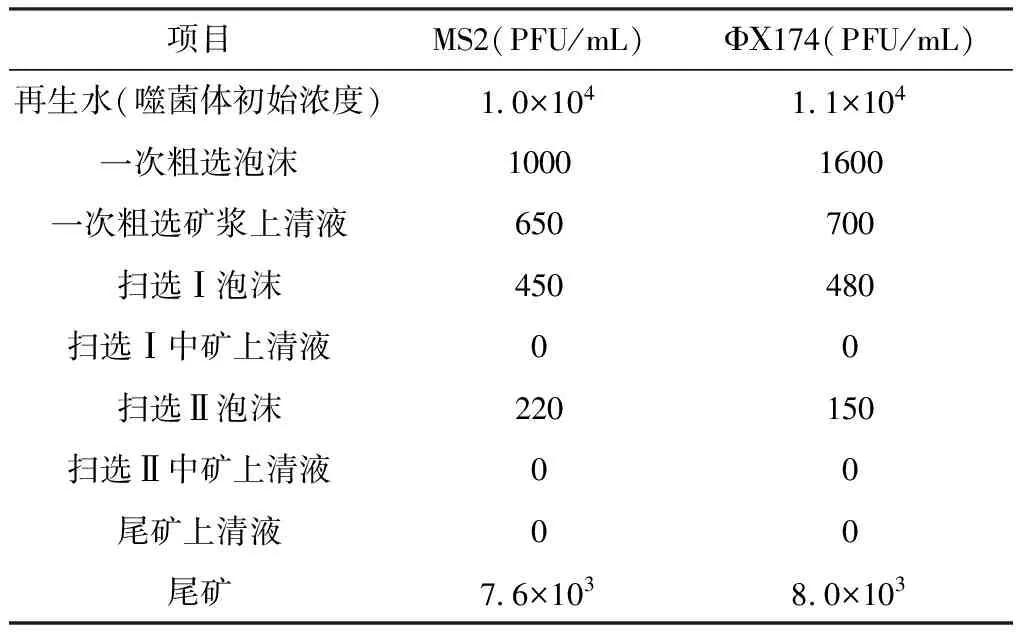
表2 再生水中病毒在浮选过程中的空间分布
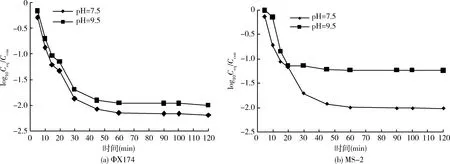
图2 pH值对噬菌体ΦΧ174(a)和 MS2(b)吸附的影响
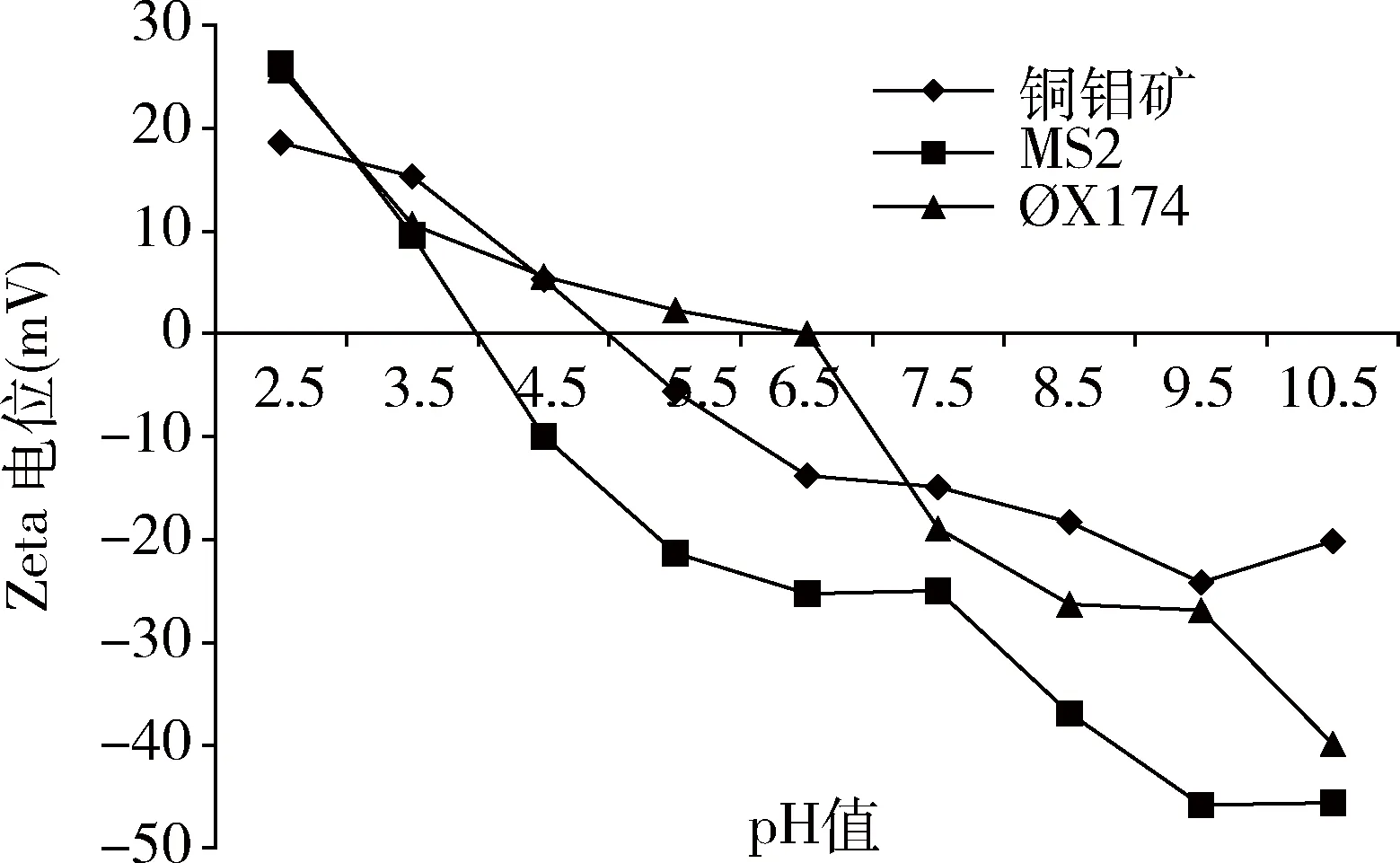
图3 不同pH值条件下噬菌体和矿物颗粒的Zeta电位
解吸附试验数据(表4)表明pH值也会影响到矿物颗粒对噬菌体的不可逆吸附/灭活。pH值为7.5时,平均有89.62%被吸附的MS2和79.18%被吸附的ΦΧ174被矿物颗粒灭活或者不可逆吸附;

表3 不同pH值下噬菌体与矿物颗粒相互作用能障和次级小能

表4 不同pH值下噬菌体衰减率
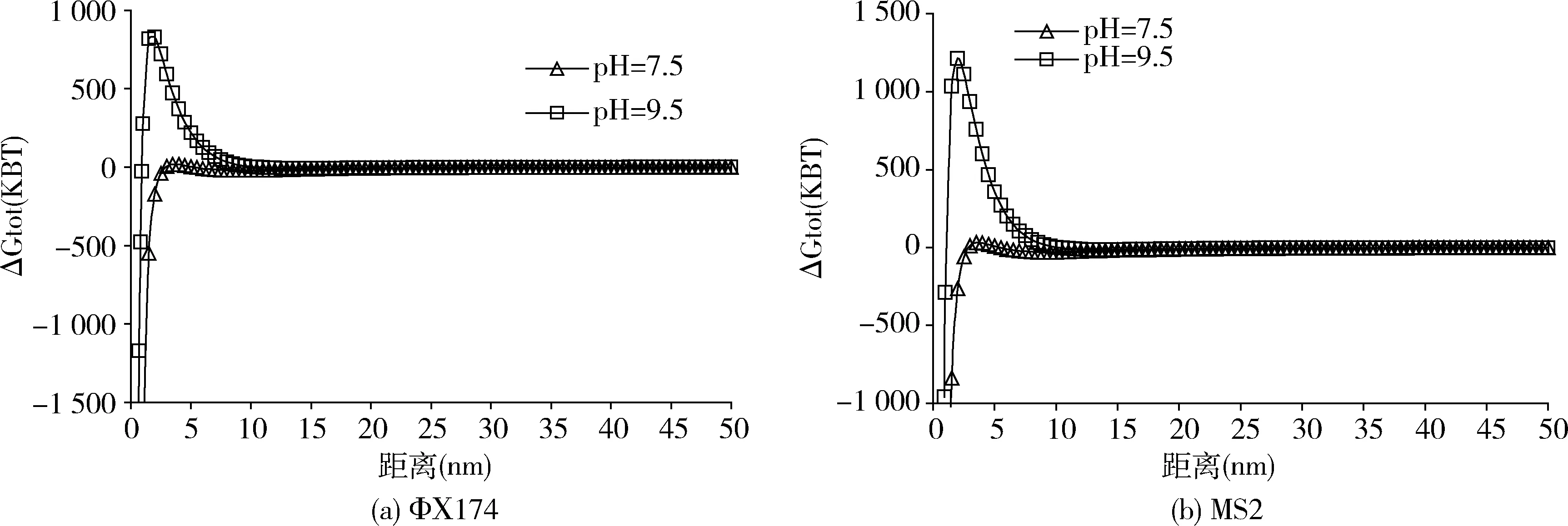
图4 ΦΧ174(a)和 MS2(b)与矿物颗粒相互作用能谱
值为9.5时MS2和ΦΧ174的不可逆吸附/灭活率分别下降为83.42%和77.35%。尽管与噬菌体ΦΧ174相比,噬菌体MS2具有较低的等电点,噬菌体MS2的不可逆吸附/灭活率高于噬菌体ΦΧ174,这是由两种噬菌体的疏水性差异引起的,噬菌体MS2疏水性高于ΦΧ174,与矿物颗粒直接表现出更强疏水作用力。这与以往的许多研究结果相似,zhang等研究表明有34%的MS2能够被氧化铝覆盖的石英砂不可逆吸附/灭活,而几乎100%噬菌体ΦΧ174能够被牛肉膏浸提液浸提,不可逆吸附/灭活率接近零[15]。Zhang等研究表明红壤可以吸附99.95%的MS2和98.23%的ΦΧ174,这部分吸附的噬菌体大部分为不可逆吸附或者被灭活。另外病毒外壳蛋白的结构差异引起的病毒灭活也是导致噬菌体MS2不可逆吸附/灭活率高于噬菌体ΦΧ174的原因[12]。Jin等研究结果表明在不饱和土柱试验中,噬菌体MS2能够被体系中的气-水-固界面灭活,而噬菌体ΦΧ174在相同试验条件下未被灭活,病毒外壳分布着极性和非极性基团,其中疏水基团会使病毒向气相靠拢远离体系中的极性组分,这个过程会引起病毒外壳蛋白结构重组导致病毒的灭活从而失去传染性[23]。Zhuang等研究表明MS2是单链F-RNA噬菌体与DNA结构的ΦΧ174相比,对溶液中的铁离子和铜离子更敏感容易被灭活[24]。试验选用的铜钼矿矿浆中含有大量的铜、铁、锌等金属离子(表1),这些金属离子导致了噬菌体MS2被灭活,从而导致噬菌体MS2的不可逆吸附/灭活率高于噬菌体ΦΧ174。
2.3 矿物粒径对病毒吸附的影响
矿样经陶瓷球磨,湿式筛分,得到5个不同粒径范围的矿物,分别为<0.038 mm、0.075~0.038 mm、0.15~0.075 mm、0.15~0.25 mm 、>0.25 mm,将矿样灭菌烘干置于灭菌广口瓶中备用。称取1g不同粒径矿样放入50 mL 离心管,加入去离子水9 mL,,噬菌体浓度2.74×107PFU/mL,按上文1.5节,1.6节方法进行吸附实验。
不同粒径矿物颗粒对噬菌体的吸附数据见图5,矿物颗粒粒径的大小对噬菌体的吸附影响显著。随着粒径的减小,矿物颗粒对噬菌体MS2、ΦΧ174的吸附明显增强。粒径<0.038 mm和0.038~0.075 mm矿物颗粒吸附速率明显加快,在60 min噬菌体完全被吸附,噬菌体去除率达到100%;粒径范围0.075~0.15 mm、0.15~0.25 mm和 >0.25 mm的矿物颗粒大约30 min达到吸附平衡。达到吸附平衡时,噬菌体ΦΧ174衰减分别为1.97-log10PFU/mL、1.89-log10PFU/mL、1.84-log10PFU/mL;噬菌体MS2衰减分别为1.67-log10PFU/mL、1.64-log10PFU/mL、1.54-log10PFU/mL。从图6、表5可以看出,随着矿物颗粒粒径减小,病毒-矿物颗粒体系的能障减小,噬菌体ΦΧ174-矿物颗粒体系能障由439.36 KBT(>0.25 mm)下降到226.23 KBT(0.075~0.15 mm);噬菌体MS2-矿物颗粒体系能障由743.15 KBT(>0.25 mm)下降到478.16 KBT(0.075~0.15 mm)。粒径范围在<0.038 mm、0.075~0.038 mm时,病毒-矿物颗粒体系作用能障不存在,总作用能全为负值(引力),表现为很强的吸附状态。
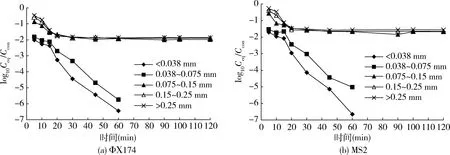
图5 矿物细度对ΦΧ174和MS2吸附的影响

图6 ΦΧ174和 MS2与不同粒径矿物颗粒相互作用能谱

表5 噬菌体与不同粒径矿物颗粒相互作用能障和次级小能
注:-代表不存在能障或次级小能。
不同粒径矿物颗粒噬菌体解吸附数据见表6,随着粒径增加,矿物颗粒对噬菌体的不可逆/灭活率明显下降,噬菌体MS2不可逆/灭活率由91.56%下降到11.95%,噬菌体ΦΧ174不可逆/灭活率由89.77%下降到18.65%。由此可见粒径的增加,矿物颗粒对噬菌体的不可逆吸附明显减少。
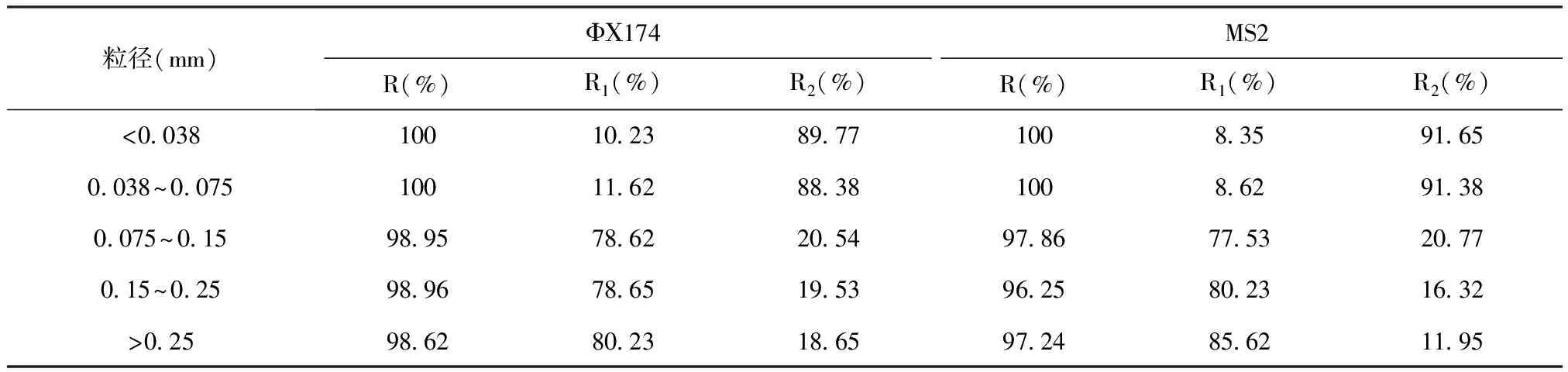
表6 不同矿物颗粒粒径下噬菌体衰减率
3 结 论
1)再生水模拟铜钼矿浮选试验中噬菌体能够快速被矿物颗粒吸附,再生水中噬菌体衰减迅速,尾矿废水中未检测到噬菌体,继续回用于浮选流程是安全的,但精矿、中矿、尾矿中吸附了大量的噬菌体,在特定暴露水平下会对从业人员构成健康风险。
2)矿物颗粒对噬菌体的吸附是影响再生水中噬菌体迁移的主要因素,吸附由可逆吸附和不可逆/灭活两部分组成。随着pH值升高,噬菌体-矿物颗粒体系作用能障增大,吸附呈下降趋势,这是由于细菌和矿物的zeta电位值随pH值升高而递减,静电斥力逐渐增大导致的,矿物颗粒对噬菌体MS2的吸附率低于ΦΧ174。随着pH值升高,矿物颗粒对噬菌体的不可逆吸附/灭活率呈下降趋势,由于疏水性和结构差异,噬菌体MS2不可逆吸附/灭活率高于ΦΧ174。
3)随着粒径的减小,噬菌体-矿物颗粒体系的作用能障减小,矿物颗粒对噬菌体MS2、ΦΧ174的吸附明显增强,粒径范围在<0.038 mm、0.075~0.038 mm时,噬菌体-矿物颗粒体系作用能障不存在,总作用能全为负值(引力),表现为很强的吸附状态。矿物颗粒对噬菌体的不可逆/灭活率随矿物颗粒粒径的减小而增大。
[1] 刘洪均,徐涛,孙春宝.城市中水用于乌努格吐山铜钼矿浮选过程的研究[J].有色金属:选矿部分,2014(1):56-60.
[2] Salgot M.Water reclamation recycling and reuse:implemen-tation issues[J].Desalination,2008,218(1-3):190-197.
[3] Castro J A,García-Presedo I,Almeida A.Contribution of treated wastewater to the contamination of recreational river areas with Cryptosporidium.spp and Giardia-duodenalis[J].Water Research,2008,42(13):3528-3531.
[4] Angelakis A N,Durham B.Water recycling and reuse in EUREAU countries:Trends and challenges[J].Desalination,2008,218(1-3):3-12.
[5] Wen Qin-xue,Tutuka C,Keegan A,et al.Fate of pathogenic microorganisms and indicators in secondary activated sludge wastewater treatment plants[J].Journal of Environmental Management,2009,90(3):1442-1447.
[6] WéRY N,Lhoutellier C,Ducray F.Behaviour of pathogenic and indicator bacteria during urban wastewater treatment and sludge composting,as revealed by quantitative PCR[J].Water Research,2008,42(1-2):53-59.
[7] 马雪姣,金妍,黄元仿等冠状病毒IBV和噬菌体MS2在饱和多孔介质中的运移规律[J].中国环境科学,2007,27(2):255-259
[8] AL-Hamaiedeh H,Bino M.Effect of treated grey water reuse in irrigation on soil and plants[J].Desalination,2010,256(1-3):115-119.
[9] Maria I,Vasiliki I,Maria A,et al.Interaction of human adenoviruses and coliphages with kaolinite and bentonite[J].Science of the Total Enviroment,2015,517(2):86-90.
[10] Allegra K,Owen V,Mary K,Menache M.Adsorption and aggregation properties of norovirus GI and GII Virus-like particles demonstrate differing responses to solution chemistry[J].Environmental Science and Technology,2013,47 (4):1896-1905.
[11] Walczak J J,Bardy S L,Feriancikova L.Influence of tetracycline resistance on the transport of manure-derived Escherichia coli in saturated porous media[J].Water Research,2011,45(4):1681-1689.
[12] Zhang Hui,Zhang Jie-bao,Zhao Bing-zi,et al.Removal of bacteriophages MS2 and phiX174 from aqueous solutions using a red soil[J].Journal of Hazardous materials,2010,180(4):640-650.
[13] Syngouna V I,Chrysikopoulos C V.Interaction between viruses andclays in static and dynamic batch systems[J].Environmental Science and Technology,2010,44 (12):4539-4542.
[14] Constantinos V,Riana F.Virus attachment onto quartz sand:Role of grain size and temperature[J].Journal of Environmental Chemical Engineering,2014,2(2):796-806.
[15] Zhuang Jie,Jin Yan.Interactions between viruses and goethite during saturated flow:effect of solution pH,carbonate and phosphate[J].Journal of Contaminant Hydrology,2008,98(1-2):15-19.
[16] 王秋英,赵炳梓,张佳宝,等.噬菌体MS2和ΦΧ174的双层琼脂平板和液体培养基扩增方法的建立[J].土壤2007,39(2):297-300.
[17] Teunis P F M,Fleming K K,Yang J.Enteric virus infection risk from intrusion of sewage into a drinking water distribution network[J].Environmental Science and Technology,2010,44 (22):8561-8566.
[18] 仇付国,王晓昌.水环境中病毒的分布存活及其健康风险评价[J].西安建筑科技大学学报:自然科学版,2007,39(1):116-122.
[19] Hogg R,Healy T W,Fuerstenau D W.Mutal coagulation of colloidal dispersions[J].Transactions of the Faraday Society,1966,62:1638-1651.
[20] Gregory J.Approximate expressions for retarded Van der Waals interaction[J].Journal of Colloid and Interface Science,1981,83(1):139-146.
[21] Yoon,R H,Darrin H,Ravinovich Y I.Hydrophobic interactions between dissimilar surface[J]. Journal of Colloid and Interface Science,1997,183(1):363-370.
[22] Fewtrell L,Bartram J,World Health Organization (WHO).Water Quality:Guidelines,Standards and Health —Assessment of Risk and RiskManagement for Water-Related Infectious Disease[M].London,IWA Publishing,2001.
[23] Jin Yan,Chu Yan-jie,Li Yun-sheng.Virus removal and transport in saturated and unsaturated sand columns[J].Journal of Contaminant Hydrology,2000,43(3-4):111-119.
[24] Zhuang Jie,Jin Yan.Virus Retention and transport through Al-oxide coated sand columns:effects of ionic strength and composition[J].Journal of Contaminant Hydrology,2003,60 (3-4):193-199.
Effect of virus in reclaimed water on flotation process
DOU Peiqian1,2,KOU Jue1,SUN Chunbao1,GU Zhijun3
(1.University of Science and Technology Beijing,Beijing 100083,China;2.China University of Labor Relations,Beijing 100048,China;3.China National Gold Group Corporation,Beijing 100011,China)
The transport of viruses (ΦΧ174 and MS2) in reclaimed water in flotation system has been investigated through Simulation of flotation experiment,adsorption experiment and desorption experiment for the safety of reclaimed water reused to flotation.The results showed that viruses in reclaimed water were rapidly adsorbed by ore particles,while tailing waste water could be reused to floatation safely,however,concentrate,middlings and tailings could pose health risks under certain exposure conditions.The transport of viruses in the floatation process was dominated by attachment onto ore particles,in which most of them are inactivated and or irreversibly adsorbed.Remove of both viruses on ore particles decreased as solution pH value increased with the increased energy barrier between virus and ore particles,more ΦΧ174 was removed in comparison to MS2.The attachment of both ΦΧ174 and MS2 on mineral particles increases significantly as the decreased ore particle size.
reclaimed water;virus;floatation;transport;adsorption
2017-03-25 责任编辑:宋菲
窦培谦(1981-),男,山东潍坊人,博士研究生,研究方向为矿山环境污染治理与安全。
孙春宝(1963-),男,河北武邑人,博士,教授,博士生导师,E-mail:suncb@ustb.edu.cn。
TD78
A
1004-4051(2017)08-0133-07
