p38 MAPK反义寡聚脱氧核苷酸抑制脑缺血预处理诱导脑缺血耐受过程中GLT-1表达上调
2017-08-29王佳磊蒋孟洋张孟岳王文帅张玲燕李文斌
王佳磊,蒋孟洋,张孟岳,王文帅,李 力,张玲燕,李文斌,5,张 敏,5
(1.河北医科大学病理生理学教研室,河北 石家庄 050017;2.河北医科大学临床医学“5+3”一体化2015级,河北 石家庄 050017;3.河北省胸科医院胸外科,河北 石家庄 050041;4.河北医科大学第二临床医学院科技处,河北 石家庄 050000;5. 河北省脑老化与认知神经重点实验室,河北 石家庄 050031)
p38 MAPK反义寡聚脱氧核苷酸抑制脑缺血预处理诱导脑缺血耐受过程中GLT-1表达上调
王佳磊1,蒋孟洋1,张孟岳2,王文帅3,李 力4,张玲燕1,李文斌1,5,张 敏1,5
(1.河北医科大学病理生理学教研室,河北 石家庄 050017;2.河北医科大学临床医学“5+3”一体化2015级,河北 石家庄 050017;3.河北省胸科医院胸外科,河北 石家庄 050041;4.河北医科大学第二临床医学院科技处,河北 石家庄 050000;5. 河北省脑老化与认知神经重点实验室,河北 石家庄 050031)
目的观察p38 MAPK反义寡聚脱氧核苷酸(AS-ODNs)是否影响大鼠脑缺血预处理(CIP)诱导脑缺血耐受过程中GLT-1蛋白的表达。方法80只健康Wistar大鼠,♂,永久凝闭椎动脉,随机分为6组:①假手术(sham)组(n=10);②CIP组(n=10);③脑缺血损伤(Ⅱ)组(n=10);④CIP+Ⅱ组(n=10);⑤p38 MAPK AS-ODNs+CIP +Ⅱ组(n=30);⑥p38 MAPK S-ODNs+CIP+Ⅱ组(n=10)。⑤组中根据p38 MAPK AS-ODNs所用剂量不同分为5 nmol、10 nmol及15 nmol亚组(n=10);p38 MAPK S-ODNs的剂量为15 nmol。所有动物均在sham手术或末次脑缺血/再灌注后6 h和2 d取材,Western blot和(或)免疫组织化学法检测p-p38 MAPK及GLT-1蛋白的表达。结果CIP引起p-p38 MAPK适度升高和GLT-1明显升高,并抑制Ⅱ引起的p-p38 MAPK过度升高及GLT-1表达下调;注射p38 MAPK AS-ODNs抑制CIP诱导脑缺血耐受过程中p-p38 MAPK和GLT-1的表达上调,呈剂量依赖性。结论p38 MAPK AS-ODNs阻断CIP诱导脑缺血耐受过程中GLT-1表达上调。
p38 MAPK;GLT-1;AS-ODNs;脑缺血预处理;海马;大鼠
脑缺血性疾病是严重危害人类健康的常见疾病之一。如何提高神经元对缺血性损害的耐受,减轻神经元的损伤,是治疗此类疾病的一个重要措施,具有深远的意义。预先给予动物短暂、轻微的脑缺血可抵抗再次给予的通常引起大量神经元死亡的严重脑缺血,这一现象称为脑缺血耐受[1],预先给予的轻微、短暂脑缺血称为脑缺血预处理(cerebral ischemic preconditioning,CIP)[2]。研究发现,脑缺血时细胞外液中异常升高的谷氨酸可与其受体结合引起兴奋性毒性作用,导致神经元损伤。脑内突触间隙缺乏谷氨酸代谢酶,兴奋性氨基酸转运体(excitatory amino acid transporters,EAATs)尤其是EAAT2在维持细胞外液谷氨酸浓度中发挥重要作用,其蛋白主要存在于星形胶质细胞,又称为胶质细胞谷氨酸转运体1(glial glutamate transporter-1,GLT-1)[3]。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)通路是重要的信号转导系统,在细胞增殖、转化、分化及凋亡等过程中起到重要的作用,p38 MAPK是其家族中的重要成员,大量研究表明,p38 MAPK参与脑缺血/再灌注过程。我室既往研究表明,CIP可上调p-p38 MAPK及GLT-1蛋白的表达。本实验应用p38 MAPK AS-ODNs观察其对CIP诱导的脑缺血耐受过程中GLT-1蛋白表达的影响,进一步探讨p38 MAPK信号通路在CIP上调GLT-1表达诱导脑缺血耐受中的作用。
1 材料与方法
1.1主要实验仪器和试剂307-6台式牙钻车(上海医用分析仪器厂),江湾Ⅰ型脑立体定位仪(淮北正华生物仪器设备有限公司),侧脑室套管(深圳瑞沃德公司),微量进样器(上海安亭微量进样器厂),外热型电烙铁(南京华夏电器厂),DYY-6C型电泳仪(北京市六一仪器厂),Odyssey FC双色红外激光成像系统(美国IL-COR公司)。
p38 MAPK AS-ODNs(上海生工生物工程股份有限公司),兔抗Pho-p38多克隆抗体(Affinity Biosciences,Cat.AF4001),辣根酶标记的山羊抗兔IgG(美国Novus公司,CAT.E030120-01),豚鼠抗大鼠GLT-1多克隆抗体(美国 MILLIPORE,Cat.AB1783,Lot NG 1897862),生物素标记山羊抗豚鼠IgG(美国 MILLIPORE,Cat.SP9001,Lot.1938125),辣根酶标记的链酶卵白素(美国 INVITROGEN Cat.43-4323,Lot.1012719A),鼠抗β-actin抗体(杭州华安生物技术有限公司,M1210-2),过氧化物酶标记的山羊抗鼠IgG(武汉三鹰生物技术有限公司,SA00001-1),免疫组化试剂盒(北京中杉金桥生物技术公司,Cat.SP-9000),DAB显色试剂盒(北京中杉金桥生物技术公司,Cat.ZLI-9017)。
1.2实验动物与分组80只健康Wistar大鼠,♂,体质量(280±20)g,由河北医科大学实验动物中心提供。部分用于侧脑室注射的大鼠于头部埋置导管,恢复5 d用于下一步实验。永久凝闭椎动脉,恢复2 d后,随机分为以下6组:①sham组(n=10):只暴露双侧颈总动脉,但不阻断其血流;②CIP组(n=10):夹闭双侧颈总动脉3 min作为CIP,之后恢复血流灌注;③脑缺血损伤(ischemic insult,Ⅱ)组(n=10):夹闭双侧颈总动脉8 min作为损伤性脑缺血,之后恢复血流灌注;④CIP+ Ⅱ组(n=10):夹闭双侧颈总动脉3 min,恢复血流再灌注2 d后,再次夹闭双侧颈总动脉8 min;⑤p38 MAPK AS-ODNs+ CIP+ Ⅱ组(n=30);⑥p38 MAPK S-ODNs+CIP+ Ⅱ组(n=10)。其中⑤组,根据p38 MAPK AS-ODNs注射剂量又分为5、10 nmol及15 nmol共3个亚组(n=10);p38 MAPK S-ODNs的注射剂量为15 nmol。p38 MAPK AS-ODNs及p38 MAPK S-ODNs均溶于15 μL人工脑脊液(artificial cerebrospinal fluid,ACSF)中,于凝闭椎动脉前1天开始注射,每天1次,连续注射5 d,其中CIP 6 h大鼠只能注射4次。以上各组动物均在sham手术或末次脑缺血/再灌注后6 h和2 d(每个时间点n=5)断头取脑,左侧取海马CA1区,通过Western blot检测p-p38 MAPK及GLT-1蛋白的表达;右侧制成蜡块,通过免疫组织化学法检测p-p38 MAPK及GLT-1蛋白的表达。
1.3p38MAPKAS-ODNsp38 MAPK AS-ODNs由上海生工生物工程公司合成。该序列以鼠p38基因翻译起始区域18个碱基序列为模板合成,合成过程中对碱基进行硫代磷酸化修饰以提高稳定性,合成序列如下:AS-ODNS: 5′-GGGCCTTTCCTGCGACAT-3′,S-ODNS: 5′-ATGTCGCAGGAAAGGCCC-3′。1.4侧脑室置管与注射体积分数为0.1的水合氯醛(350 mg·kg-1)腹腔注射麻醉,将大鼠头部固定于脑立体定位仪上,依据Paxinos and Watson(1997)大鼠脑解剖图谱,右侧颅骨钻孔,定位:前囟向右1.5 mm,向后0.8 mm,套管进入深度3.8~3.9 mm。牙科水泥固定套管。动物单笼饲养,自由进食进水。5 d后,根据实验分组,给予15 μL不同浓度的p38 MAPK AS-ODNs,使用微量注射器由连接管连接脑室套管,将p38 MAPK AS-ODNs缓慢、匀速注射入侧脑室中。注药期间保持大鼠安静、清醒,1 μL·min-1,共15 min,留针10 min。
1.5全脑缺血采用四血管闭塞法[4]。体积分数为0.1的水合氯醛(350 mg·kg-1)腹腔注射麻醉大鼠,电灼凝闭双侧椎动脉,术后恢复48 h。异氟烷麻醉下,游离双侧颈总动脉,夹闭双侧颈总动脉行全脑缺血或行假手术处理(仅暴露双侧颈总动脉,但并不夹闭颈总动脉),然后再恢复双侧颈总动脉的血流灌注。夹闭双侧颈总动脉后大鼠意识丧失、瞳孔散大、对光反射及翻正反射消失,表明全脑缺血模型成功。
1.6Westernblot分析在归定时间点将大鼠断头取脑,分离左侧海马,沿海马腹侧面的海马沟向背侧面分割至海马沟底,之后沿CA3区和齿状回区间的切迹向海马背侧切割可得到海马CA1区[5]。称重后加入裂解液,冰浴下匀浆,吸出上清液,考马斯亮蓝试剂盒测定蛋白定量。每孔加入50 μg上样蛋白,SDS-PAGE凝胶电泳,转膜仪将蛋白转移至PVDF膜。牛奶封闭,加入一抗,4℃静置过夜,次日37℃复温1 h,TPBS溶液振洗,加入二抗,37℃孵育1 h,TPBS溶液振洗,加入三抗,37℃孵育,TPBS溶液振洗,化学发光显色法显色。应用Alpha Imager凝胶图像分析系统对Western免疫反应阳性条带进行蛋白条带积分光密度(integrated optical density,IOD)测定。
1.7免疫组织化学规定时间点取材,多聚甲醛固定,梯度酒精脱水,二甲苯透明,石蜡包埋。常规石蜡切片,采用免疫组化ABC法观察海马CA1区p-p38 MAPK及GLT-1蛋白的表达,DAB显色,免疫阳性标记物呈棕黄色。应用图像分析系统对免疫组化染色后p-p38 MAPK及GLT-1阳性标记物进行积分光密度测定。

2 结果
2.1CIP诱导脑缺血耐受过程中p-p38MAPK蛋白的表达Western blot 结果显示,6 h时间点(Fig 1A) sham组大鼠海马CA1区的p-p38 MAPK蛋白有一定量的基础表达。与sham组相比,CIP组p-p38 MAPK蛋白的表达明显升高(P<0.05),为基础表达值的2.13倍;Ⅱ组p-p38 MAPK蛋白表达明显上升,为基础表达值3.02倍(P<0.05),为CIP组的1.42倍(P<0.05)。CIP+ Ⅱ组与Ⅱ组相比,p-p38 MAPK蛋白表达明显下降(P<0.05)。2 d时间点p-p38 MAPK蛋白在各组表达的变化趋势均与6 h时间点相类似(Fig 1B)。但6 h时间点变化更明显,因此我们还通过免疫组织化学法观察了6 h时间点p-p38 MAPK蛋白表达。

Fig 1 Western blot shows expression of p-p38 MAPKin hippocampal CA1 subfield during brain ischemictolerance induced by CIP (n=5)
A:6 h;B:2 d.*P<0.05vssham group;#P<0.05vsischemic insult group
免疫组化结果显示(Fig 2),在6 h时间点,sham组大鼠海马CA1区p-p38 MAPK免疫阳性颗粒分布均匀呈棕黄色,染色较浅,主要位于锥体层(Fig 2A、2B)。与sham组相比,CIP组p-p38 MAPK免疫阳性颗粒明显加深(Fig 2C),IOD值明显增高(P<0.05);Ⅱ组p-p38 MAPK免疫阳性颗粒染色强度进一步增加(Fig 2D),IOD值明显增高(P<0.05)。预先给予CIP,可明显抑制脑缺血打击引起的p-p38 MAPK的过度表达(Fig 2E),与Ⅱ组相比p-p38 MAPK的表达明显下降(P<0.05)。p-p38 MAPK免疫组化结果的变化趋势与Western blot结果的相符。

Fig 2 Immunohistochemistry shows expression of p-p38 MAPKat 6 h time point in hippocampal CA1 subfield during induction ofbrain ischemic tolerance induced by CIP (scale bar is 200 μm in A and 100 μm in E for B-E, n=5)
A and B: sham; C: CIP; D: ischemic insult (Ⅱ); E: CIP+ Ⅱ.*P<0.05vssham group;#P<0.05vsischemic insult group.
2.2CIP诱导脑缺血耐受过程中GLT-1蛋白的表达Western blot 结果显示,6 h时间点(Fig 3A) sham组大鼠海马CA1区的GLT-1蛋白有一定量的基础表达。与sham组相比,CIP组GLT-1蛋白表达升高(P<0.05),为基础表达的1.81倍;Ⅱ组GLT-1蛋白的表达明显下调,是基础值的0.28倍(P<0.05),是CIP组的0.15倍(P<0.05)。CIP+ Ⅱ组与Ⅱ组相比,GLT-1蛋白表达明显上升(P<0.05)。2 d时间点GLT-1蛋白在各组表达的变化趋势均与6 h时间点相类似(Fig 3B)。但6 h时间点变化更明显,因此我们还通过免疫组织化学法观察6 h时间点GLT-1蛋白表达。

Fig 3 Western blot shows expression of GLT-1 inhippocampal CA1 subfield during induction of brainischemic tolerance induced by CIP (n=5)
A:6 h;B:2 d.*P<0.05vssham group;#P<0.05vsischemic insult group
免疫组化结果显示(Fig 4),在6 h时间点,sham组大鼠海马CA1区GLT-1阳性标记物呈棕黄色,染色较浅(Fig 4A)。与sham组相比,CIP组GLT-1免疫颗粒染色明显加深(Fig 4B),IOD值明显增高(P<0.05);Ⅱ组GLT-1的表达明显下降(Fig 4C)(P<0.05)。预先给于CIP,可抑制脑缺血打击引起的GLT-1表达下调(Fig 4D),与Ⅱ组相比GLT-1的表达明显增多(P<0.05)。GLT-1免疫组化结果的变化趋势与Western blot结果的相符。

Fig 4 Immunohistochemistry shows expression ofGLT-1 at 6 h time point in hippocampal CA1 subfieldduring induction of brain ischemic toleranceinduced by CIP (scale bar is 20 μm in D for A-D, n=5)
A: sham; B: CIP; C: ischemic insult (Ⅱ); D: CIP+ Ⅱ.*P<0.05vssham group;#P<0.05vsischemic insult group.
2.3p38MAPKAS-ODNs剂量依赖性抑制CIP诱导脑缺血耐受过程中p-p38MAPK蛋白表达上调6 h时间点(Fig 5A),p38 MAPK AS-ODNs+ CIP+ Ⅱ组中,5、10、15 nmol组与CIP+ Ⅱ组相比,p-p38 MAPK蛋白的表达均明显下降(P<0.05);10 nmol组与5 nmol组相比,p-p38 MAPK蛋白的表达明显降低(P<0.05);15 nmol组与10 nmol组相比,p-p38 MAPK蛋白的表达进一步下降(P<0.05),即随着p38 MAPK AS-ODNs剂量的增加,p-p38 MAPK蛋白的表达剂量依赖性地下降。p38 MAPK S-ODNs+ CIP+ Ⅱ组与CIP+ Ⅱ组相比,p-p38 MAPK蛋白表达无明显差别(P>0.05)。2 d时间点p-p38 MAPK蛋白在各组表达的变化趋势与6 h时间点一致(Fig 5B)。

Fig 5 Western blot shows inhibitory effect of p38 MAPKAS-ODNs on expression of p-p38 MAPK in hippocampalCA1 subfield during induction of brain ischemic toleranceinduced by CIP (n=5)
*P<0.05vsCIP+ Ⅱ group;#P<0.05vsp38 MAPK AS-ODNs (5 nmol)+CIP+Ⅱ group;△P<0.05vsp38 MAPK AS-ODNs (10 nmol)+CIP+Ⅱ group.
2.4p38MAPKAS-ODNs剂量依赖性抑制CIP诱导脑缺血耐受过程GLT-1蛋白表达上调6 h时间点,p38 MAPK AS-ODNs+ CIP+ Ⅱ组中,随着p38 MAPK AS-ODNs剂量的增加,GLT-1蛋白的表达剂量依赖性地下降(Fig 6A)。p38 MAPK S-ODNs+ CIP+ Ⅱ组与CIP+ Ⅱ组相比,GLT-1蛋白表达无明显差别(P>0.05)。2 d时间点GLT-1蛋白在各组表达的变化趋势与6 h时间点一致(Fig 6B)。
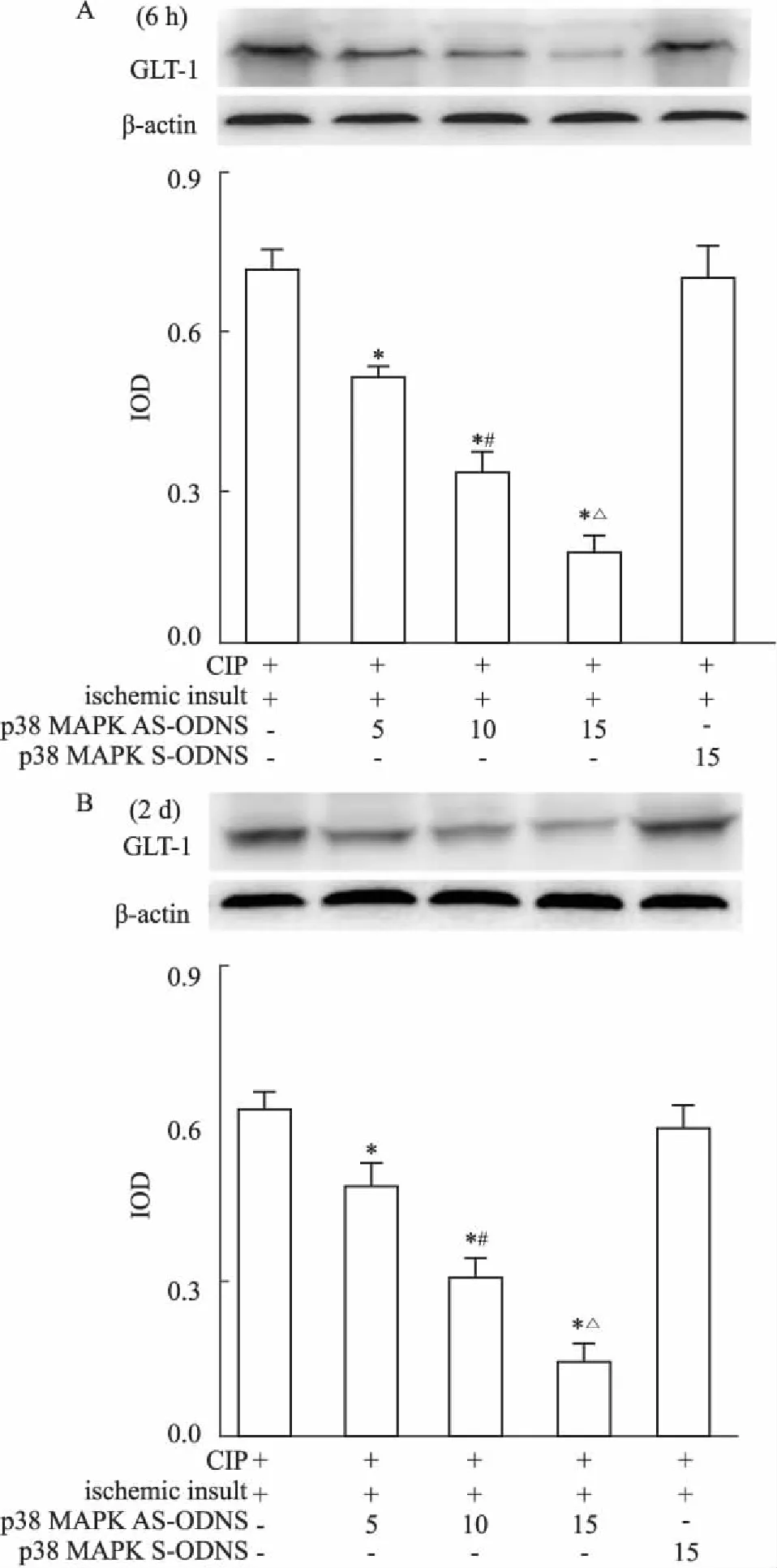
Fig 6 Western blot shows restraining effect of p38 MAPKAS-ODNs on expression of GLT-1 in hippocampal CA1subfield during induction of brain ischemic tolerance by CIP(n=5)
3 讨论
本实验室应用四血管闭塞法大鼠全脑缺血模型研究脑缺血耐受及其诱导机制,至今已有20余年[4-8]。大鼠全脑缺血时出现意识丧失、双侧瞳孔散大、对光反射消失及翻正反射消失等,可作为全脑缺血模型制备成功的判断依据,经过多年的实践检验具有可信性。
MAPKs是一类广泛存在于细胞内的丝氨酸/苏氨酸蛋白激酶,该通路可将细胞外的刺激信号转导至细胞及其核内,在一系列细胞生物学反应中发挥重要作用[9]。p38 MAPK是MAPKs家族中的重要成员,研究发现,p38 MAPK参与调节大鼠海马神经细胞凋亡[10]、炎症[11]及缺血/再灌注等过程,但是在脑缺血/再灌注中发挥何种作用,目前的研究结果并不一致。有研究发现,p38 MAPK在缺血/再灌注过程中介导损伤作用,阻断p38 MAPK级联反应能减轻炎症反应,同时降低大脑的缺血/再灌注损伤[12];也有研究发现,p38 MAPK在脑缺血过程中发挥保护作用,BMP-7可以协同p38 MAPK的表达诱导脑缺血耐受,而应用p38 MAPK的特异性抑制剂SB203580可削弱神经元的保护作用[13]。Western blot结果显示,CIP引起p-p38 MAPK适度升高,8 min全脑缺血即严重脑缺血时p-p38 MAPK过量表达,而提前给予CIP可抑制严重脑缺血所引起的p-p38MAPK过度升高,免疫组化结果分析符合上述变化特点。提示p-p38MAPK在脑缺血中发挥了双重作用,即p-p38 MAPK的适度升高发挥脑保护作用,p-p38 MAPK的过量表达导致神经元损伤。这与我室的前期研究相一致,p38 MAPK参与脑缺血预处理诱导的脑缺血耐受,且这种保护作用可被p38 MAPK的特异性抑制剂SB203580所抑制[6]。反义寡核苷酸是一类人工合成的单链核苷酸片段,可与靶基因DNA或mRNA结合而干扰基因的表达从而抑制蛋白合成。本实验通过侧脑室注射p38 MAPK AS-ONDs,发现在CIP诱导的脑缺血耐受中随着p38 MAPK AS-ODNs剂量增大,p-p38 MAPK蛋白表达呈剂量依赖性降低;注射p38 MAPK S-ODNs对p-p38 MAPK蛋白表达无影响。表明p38 MAPK AS-ODNs剂量依赖性抑制CIP诱导的脑缺血耐受过程中p-p38 MAPK蛋白表达的上调。
脑缺血时异常升高的谷氨酸可对大脑神经元产生神经毒性损伤,GLT-1在维持细胞外液谷氨酸浓度,防止其引起的兴奋性毒性作用中发挥重要作用。我室前期研究发现,提前进行的脑缺血预处理通过GLT-1大量表达诱导脑缺血耐受,减轻严重脑缺血时神经元损伤[7-8]。本实验中GLT-1在CIP诱导的脑缺血耐受中的作用与我室前期的结果相符。
Reichl等[14]报道通过p38 MAPK通路调节脊髓神经胶质GLT-1的表达缓解大鼠手术切口的持续性疼痛。Matos等[15]发现淀粉β肽可经p38 MAPK通路下调GLT-1的表达,且p38 MAPK的特异性抑制剂SB203580可以下调星形胶质细胞GLT-1蛋白的表达。因此,我们推测在CIP诱导脑缺血耐受过程中P38 MAPK可能调控GLT-1的表达。本实验结果显示,在CIP诱导脑缺血耐受过程中,p38 MAPK AS-ONDs明显抑制了GLT-1蛋白的表达,呈剂量依赖性;但p38 MAPK S-ODNs对GLT-1蛋白表达无影响。综上表明,p38 MAPK AS-ONDs剂量依赖性抑制CIP诱导脑缺血耐受过程中GLT-1表达上调,进一步证实p38 MAPK信号通路参与CIP上调GLT-1表达诱导的脑缺血耐受。
(致谢:本实验是在本教研室完成的,感谢实验参与人员的共同努力。)
[1] Kitagawa K, Matsumoto M, Tagaya M, et al. ‘Ischemic tolerance’ phenomenon found in the brain[J].BrainRes, 1990,528(1): 21-4.
[2] Dirnagl U, Simon R P, Hallenbeck J M. Ischemic tolerance and endogenous neuroprotection[J].TrendsNeurosci, 2003,26(5): 248-54.
[3] Krzyzanowska W, Pomierny B, Filip M, Pera J. Glutamate transporters in brain ischemia: to modulate or not[J].ActaPharmacolSin, 2014,35(4): 444-62.
[4] Schmidt-Kastner R, Paschen W, Ophoff B G, Hossmann KA. A modified four-vessel occlusion model for inducing incomplete forebrain ischemia in rats[J].Stroke, 1989,20(7): 938-46.
[5] 孙晓彩, 李 力, 张 敏, 等. Wistar大鼠海马CA1区、CA3区和齿状回区的解剖分割[J]. 中国应用生理学杂志, 2012,28(2): 189-92.
[5] Sun X C, Li L, Zhang M, et al. Division of CA1, CA3 and DG regions of the hippocampus of Wistar rat[J].ChinJApplPhysiol, 2012,28(2): 189-92.
[6] Zhang M, Gong J X, Wang J L, et al. p38 MAPK Participates in the mediation of GLT-1 Up-regulation during the induction of brain ischemic tolerance by cerebral ischemic preconditioning[J].MolNeurobiol, 2017,54(1): 58-71.
[7] Liu Y X, Zhang M, Liu L Z, et al. The role of glutamate transporter-1a in the induction of brain ischemic tolerance in rats[J].Glia, 2012,60(1): 112-24.
[8] Gong J X, Gong S J, Zhang M, et al. Cerebral ischemic preconditioning reduces glutamate excitotoxicity by up-regulating the uptake activity of GLT-1 in rats[J].AminoAcids, 2014,46(6): 1537-45.
[9] Kovalska M, Kovalska L, Mikuskova K, et al. p-ERK involvement in the neuroprotection exerted by ischemic preconditioning in rat hippocampus subjected to four vessel occlusion[J].JPhysiolPharmacol, 2014,65(6): 767-76.
[10] 廖朝霞, 王 飞, 曹德雄, 等. p38 MAPK信号通路在异氟醚诱导新生大鼠海马神经细胞凋亡的作用[J]. 中国药理学通报, 2014,30(12): 1661-6.
[10] Liao Z X, Wang F, Cao D X, et al. Effect of p38 MAPK pathway on isoflurane-induced neuronal apoptosis in hippocampus of neonatal rats[J].ChinPharmacolBull, 2014,30(12): 1661-6.
[11] 宋来新, 张长城, 王 婷, 等. 淫羊藿总黄酮通过抑制MAPK/NF-κB信号通路减轻自然衰老大鼠脑组织炎症反应[J]. 中国药理学通报, 2017,33(1): 84-9.
[11] Song L X, Zhang C C, Wang T, et al. Total flavonoids of Epimedium attenuate aging-related inflammation in rat brain by inhibiting MAPK/NF-κB signaling pathway[J].ChinPharmacolBull, 2017,33(1): 84-9.
[12] Mukhopadhyay P, Rajesh M, Horvath B, et al. Cannabidiol protects against hepatic ischemia/reperfusion injury by attenuating inflammatory signaling and response, oxidative/nitrative stress, and cell death[J].FreeRadicBiolMed, 2011,50(10): 1368-81.
[13] Guan J, Li H, Lv T, et al. Bone morphogenic protein-7 contributes to cerebral ischemic preconditioning induced-ischemic tolerance by activating p38 mitogen-activated protein kinase signaling pathway[J].Inflammation, 2014,37(4): 1289-96.
[14] Reichl S, Segelcke D, Keller V, et al. Activation of glial glutamate transporter via MAPK p38 prevents enhanced and long-lasting non-evoked resting pain after surgical incision in rats[J].Neuropharmacology, 2016,105: 607-17.
[15] Matos M, Augusto E, Oliveira C R, Agostinho P. Amyloid-beta peptide decreases glutamate uptake in cultured astrocytes: involvement of oxidative stress and mitogen-activated protein kinase cascades[J].Neuroscience, 2008,156(4): 898-910.
p38MAPKantisenseoligodeoxynucleotideinhibitedup-regulationofGLT-1duringinductionofbrainischemictoleranceinducedbycerebralischemicpreconditioning
WANG Jia-lei1, JIANG Meng-yang1, ZHANG Meng-yue2, WANG Wen-shuai3, LI Li4, ZHANG Ling-yan1, LI Wen-bin1,5, ZHANG Min1,5
(1.DeptofPathophysiology,HebeiMedicalUniversity,Shijiazhuang050017,China; 2.ClinicalMedicine‘5+3’Integration,HebeiMedicalUniversity,Shijiazhuang050017,China; 3.DeptofThoracicSurgery,HebeiChestHospital,Shijiazhuang050041,China; 4.DeptofScienceandTechnology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China; 5.AgingandCognitionNeuroscienceLabofHebeiProvince,Shijiazhuang050031,China)
AimTo investigate the effect of p38 MAPK AS-ODNs on the expression of GLT-1 during the induction of brain ischemic tolerance induced by cerebral ischemic preconditioning (CIP).MethodsEighty healthy male Wistar rats with permanent occlusion of the bilateral vertebral arteries were randomly divided into 6 groups: ①Sham group (n=10); ②CIP group (n=10); ③ischemic insult (Ⅱ) group (n=10); ④CIP+Ⅱ group (n=10); ⑤p38 MAPK AS-ODNs+CIP+Ⅱ group (n=30); ⑥p38 MAPK S-ODNs+CIP+Ⅱ group (n=10). Group ⑤ was divided into 5 nmol, 10 nmol and 15 nmol subgroups according to the dose of p38 MAPK AS-ODNs (n=10). The dose of p38 MAPK S-ODNs was 15 nmol. All the rats were sacrificed 6 h and 2 d after the sham operation or the last time of global brain ischemia reperfusion. Western blot and immunohistochemistry analysis were used for detecting the expression of p-p38 MAPK and GLT-1 protein.ResultsCIP moderately up-regulated the expression of p-p38 MAPK and significantly up-regulated the expression of GLT-1 protein, inhibited the excessively up-regulation of p-p38 MAPK and the down-regulation of GLT-1 induced by ischemic insult. p38 MAPK AS-ODNs significantly inhibited the up-regulation of p-p38 MAPK and GLT-1 protein in a dose-dependent manner during the induction of brain ischemic tolerance by CIP.Conclusionp38 MAPK AS-ODNs inhibit the up-regulation of GLT-1 during the induction of brain ischemic tolerance induced by CIP.
p38 MAPK; GLT-1; AS-ODNs; cerebral ischemic preconditioning; hippocampus; rat
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.028.html
2017-06-15,
2017-07-20
国家自然科学基金资助项目(No 31271149,81271454);河北省自然科学基金资助项目(No H2015206492);河北省人才培养工程资助项目(No A201400544)
王佳磊(1988-),女,硕士,助教,研究方向:神经病理生理学,E-mail:apple__173@163.com; 张 敏(1968-),女,博士,教授,博士生导师,研究方向:神经病理生理学,通讯作者,Tel:0311-86261072,E-mail:hebmuzhangmin@163.com
10.3969/j.issn.1001-1978.2017.09.014
A
:1001-1978(2017)09-1253-07
R-332;R322.81;R345.57;R743.310.22;R977.3
