A20基因缺失对弥漫大B细胞淋巴瘤临床病理特征和预后的影响及相关分子机制研究
2017-08-16冯江龙杨文秀王佳蕊
冯江龙,杨文秀,王佳蕊,李 泊
(1.贵州医科大学病理学教研室,贵阳 550004;2.贵州医科大学附属医院病理科,贵阳 550004)
·论 著· doi:10.3969/j.issn.1671-8348.2017.19.002
A20基因缺失对弥漫大B细胞淋巴瘤临床病理特征和预后的影响及相关分子机制研究
冯江龙1,杨文秀2△,王佳蕊1,李 泊2
(1.贵州医科大学病理学教研室,贵阳 550004;2.贵州医科大学附属医院病理科,贵阳 550004)
目的 检测弥漫大B细胞淋巴瘤(DLBCL)中肿瘤坏死因子α诱导蛋白3基因(A20基因)缺失情况,探讨A20基因缺失对DLBCL临床过程及预后的影响及其与核因子-κB(NF-κB)通路活化的关系。方法 荧光原位杂交检测其A20基因缺失情况;免疫组织化学染色检测肿瘤中A20、Survivin、P65、Ki-67蛋白的表达,TUNEL技术检测肿瘤细胞凋亡水平,收集临床病理资料并随访,进行统计分析。结果 DLBCL病例A20基因缺失率为21.7%,活化后B细胞样型(ABC)-DLBCL的A20基因缺失率明显高于生发中心B细胞样型(GCB)-DLBCL(30.6%vs. 8.3%,P<0.05),A20蛋白表达与A20基因缺失呈负相关(r=-0.259,P=0.023),P65蛋白和Survivin蛋白表达与A20基因缺失呈正相关(r=0.280、0.313,P=0.015、0.007);肿瘤细胞凋亡在A20基因缺失的DLBCL病例中较低,在A20蛋白表达阳性病例中明显高于表达阴性病例,在Survivin和P65蛋白阳性表达病例中明显低于阴性表达病例(P<0.05),而在ABC-DLBCL和GCB-DLBCL病例间差异无统计学意义(P>0.05);COX回归分析结果显示,年龄、A20基因的缺失、DLBCL类型和Ki67表达是DLBCL独立的生存相关因素;A20基因缺失者的生存状况明显较未缺失者差(P=0.015)。结论 A20缺失可能影响A20蛋白表达,使其对NF-κB活化的负调节作用减弱,使Survivin表达上调而影响肿瘤细胞的增殖和凋亡;A20基因缺失对DLBCL的临床过程和预后有一定影响。
淋巴瘤;A20基因;NF-κB;Survivin;预后;基因缺失
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是成人淋巴瘤中最常见的一种类型,约占非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)的30%[1],在我国已达45.8%[2]。它可发生于任何年龄,以中老年人最为常见,中位发病年龄60~64岁。根据肿瘤细胞的基因表达谱,非特指的DLBCL可分为生发中心B细胞样型(germinal center B-cell-like,GCB)和活化后B细胞样型(activated B-cell-like,ABC)及原发性纵隔B细胞淋巴瘤型(primary mediastinal B-cell lymphoma,PMBL)。不同亚型的DLBCL无论在发病机制还是在临床预后方面都显现出差异,其治疗效果也不尽相同。最近研究发现,核因子-κB(nuclear factor-kappa B,NF-κB)与DLBCL的发生、发展关系密切,NF-κB信号传导通路的激活是DLBCL的一个重要特性[3]。在NF-κB通路中,P50/P65是最常见的NF-κB二聚体,与靶基因的启动子DNA结合,激活基因转录。在DLBCL中存在多种与NF-κB异常活化相关的基因异常。肿瘤坏死因子α诱导蛋白3基因(tumor necrosis factor alpha-induced protein 3 gene,TNFAIP3,A20 gene)就是其中之一。凋亡抑制基因Survivin是凋亡抑制蛋白(inhibitor apoptosis of protein,IAP)家族成员,它在很多肿瘤的发生、发展中具有作用。Survivin在间变性大细胞淋巴瘤、霍奇金淋巴瘤和DLBCL中的异常及其对上述淋巴瘤临床过程的影响国内外都有一些报道[4]。Survivin是NF-κB的下游调控基因,主要通过直接作用于凋亡蛋白酶级联效应因子半胱氨酰天冬氨酸蛋白酶(Caspase)-3、Caspase-7而发挥抗凋亡作用[5]。DLBCL中存在的A20基因的缺失是否通过NF-κB信号通路的持续活化而影响Survivin的表达,并影响淋巴瘤的发生、发展尚不清楚。据此,本研究收集了一组DLBCL病例,应用荧光原位杂交(fluorescence in situ hybridization,FISH)、TUNEL技术和免疫组织化学方法检测DLBCL中A20缺失、凋亡和Survivin等相关分子的变化,为完善DLBCL的发生、发展机制,以及发现其预后和治疗评估的相关因子提供可靠的试验依据。
1 资料与方法
1.1 一般资料 收集贵州医科大学附属医院病理科2009年6月至2015年6月诊断的DLBCL手术切除后病例,按照2008年版淋巴造血组织WHO分类诊断标准,通过复习组织学和免疫组织化学染色方法,筛选出临床病理资料相对完整的60例DLBCL患者进行研究,其中男36例,女24例,男女比1.5∶1.0;发病年龄1~83岁,中位年龄57岁,发病高峰年龄55~65岁;ABC-DLBCL 36例,GCB-DLBCL 24例;临床分期:Ⅰ期22例,Ⅱ期14例,Ⅲ期13例,Ⅳ期11例。另外,以同期的12例淋巴结反应性增生病例作为对照。本研究通过贵州医科大学伦理委员会审批。
1.2 方法
1.2.1 FISH检测 石蜡包埋肿瘤组织切片,FISH检测A20探针购自北京金培佳试剂公司,试验方法如下:石蜡组织切片厚3 μm,常规脱蜡至水,胃蛋白酶消化20 min,每张切片滴加5 μL探针,80 ℃水浴箱进行DNA变性20 min,37 ℃杂交24 h,4′,6-二脒基-2-苯基吲哚(DAPI)复染。结果判读:荧光显微镜下观察,通过Image J合成彩色图像,随机计数100个清晰的细胞后,统计Ratio值,A20红色信号数:6号染色体着丝粒(chromosome 6 centromre probe,CEP6)绿色信号数小于1.8者为缺失阳性结果。
1.2.2 免疫组织化学染色 石蜡包埋组织切片厚3 μm,脱蜡、水化、消除内源性过氧化物酶,采用乙二胺四乙酸(EDTA)pH 9.0高压热修复,EV二步法,3,3′-二氨基联苯胺(DAB)显色,Harris苏木精复染,脱水,透明,封片。Survivin (福州迈新生物技术开发有限公司,1∶50)和Ki-67(美国Abcam公司,1∶100)为多克隆抗体,A20(美国Abcam公司,1∶300)、NF-κB(P65,美国Abcam公司,1∶100)均为单克隆抗体。阳性对照:A20蛋白为胎盘组织,P65蛋白为乳腺癌组织,Survivin蛋白为正常胃组织,用pH 7.0、0.01 mol/L的磷酸盐缓冲液(PBS)代替一抗作为空白对照。结果判读:阳性信号Survivin蛋白位于细胞核或细胞质,A20蛋白位于细胞质,P65和Ki-67位于细胞核。每张切片随机观察10个高倍视野(×400),计数阳性细胞百分比,取10个高倍视野的百分比均数为其阳性率。A20、P65、Survivin蛋白表达阳性率小于20%判为阴性,≥20%判为阳性。Ki-67蛋白表达分为低表达(<40%)和高表达(≥40%)两个等级。
1.2.3 凋亡检测 显色法TUNEL细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,具体步骤按说明书进行:石蜡包埋组织切片3 μm厚,脱蜡水化,用不含脱氧核糖核酸酶(DNase)的蛋白酶K进行消化,3%过氧化氢去除内源性过氧化物酶,依次滴加生物素标记dUTP、辣根过氧化物酶(HRP)标记链霉亲和素工作液,37 ℃水浴箱孵育,DAB显色,Harris苏木精复染。结果判定:棕色阳性细胞占总细胞数的百分比,细胞凋亡可以划分为低凋亡率(<2%)和高凋亡率(≥2%)两个组。
1.3 随访 主要通过信访和电话随访完成,以首次明确病理诊断为随访开始时间,2016年1月31日为随访结束时间。
1.4 统计学处理 采用SPSS19.0软件进行统计分析,计数资料以例数或百分率表示,组间比较采用四格表χ2检验,相关性分析采用Pearson相关分析,生存分析采用Kaplan-Meier方法绘制生存曲线,生存曲线的比较采用对数秩检验(Log-rank test),影响生存的多因素分析采用COX回归分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 A20基因的缺失检测 60例DLBCL中A20 缺失阳性(图1)13例,阳性率为21.7%,12例淋巴结反应性增生中未检测出A20缺失。

图1 DLBCL A20缺失突变(FISH,×1 000)
2.2 淋巴瘤中A20、P65、Survivin蛋白的表达 DLBCL和淋巴结反应性增生中均见A20、P65和Survivin蛋白表达(图2)。淋巴结反应性增生患者中A20蛋白阳性表达率为83.3%(10/12)、P65蛋白为8.3%(1/12),Survivin蛋白为16.7%(2/12);DLBC组中A20蛋白阳性表达率为28.3%(17/60),P65蛋白为58.3%(35/60),Survivin蛋白为55.0%(33/60)。两组间A20、P65、Survivin蛋白阳性表达率比较,差异有统计学意义(P<0.05)。
2.3 A20基因缺失与A20、P65、Survivin蛋白表达及患者临床特征的关系 A20基因缺失发生率在ABC-DLBCL和GCB-DLBCL患者间(30.6%vs. 8.3%)、A20蛋白表达阳性与阴性患者间(5.9%vs. 30.2%)、P65蛋白表达阳性与阴性患者间(31.4%vs. 8.0%)、Survivin蛋白表达阳性与阴性患者间(33.3%vs. 7.4%)、Ki-67蛋白低表达与高表达患者间(5.3%vs. 29.3%)比较,差异均有统计学意义(P<0.05);而在不同性别及临床分期患者间、复发与未复发患者间比较,差异均无统计学意义(P>0.05),见表1。Pearson相关分析显示:A20蛋白表达与A20基因缺失呈负相关(r=-0.259,P=0.023),P65蛋白和Survivin蛋白表达与A20基因缺失呈正相关(r=0.280、0.313,P=0.015、0.007),见表2。
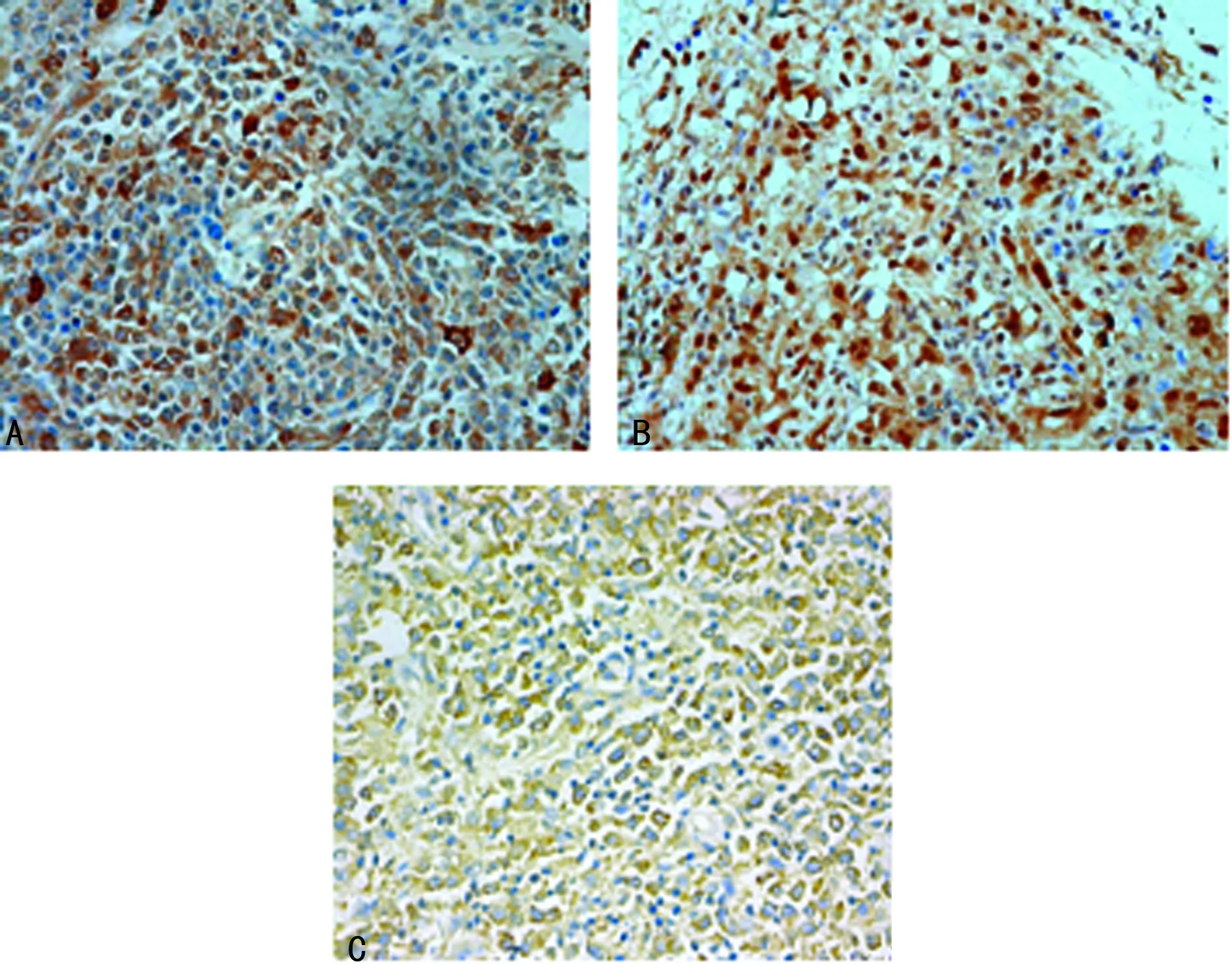
A:A20蛋白表达;B:P65蛋白表达;C:Survivin蛋白表达
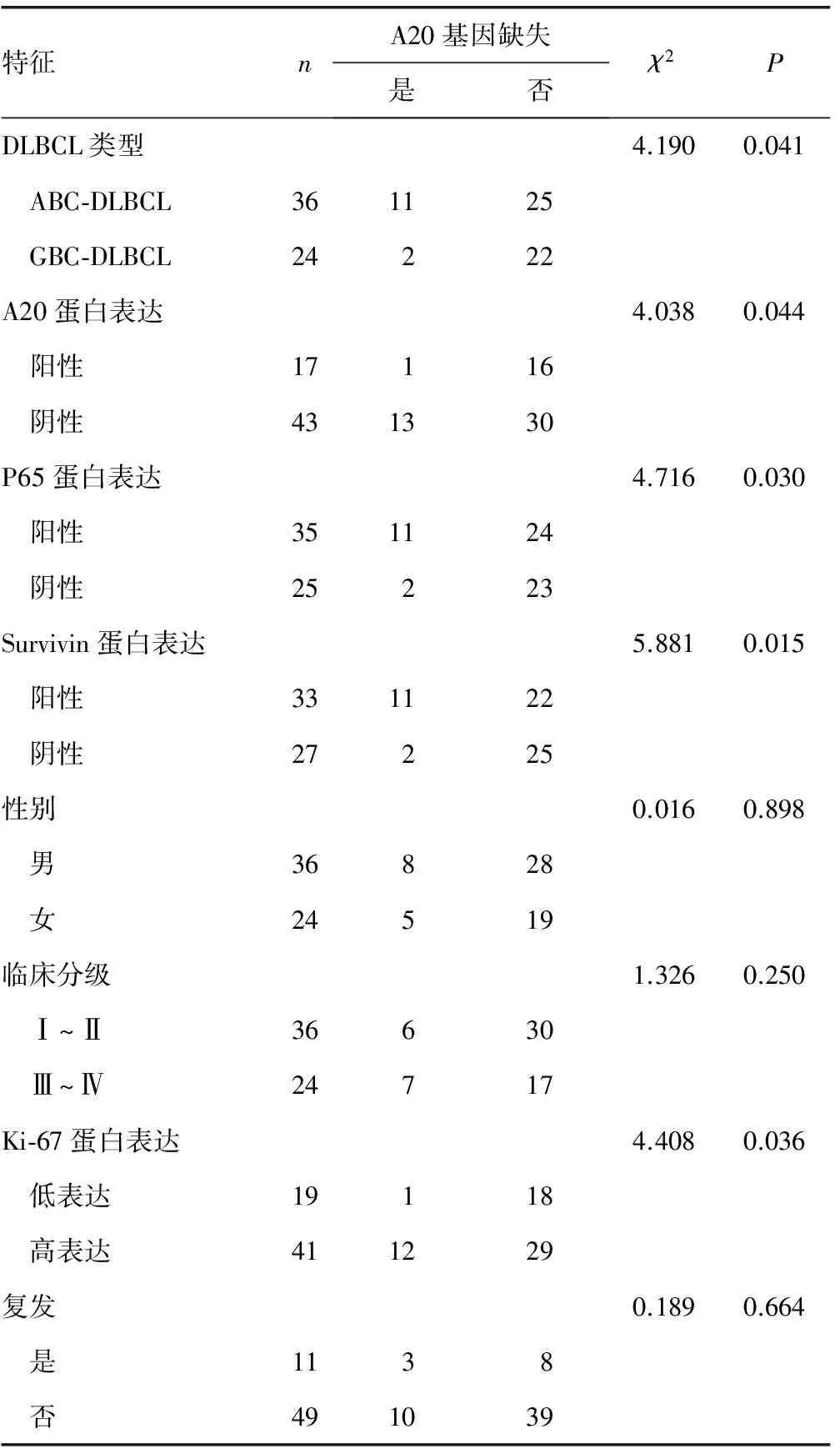
图2 DLBCL中A20、p65和Survivin蛋白

表2 A20基因缺失与A20、P65、Survivin蛋白表达的相关关系(n=60)
2.4 肿瘤细胞凋亡检测 DLBCL肿瘤细胞核中见棕黄色阳性信号(图3)。细胞凋亡水平与A20基因缺失和A20蛋白表达的关系、与P65和Survivin蛋白表达的关系见表3。
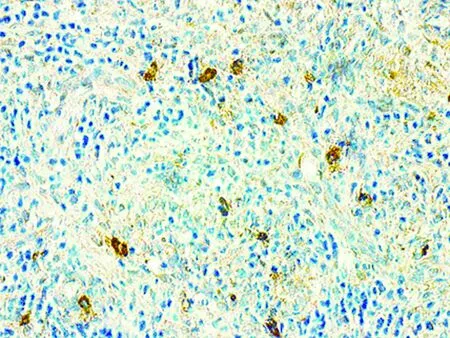
图3 DLBCL细胞凋亡水平检测(TUNEL,×400)
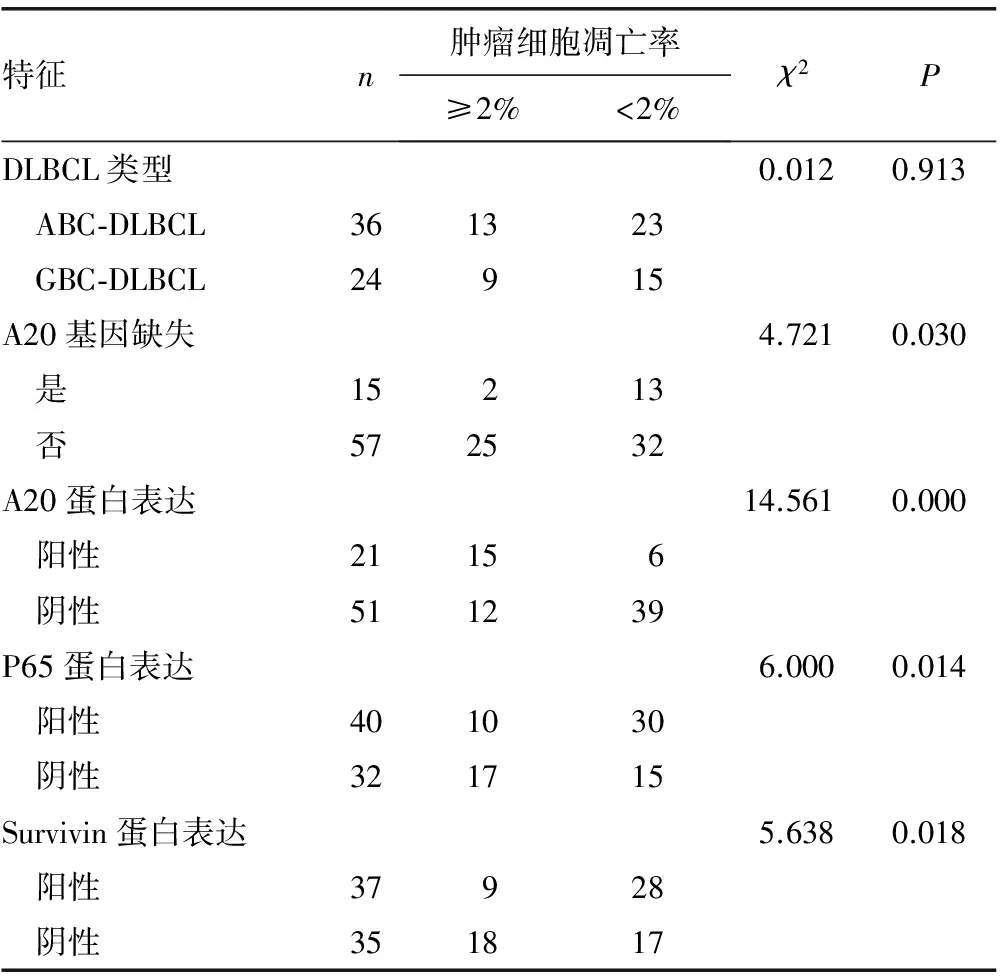
特征n肿瘤细胞凋亡率≥2%<2%χ2PDLBCL类型0.0120.913 ABC⁃DLBCL361323 GBC⁃DLBCL24915A20基因缺失4.7210.030 是15213 否572532A20蛋白表达14.5610.000 阳性21156 阴性511239P65蛋白表达6.0000.014 阳性401030 阴性321715Survivin蛋白表达5.6380.018 阳性37928 阴性351817
2.5 随访 60例DLBCL中有随访结果者36例,获访率为60.0%,随访时间4~48个月,中位随访时间为33.1个月。随访结果显示:存活26例,死亡10例(7例死于肿瘤,2例死于化疗反应,1例死于其他疾病);共11例复发;25例术后接受化疗治疗,其余病例治疗方案不详。A20基因缺失病例和未缺失病例生存曲线比较见图4,A20基因缺失病例生存状况明显较未缺失病例差,差异有统计学意义(P=0.015)。COX回归分析结果显示:年龄、Ki67的表达、A20基因的缺失、DLBCL类型对DLBCL患者的生存时间有影响,见表4。

图4 A20基因缺失病例与未缺失病例的生存曲线比较

变量βSEWaldχ2PRR年龄0.0570.0208.0510.0051.059Ki67-1.0400.4924.4700.0340.354A20基因缺失-1.9050.6598.3590.0040.140DLBCL类型-2.0620.6609.7640.0020.127
3 讨 论
A20基因位于染色体6q23.3,其编码的A20蛋白是一种新型的锌指蛋白,具有去泛素化酶的功能[6]。目前,A20蛋白在肿瘤发生、发展中的作用报道较多,A20可通过抑制twist1表达而抑制肝细胞癌的生长和转移[7],它还是NF-κB的负调节因子,故被视为肿瘤抑制基因。A20可通过多种途径机制抑制NF-κB的活化:它可抑制卡波西肉瘤相关疱疹病毒FLICE抑制蛋白(vFLIP)诱导的NF-κB活化[8];A20的锌指7与线性的多泛素链结合可以抑制LUBAC介导的NF-κB活化[9];在肿瘤坏死因子(TNF)作用下或者TNF-R1应答过表达时,A20蛋白能够与NF-κB抑制蛋白激酶γ亚基(IKKγ)相互作用,阻断IKKγ将上游信号传递给IKKα和IKKβ亚基,从而阻止NF-κB的活化[10]。NF-κB信号传导通路的持续活化是DLBCL的一个重要特性,它通过控制多种细胞因子和生存基因表达,对淋巴细胞的分化、凋亡、成熟、增生及先天免疫反应发挥重要作用。
A20基因异常在多种淋巴造血组织肿瘤都被发现[11-13]。这些异常对相应的淋巴瘤临床过程、治疗和预后产生不同程度的影响:伴有A20基因的缺失或突变的眼附属器黏膜相关淋巴组织(MALT)型淋巴瘤放疗需更大的剂量[14-15]。本课题组前期研究发现,在部分DLBCL中存在A20基因的甲基化和错义突变,这些A20基因的异常在ABC-DLBCL中较GCB-DLBCL多见,而且伴有A20基因突变和甲基化的DLBCL患者具有较差的临床过程和预后,A20甲基化者复发率高,A20突变者生存状况较差[16-17]。本研究发现,在DLBCL中存在A20基因的缺失,缺失率为21.7%,ABC-DLBCL中A20基因缺失较GCB-DLBCL更多见。在复发的DLBCL病例中A20基因缺失更多见,生存状况也较差,这与本课题组前期发现的A20错义突变和甲基化对DLBCL的影响相似。
在淋巴瘤中有关A20基因的异常对其编码蛋白表达的影响,以及与NF-κB下游分子表达的关系报道较少。本课题组既往研究发现,A20基因的小分子干扰RNA(siRNA)干扰DLBCL细胞OCI-LY1内的A20表达后,NF-κB的P65和P50表达明显降低,细胞的生长和凋亡明显受到抑制,多药耐药基因1(multi-drug resistance gene 1)及其编码蛋白P-gp的表达都明显上调[18]。Survivin蛋白是NF-κB的下游靶基因,有研究报道,Survivin在侵袭性和高侵袭性的非霍奇金淋巴瘤中都有高表达,其表达能预测相应淋巴瘤的临床过程和预后[19];Survivin表达产生的凋亡抑制作用还对多种肿瘤的化疗耐药和血管形成有重要影响,它作为生物靶向治疗的靶标在多种恶性肿瘤中有体外实验的研究报道[20]。经过Pearson相关分析发现,A20蛋白表达与A20基因缺失呈负相关(r=-0.259,P=0.023),P65蛋白和Survivin蛋白表达与A20基因缺失呈正相关(r=0.280、0.313,P=0.015、0.007),因此有理由推测淋巴瘤中Survivin蛋白表达异常可能与A20基因异常导致的NF-κB持续活化有关。本研究还发现,A20基因缺失的DLBCL患者A20蛋白表达降低,P65蛋白和Survivin蛋白表达都明显增强,且肿瘤凋亡明显抑制。结果表明:DLBCL中A20基因的缺失对A20蛋白表达可能有影响,A20表达的减少可能削弱了对NF-κB信号通路的负调控作用,使NF-κB下游靶基因Survivin的表达上调,从而影响肿瘤细胞的凋亡和增殖。
综上所述,A20基因的缺失对DLBCL的临床过程和预后有一定影响,可能是DLBCL不良预后的预测相关因子;DLBCL中Survivin表达上调可能是A20基因缺失导致A20表达下调的结果,Survivin的表达可能是淋巴瘤肿瘤细胞凋亡抑制和增殖活性增强重要的分子机制之一。
[1]Menon MP,Pittaluga S,Jaffe ES.The histological and biological spectrum of diffuse large B-cell lymphoma in the WHO classification[J].Cancer J,2012,18(5):411-420.
[2]Morton LM,Cerhan JR,Hartge P,et al.Immunostaining to identify molecular subtypes of diffuse large B-cell lymphoma in a population-based epidemiologic study in the pre-rituximab era[J].Int J Mol Epidemiol Genet,2011,2(3):245-252.
[3]Grégoire M,Guilloton F,Pangault C,et al.Neutrophils trigger a NF-κB dependent polarization of tumor-supportive stromal cells in germinal center B-cell lymphomas[J].Oncotarget,2015,6(18):16471-16487.
[4]Kaneko N,Kita A,Yamanaka K,et al.Combination of YM155,a survivin suppressant with a STAT3 inhibitor:a new strategy to treat diffuse large B-cell lymphoma[J].Leuk Res,2013,37(9):1156-1161.
[5]Leslie LA,Younes A.Targeting oncogenic and epigenetic survival pathways in lymphoma[J].Leuk Lymphoma,2013,54(11):2365-2376.
[6]Bosanac I,Wertz IE,Pan B,et al.Ubiquitin binding to A20 ZnF4 is required for modulation of NF-κB signaling[J].Mol Cell,2010,40(4):548-557.
[7]Chen HY,Hu L,Luo ZL,et al.A20 suppresses hepatocellular carcinoma proliferation and metastasis through inhibition of Twist1 expression[J].Mol Cancer,2015,14:186.
[8]Sakakibara S,Espigol-Frigole G,Gasperini P,et al.A20/TNFAIP3 inhibits NF-κB activation induced by the Kaposi′s sarcoma-associated herpesvirus vFLIP oncoprotein[J].Oncogene,2013,32(10):1223-1232.
[9]Verhelst K,Carpentier I,Kreike M,et al.A20 inhibits LUBAC-mediated NF-κB activation by binding linear polyubiquitin chains via its Zinc finger 7[J].EMBO J,2012,31(19):3845-3855.
[10]Hymowitz SG,Wertz IE.A20:from ubiquitin editing to tumour suppression[J].Nat Rev Cancer,2010,10(5):332-341.
[11]Ando M,Sato Y,Takata K,et al.A20 (TNFAIP3) deletion in Epstein-Barr virus-associated lymphoproliferative disorders/lymphomas[J].PLoS One,2013,8(2):e56741.
[12]Dong G,Chanudet E,Zeng N,et al.A20,ABIN-1/2,and CARD11 mutations and their prognostic value in gastrointestinal diffuse large B-cell lymphoma[J].Clin Cancer Res,2011,17(6):1440-1451.
[13]Nomoto J,Hiramoto N,Kato M,et al.Deletion of the TNFAIP3/A20 gene detected by FICTION analysis in classical Hodgkin lymphoma[J].BMC Cancer,2012,12:457.
[14]Bi Y,Zeng N,Chanudet E,et al.A20 inactivation in ocular adnexal MALT lymphoma[J].Haematologica,2012,97(6):926-930.
[15]Troppan K,Hofer S,Wenzl K,et al.Frequent down regulation of the tumor suppressor gene A20 in multiple myeloma[J].PLoS One,2015,10(4):e0123922.
[16]李逸,陈琴,李品浩,等.A20基因甲基化对弥漫性大B细胞性淋巴瘤的影响[J].诊断病理学杂志,2015,22(12):772-775.
[17]庹樱篮,陈琴,杨文秀.A20突变与弥漫大B细胞淋巴瘤临床病理特征及预后的关系[J].中国肿瘤临床,2015,42(20):1018-1024.
[18]王玲玲,杨文秀,李逸,等.TNFAIP3siRNA对弥漫大B细胞淋巴瘤OCI-LY1细胞NF-κB活性及增殖的影响[J].临床与实验病理学杂志,2016,32(4):405-408,412.
[19]Schlette EJ,Medeiros LJ,Goy A,et al.Survivin expression predicts poorer prognosis in anaplastic large-cell lymphoma[J].J Clin Oncol,2004,22(9):1682-1688.
[20]Huang J,Lyu H,Wang J,et al.MicroRNA regulation and therapeutic targeting of survivin in cancer[J].Am J Cancer Res,2015,5(1):20-31.
Impacts of A20 gene deletion on clinicopathological features and prognosis of diffuse large B cell lymphoma and relative molecular mechanism*
FengJianglong1,YangWenxiu2△,WangJiarui1,LiBo2
(1.DepartmentofPathology,GuizhouMedicalUniversity,Guiyang,Guizhou550004,China;2.DepartmentofPathology,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang,Guizhou550004,China)
Objective To detect the A20 gene deletion,investigate the impacts of A20 gene deletion on clinicopathological features and prognosis of DLBCL,and relationship between activation of NF-κB pathway and relative molecular pathogenesis.Methods A20 gene deletion was detected by fluorescence in situ hybridization (FISH).The expression of A20,Survivin,P65 and Ki-67 were detected by immunohistochemistry stain.Apoptosis was assayed by TUNEL.Follow-up and statistical analysis were done.Results The deletion rate of A20 gene was 21.7%.The deletion rate of A20 gene was obviously higher in ABC-like DLBCL than that in GCB-like DLBCL (30.6%vs. 8.3%,P<0.05).It was observed that there was a negative correlation between A20 protein expression and A20 gene deletion (r=-0.259,P=0.023).The expression of P65 and Survivin protein was positively correlated with the A20 gene deletion (r=0.280,P=0.015;r=0.313,P=0.007).Apoptosis rate was significantly reduced in DLBCL patients with A20 gene deletion.The apoptosis rate was higher in cases with positive expression of A20 protein,while that was lower in cases with positive expression of p65 and Survivin protein than those with negative expression of corresponding protein.There was no statistically significant difference in apoptosis rate between ABC-like and GCB-like DLBCL patients (P>0.05).COX regression analysis indicated that age,A20 gene deletion,types of DLBCL and Ki67 expression were independent factors associated with survival status.Log-rank test showed that there was a statistical difference in survival status between the cases with and without A20 gene deletion (P=0.015).Conclusion A20 gene deletion may associate with the attenuation of A20 protein expression.The latter weakens negative feedback regulation of A20 protein for NF-κB pathway.An up-regulated expression of Survivin and abnormal proliferation and apoptosis may be result from the abnormal activation of NF-κB.A20 gene deletion brings certain influence on clinical course and prognosis of DLBCL.
lymphoma;A20 gene;NF-κB;Survivin;prognosis;gene deletion
国家自然科学基金资助项目(NO.81160299)。 作者简介:冯江龙(1991-),在读硕士,主要从事淋巴瘤发病机制方面的研究。△
,E-mail:ypq1964@163.com。
R361+.2
A
1671-8348(2017)19-2594-05
2017-02-18
2017-04-16)
